Ж. П. Цикина Муниципальное оздоровительное образовательное учреждение санаторного типа для детей, нуждающихся в длительном лечении, Тема программы. Соединения химических элементов. (О. С. Габриелян. 8 класс). Тема урок
| Вид материала | Урок |
СодержаниеЗадачи урока Аморфные вещества Кристаллические вещества III. Типы кристаллических решеток IV. Закрепление V. Закон постоянства состава веществ |
- Публичный доклад о деятельности государственного областного оздоровительного образовательного, 570.21kb.
- Публичный доклад о деятельности государственного областного оздоровительного образовательного, 540.93kb.
- Основная образовательная программа начального общего образования, 8926.07kb.
- Документация об аукционе > подготовка заявки на участие в аукционе, 1449.91kb.
- Заявление родителей (законных представителей) o приеме ребёнка в учреждение, 10.29kb.
- Руководитель Тепляшина Ольга Геннадьевна: учитель русского языка Ачинск 2010 год Содержание:, 403.76kb.
- Конкурс «рождественские встречи» номинация: фольклор и этнография» тема: «праздник, 180.24kb.
- Доклад руководителя, 155.03kb.
- Методические разработки занятий Школы приемного родителя Составитель, 870.49kb.
- Паршина Наталья Юрьевна высшая категория. Особенности образовательного процесса Приоритетное, 76.76kb.
ПЛАН – КОНСПЕКТ УРОКА ХИМИИ
«АМОРФНЫЕ И КРИСТАЛЛИЧЕСКИЕ ВЕЩЕСТВА»
Ж.П. Цикина
Муниципальное оздоровительное образовательное учреждение санаторного типа для детей, нуждающихся в длительном лечении,
Тема программы. Соединения химических элементов. (О.С. Габриелян. 8 класс).
Тема урока. Аморфные и кристаллические вещества.
Вид урока. Изучение нового материала.
Цель урока: создание условий для формирования у воспитанников представлений кристаллических и аморфных веществах, типах кристаллических решеток, о законе постоянства состава вещества.
Задачи урока:
Обучающие:
- сформировать понятие о кристаллическом и аморфном состоянии твердых тел;
- ознакомить с типами кристаллических решеток;
- рассмотреть влияние химической связи на свойства твердых тел;
- дать представление о законе постоянства состава вещества.
Развивающие:
- продолжить формирование умения разъяснять смысл изученных определений, проводить операции сравнения, анализа.
Воспитательные:
- продолжить работу по формированию навыков самостоятельной работы.
Тип урока: комбинированный
Вид урока: объяснительно-иллюстративный .
Методы организации и осуществления учебно-познавательной деятельности:
- репродуктивный;
- самостоятельная работа.
Методы контроля и самоконтроля:
- устный;
- письменный.
Формы организации познавательной деятельности учащихся:
- объяснение;
- фронтальная работа;
- индивидуально-обособленная.
Оборудоваие:
- мультимедийное оборудование (компьютер, проектор, экран);
- учебник О.С. Габриеляна. Химия (8 класс), 2006 г.
Х
 од урока
од урокаI.Организационный момент.
Предлагаю вас посмотреть два видеофрагмента, которые связаны с сегодняшней темой. Предложите свои варианты названия урока.
Слайд 1. Видеофрагмент мультфильма «Пластилиновая ворона».
Слайд 2. Фотографии кристаллических веществ.
- Кристаллическое и аморфное состояние твердых вещества
Учащиеся предлагают свои названия темы урока, после чего обобщаю все высказывания, называю тему урока «Кристаллическое и аморфное состояние твердых веществ, типы кристаллических решеток». На сегодняшнем уроке мы рассмотрим, как влияют особенности химических связей на свойства твердых веществ.

Слайд 3. Название темы урока.
Вещество, как вам известно, сожжет существовать в трех агрегатных состояниях. Назовите - в каких ? Газообразном, жидкое и твердом. Любое вещество можно получить в твердом, жидком и газообразном виде. Надо только создать соответствующие условия.
С
 лайд 4. Фото воды в трех агрегатных состояниях.
лайд 4. Фото воды в трех агрегатных состояниях.Например, вода при обычных условиях находится в жидком состоянии, понизив температуру ниже 0°С, мы получим воду в твердом кристаллическом состоянии. Повысив температуру до 100°С, мы переведем жидкую воду в газообразное состояние.
Металлы, находящиеся в твердом состоянии при нормальных условиях, при нагревании начинают размягчаться, и при определенных температурах начинают плавиться, т. е. переходить в жидкое состояние. При дальнейшем нагревании, до температуры кипения металлы начинают испаряться, т. е. переходить в газообразное состояние. Любой газ можно перевести в жидкое и твердое состояние, понижая температуру. Например, водород при температуре —259 °С переходит в твердое состояние, а кислород при температуре -218,8 °С.
Температурный интервал существования вещества в твердом состоянии определяется его температурой плавления и кипения.

Слайд 5. Аморфные и кристаллические вещества.
Различают два вида твердых веществ: аморфные и кристаллические.
К аморфным относятся пластмассы, смолы, пластилин, воск, шоколад, жевательная резинка. Образцы аморфных тел представлены на слайде (воск, смолу, пластилин).
Кристаллическими являются такие вещества, как серебро, хлорид натрия, алмаз.
Слайд 6. Определение кристаллических и аморфных веществ.
Аморфные вещества не имеют четкой t плавления –
(при нагревании они легко размягчаются и переходят в текучее состояние), не имеют строго регулярного упорядоченного строения.
Аморфные тела размягчаются постепенно и переходят в текучее состояние.
Кристаллические вещества имеют строго определенную t плавления, характеризуются правильным расположением частиц, из которых они состоят: атомов, молекул и ионов.
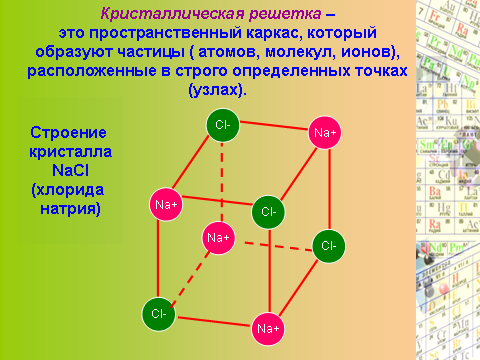
Слайд 7. Кристаллическая решетка.
Эти частицы находятся в строго определенных точках пространства, называемых узлами. Если мысленно соединить эти узлы прямыми линиями, образуется пространственный каркас, называемый кристаллической решеткой.
III. Типы кристаллических решеток
В
 зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа: ионные, атомные, молекулярные и металлические.
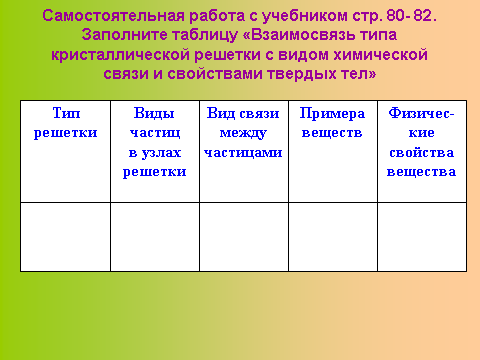
зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа: ионные, атомные, молекулярные и металлические.Слайд 8. Образец таблицы.
Пользуясь учебником (стр.80 - 82), выполните самостоятельную работу, составите таблицу «Взаимосвязь типа кристаллических решеток с видом химической связи и свойствами твердых тел».
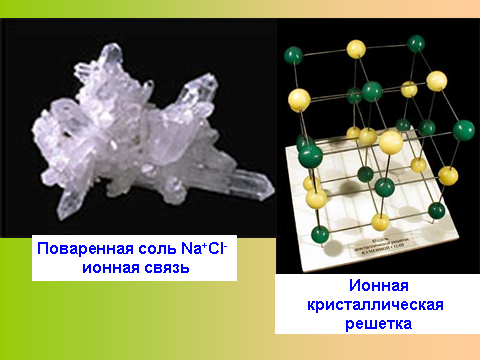
Слайд 9. Ионная кристаллическая решетка.
Теперь давайте проверим, правильно ли вы выполнили самостоятельную работу (один из учащихся зачитывает по тетради ответ, остальные сверяют свою работу с информацией на слайде).
И
 онными кристаллическими решетками называют кристаллические решетки, в узлах которых находятся ионы, например Na+ и Cl- ( т.е. вещества у которых ионная химическая связь, в данном случае у поваренной соли).
онными кристаллическими решетками называют кристаллические решетки, в узлах которых находятся ионы, например Na+ и Cl- ( т.е. вещества у которых ионная химическая связь, в данном случае у поваренной соли).Слайд 10.
Атомными называют кристаллические решетками, в узлах которых находятся отдельные атомы, которые соединены между собой очень прочными ковалентными связями , например у алмаза.
С
 лайд 11.
лайд 11.Молекулярными называют кристаллические решетки, в узлах которых расположены молекулы. Химические связи могут быть полярными H2O, HCl, и неполярными - I2, N2. между молекулами действуют слабые силы межмолекулярного притяжения.
Веществам с молекулярной связью присуще такое явление, как возгонка.
С
 лайд 12.
лайд 12.Металлическая решетка соответствует веществам с металлической связью, в узлах такой решетки находятся атомы, ионы - в которые легко превращаются атомы металлов, отдавая свои внешние электроны в общее пользование.
После выполнения самостоятельной работы учащиеся проверяют выполнение работы с образцом на слайдах. Учитель по ходу проверки дает пояснения, уделяя особое внимание взаимосвязи типа кристаллической решетки, вида химической связи и свойств твердых веществ.
Слайд 13.
Тип кристаллической решетки зависит от вида химической связи вещества:
Ионная связь – ионная кристаллическая решетка.
 Ковалентная связь – атомная и молекулярная кристаллические решетки.
Ковалентная связь – атомная и молекулярная кристаллические решетки.Металлическая связь – металлическая кристаллическая решетка.
Слайд 14.
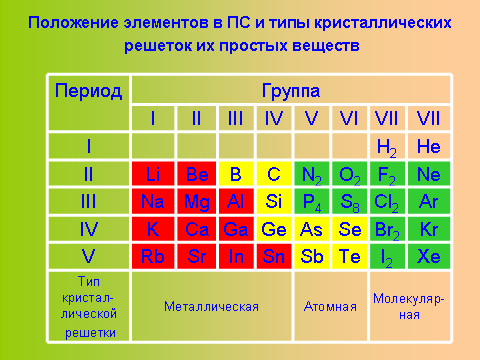
Обратите внимание на зависимость типа кристаллических решеток для простых веществ от положения элементов в ПС Д.И. Менделеева. Скажите, какой тип решетки из рассмотренных не встречается в простых веществах. Конечно, ионные.
IV. Закрепление
Слайд 15.
Определите вид химической связи и кристаллической решетки углекислого газа СО2. (Молекулярная).
Слайд 16.
Определите вид химической связи и кристаллической решетки железе Fe. (металлическая)
Слайд 17.
Определите вид химической связи и кристаллической решетки Si, S8, Li, N2. (Атомная, молекулярная, металлическая, молекулярная).
С
 лайд 18.
лайд 18.V. Закон постоянства состава веществ
При объяснении данного закона учитель подчерквает, что он справедлив только для веществ с молекулярным строением. Закон был открыт французским химиком Ж. Л. Прустом в 1808 году.
Постоянства состава веществ независимо от способа получения объясните на примере получения углекислого газа: сгоранием угля в кислороде, разложение карбоната кальция, действием соляной кислоты на мрамор:
С + О2 - СО2↑
СаСОз - СаО + СО2 ↑
СаСО3+2НС1 = СаС12 + СО2 ↑+Н2О
Учитель разъясняет обучающимся, что каким бы способом не получали углекислый газ, его состав будет постоянен. Практическое значение данного закона состоит в том, что на его основании мы можем утверждать, что каждому веществу соответствует только одна химическая формула.
С
 лайд 19.
лайд 19.Характеристика углекислого газа по его молекулярной формулеСО2
1.Вещество – углекислый газ.
2. Тип в-ва – сложное, класс- оксид.
3. Количественный состав – состоит из С и О.
4.Качсетвенный состав: 1 атом С и 2 атома О.
5.Относительная молекулярная масса:
Мr (СО2) = 12+ 16х2 = 44
6. Другая информация: 1 моль, молярная масса
 44 г/моль, Vм = 22, 4 л/моль
44 г/моль, Vм = 22, 4 л/мольСлайд 20.
VI. Домашнее задание
§22, дать характеристику Н2О, SO3.
