Волостных ольга Геннадьевна структурная реорганизация азатриеновых систем в азепины под действием
| Вид материала | Автореферат |
- Региональная олимпиада по физике, 38.6kb.
- Содержани министрество образования российской федерации, 852.35kb.
- Большое влияние на дальнейшее развитие тепловых двигателей оказал Дени Папен, 34.83kb.
- Тся задача определения вероятности срыва управления для нелинейных динамических систем,, 8.46kb.
- Поведение пузырьков в воде под действием сильных электрических полей: Обсуждение, 104.12kb.
- Копытова Ольга Геннадьевна, учитель информатики; Кузнецова Елена Эриковна, учитель, 290.72kb.
- Талалаева ольга геннадьевна, 308.98kb.
- Реорганизация и ликвидация Учреждения, 16.08kb.
- Исследование фрактальных характеристик развития трещиноватости горных пород под действием, 333.68kb.
- IX. реорганизация и ликвидация лоо вои и юридических лиц в ее составе, 15.72kb.
На правах рукописи
ВОЛОСТНЫХ
Ольга Геннадьевна
СТРУКТУРНАЯ РЕОРГАНИЗАЦИЯ
АЗАТРИЕНОВЫХ СИСТЕМ В АЗЕПИНЫ ПОД ДЕЙСТВИЕМ
ТРЕТ.-БУТОКСИДА КАЛИЯ
Специальность 02.00.03 – органическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Иркутск – 2011
Работа выполнена в Учреждении Российской академии наук
Иркутском институте химии им. А. Е. Фаворского
Сибирского отделения РАН
| Научный руководитель | Ph.D. (The Netherlands), доктор химических наук Недоля Нина Алексеевна |
| Официальные оппоненты: | доктор химических наук, профессор Корчевин Николай Алексеевич |
| | доктор химических наук, профессор Левковская Галина Григорьевна |
| Ведущая организация | Иркутский государственный университет |
Защита состоится 18 октября 2011 года в 9 часов на заседании совета по защите докторских и кандидатских диссертаций Д 003.052.01 при Иркутском институте химии им. А. Е. Фаворского СО РАН по адресу: 664033, Иркутск, ул. Фаворского, 1.
С диссертацией можно ознакомиться в научной библиотеке Иркутского института химии им. А. Е. Фаворского СО РАН.
Автореферат разослан 13 сентября 2011 г.
Учёный секретарь совета
д.х.н. Тимохина Л. В.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Азепины и их производные являются ключевыми структурными фрагментами широкого ряда биологически активных соединений природного и синтетического происхождения и находят разнообразное применение как в химии, в том числе промышленной (например, в производстве найлона), так и в медицине и фармакологии. Это – и азепиновые алкалоиды, и уникальные лекарственные препараты (Карбамазепин, Инсидон, Имипрамин и мн. др.) для лечения таких серьёзных заболеваний, как невралгия тройничного нерва, различные формы эпилепсии, шизофрения, ухудшение памяти, алкоголизм, старческое слабоумие, болезнь Альцгеймера, а также рак, ВИЧ и др. Кроме того, соединения этих классов используют в качестве важных синтетических интермедиатов, лигандов, органических катализаторов, оптически активных веществ и объектов для изучения различных аспектов стереохимии и термодинамики (таутомерии, валентной изомерии, сигматропных перегруппировок и мн.др.). Повышенный интерес к этим гетероциклам стимулирует поиск и разработку простых и универсальных способов их получения, в том числе обеспечивающих выход к новым функциональным производным с расширенными синтетическими возможностями и спектром биологической активности.
Развитие ранее найденных концептуально новых общих подходов к селективной сборке биологически важных гетероциклических структур (пирролов, циклобута[1,2-b]пирролов, пиридинов, дигидропиридинов, хинолинов, тиофенов, дигидротиофенов, тиетанов, тиопиранов и др.) из доступных изотиоцианатов и металлированных диенов или алкинов показало, что образующиеся в этих реакциях азатриеновые интермедиаты являются универсальными прекурсорами не только четырёх-, пяти- и шестичленных аза- и тиагетероциклов, но и, как оказалось, легко трансформируются в семичленные азагетероциклы – 3Н-азепины и 4,5-дигидро-3Н-азепины.
В данной диссертации открытая на единичных примерах реакция лёгкой реорганизации сопряжённых азатриеновых систем, генерируемых из алленов или алкинов, изотиоцианатов и алкилирующих агентов, в ценные и труднодоступные иными путями азепиновые и дигидроазепиновые структуры под действием оснований получила дальнейшее систематическое развитие.
Работа выполнена в соответствии с планами НИР Иркутского института химии им. А. Е. Фаворского СО РАН ( Программа V.36.6. «Развитие научных основ направленного органического, элементоорганического и неорганического синтеза с целью разработки рациональных методов получения новых биологически активных веществ, синтонов, мономеров, полимеров и прекурсоров высокотехнологичных материалов»), в рамках Интеграционного научного проекта (№ 1.27 «Генерируемые in situ карбанионы 2-аза-1,3,5-триеновых систем как предшественники 3Н-азепинов и дигидроазепинов») при финансовой поддержке РФФИ (Проект № 09-03-00890а «Контролируемые заместителями и катализаторами автотрансформации гетерополиеновых систем – универсальных прекурсоров фундаментальных карбо- и гетероциклов»; № государственной регистрации 01200957186).
Цель работы: Систематическое изучение структурной реорганизации сопряжённых 2-аза-1,3,5-триеновых систем [N-(бута-1,3-диенил)альдиминов и -кетиминов] в семичленные азагетероциклы под действием оснований. Синтез новых семейств и новых классов гидрокси-, алкокси-, ацеталь-, алкилсульфанил-, арил- и гетарилзамещенных моно- и бициклических азепинов и дигидроазепинов.
Научная новизна и практическая значимость. В результате проведённых исследований получена новая фундаментально значимая информация о реакционной способности и синтетическом потенциале азатриеновых систем, легкодоступных из изотиоцианатов, алленов или алкинов и алкилгалогенидов. Принципиально расширены ряды 1-аза-1,3,4-триенов и их изомеров – 2-аза-1,3,5-триенов (объекты исследования), что служит дополнительным подтверждением общности и универсальности ранее найденного подхода к их синтезу.
Впервые систематически изучены сигматропные перегруппировки в ряду 1-аза-1,3,4-триенов и реакции металлирования 2-аза-1,3,5-триенов (полиненасыщенных сопряжённых альдиминов и кетиминов). В результате широкого скрининга депротонирующих оснований [n-BuLi, (i-Pr)2NLi, t-AmOCs, t-BuOK, t-BuONa и др.] установлено, что наиболее эффективным реагентом для трансформации исследуемых 2-аза-1,3,5-триенов в семичленные азагетероциклы является трет.-бутоксид калия.
На обширном фактическом материале показано, что азаполиеновые системы, генерируемые из доступных полиненасыщенных карбанионов и гетерокумуленов, могут стать принципиально новым перспективным источником самых разнообразных азациклогептадиенов и -триенов – новых семейств и новых классов азепинов и их производных. В основе найденного подхода лежит быстрая (10–30 мин) [1,7]-циклизация 2-аза-1,3,5-триенов [преимущественно N-(бута-1,3-диенил)кетиминов] под действием t-BuOK (1.0–1.5 экв., ТГФ или ТГФ/ДМСО, –30÷0°С), сопровождающаяся элиминированием сульфид-аниона.
на примере аллилсульфанилзамещенного 2-аза-1,3,5-триена показана принципиальная возможность применения данной реакции для получения полифункционализированных 4,5-дигидро-1,3-тиазолов, в частности 4,4-диметил-2-(1-метоксипроп-2-енил)-5-(этилиден)-4,5-дигидро-1,3-тиазола.
Установлено, что при обработке трет.-бутоксидом калия 2-аза-1,3,5-триена [N-(бута-1,3-диенил)альдимина], полученного из 1-литио-1-метоксиаллена, n-BuNCS и MeI, вместо ожидаемых 4,5-дигидро-3Н-азепина и 3Н-азепина образуются ранее неизвестные метил-(Z)-N-[(Z)-бут-1-енил]-2-метоксибут-2-енимидотиоат и N-(бут-1-енил)-N'-бутил-N-[1-(метилсульфанил)-2-метоксибута-1,3-диенил]тиомочевина, а из 2-аза-1,3,5-триена, синтезированного по этой же схеме заменой n-BuNCS на EtNCS, – 4,5-дигидро-3Н-азепин, 3,4-дигидро-2Н-азепин и 3-аза-1,4,6-триен.
Найдены оригинальные пути синтеза ранее неизвестных и недоступных азадиеновых N,O-аминалей с редкими гетероатомными заместителями и 1,3-бутадиенов с формамидной группировкой – соответственно из 1-аза-1,3,4-триена (N-этилбута-2,3-диенимидотиоата) и 2-аза-1,3,5-триена [N-(бута-1,3-диенил)иминоформиата] под действием КОН в метаноле при комнатной температуре.
Обнаружена легкая кислотно-индуцируемая трансформация 4,5-дигидро-3H-азепин-3-олов в 8-окса-6-азабицикло[3.2.1]окт-6-ены (через внутримолекулярное присоединение гидроксильной группы к енаминному фрагменту).
Разработана принципиально новая общая стратегия одновременной сборки азепиновых и дигидроазепиновых молекул из изотиоцианатов и литиированных алленов или алкинов – через синтез и металлирование сопряжённых 2-аза-1,3,5-триенов. Создан широкий ассортимент не имеющих аналогов 3Н-азепинов, 4,5-дигидро-3Н-азепинов, 3,4-дигидро-2Н-азепинов, 2-этилиден-3,4,5,6-тетрагидро-2H-азепинов, гексагидроциклопента[b]азепинов, гексагидро-3H-1-бензазепинов и октагидроциклогепта[b]азепинов с реакционноспособными, биогенными и фармакофорными заместителями (гидрокси-, алкокси-, аллилокси-, ацеталь-, алкилсульфанил-, арил-, 1- и 2-пирролил-, 2-тиенил-).
Апробация работы и публикации. Основные результаты работы представлялись на Международной конференции по органической химии «Химия соединений с кратными углерод–углеродными связями» (С.-Петербург, 2008), Международной конференции «Основные тенденции развития химии в начале XXI-го века», посвящённой 175-летию со дня рождения Д. И. Менделеева и 80-летию создания химического факультета Санкт-Петербургского университета (С.-Петербург, 2009), Всероссийской Молодёжной конференции–школе, посвящённой 150-летию со дня рождения
А. Е. Фаворского «Идеи и наследие А. Е. Фаворского в органической и металлоорганической химии XXI века» (С.-Петербург, 2010), XIII Молодёжной научной школе–конференции «Актуальные проблемы органической химии» (Новосибирск, 2010).
По материалам диссертации опубликовано 10 работ, в том числе 6 статей (одна из которых получила статус “Feature article”) в ведущих отечественных и международных журналах и 4 тезисов; ещё 2 статьи приняты к опубликованию.
Объём и структура работы. Диссертация изложена на 209 стр. машинописного текста, проиллюстрирована 39 таблицами, 48 рисунками и схемами и состоит из введения, трёх глав, выводов и списка цитированной литературы, включающего 419 наименований.
В первой главе дан краткий обзор литературных данных о биологической активности и практической значимости семичленных азагетероциклов (азепинов и их производных) и основных методах их синтеза. Особое внимание уделено современным методам синтеза азепинов и дигидроазепинов, включая реакции [1,7]-электроцикли-зации азатриеновых анионов и полиненасыщенных азометиновых илидов.
Во второй главе изложены результаты собственных исследований автора, направленных на разработку и развитие принципиально новой стратегии одновременного синтеза азепинов и дигидроазепинов, исходя из доступных алленов или алкинов, изотиоцианатов и алкилгалогенидов.
В третьей главе (экспериментальная часть) приведены типичные методики синтезов, разработанные в ходе настоящего исследования, и детали физико-химического анализа.
Результаты проведённых исследований, научные положения и выводы работы базируются на надёжном экспериментальном материале и подтверждены современными физико-химическими методами исследования [ЯМР (1Н, 13С, 2D 1H1H-COSY, 1H1H-NOESY, 1H13C-HSQC, 1H13C-HMQC, 1H13C-HMBC, 1H15N-HMBC) и ИК спектроскопией, масс-спектрометрией, РСА].
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Реакции алкоксизамещённых N-(бута-1,3-диенил)кетиминов и -альдиминов (2-аза-1,3,5-триенов) с основаниями
1.1. N-(Бута-1,3-диенил)имины пропан-2-она как предшественники алкоксизамещённых 3Н-азепинов и 4,5-дигидро-3Н-азепинов
Алкоксизамещённые N-(бута-1,3-диенил)имины пропан-2-она (2-аза-1,3,5-триены 1а–ж) получены из алкоксиалленов 2а–д, изопропилизотиоцианата и алкилиодидов через одностадийный синтез и изомеризацию 1-аза-1,3,4-триенов 3а–ж. В качестве побочных продуктов в небольших количествах образуются пирролы 4 и в отдельных случаях – 2,3-дигидропиридины 5.
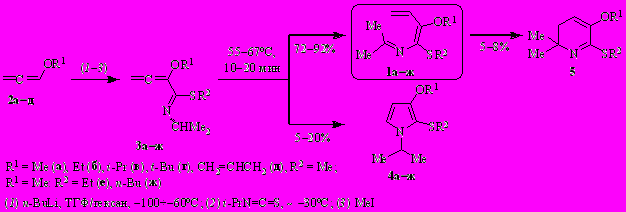
2-Аза-1,3,5-триены 1а–ж взаимодействуют с трет.-бутоксидом калия [1–1.5 экв., ТГФ/ДМСО (~4–5/1 по объёму), ~ –30°C, 30 мин] с образованием ранее неизвестных 2-(алкилсульфанил)-3-алкокси-7-метил-4,5-дигидро-3H-азепинов 6а–ж и 6-алкокси-2-метил-3H-азепинов 7а–в,д. Конверсия азатриенов 1а–ж количественная.
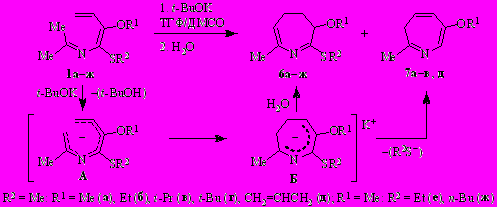
Таблица 1. Соотношение и выход 4,5-дигидро-3H-азепинов 6 и 3H-азепинов 7
| | R1 | R2 | Соотношение 6/7а | Общий выход,б,в % | Выход,б % | |
| Дигидроазепин 6 | Азепин 7 | |||||
| а | Me | Me | ~55/45 | 61 (71) | 23 | 38 |
| б | Et | Me | ~55/45 | 57 (85) | 23 | 34 |
| в | i-Pr | Me | ~85/15 | 75 (81) | 57 | 18 |
| г | t-Bu | Me | 100/0 | 31 (46) | 31 | 0 |
| д | CH2=CHCH2 | Me | ~65/35 | 57 (73) | 26г | 31г |
| е | Me | Et | ~70/30 | 58 (77) | 38 | 20д |
| ж | Me | n-Bu | ~80/20 | 50 (62) | 36 | 14д |
Примечание. аВ сырых продуктах реакции (по спектрам ЯМР 1Н). бПосле разделения продуктов колоночной хроматографией. вВ скобках указан общий выход всех продуктов, включая пиррол 4. гПосле разделения продуктов с помощью ~3%-ного раствора HCl. дАзепин 7а.
Роль трет.-бутоксида калия заключается в депротонировании метильной группы кетиминного фрагмента с образованием аниона А, который подвергается [1,7]-электроциклизации в азациклогептадиенил-анион Б. Протонирование последнего приводит к 4,5-дигидро-3H-азепину 6, а конкурентное элиминирование сульфид-аниона – к 3H-азепину 7.
Варьирование алкильных заместителей у атомов кислорода и серы заметно влияет на выход и соотношение продуктов реакции, основным из которых является 4,5-дигидро-3H-азепин 6. В случае азатриена 1г (R1 = t-Bu, R2 = Me) 4,5-дигидро-3H-азепин 6г – единственный продукт реакции.
Однако попытка получить аналогичным путем S-аллилзамещённый 4,5-дигидро-3Н-азепин 6з из 2-аза-1,3,5-триена 1з, синтезированного по той же схеме заменой MeI на аллилбромид, привела к неожиданному результату. Вместо дигидроазепина 6з был получен 4,4-диметил-2-(1-метоксипроп-2-енил)-5-(этилиден)-4,5-дигидро-1,3-тиазол (8) в смеси с 3Н-азепином 7а.
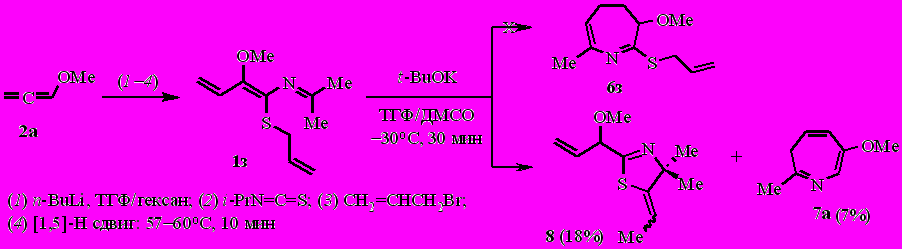
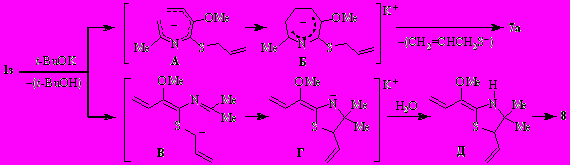
Очевидно, что при обработке 2-аза-1,3,5-триена 1з трет.-бутоксидом калия депротонированию подвергаются сразу два реакционных центра. Конкурентное депротонирование аллилсульфидного заместителя завершается образованием дигидротиазола 8.
Реакция, вероятнее всего, протекает через интермедиаты В–Д.
На примере 2-аза-1,3,5-триена 1a (R1 = R2 = Me) показано, что при проведении реакции в отсутствие ДМСО (1.1 экв. t-BuOK, ТГФ, 0°C, 10 мин) содержание 4,5-дигидро-3H-азепина 6a в смеси с 3H-азепином 7a повышается с 55 (см. табл. 1) до 75%. Однако увеличение продолжительности реакции с 10 до 60 мин не повлияло на соотношение продуктов. Изменение порядка и скорости введения реагентов, например, добавление азатриена 1a к суспензии t-BuOK в ТГФ по каплям при −85÷−65°C с последующим повышением температуры до –5°C уже через 2–3 мин привело к соединениям 6a и 7a в соотношении ~85:15 (по спектру ЯМР 1H).
Таким образом, очевидно, что ни большой избыток t-BuOK, ни увеличение продолжительности реакции не способствуют образованию 3Н-азепина 7.
С целью получения дополнительных данных о механизме образования 3 H-азепинов 7 протестирована реакция 4,5-дигидро-3H-азепина 6a с t-BuOK. Оказалось, что в условиях синтеза соединений 6а и 7а, т.е. в среде ТГФ/ДМСО при −30°C, реакция не идёт. Образование 3H-азепина 7a наблюдалось (по спектру ЯМР 1Н) при проведении реакции в ДМСО и при более высокой температуре (20−28°C).

Отсюда следует, что реакции протонирования–депротонирования циклических интермедиатов (с участием t-BuOН и t-BuOK) в условиях синтеза не реализуются, и что предшественником 3H-азепина, наиболее вероятно, является одна из таутомерных форм аниона Б.
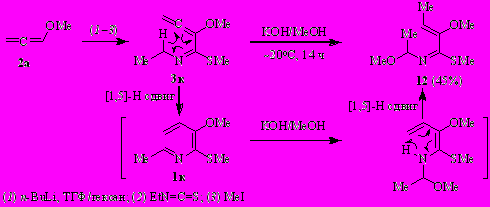
1.2. N-(Бута-1,3-диенил)имины бутан-2-она как предшественники 3Н-азепинов, 4,5-дигидро-3Н-азепинов и 2-(этилиден)-3,4,5,6-тетрагидро-2H-азепинов
Продолжая эти исследования, мы вовлекли в обсуждаемую реакцию несимметричный N-(бута-1,3-диенил)кетимин (2-аза-1,3,5-триен 1и), полученный из аллена 2а, втор-бутилизотиоцианата и MeI.
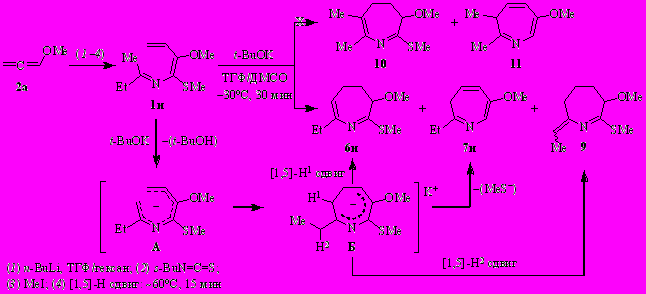
Оказалось, что депротонирование азатриена 1и трет.-бутоксидом калия протекает исключительно по метильной группе кетиминного фрагмента и наряду с 4,5-дигидро-3Н-азепином 6и и 3Н-азепином 7и приводит к 2-(этилиден)-3,4,5,6-тетрагидро-2H-азепину 9 [почти исключительно в (Z)-форме]. Суммарный выход соединений 6и, 7и и 9 ~93% (соотношение ~7:1:9 соответственно), по спектру ЯМР 1Н, и ~80% – после очистки. Образование экзо-азациклогептадиена 9, наиболее вероятно, связано с реализацией конкурентного [1,5]-Н2 сдвига. Соединения 10 и 11, образования которых можно было также ожидать, среди продуктов реакции не идентифицированы.
1.3. Алкоксизамещённые N-(бута-1,3-диенил)альдимины и их предшественники в реакциях с основаниями
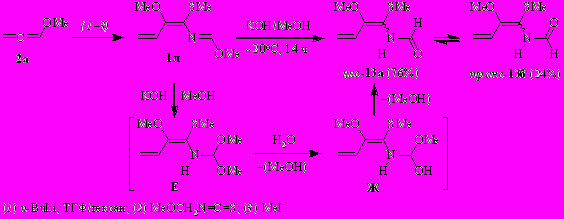
Обработка 1-аза-1,3,4-триена 3к, полученного из аллена 2а, этилизотиоцианата и MeI (без его выделения из реакционной смеси), раствором КОН в метаноле привела к метил-(Z)-2-метокси-N-(1-метоксиэтил)бут-2-енимидотиоату (12). Возможный маршрут реакции представлен на схеме.
Вовлечение в реакцию с метоксидом калия 2-аза-1,3,5-триена 1л (синтезированного из аллена 2а, метоксиметилизотиоцианата и MeI) в сопоставимых условиях эксперимента неожиданно привело к N-[(1Z)-1-(метилсульфанил)-2-метоксибута-1,3-диенил]формамиду (13) (неоптимизированный выход ~5%), вероятно, через последовательные реакции присоединения метанола к азатриену 1л, гидролиз амидацеталя Е и элиминирование метанола из интермедиата Ж.
В отличие от N-(бута-1,3-диенил)кетиминов 1а–ж, альдимин 1к взаимодействует с t-BuOK с образованием, наряду с ожидаемым 4,5-дигидро-3H-азепином 6к, 3,4-дигидро-2H-азепина 14 (в соотношении ~1:2, по спектру ЯМР 1Н) и 3-аза-1,4,6-триена 15. Последний является линейным предшественником азациклогептадиенов и идентифицирован впервые. При перегонке азатриен 15 циклизуется в дигидроазепины 6к и 14.

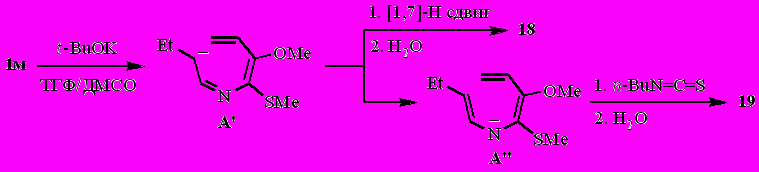
Тогда как N-(бута-1,3-диенил)альдимин 1м (с небольшой примесью бутилизотиоцианата) под действием t-BuOK вместо ожидаемых 4,5-дигидро-3Н-азепина 16 и 3Н-азепина 17 трансформируется в ранее неизвестные 3-аза-1,3,5-триен 18 [реализуется исключительно в (Z)-конфигурации] и тиомочевину 19.
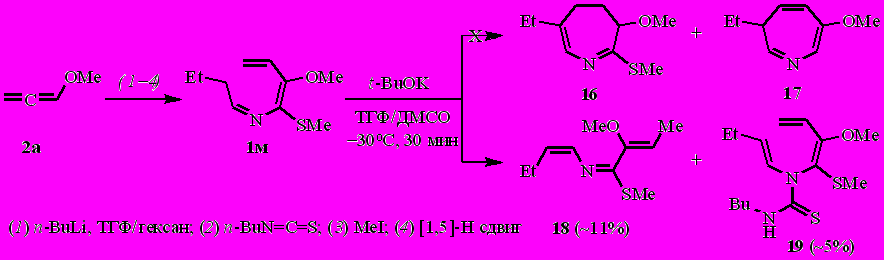
Наиболее вероятно, реакция протекает через интермедиаты А' и А".
2. N-(Бута-1,3-диенил)кетимины как предшественники ацеталь- и гидроксизамещённых 3Н-азепинов, 4,5-дигидро-3Н-азепинов, 2-этилиден-3,4,5,6-тетрагидро-2H-азепинов и 8-окса-6-азабицикло[3.2.1]окт-6-енов
Ацетальзамещённые N-(бута-1,3-диенил)имины пропан-2-она 1н–р взаимодействуют с трет.-бутоксидом калия с образованием преимущественно 4,5-дигидро-3Н-азепинов 6н–р (табл. 2), существующих в виде ~2:1 смеси диастереомеров. Как и в случае алкоксианалогов 1а–ж, в реакционной смеси идентифицированы пирролы 4н–р – побочные продукты синтеза 2-аза-1,3,5-триенов 1н–р.
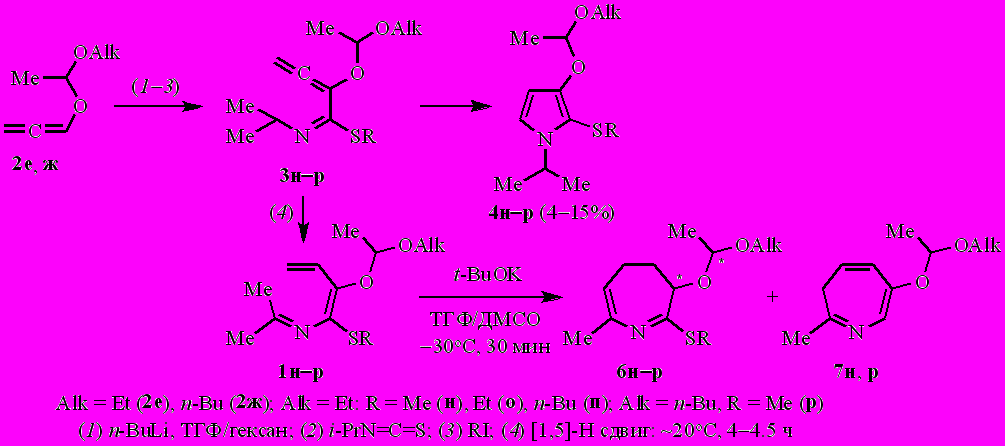
Таблица 2. Соотношение и выход 4,5-дигидро-3H-азепинов 6 и 3H-азепинов 7
| | Alk | R | Соотношение 6/7а | Общий выход,б % | Выход,б % | |
| Дигидроазепин 6 | Азепин 7 | |||||
| н | Et | Me | ~93/7 | 65 | 59 | 6 |
| о | Et | Et | ~96/4 | 69 | 55 | 14в |
| п | Et | n-Bu | ~99/1 | 61 | 56 | 5в |
| р | n-Bu | Me | ~93/7 | 64 | 59 | 5 |
Примечание. аВ сырых продуктах реакции (по спектрам ЯМР 1Н). бПосле разделения продуктов колоночной хроматографией. вАзепин 7н.
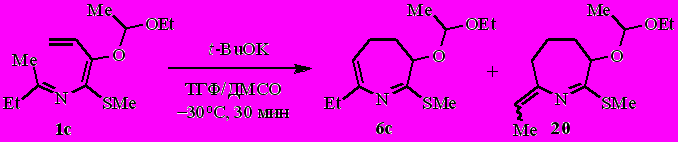
N-(Бута-1,3-диенил)имин бутан-2-она 1с, подобно метоксианалогу 1и, депротонируется трет.-бутоксидом калия с образованием эндо- и экзо-изомеров дигидроазепина – 6с и 20 в соотношении ~47:53 (по спектру ЯМР 1Н). Выход соединений 6с и 20 44% (после очистки).
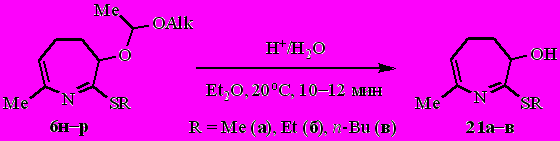
Обработка эфирных растворов 4,5-дигидро-3 Н-азепинов 6н–р ~3.5%-ным раствором соляной кислоты приводит к 4,5-дигидро-3H-азепин-3-олам 21а–в с выходом 52–75% (после перекристаллизации).
Из смеси дигидроазепинов 6с и 20 в аналогичных условиях с выходом 60% были получены 7-этил-4,5-дигидро-3 H-азепин-3-ол 22 и 2-этилиден-3,4,5,6-тетрагидро-2H-азепин-6-ол 23.
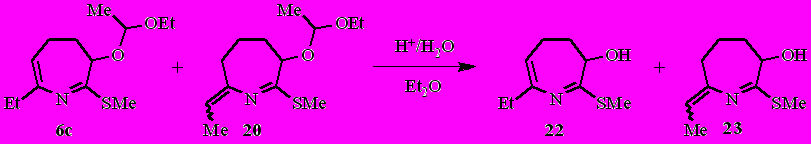
В присутствии каталитических количеств HCl 4,5-дигидро-3Н-азепин-3-олы 21а–в легко превращаются в 8-окса-6-азабицикло[3.2.1]окт-6-ены 24а–в (выход 62–80%).
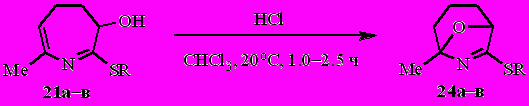
Из смеси азепинолов 22 и 23 с выходом 73% получен 8-окса-6-азабицикло[3.2.1]окт-6-ен 25.
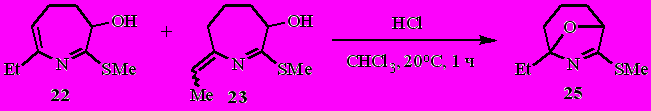
3. N-(Бута-1,3-диенил)кетимины как предшественники арил- и гетарилзамещённых 3Н-азепинов, 4,5-дигидро-3Н-азепинов и 2-этилиден-3,4,5,6-тетрагидро-2H-азепинов
Пропаргиларены 26а–д и -гетарены 26е–ж также, как алкокси- (2а–д) и ацеталь- (2е,ж) аллены, являются удобными стартовыми соединениями для получения разнообразных азатриеновых систем. Причём, в отличие от алленов 2а–ж, синтез арилзамещённых азатриенов не осложняется образованием пирролов и/или дигидропиридинов.
Вовлечение в реакцию с трет.-бутоксидом калия N-(бута-1,3-диенил)иминов пропан-2-она 27а–д приводит к 4,5-дигидро-3Н-азепинам 28а–д и 3Н-азепинам 29а–д с хорошими выходами (табл. 3).
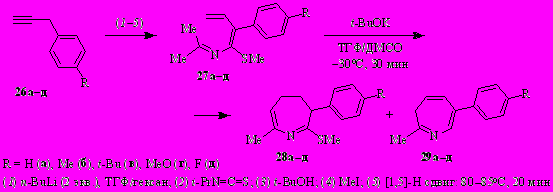
Таблица 3. Соотношение и выход 4,5-дигидро-3H-азепинов 28 и 3H-азепинов 29
| | R | Соотношение 28/29а | Общий выход,б % | Выход,б % | |
| Дигидроазепин 28 | Азепин 29 | ||||
| а | H | ~30/70 | 66 | 23 | 43 |
| б | Me | ~10/90 | 56 | 8 | 48 |
| в | t-Bu | ~25/75 | 99 | 25 | 74 |
| г | MeO | ~25/75 | 72 | 16 | 56 |
| д | F | ~45/55 | 65 | 24 | 41 |
Примечание. аВ сырых продуктах реакции (по спектрам ЯМР 1Н). бПосле разделения продуктов колоночной хроматографией.
Здесь, в отличие от алкокси- и ацетальаналогов 1, основным продуктом реакции является не 4,5-дигидро-3 H-азепин, а соответствующий 3H-азепин. Однако в отсутствие ДМСО (ТГФ, t-BuOK, 15°С, 30 мин) из 2-аза-1,3,5-триена 27а (R = H) получена ~1:1 смесь 4,5-дигидро-3H-азепина 28а и 3H-азепина 29а с общим выходом 74% (после флэш-хроматографии).
4-(5-Метил-2-тиенил)-2-аза-1,3,5-триен 27е под действием t-BuOK трансформируется исключительно в 6-(5-метил-2-тиенил)-3Н-азепин 29е.

Однако при переходе от тиенилзамещённого 2-аза-1,3,5-триена 27е к азатриену 27ж, содержащему 1-метилпиррол-2-ильный фрагмент, фактически, при замене атома серы на атом азота образуется смесь 4,5-дигидро-3H-азепина 28ж и 3H-азепина 29ж в соотношении ~78:22 (по спектру ЯМР 1Н).
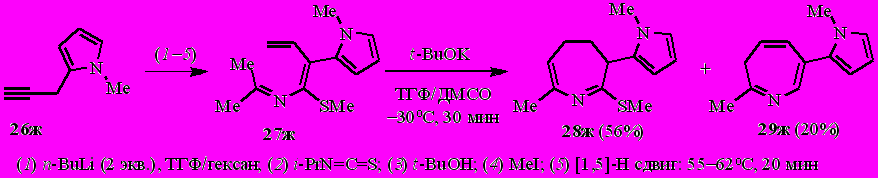
Пиррол-1-илзамещённый 2-аза-1,3,5-триен 27з под действием t-BuOK превращается в 4,5-дигидро-3Н-азепин 28з и 3Н-азепин 29з в соотношении ~87:13 (по спектру ЯМР 1Н).
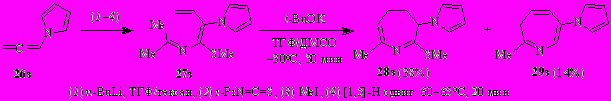
Из N-(бута-1,3-диенил)имина бутан-2-она 30 в аналогичных условиях получена смесь дигидроазепинов 31 и 32 в соотношении ~40:60 (по спектру ЯМР 1Н). Выход 44% (после флэш-хроматографии).

4. N-(Бута-1,3-диенил)имины циклоалканонов как предшественники аннелированных азепинов и ди- и тетрагидроазепинов
Ди- и трициклические азепины, в том числе 1-бензазепины и их производные обладают ярко выраженной биологической активностью и находят широкое применение в медицинской практике. Однако 6,7,8,9-тетрагидро-1-бензазепины и другие циклоалкан[b]азепины до сих пор оставались неизвестными.
Вовлечение в реакцию с t-BuOK N-(бута-1,3-диенил)иминов циклопентанона, циклогексанона и циклогептанона 33а–к, полученных из алленов 2а,е или алкинов 26а,е, циклоалкилизотицианатов (циклопентил-, циклогексил- и циклогептил-) и алкилиодидов, привело к новым классам бициклических азепинов и дигидроазепинов.
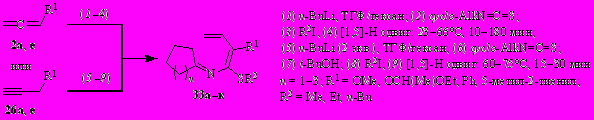
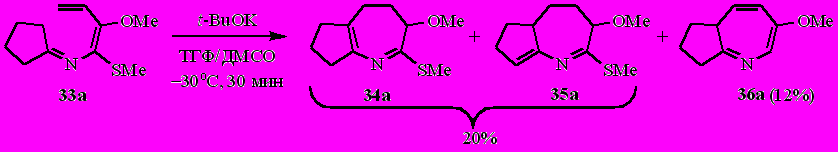
Так, из метоксизамещённого N-(бута-1,3-диенил)имина циклопентанона 33а получена смесь 3,4,5,6,7,8-гексагидроциклопента[b]азепина 34а, 3,4,5,5a,6,7-гексагидроциклопента[b]азепина 35а и 5a,6,7,8-тетрагидроциклопента[b]азепина 36а в соотношении ~58:12:30 (по спектру ЯМР 1Н).
Реакция ацетальаналога 33б с t-BuOK привела к двум продуктам – гомо- и гетероаннулярным дигидроазепинам 34б и 35б в соотношении ~2:1 (по спектру ЯМР 1Н), которые были выделены с общим выходом 53%.

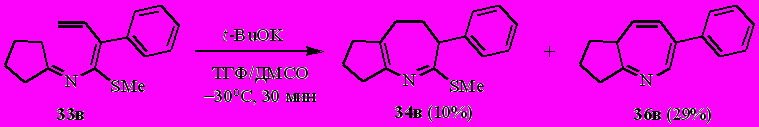
В отличие от кетиминов 33а,б, фенилзамещённый N-(бута-1,3-диенил)имин циклопентанона 33в при обработке трет.-бутоксидом калия, во-первых, не даёт гетероаннулярного азациклогептадиена, а во-вторых, образует смесь двух продуктов, основным в которой является не дигидроазепин (как в случае соединений 33а,б), а азепин 36в. Соотношение соединений 34в/36в = ~30:70 (по спектру ЯМР 1Н). Аналогичное соотношение продуктов наблюдалось и в реакции фенилзамещённого имина пропан-2-она 27а с t-BuOK (см. табл. 3).
Единственными продуктами реакции метокси- и ацетальзамещённых N-(бута-1,3-диенил)иминов циклогексанона 33г–ж с t-BuOK оказались гетероаннулярные азациклогептадиены 35г–ж (табл. 4).
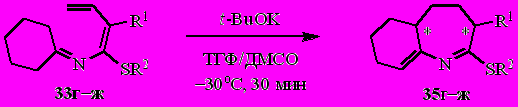
Таблица 4. Выход и соотношение диастереомеров гетероаннулярных азациклогептадиенов 35г–ж
-
R1
R2
Выход,а %
Соотношение диастереомеровб
г
OMe
Me
66
~3.0/1
д
OMe
Et
54
~3.5/1
е
OMe
n-Bu
65
~4.2/1
ж
OCH(Me)OEt
Me
62
~4.0/1
Примечание. аПосле разделения продуктов колоночной хроматографией. бПо спектру
ЯМР 1Н.
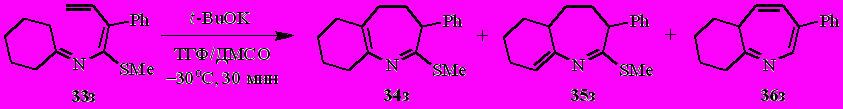
Иначе ведёт себя в обсуждаемой реакции и фенилзамещённый N-(бута-1,3-диенил)имин циклогексанона 33з. В этом случае основными продуктами являются гомо- и гетероаннулярные дигидроазепины 34з и 35з (до 98% в смеси, соотношение ~1.5:1), тогда как содержание азепина 36з не превышает 2% (по спектру ЯМР 1Н). Выход 64% (после флэш-хроматографии).
Механизм образования гомо- и гетероаннулярных азациклогептадиенов, скорее всего, аналогичен таковому для эндо- и экзо-азациклогептадиенов.
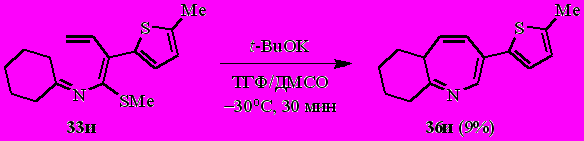
Как и в случае тиенилзамещённого азатриена 27е, единственным продуктом реакции N-(бута-1,3-диенил)имина циклогексанона 33и с t-BuOK является соответствующий азепин (36и).
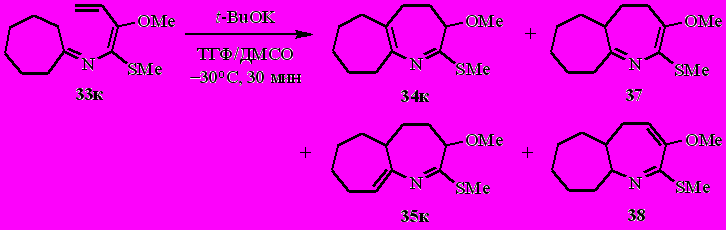
Из метоксизамещённого N-(бута-1,3-диенил)имина циклогептанона 33к под действием t-BuOK, напротив, образуются сразу четыре бициклических дигидроазепиновых структуры с общим выходом 70%, две из которых (34к и 37) выделены в индивидуальном виде, а две другие идентифицированы по спектрам ЯМР. Соотношение соединений 34к/35к/37/38 = ~47:3:25:25 (по спектру ЯМР 1Н).
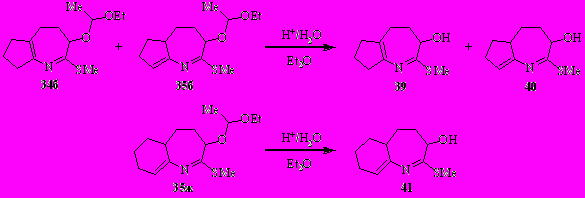
Ещё три новых представителя бициклических производных азепина, содержащих гидроксильные группы, были получены мягким гидролизом ацетальзамещённых предшественников. Из дигидроазепинов 34б и 35б была получена смесь азепинолов 39 и 40 с выходом 39%, а из гетероаннулярного дигидроазепина 35ж – азепинол 41 (выход 66%).
выводы
1. Впервые систематически изучены реакции 2-аза-1,3,5-триенов [N-(бута-1,3-диенил)альдиминов и -кетиминов], легкодоступных из изотиоцианатов, литиированных алленов или ацетиленов и алкилирующих агентов, с сильными основаниями, и на их основе разработан принципиально новый общий подход к конструированию семичленных азагетероциклов – азепинов и дигидроазепинов, известные представители которых широко распространены в природных биосистемах и находят применение в медицине и фармакологии в качестве лекарственных средств либо их предшественников:
1.1. Синтезированы широкие ряды (~40 соединений) ранее неизвестных 1-аза-1,3,4-триенов [N-алкил(циклоалкил)бута-2,3-диенимидотиоатов] и изучены их сигматропные перегруппировки в 2-аза-1,3,5-триены. Найдены условия, позволяющие исключить или минимизировать конкурентные реакции гетероциклизации алкоксизамещённых представителей 1-аза-1,3,4-триенов и 2-аза-1,3,5-триенов в пирролы и 2,3-дигидропиридины.
1.2. Исследовано влияние строения исходного 2-аза-1,3,5-триена, природы основания, растворителя, соотношения реагентов и других параметров процесса на выход, строение и соотношение продуктов реакции:
- Найдено, что наиболее эффективным депротонирующим основанием для объектов данного исследования оказался простой и доступный трет.-бутоксид калия, а наиболее подходящим растворителем – тетрагидрофуран или тетрагидрофуран/диметилсульфоксид (~4–5/1 по объему).
- Установлено, что условия реакции и природа заместителей в бутадиеновой части молекулы (контролируемых строением исходного аллена или алкина и алкилгалогенида) в основном влияют на выход и соотношение продуктов реакции – 4,5-дигидро-3H-азепинов и 3H-азепинов. Тогда как заместители в азометиновой части молекулы (контролируемые строением изотиоцианата) оказывают существенное влияние на направление реакции, состав и строение продуктов.
1.3. Доказано, что трансформации нейтральных молекул 4,5-дигидро-3Н-азепинов в 3Н-азепины под действием t-BuOK в условиях синтеза (ТГФ/ДМСО, –30°С, 30 мин) не происходит. Образование 3Н-азепинов из 4,5-дигидро-3Н-азепинов наблюдалось в среде ДМСО и при более высоких температуре и продолжительности реакции (t-BuOK, 20–28°С, ≥ 1 ч).
1.4. Обнаружены неожиданные направления реакций азатриеновых систем с основаниями, открывающие оригинальные выходы к новым классам потенциально полезных и перспективных соединений – 2-(проп-2-енил)-5-(этилиден)-4,5-дигидро-1,3-тиазолам, азадиеновым N,O-аминалям, 1,3-бутадиенам с формамидными группировками, N-(алк-1-енил)-N-(бута-1,3-диенил)тиомочевинам, N-(алк-1-енил)алк-2-енимидотиоатам и др.
2. Найден простой и эффективный подход к синтезу алкилсульфанилзамещённых 8-окса-6-азабицикло[3.2.1]окт-6-енов – из ацетальалленов, изотиоцианатов и алкилгалогенидов.
3. Создан уникальный ассортимент (свыше 70 соединений) не имеющих аналогов биологически и синтетически важных функционально замещённых азепиновых структур (моно- и бициклических, с эндо- и экзо-циклическими двойными связями, гомо- и гетероаннулярных) – 3H-азепинов, 3,4-дигидро-2Н-азепинов, 4,5-дигидро-3H-азепинов, 2-этилиден-3,4,5,6-тетрагидро-2H-азепинов, тетрагидроциклопента[b]азепинов, гексагидроциклопента[b]азепинов, гексагидро-3H-1-бензазепинов и др. с биогенными и фармакофорными заместителями.
Основное содержание диссертации изложено в следующих публикациях:
Статьи:
| | Nedolya N.A., Tarasova O.A., Albanov A.I., Volostnykh O.G., Brandsma L., Trofimov B.A. A New Approach to Densely Functionalised Azepines and Dihydroazepines. Mendeleev Commun. 2008. Vol. 18. No. 3. P. 164–166. |
| | Недоля Н.А., Тарасова О.А., Волостных О.Г., Албанов А.И. Новый подход к формированию азепинового ядра: синтез 2-метил-6-(5-метил-2-тиенил)-3Н-азепина из 2-метил-5-пропаргилтиофена и изотиоцианата. ХГС. 2008. № 9. С. 1380–1383. |
| | Недоля Н.А., Волостных О.Г., Тарасова О.А., Албанов А.И., Трофимов Б.А. Новые направления трансформаций 2-аза-1,3,5-триенов под действием системы t-BuOK–ТГФ–ДМСО. ЖОрХ. 2011. Т. 47. Вып. 1. С. 141−145. |
| | Недоля Н.А., Тарасова О.А., Волостных О.Г., Албанов А.И., Трофимов Б.А. Неожиданные трансформации 1-аза-1,3,4-триенов в спиртовом растворе КОН. Выход на новые классы азадиенов. ЖОрХ. 2011. Т. 47. Вып. 1. С. 146−149. |
| | Nedolya N.A., Tarasova O.A., Volostnykh O.G., Albanov A.I., Klyba L.V., Trofimov B.A. Reactions of Lithiated Alkynes and Allenes with Isothiocyanates: A Simple and Efficient Synthesis of New Aryl- or Hetaryl-Substituted 3H-Azepines and 4,5-Dihydro-3H-azepines. Synthesis. 2011. No. 14. P. 2192−2204 (Feature article). |
| | Nedolya N.A., Tarasova O.A., Volostnykh O.G., Albanov A.I., Trofimov B.A. Simultaneous synthesis of 4,5-dihydro-3H-azepines and 3H-azepines, bearing alkoxy and alkylsulfanyl substituents, through metallation of 2-aza-1,3,5-trienes by t-BuOK. J. Organomet. Chem. 2011. Vol. 696. No. 21. P. 3359−3368. |
Тезисы докладов:
| | Недоля Н.А., Волостных О.Г., Тарасова О.А., Дмитриева Г.В., Брандсма Л., Трофимов Б.А. Блокированный алленол в синтезе функционализированных дигидроазепинов. – В кн.: Тезисы Международной конференции по органической химии «Химия соединений с кратными углерод–углеродными связями» (16–19 июня 2008, Санкт-Петербург). С. 131. |
| | Волостных О.Г., Недоля Н.А., Тарасова О.А., Кажева О.Н., Чехлов А.Н., Дьяченко О.А., Албанов А.И., Шагун В.А., Трофимов Б.А. Новый подход к синтезу аннелированных дигидроазепинов. Неожиданная миграция С=С связи в гексагидро-3Н-1-бензазепинах. – В кн.: Материалы международной конференции «Основные тенденции развития химии в начале XXI-го века», посвященной 175-летию со дня рождения Д. И. Менделеева и 80-летию создания химического факультета Санкт-Петербургского университета (21–24 апреля 2009, Санкт-Петербург). С. 341. |
| | Волостных О.Г., Недоля Н.А., Тарасова О.А., Албанов А.И., Трофимов Б.А. Неожиданные трансформации азатриеновых систем в спиртовом растворе КОН: оригинальный синтез азадиениламиналя и бутадиенилформамида. – В кн. Материалы Всероссийской Молодежной конференции-школы, посвященной 150-летию со дня рождения А. Е. Фаворского «Идеи и наследие А. Е. Фаворского в органической и металлоорганической химии XXI века» (23–26 марта 2010 г., Санкт-Петербург). С. 56. |
| | Волостных О.Г., Недоля Н.А., Тарасова О.А., Албанов А.И., Трофимов Б.А. Неожиданные перегруппировки в ряду 2-аза-1,3,5-триеновых карбанионов. – В кн.: Тезисы докладов XIII Молодежной научной школы–конференции «Актуальные проблемы органической химии» (12–19 сентября 2010, Новосибирск). С. 98. |
