Гнойно-септические заболевания послеродового периода: комплексная диагностика, лечение и профилактика 14. 01. 01 акушерство и гинекология
| Вид материала | Автореферат диссертации |
- Гнойно-септические осложнения в трансплантологии и кардиохирургии: эпидемиология, 966.17kb.
- Япоевна клиническое значение диагностики и коррекции нарушений в системе гемостаза, 316.66kb.
- Кардиаск — спросите у сердца, 65.82kb.
- 1. Параректальные свищи. Этиология. Патогенез. Классификация. Клиника. Диагностика., 80.83kb.
- Немедикаментозная терапия послеродового нейрообменного эндокринного синдрома 14. 00., 562.97kb.
- Российская научно-практическая конференция Нарушения мозгового кровообращения: диагностика,, 51.34kb.
- Задачи занятия: научить студента уметь целенаправленно выявлять и оценивать жалобы:, 161.25kb.
- Тема: Сепсис новорожденного. Гнойно-воспалительные заболевания, 189.17kb.
- Программа «Профилактика, ранняя диагностика и лечение онкологических заболеваний, 118.22kb.
- Дифференцированное консервативное лечение обострения хронического сальпингоофорита, 362.88kb.
Таблица 2.
Результаты лабораторных тестов у обследованных групп женщин
| Лабораторные показатели | Подгруппа А (n=25) Ме | Подгруппа Б (n=92) Ме | Контрольная гр. (n=45) Ме |
| Эритроциты(1012 /л | 2,8[2,5;3,0] | 3,2[2,9;3,6] | 3,4[2,9;4,1] |
| Гемоглобин г/л | 78[73;82]* ** | 85[82;95] | 98 [90;132] |
| Лейкоциты (109 /л) | 15,4[2,1;35,0]** | 13,2[7,5;20,5] | 10,2[7,5;15,5] |
| Тромбоциты(109 /л) | 120[100;145]* ** | 175[120;230] | 163[120;230] |
| Протеинемия г/л | 48[42;52] * ** | 63[55,1;69,9] | 67[55,1;59,9] |
| AST ед | 0,5[0,48;0,61]* ** | 0,35[0,47;0,27] | 0,3[0,47;0,27] |
| ALT ед | 0,7[0,64;0,78]* ** | 0,5[0,47;0,62] | 0,5[0,47;0,62] |
| Альфа-амилаза | 106[90;125]* ** | 34,5[26;40]*** | 24,5[16;40] |
| Креатинин мкм/л | 153[103;180]* ** | 86 [66;101]*** | 66 [46;91] |
| ЛИИ У.Е | 6,3±0,4* | 3,2±0,2*** | 1,4±0,2 |
| РСТ-Q тест нг/мл | > 10* | От 0,5 до 2*** | <0,5 |
Примечание: * - р < 0,05 - достоверная разница между подгруппой А и подгруппой Б; ** - р < 0,05 - между подгруппой А и контрольной группой, ***- р < 0,05 - между подгруппой Б и контрольной группой.
Достоверную разницу (p<0,05) у родильниц подгруппы А по отношению к контрольной наблюдали в количестве тромбоцитов, протеинемии, уровне панкреатической амилазы, креатинина, лейкоцитарного индекса интоксикации и прокальцитонина, что подтверждает диагноз сепсиса и нарушение функции жизненно важных органов. Важно подчеркнуть, что у всех женщин содержание прокальцитонина в сыворотке крови было больше 10 нг/мл. При сравнении показателей у женщин с послеродовым эндометритом и контрольной группы достоверные различия (p<0,05) были только в уровнях лейкоцитарного индекса интоксикации (в 2раза) и прокальцитонина. Отмечена слабая корреляция по количеству лейкоцитов в крови у родильниц подгруппы А и подгруппы Б (r=0,25; p<0,05). У родильниц с сепсисом и послеродовым эндометритом не было достоверной разницы (p>0,05) по количеству лейкоцитов в крови, при этом у родильниц в подгруппе А уровень лейкоцитоза имел диапазон от 2,1 до 35,0 ∙ 109/л.
Следует отметить, что у женщин подгруппы А, наличие синдрома системного воспалительного ответа подтверждалось наличием лихорадки, тахикардии, как высоким лейкоцитозом, так и лейкопенией, а также уровнем прокальцитонина, который неизменно у всех родильниц был более 10 нг/л, и лейкоцитарного индекса интоксикации (в среднем 6,3±0,4). Особый интерес вызывает уровнень прокальцитонина в сыворотке крови при различных формах послеродовой инфекции представлено в табл. 3.
Таблица 3
Показатели прокальцитонина при различных клинических формах гнойно-септических заболеваний послеродового периода
-
Заболевание
Клиническая форма
Уровень РСТ
Коэффициент Спирмена
Эндометрит (n=165)
ПЭ стертая форма (n=73)
< 0,5 нг/мл
0,56
Классический ПЭ (n=92)
> 0,5 < 2,0 нг/мл
0,83
ССВО (n=14)
> 2,0 < 10,0 нг/мл
0,75
Сепсис (n=25)
> 10,0 нг/мл
0,90
Примечание: уровень прокальцитонина определяли полуколичественным методом
Нами выявлена прямая зависимость (r=0,81; p<0,05) между тяжестью ГСЗ послеродового периода и нарастанием уровня прокальцитонина в сыворотке крови последовательно - от классического эндометрита до сепсиса (рис. 1).
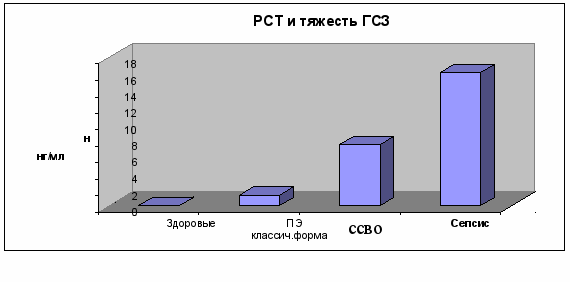
Рис. 1. Соотношение уровня прокальцитонина (РСТ) со степенью тяжести послеродового эндометрита и сепсиса.
Необходимо отметить, что тест на прокальцитонин позволяет дифференцировать ПЭ и от сепсиса, что особенно важно в определении лечебной тактики. Нами выявлена сильная корреляция (r=0,86; p<0,05) показателей лейкоцитарного индекса интоксикации и тяжести инфекционного процесса (рис. 2).
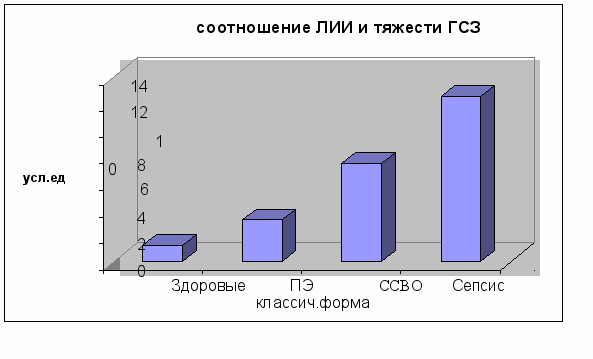
Рис. 2. Соотношение уровня лейкоцитарного индекса интоксикации и различных форм гнойно-септических заболеваний послеродового периода.
При типичной картине ПЭ и послеродового сепсиса постановка диагноза у практического врача не вызывает никаких затруднений. Диагностические трудности возникают при наличии пограничных состояний: при ПЭ – когда клинические признаки не соответствуют тяжести процесса, а синдром системного воспалительного ответа необходимо дифференцировать от сепсиса, чтобы определить метод лечения (хирургический радикальный или консервативно-хирургический). С учетом этих обстоятельств, а также результатов наблюдений для оценки тяжести ГСЗ послеродового периода нами предложен алгоритм с применением РСТ-Q-теста. Его целесообразно использовать в группе родильниц, имеющих два и более симптома послеродовой инфекции: температура тела выше 37,5ºС; патологический характер лохий, болезненность матки при пальпации, субинволюция матки, лейкоцитоз, лейкопения (рис.3).
АЛГОРИТМ ДИАГНОСТИКИ ПОСЛЕРОДОВОГО ЭНДОМЕТРИТА И СЕПСИСА С ПОМОЩЬЮ ОПРЕДЕЛЕНИЯ УРОВНЯ ПРОКАЛЬЦИТОНИНА (PCT)
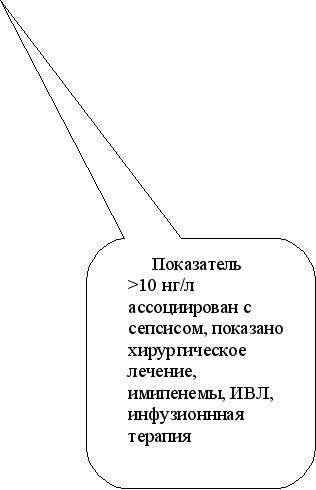
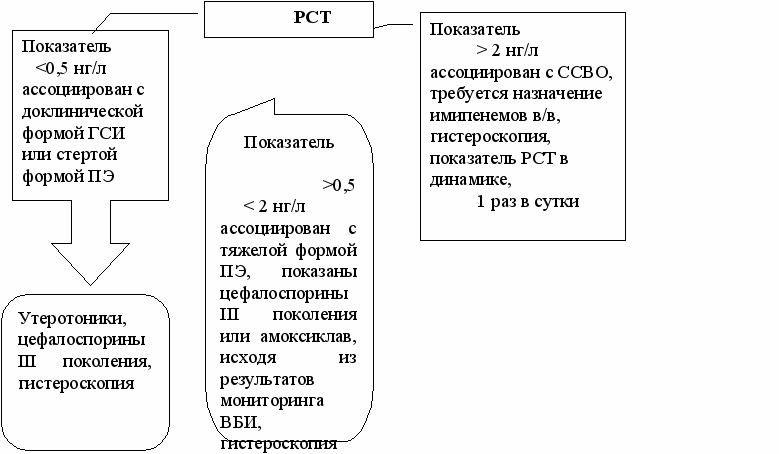
Рис. 3. Алгоритм диагностики послеродового эндометрита и сепсиса с применением РСТ-Q-теста.
Этот алгоритм позволяет выбрать адекватную лечебную и хирургическую тактику при гнойно-септических заболеваниях послеродового периода. Уровень прокальцитонина в сыворотке крови является высокочувствительным тестом в случаях стертой клинической картины для дифференциального диагноза осложнений послеродового периода.
Для определения специфичности теста на прокальцитонин при различном генезе синдрома системного воспалительного ответа мы исследовали уровни указанного прогормона у родильниц с тяжелыми формами гестоза. При определении уровня РСТ в крови в комплексе с биохимическими маркерами отчетливо определена разница в тяжести гестоза, который находится: при преэклампсии в интервале от 0,5 до 2,0 нг/мл; при эклампсии более 2,0 нг/мл (p<0,05) и полиорганной недостаточностью (шкала SOFA до 12±4 баллов). В группе родильниц без гестоза (из контрольной группы) у всех женщин (n=46) уровень РСТ в сыворотке крови составил <0,5 нг/мл, что указывает на присутствие у женщин с преэклампсией и эклампсией генерализованной воспалительной сосудистой реакции (третьей стадии синдрома системного воспалительного ответа) и подтверждает значение РСТ-теста в определении тяжести гестоза как наиболее достоверного и доступного метода диагностики (приэтом его выполнение возможно у постели больного) (табл. 4).
Таблица 4.
Изменения биохимических тестов у родильниц на 1-е сутки родоразрешения по поводу преэклампсии и эклампсии в комплексе с РСТ - тестом
-
Неинфекционный ССВО, n=33
Биохимические тесты
Преэклампсия, n=22
Эклампсия, n=11
ALT, у.е
32,93±4,96
31,20±4,34
AST, у.е
27,06±4,62
24,63±5,37
Белок общий, г/л
54,50±2,00
48,99±3,41*
Креатинин, мкм/л
71,78±4,11
93,72±5,90*
Мочевина, мм/л
5,09±0,43
4,84±0,55
Глюкоза, г/л
6,44±2,13
4,50±0,28
Шкала SOFA
0 баллов
от 1 до 15 баллов
РСТ, нг/мл
> 0,5 < 2,0
> 2*
Примечание: * - p<0,05 - достоверная разница между лабораторными показателями у женщин с преэклампсией и эклампсией.
Далее нами было проведено формирование комплекса критериев, указывающих на присоединение инфекции на фоне имеющегося синдрома системного воспалительного ответа у женщин после перенесенной эклампсии, с формированием клиники сепсиса (табл. 5).
Таблица 5.
Сравнительная характеристика синдрома системного воспалительного ответа неинфекционного и инфекционного генеза
| Критерии | Неинфекционный ССВО (преэклампсия n=22, эклампсия n=11) n=33 | Инфекционный ССВО (ССВО n=14, сепсис после перенесеннной эклампсии) n=23 |
| Температура тела в ºС | Норма или до 37,5±0,4ºС в первые сутки после родов | Температура тела больше 38ºС с ознобом |
| Частота пульса | Более 90 ударов в мин. | Более 90 ударов в мин. |
| Частота дыхания | 12-16 дых. движений в мин, более 18 дых. движений в мин. при РДСВ и отеке легких | Более 20 дых. движений в мин, при РДСВ и отеке легких – продленная ИВЛ с кислородной поддержкой |
| Сознание | При преэклампсии – оглушенность, сопор; при эклампсии – сопор, кома | Кома, сопор, продленная ИВЛ с нейровегетативной. блокадой |
| Эндогенная интоксикация | ЛИИ от 7,1 до 12,0 у.е. | ЛИИ от 12,1 у.е и более |
| ЖВО | Преэклампсия – нарушение микроциркуляции ЖВО; эклампсия – ПОН | ССВО – дисфункция ЖВО; сепсис – ПОН |
| Уровень РСТ в крови | Преэклампсия - от 0,5 до 2,0 нг/мл; эклампсия - более 2,0 нг/мл | более 2,0 нг/мл – ССВО более 10,0 нг/мл – сепсис |
| Уровень лейкоцитов в крови 109 /л | Преэклампсия-11,6±1,14; эклампсия - 21,37±9,4 | ССВО – 23,16±7,6 сепсис- 28,4±8,8 |
| Уровень лимфоцитов в лейкоцитарной формуле, % | Преэклампсия 20,29±0,87 эклампсия 12,91±0,73 | 12,06±1,01 – ССВО; 11,0±0,79 - сепсис |
| Шкала SOFA | Преэклапсия – 0 баллов Эклапсия 12±4 | ССВО – 0 баллов Сепсис - 21±4 |
Таким образом, у женщин, родоразрешенных по поводу тяжелой преэклампсии и эклампсии, особенно осложненных комой, кровотечением, респираторным дистресс-синдромом, создаются условия для присоединения инфекции на фоне имеющейся полиорганной недостаточности.
Необходимо отметить, что у родильниц при инфекционных осложнениях после перенесенной эклампсии не было корреляции между уровнем прокальцитонина в сыворотке крови и признаками сепсиса, так как при проведении теста на прокальцитонин у группы женщин с ССВО (n=14) и акушерским сепсисом без признаков гестоза (n=25) содержание предшественника кальцитонина составило более 2 нг/мл. Такие же данные в уровне содержания прокальцитонина мы наблюдали у родильниц с эклампсией (n=11).
Таким образом, тест на прокальцитонин высоко информативен при «чистом» акушерском сепсисе и «чистой» эклампсии, но не работает у родильниц с сепсисом после перенесенной эклампсии (n=23), так как нельзя определить генез патологии, вызывающий усиленный синтез прокальцитонина.
При проведении реополикардиографии и объемной компрессионной осциллометрии у женщин с синдромом системного воспалительного ответа инфекционного генеза, развившейся на фоне преэкламсии и эклампсии как проявление тяжелой эндотелиальной дисфункции, нами выявлены значительные гемодинамические нарушения, как сердечной деятельности, так и периферического кровообращения.
Для проведения объемной компрессионной осциллометрии с целью оценки гемодинамики у женщин с признаками синдрома системного воспалительного ответа инфекционного генеза на фоне эклампсии были обследованы три группы пациенток: подгруппа А (n=25) (послеродовой сепсис) подгруппа В (n=23) женщин с сепсисом после перенесенной эклампсии и здоровые родильницы (из контрольной группы, n=25). Сначала исследовали изменения центрального кровотока (табл. 6). При оценке данных осциллометрических критериев сердечной деятельности, достоверная разница (р<0,05) между группами наблюдалась в частоте пульса и величине сердечного индекса, но при этом необходимо отметить снижение в подгруппе В по сравнению с контрольной, волюметрических показателей – ударного объема и ударного индекса. Это свидетельствует о том, что сопровождающая эклампсию гиповолемия, сохраняется далее при сепсисе.
Таблица 6. Осциллометрические показатели сердечной деятельности у женщин с послеродовым сепсисом и сепсисом после перенесенной эклампсии
| Показатели гемодинамики | Единицы измерения | Подгруппа В (n=23) | Подгруппа А (n=25) | Контрольная группа (n=25) |
| Пульс | уд./мин | 104±11* | 97±11** | 72±12 |
| Сердечн. выброс | л/мин | 4,1±1,4 | 4,8±1,8 | 5,1±1,8 |
| Сердечн. индекс | л/(мин.кв.м | 1,8±0,6* | 1,6±0,6** | 2,9±0,5 |
| Ударный объем | мл | 54±11 | 52±8 | 69±13 |
| Ударный индекс | Мл/кв.м | 29±5 | 28±5 | 36±6 |
| Объемная скорость выброса | мл/с | 162±19 | 144±19 | 216±24 |
| Мощность сокращений ЛЖ | Вт | 2,5±1,7 | 2,4±1,9 | 3,0±1,8 |
| Расход энергии на 1л сердечного. выброса | Вт ∙ с/л | 12,4±2,9 | 13,2±3,6 | 11,1±3,8 |
Примечание: * - p<0,05 - достоверная разница между группой В и контрольной группой. ** - p<0,05 - между группой А и контрольной.
Затем нами было проведено осциллометрическое исследование сосудистых показателей периферического кровообращения, результаты которого приведены в табл. 7.
Таблица 7
Осциллометрические показатели гемодинамики в подгруппах А, В и в контрольной группе
| Показатели гемодинамики | Единицы измерения | Подгруппа В n=23 | Подгруппа А n=25 | Контрольная группа n=25 |
| Скорость кровотока линейная | см/с | 54±12 | 51±12 | 45±17 |
| Скорость пульсовой волны | см/с | 1186±112* ** | 456±73 *** | 615±87 |
| Податливость сосудист. системы | мл/мм.рт.ст | 2,1±0,6* ** | 0,9±0,4 | 1,2±0,5 |
| ОПСС | дин∙см-5∙с | 1389±84* ** | 689±67 *** | 1012±73 |
| УПСС | у.ед. | 34±6* ** | 14±3 | 21±4 |
Примечание:* - p<0,05 - достоверная разница между подгруппой В и контрольной группой. ** - p<0,05 - между подгруппой А и подгруппой В,*** - p<0,05 - между подгруппой А и контрольной группой.
При оценке осциллометрических показателей периферического кровообращения достоверная разница между женщинами подгрупп А и В наблюдалась в скорости пульсовой волны и в показателях периферического сопротивления сосудов (ОПСС, УППС, податливость сосудистой системы, скорость пульсовой волны), что указывает на выраженный спазм периферических сосудов, который сохраняется при септических осложнениях эклампсии, особенно на фоне эклампсической комы. У женщин подгруппы А (послеродовой сепсис), напротив, были низкие показатели периферического сопротивления сосудов, что сопровождалось гипотонией и тахикардией. У всех родильниц контрольной группы выявлен эукинетический тип кровообращения. У женщин подгруппы В (n=23) в 21 случаях определяли гипокинетический тип кровообращения и только в 2 случаях - смешанный тип.
Таким образом, сепсис у родильниц после перенесенной эклампсии в сравнении с «классическим» послеродовым сепсисом имеет свои клинико-лабораторные особенности. Прежде всего прокальцитониновый тест теряет свою универсальность, кроме того сохраняются и даже прогрессируют выраженные изменения периферического кровообращения (ОПСС, УППС, податливость сосудистой системы, скорость пульсовой волны), что способствует продолжающейся ишемии жизненно важных органов и усугубляет полиорганнную недостаточность.
Первым симптомом, указывающим на появление инфекционного осложнения у женщин, родоразрешенных по поводу тяжелого гестоза, является гипертермия более 38˚С с ознобом в сочетании с признаками эндогенной интоксикации (тахикардия, гипотония, лимфоцитопения). Важным критерием, позволяющим подтвердить синдром системного воспалительного ответа реакцию при эклампсии, является уровень прокальцитонина в крови. Как уже указывалось, данный показатель теряет специфичность при появлении признаков инфекции (септических осложнениях эклампсии), так как при эклампсии и системного инфекционного ответа инфекционного генеза содержание прокальцитонина в сыворотке крови > 2 нг/мл.
Нами выявлено, что уровень прокальцитонина значительно снижается в случае хирургического лечения сепсиса при отсутствии признаков тяжелого гестоза. Показанием к радикальному удалению первичного очага во всех случаях наблюдения была клиническая картина тяжелого сепсиса признаками гнойного послеродового эндометрита (гистологическое заключение – гнойный метроэндометрит) и полиорганной недостаточности. При этом в 1-3 дни после родов, 1-2 сутки после операции наблюдали рост уровня прокальцитонина, а затем прогрессивное его снижение. Результаты представлены на рис. 5.
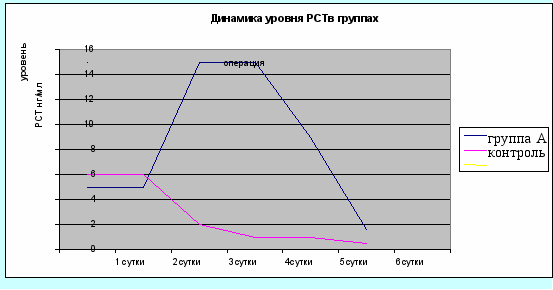
Рис. 5. Изменение уровня прокальцитонина (РСТ) у женщин группы А с сепсисом) и группы сравнения с 1 по 6 сутки послеродового периода.
У женщин подгруппы А (сепсис) к 3-4-м суткам послеродового периода отмечалось как повышение температуры тела более 38˚С с ознобом, так и признаки эндогенной интоксикации (тахикардия, гипотония, высокий уровень лейкоцитов в крови, лифоцитопения). На этом фоне повышался уровень РСТ в крови более 10 нг/л , а в контрольной группе – от 0,5 до 2,0 нг/мл.
При сравнительном анализе динамики (с 1-х по 6-е сутки) гипертермии и нарастания уровня прокальцитонина у родильниц подгруппы А отмечена прямая зависимость (r=0,78; p<0,05) между данными показателями, то есть нарастанию температурной реакции соответствовало повышение уровня прокальцитонина более 10 нг/мл, что позволяет использовать РСТ как критерий ранней диагностики присоединения послеродовой инфекции, как проявления синдрома системного воспалительного ответа, когда еще возможна консервативная терапия и методики, сохраняющие репродуктивную функцию.
Для снижения заболеваемости гнойно-септическими заболеваниями послеродового периода и случаев материнской смертности от септических осложнений необходимо выделить среди беременных женщин группу риска по данной патологии. В этой ситуации существенное значение имеет, как выявление факторов риска обуславливающих ОАГА, осложнения в течение беременности, осложнения родового процесса, а также диагностика доклинических форм инфекционных осложнений в послеродовом периоде. Заболеваниями, на фоне которых в послеродовом периоде диагностировали послеродовой эндометрит и послеродовый сепсис, были анемия (всех степеней тяжести) и хронический пиелонефрит. Субинволюция матки и лохиометра чаще протекали на фоне анемии.
В наших исследованиях ведущими факторами риска при отягощенном акушерско-гинекологическом анамнезе, при которых послеродовый период протекал с послеродовым эндометритом и сепсисом, были: аборты, осложненные выкидыши, бактериальный вагиноз, кандидозный вульвовагинит и урогенитальный хламидиоз. Угрозу прерывания беременности и маловодие можно рассматривать в большей степени как проявления внутриутробной инфекции (имеет прямую корреляцию с манифестацией гнойно-септических заболеваний послеродового периода (r=0,76; р<0,05)), а гестоз - как проявление синдрома системного воспалительного ответа на фоне эндотелиальной дисфункции усугубляющий иммунодефицит. Известно, что оперативные роды являются фактором высокого риска осложнений послеродового периода, так как гнойно-септические осложнения при них встречаются в 6-8 раз чаще, чем в родах per vias naturalеs.
Для появления в послеродовом периоде гнойно-септических заболеваний имеет значение инфицирование во время беременности. Нормоценоз влагалища препятствует восходящей инфекции и, напротив, нарушения состава влагалищной микрофлоры (кандидоз, бактериальный вагиноз) приводят к воспалительным процессам в плодных оболочках (хориоамнионит, плацентит, базалуит и др.), эндометрии, проникновению микроорганизмов в амноитическую жидкость и к плоду. В наших исследованиях у женщин первой группы (преимущественно с ПЭ) у каждой пятой выявляли при беременности кандидозный вульвовагинит, у каждой 3-4-й бактериальный вагиноз (табл. 8)
Таблица 8
Заболевания влагалища у женщин первой группы
-
Патология
Абс.число
%
Кандидиозный вульвовагинит
57
22,6
Бактериальный вагиноз
95
37,6*
Неспецифический вагинит
16
6,3
Примечание: * - р<0,05, достоверная разница между нозологиями
В ранее опубликованных исследованиях авторы указывают на бактериальный вагиноз (до 56,9% случаев) как причину, ассоциированную с ГСЗ в послеродовом периоде. По нашим данным у родильниц с инфекционными осложнениями в пуэрперии бактериальный вагиноз выявлен в 37,6%, при этом кандидозный вульвовагинит в 22,6%.
Фактор взаимного отягощения необходимо считать одним из главных критериев риска развития гнойно-септических заболеваний послеродового периода. При анализе результатов наших исследований выявлено, что наиболее неблагоприятными комбинациями факторов риска явились: хронический пиелонефрит в сочетании с анемией (R=0,61; р<0,05), тяжелый гестоз в сочетании с хроническим пиелонефритом, бактериальным вагинозом и анемией (R=0,76; p<0,05), а также клинически узкий таз при полном открытии маточного зева, затянувшемся 2-м периоде родов и длительном безводном периоде (R=0,81; p<0,05) (табл. 9). Исходя из результов исследования, взаимоотягощающее влияние нескольких факторов риска наиболее часто встречалось у родильниц с сочетанием тяжелого гестоза, хронического пиелонефрита, бактериального вагиноза и анемии (9,1%).
Таблица 9
Сочетание факторов риска у женщин первой группы (n=252)
-
Сочетание факторов риска
Абс.
%
Хронический пиелонефрит и ожирение
3
1,3%
Тяжелый гестоз, хронический пиелонефрит, бактериальный вагиноз и анемия
23
9,1%*
Тяжелый гестоз, пиелонефрит и анемия
6
2,2%
Примечание * - преобладающая комбинация факторов риска
Одним из важных аспектов в профилактике гнойно-септических заболеваний послеродового периода является мониторинг субинволюции матки как одного из осложнений послеродового периода, на фоне которого появляется клиника послеродового эндометрита.
На сегодняшний день отсутствуют четкие критерии диагностики субинволюции матки. По мнению ряда исследователей [Баев О.Р., 1994; Маевская Н.Ф., 2006; Поженко Е.В., 2002; Басиладзе Е.Н., 2005], для своевременной постановки диагноза – ультразвуковое сканирование целесообразно проводить на 4-й день послеродового периода.
При выполнении этих рекомендаций мы выявили существенный размах в данных объема матки после родов у женщин первой группы от 292,4 до 778,8 см3. По нашему мнению, факторы, способствующие субинволюции матки, а следовательно, и диагноз могут быть установлены только при динамическом наблюдении, что послужило поводом к проведению скрининга у 101 родильницы в Перинатальном центре Пермской краевой клинической больницы. Влияние основных факторов риска на сократительную деятельность матки представлено на рис. 6 и 7. Приведенные данные свидетельствуют, что у здоровых женщин (уменьшение объема матки на 32,14±1,50%) при естественных родах и имеющих хронический пиелонефрит в анамнезе отмечалась достоверная разница в уменьшении (на 22,0±1,4%) объема матки (p<0,05). Кроме того, отмечено снижение сократительной способности матки при хроническом пиелонефрите у женщин, родивших естественным путем, и наличие у них субинволюции матки, а также более медленное сокращение матки у женщин после естественных родов при наличии крупного плода (на 29,1±1,3%).
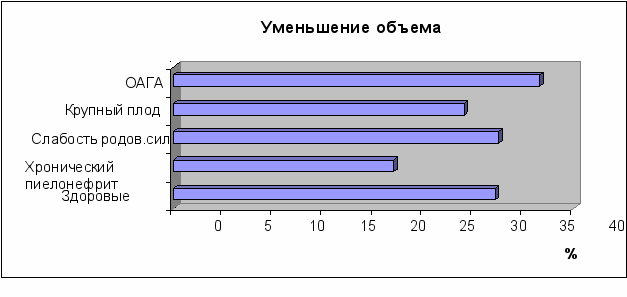
Р
 ис. 6. Уменьшение объема матки на 1-е и 3-и-4-есутки послеродового периода в основной группе А (n=36) с ОАГА, крупным плодом, хроническим пиелонефритом, слабостью родовых сил и в контрольной группе (здоровые родильницы) А (n=18).
ис. 6. Уменьшение объема матки на 1-е и 3-и-4-есутки послеродового периода в основной группе А (n=36) с ОАГА, крупным плодом, хроническим пиелонефритом, слабостью родовых сил и в контрольной группе (здоровые родильницы) А (n=18).При слабости родовой деятельности и отягощенном акушерско-гинекологическом анамнезе уменьшение объема матки составило соответственно 32,5±2,6% и 36,6±3,4%, что не имело достоверной разницы со здоровыми родильницами (32,14±1,5%). У женщин с оперативным родоразрешением ведущим фактором риска, влияющим на инволюцию матки, был отягощенный акушерско-гинекологический анамнез (p<0,05) при котором объем матки с 1-х по 3-и-4-е сутки уменьшился всего на 17,2±1,7%, что является подтверждением субинволюции матки и имеет достоверную разницу (p<0,05) с динамикой изменения объема матки в контрольной группе В (30,5±1,7%).
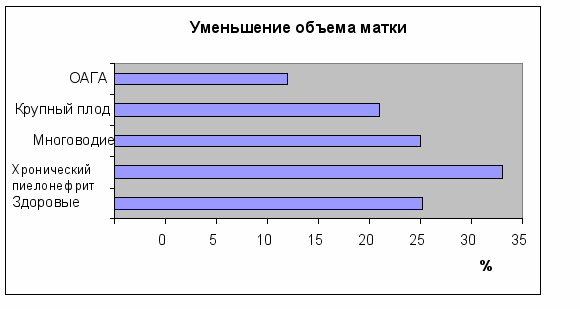
Рис. 7. Уменьшение объема матки на 1-е и 3-и-4-е сутки послеродового периода у женщин после кесарева сечения с отягощенным акушерско-гинекологическим анамнезом (ОАГА), крупным плодом, многоводием, хроническим пиелонефритом и у здоровых женщин после оперативных родов).
У женщин после кесарева сечения в сочетании с крупным плодом, многоводием и с отсутствием риска инфекционных послеродовых осложнений достоверной разницы в уменьшении объема матки не было обнаружено.
Ведущими факторами в развитии субинволюции матки были: у женщин после кесарева сечения: а) крупный плод (уменьшение объема матки на 26,3±1,3%); б) отягощенный акушерско-гинекологический анамнез (основные факторы риска аборты и выкидыши, хронические эндометрит и аднексит), при которых уменьшение объема матки составило 17,2±1,7%; у женщин после естественных родов: в) хронический пиелонефрит (уменьшение объема матки на 22,0±1,4%) и крупный плод (уменьшение объема матки на 29,1±1,3%).
Таким образом, женщины, имеющие отягощенный акушерско-гинекологический анамнез и хронический пиелонефрит при естественных родах, а также родоразрешенные операцией кесарева сечения при наличии крупного плода и отягощенного акушерско-гинекологического анамнеза (основные факторы риска - аборты и выкидыши, хронические эндометрит), являются группой риска по субинволюции матки в послеродовом периоде, а при отсутствии адекватного лечения этой доклинической формы - послеродового эндометрита.
Для выявления спектра микроорганизмов в выделениях из влагалища у женщин первой и контрольной групп на 3-и-4-е сутки после родов проведено бактериологическое исследование образцов лохий (в первой группе при появлении клиники инфекционного осложнения). Всего было выделено 184 культуры микроорганизмов в первой и 101 в контрольной группах наблюдения. У женщин обеих групп преобладали:- S. cohnii; - S. epidermidis; - Enterococcus spp.; - Lactobacillus; - Candida spp. Подобный спектр микроорганизмов обнаружен и в аспиратах из полости матки (табл. 10) при послеродовом эндометрите с уровнем обсемененности - Enterococcus spp. 105 КОЕ/мл и E.coli 106 КОЕ/мл, следовательно, можно полагать, что именно эти микроорганизмы в значительном числе случаев явились возбудителями послеродового эндометрита. Анализ видового состава изолированных культур свидетельствует о том, что как в аспирате содержимого полости матки, так и в лохиях у женщин с послеродовым эндометритом выделяли практически одни и те же культуры: S. cohnii, S. epidermidis, S. haemoliticus, Enterococcus spp., E.coli., при этом из аспирата полости матки микроорганизмы выделяли достоверно (p<0,05) чаще, чем из лохий. Особенно существенна эта разница была при изоляции энтерококков и E.coli. Полученные данные свидетельствуют о возрастающей роли в этиологии ГСЗ послеродового периода грамположительной микрофлоры (стафилококки, энтерококки). Культуры Enterococcus spp.и E.coli выделенные при тяжелых формах ПЭ и у родильниц с сепсисом, как правило обладали гемолитическими свойствами (одним из факторов вирулентности) и отличались устойчивостью к различным антибиотикам. При этом их титр в аспиратах достигал значительных величин.
Таблица 10.
Спектр микробных культур, выделенных из аспиратов полости матки при послеродовом эндометрите
| Выделенные изоляты (n=37) | Количество выделенных культур абс. % | Уровень обсемененности КОЕ/МЛ | |
| S. cohnii | 4 | 11,1 | 104 |
| S. epidermidis | 6 | 16,6* | 104 |
| S. haemoliticus | 4 | 11,1 | 105 |
| Enterococcus spp. | 10 | 27,7* | 105 |
| E.coli | 13 | 36,1* | 106 |
| Всего | 37 | 100 | |
Примечание: * - p<0,05 - преобладающие микроорганизмы в аспиратах из полости матки при ПЭ.
На фоне преэклампсии и эклампсии, осложненных полиорганной недостаточностью и наличием синдрома системного воспалительного ответа, у условно-патогенных микроорганизмов, заселяющих половые пути после родов, создаются условия для реализации патогенных свойств. В этом отношении особенно значим эндотоксин грамотрицательных бактерий, влияющий на синтез прокальцитонина клетками поврежденных тканей. Установлена сильная корреляция (r=0,97; p<0,05) при тяжелых формах ГСЗ послеродового периода между уровнем прокальцитонина и титром E.coli изолированных из лохий (рис.8).
В настоящее время нет четких критериев подбора антибиотиков для периоперационной профилактики инфекционных осложнений кесарева сечения. В этой связи нами была изучена эффективность интраоперационной антибиоикопрофилактики на основе результатов микробиологического мониторинга и анализа антибиотикорезистентности микроорганизмов с применением компьютерной программы WHONET в сравнении с предложенными ранее методиками [Гуртовой Б.Л., 2004; Никонов А.П., 2006 и др].
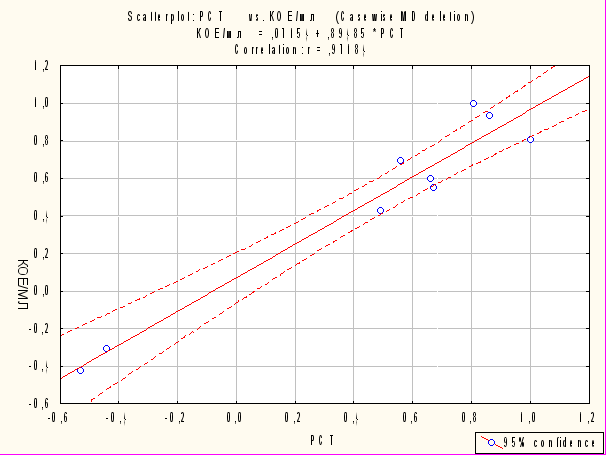 Рис. 8. Данные корреляционного анализа между уровнем прокальцитонина и обсемененностью лохий E.coli при сепсисе.
Рис. 8. Данные корреляционного анализа между уровнем прокальцитонина и обсемененностью лохий E.coli при сепсисе.Для подготовки материалов для компьютерного анализа с помощью программы WHONET на базе акушерского стационара проведено бактериологическое исследование лохий у родильниц (n=132) на 3-4-е сутки послеродового периода. Преобладала грамположительная микрофлора - 78,6%; грамотрицательные микроорганизмы составили 18,3%; - грибы рода Candida -1,5%;- облигатная анаэробная микрофлора (бактероиды) – 1,5%; Среди грамположительных микроорганизмов чаще выделяли: S. haemolyticus (44,6%); - Enterococcus spp. (25,2%). Среди грамотрицательных – E. coli (54,1%).
На основании данных мониторинга составлены таблицы антибитикорезистентности изолятов - чувствительных, умеренно чувствительных и резистентных изолятов грамположительной и грамотрицательной микрофлоры (табл. 11 и 12).
Практически все изолированные грамположительные микроорганизмы были чувствительны к цефуроксиму – 92,5% и резистентны к ампициллину - 90,9%.
Таблица 11
Распределение по доли резистентных (R), умеренно чувствительных (I) и чувствительных штаммов (S). S. haemolyticus (n=103)
| Антибиотик | Breakpoints, мм | Количество изолятов | % R (резистент.) | % I (ум. чувств) | % S (чувствит.) |
| Ампициллин | 21-28 | 92 | 90,9** | 2,59 | 6,49 |
| Цефотаксим | 15-18 | 103 | 16,04 | 3,70 | 80,2 |
| Цефазолин | 15-18 | 103 | 23,45 | 2,46 | 74,07 |
| Цефуроксим | 15-18 | 99 | 6,25 | 1,25 | 92,5* |
| Оксациллин | 11-12 | 96 | 17,5 | 0 | 82,5 |
| Ципрофлоксацин | 16-20 | 92 | 19,48 | 5,19 | 75,32 |
| Гентамицин | 15-16 | 96 | 63,75 | 1,25 | 35,0 |
| Эритромицин | 18-21 | 99 | 66,25 | 2,5 | 31,25 |
| Линкомицин | 20-23 | 74 | 52,94 | 4,41 | 42,64 |
| Амикацин | 15-16 | 74 | 26,47 | 1,47 | 86,76* |
Примечание: * - p<0,05 лучшая чувствительность,** p<0,05 наиболее выраженная резистентность.
Таблица 12
Распределение по доли резистентных (R), умеренно чувствительных (I) и чувствительных штаммов (S). E. coli (n=24)
| Антибиотик | Breakpoints Мм | Количество изолятов | % R (резистент.) | % I (ум. чувств) | % S (чувствит.) |
| Ампициллин | 21-28 | 24 | 86,34** | 4,16 | 9,5 |
| Цефотаксим | 15-18 | 24 | 9,48 | 8.32 | 82,2 |
| Цефазолин | 15-18 | 22 | 22,46 | 4,54 | 74,0 |
| Цефуроксим | 15-18 | 24 | 7,14 | 4,16 | 88,7* |
| Оксациллин | 11-12 | 24 | 12,44 | 4,16 | 83,5 |
| Ципрофлоксацин | 16-20 | 24 | 13,36 | 8,32 | 78,32 |
| Гентамицин | 15-16 | 23 | 60,75 | 4,34 | 34,01 |
| Эритромицин | 18-21 | 23 | 60,25 | 4,34 | 35,41 |
| Линкомицин | 20-23 | 20 | 52,94 | 4,41 | 42,65 |
| Амикацин | 15-16 | 20 | 8,24 | 5,0 | 86,76* |
Примечание. * - p<0,05 лучшая чувствительность,** - p<0,05 наиболее выраженная резистентность.
Что касается грамотрицательных микроорганизмов, то они были (табл.13). резистентны к ампициллину (86,3% изолятов), и гентамицину (60,7%) и чувствительны к цефуроксиму 88,7%. После введения результатов антибиотикограммы в базу данных программы получены гистограммы распределения R, I и S штаммов грамположительных микроорганизмов по каждому антибиотику.
Как следует из полученных гистограмм, основная зона подавления роста грамположительной микрофлоры составила 22 - 31мм при брекпойнте 15-18мм, что говорит об эффективности использования цефуроксима. Напротив, в гистограмме ампициллина, зона подавления роста грамположительной микрофлоры находится между 7мм и 13мм (при брекпойнте 15-18мм), что свидетельствует о наличии устойчивых к данному антибиотику штаммов грамположительных микроорганизмов. На основании данных, полученных с помощью компьютерного анализа - в основной группе проведена периоперационная антибиотикопрофилактика цефуроксимом в дозе 1,5 г внутривенно после пережатия пуповины. В группе сравнения антибиотикопрофилактику проводили гентамицином в дозе 160 мг в сочетании с линкомицином в дозе 600 мг, а также цефатоксимом 1,0г внутривенно, цефазолином в дозе 1,0 г в соответствии с методическими рекомендациями. Неэффективной считали антибиотикопрофилактику, после которой были отмечены гнойно-септические осложнения кесарева сечения и доклинические формы послеродовых осложнений (гипертермия, лохиометра, субинволюция матки, серома шва), что потребовало назначения другой группы препаратов,
У родильниц основной группы (n=215) при проведении антибиотикопрофилактики цефуроксимом 1,5г внутривенно было достоверно (p<0,05) меньше послеоперационных инфекционных осложнений – у 4 женщин (1,9%), при использовании цефотаксима 1,0 г внутривенно - 24 чел. (30%); цефазолином – 2,0 г. внутривенно –15 чел. (18,7%;) линкомицином 600мг с гентамицином 160мг внутривенно –19 чел.( 31,6%).
Таким образом, применение цефуроксима для периоперационной профилактики у 98,1% женщин позволило предупредить развитие инфекционных осложнений операции кесарево сечение. Следовательно, для подбора антибиотика для профилактики ГСЗ послеродового периода с учетом результатов микробиологического мониторинга и определения чувствительности к антибиотикам у выделенных микроорганизмов, может быть рекомендована программа WHONET.
Проблема определения показаний к оперативному лечению при сепсисе и у пациенток с септическими осложнениями после перенесенной эклампсии заключается в длительном респираторном протезировании, проведение которого не позволяет опираться на отдельные симптомы в постановке диагноза: респираторная дисфункция, тахикардия, снижение показателей артериального давления.
Поэтому, круг показаний к хирургическому лечению у родильниц с сепсисом (признаки генерализации инфекции) следующий: высокая температура тела 38°С и более с ознобом; нарастание лейкоцитоза выше 12∙109/л, появление палочкоядерных форм нейтрофилов более 11%, лимфоцитопения; уровень прокальцитонина более 10 нг/мл; синдром полиорганной недостаточности; лейкоцитарный индекс интоксикации > 6,3 у.е.,; - отсутствие эффекта от антибактериальной терапии карбапенемами.
В случаях септических осложнений эклампсии нельзя использовать в перечне показаний к гистерэктомии уровень содержания прокальцитонина сыворотке крови, так как не ясно сепсис или эклампсия являются причиной его повышения.
Хирургическая санация способствовала: уменьшению эндотоксикоза; улучшению показателей сатурации, улучшению неврологической симптоматики вплоть до выхода из комы и экстубации; нормализации температуры тела, лейкоцитоза, положительной динамике в состоянии печени (снижение АЛТ, АСТ), почек (восстановление диуреза, снижение уровня креатинина и мочевины в крови), поджелудочной железы (исчезновения выпота, нормализации биохимических тестов).
С практической точки зрения, исходя из современного понимания сущности сепсиса, кроме представленных выше симптомов, динамическое наблюдение пациента должно проводиться в трех направлениях:
- контроль эволюции основного очага инфекта и появления новых;
- оценка проявлений SIRS;
- анализ функциональной полноценности отдельных органов и систем.
ВЫВОДЫ
1. Сепсис у родильниц после перенесенной эклампсии отличается следующими особенностями: чаще возникает на фоне эклампсической комы, респираторного дистресс-синдрома, массивного кровотечения; - представлен симптомами нарастающей эндогенной интоксикации, не коррелирующими с показателем уровня прокальцитонина в сыворотке крови. Тест на прокальцитонин не может быть использован как маркер сепсиса у женщин после перенесенной эклампсии.
2. У родильниц с сепсисом после перенесенной эклампсии выявлена сильная корреляция с высокими показателями общего и удельного сопротивления сосудов, скоростью пульсовой волны и податливостью сосудистой системы указывающих на прогрессирующую эндотелиальную дисфункцию при развитии послеродовой инфекции.
3. Вероятность развития синдрома системного воспалительного ответа инфекционного генеза в виде генерализованной воспалительной реакции при послеродовой инфекции в значительной степени определяется видом микроорганизма, уровнем его обсемененности и антибиотикорезистентностью. Особенностями клинической картины послеродового эндометрита являются: преимущественно безболевая форма (r=0,61; p<0,05), длительная задержка (более 10 суток) децидуальной оболочки в полости матки с некрозом и воспалением, низкая специфичность традиционных критериев воспалительного процесса (лейкоцитоз крови, скорость оседания эритроцитов, температура тела), высокая специфичность трансвагинального ультразвукового сканирования и гистероскопии.
4. Динамическая утероэховолюметрия более эффективна по сравнению с ранее предлагаемыми методиками в плане своевременной диагностики субинволюции матки в послеродовом периоде на фоне факторов риска гнойно-септических осложнений, таких как хронический пиелонефрит и крупный плод при естественных родах, хронический эндометрит и аборты при оперативном родоразрешении.
5. Использование компьютерного анализа результатов микробиологического мониторинга с применением программы WHONET существенно повышает качество периоперационной профилактики гнойно-септических осложнений операции кесарево сечение и позволяет снизить их количество до 1,9%.
6. Ведущими факторами риска развития послеродовых гнойно-септических заболеваний при беременности и в родах являются: гестоз (42,0%), в том числе преэкламсия (8,7%) и эклампсия (9,1%), невынашивание беременности (30,9%), из нарушений влагалищного биотопа – бактериальный вагиноз (34,9%) и кандидозный вульвовагинит (22,6%). При этом бактериальный вагиноз вызывает взимоотягощающее действие при сочетании с такими факторами риска, как тяжелый гестоз, ожирение, хронический пиелонефрит и анемия (r=0,92; p<0,05).
7. Установлена прямая сильная корреляционная связь между уровнем прокальцитонина в сыворотке крови и степенью тяжести послеродовых гнойно-септических заболеваний у родильниц без признаков тяжелого гестоза (r=0,81; р<0,05) от что позволяет использовать этот тест для дифференциальной диагностики в случаях отсутствия классической клинической картины заболевания.
8. Внедрение результатов диссертационной работы в клиническую практику Пермской краевой больницы позволило снизить с 3,6% до 1,9% частоту инфекционных осложнений операции кесарево сечение, обеспечить своевременное выявление субинволюции матки и самое главное добиться отсутствия материнской смертности от сепсиса и сепсиса после перенесенной эклампсии.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. При появлении симптомов послеродового эндометрита необходимо проводить бактериологическое исследование аспирата из полости матки, так как это наиболее информативный метод определения возбудителя.
2. Для повышения качества периоперационной профилактики гнойно-септических осложнений операции кесарево сечение, следует применять в акушерских стационарах компьютерную программу WHONET
3. В составе комплексной лабораторной диагностики для дифференцирования степени тяжести гнойно-септического процесса, наличие гнойного очага, сепсиса, определять уровень прокальцитонина согласно предложенного в диссертации алгоритма диагностики послеродового эндометрита и сепсиса с помощью определения уровня прокальцитонина в сыворотке крови у родильниц при следующих симптомах: температура >37,5ºС; патологический характер лохий, болезненность матки, субинволюция матки, лейкоцитоз, лейкопения. Для диагностики использовать РСТ-Q – тест фирмы BRACHMS,
4. При осложненной эклампсии (кома, кровотечение), учитывая высокий риск септических осложнений проводить антибактериальную терапию цефалоспоринами III-IV поколения в сочетании с имидазолами .
5. В послеродовом периоде проводить динамическую эховолюметрию матки для своевременной диагностики субинволюции, а при наличии факторов риска гнойно-септических заболеваний необходимо назначить утеротоники и электротонизацию матки.
6. У родильниц с осложненной эклампсией и преэклампсией проводить исследование центрального и периферического кровообращения методами компьютерной осциллометрии и импедансной гепатографии для раннего выявления нарушений функции жизненно важных органов и постановки вопроса о родоразрешении.
Список работ, опубликованных по теме диссертации .
- Гребенкин Б.Е. Синдром системного воспалительного ответа у пациенток с осложненным тяжелым гестозом / Б.Е. Гребенкин, В.П. Черемискин//Актуальные вопросы акушерства и гинекологии в постдипломном образовании врачей: Материалы Всероссийской учебно-методической и научно-практической конференции. – Пермь: ГОУ ВПО ПГМА им. ак. Е.А. Вагнера Росздрава, 2006. – 164с.
- Черемискин В.П. Группа риска инфекционно-воспалительных и септических заболеваний в условиях областного перинатального центра//Материалы юбилейной научной сессии 2006 года. Т 2. Клинические науки. – Пермь: ГОУ ВПО ПГМА им. ак. Е.А. Вагнера Росздрава, 2006. – 384с.
