Совершенствование способов повышения воспроизводительных качеств свиней и овец 06. 02. 07 Разведение, селекция и генетика сельскохозяйственных животных
| Вид материала | Лекция |
- Программа минимум кандидатского экзамена по специальности 06. 02. 01 Разведение, селекция,, 74.53kb.
- Влияние генотипических и паратипических факторов на формирование продуктивных и воспроизводительных, 335.91kb.
- Способы повышения воспроизводительной функции свиней 06. 02. 01 разведение, селекция,, 568.29kb.
- Прогнозирование воспроизводительных способностей баранов в раннем возрасте 06. 02., 373.64kb.
- Влияние генотипа на мясную продуктивность и естественную резистентность свиней 06., 327.83kb.
- Селекционно-генетические аспекты повышения плодовитости овец породы казахский архаромеринос, 997.96kb.
- Разработка и совершенствование биотехнологических методов и технических приемов воспроизводства, 871.79kb.
- Программа-минимум кандидатского экзамена по специальности, 80.52kb.
- Эффективность хозяйственного использования животных разных генотипов в холмогорской, 304.53kb.
- Естественная резистентность, воспроизводительные и мясные качества свиней в связи, 413.2kb.
3.1 ИЗУЧЕНИЕ ВИДОВЫХ ОСОБЕННОСТЕЙ ИЗМЕНЕНИЯ МЕТАБОЛИЗМА ГАМЕТ ХРЯКОВ И БАРАНОВ ПРИ ХРАНЕНИИ IN VITRO
Процессы получения, разбавления и хранения спермы в охлажденном или глубокозамороженном состоянии вызывают структурные и функциональные нарушения сперматозоидов, что приводит к снижению их оплодотворяющей способности.
Наши исследования были направлены на выяснение видовых особенностей изменения метаболизма сперматозоидов хряков и баранов в результате технологической обработки спермы, для выявления предпосылок разработки более эффективных способов повышения оплодотворяющей способности спермы животных, сохраняемой вне организма, с целью улучшения репродуктивных качеств свиней и овец.
Для этого мы проводили биохимические исследования семенной плазмы нативной спермы и семенной плазмы разбавленной спермы хряков и баранов, сохраняемой в охлажденном до плюсовых температур состоянии.
Изменение углеводного обмена (анаэробного гликолиза) контролировали путем определения ключевых ферментов анаэробного гликолиза – лактатдегидрогеназы (ЛДГ) и щелочной фосфатазы (ЩФ);
аминокислотно-белкового метаболизма – путем определения активности ключевых ферментов – АСТ и АЛТ, содержания альбумина и мочевины;
липидного и липопротеидного обмена – определением содержания общего белка, холестерина и триглицеридов.
Состояние антиоксидантной защиты контролировали определением активности антиоксидантных ферментов супероксиддисмутазы (СОД), глутатионпероксидазы (ГПО), глутатионредуктазы (ГР) и каталазы.
Интенсивность свободнорадикального окисления липидов при хранении разбавленной спермы хряков и баранов в охлажденном состоянии и при глубоком замораживании спермы баранов контролировали путем определения содержания диеновых (кетодиеновых) конъюгатов и малонового диальдегида.
Динамика изменения активности ферментов АСТ, АЛТ, ЛДГ, ЩФ в семенной плазме нативной спермы и в семенной плазме разбавленной спермы хряков и баранов сохраняемой при температуре 160С, и у баранов, сохраняемой при 40С представлены графически на рисунках 2-5. О выходе ферментов из сперматозоидов судили косвенным путем по их суммарной активности в семенной плазме.

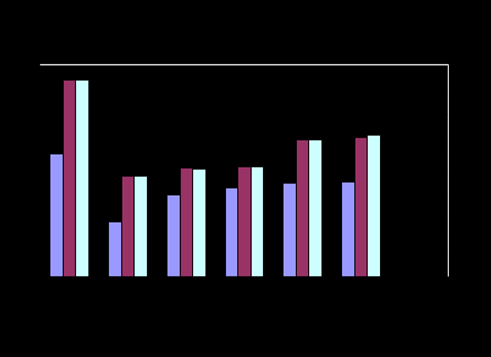 Рис.2- Изменение активности АСТ Рис.3- Изменение активности АЛТ
Рис.2- Изменение активности АСТ Рис.3- Изменение активности АЛТ 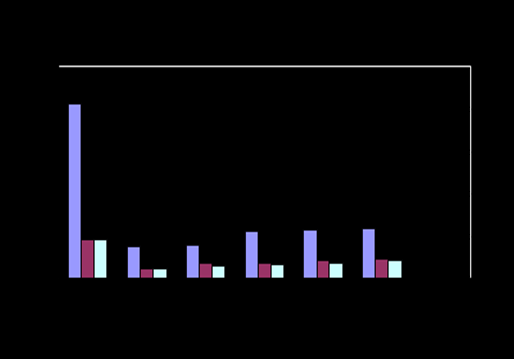
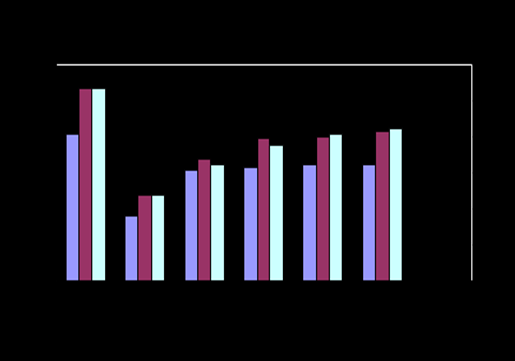
Рис.4- Изменение активности ЛДГ Рис.5- Изменение активности ЩФ
Результаты анализа семенной плазмы нативной спермы хряков и баранов свидетельствуют что, активность ферментов АСТ, АЛТ и ЩФ в семенной плазме хряков достоверно ниже, чем баранов. Активность ЛДГ ниже в семенной плазме баранов, чем хряков.
После разбавления спермы активность ферментов в семенной плазме животных снижается на статистически достоверную величину P< 0,05.
В процессе хранения разбавленной спермы было зарегистрировано достоверное повышение активности ферментов АСТ, АЛТ, ЛДГ и ЩФ в семенной плазме. Выявлены видовые особенности в изменении активности ферментов АСТ и ЛДГ в семенной плазме животных.
В семенной плазме хряков активность фермента АСТ достоверно повышается через 72 часа хранения разбавленной спермы в среднем на 26,5%, в семенной плазме баранов активность фермента АСТ достоверно повышается через 48 часов хранения в среднем на 20,7% и увеличивается в процессе хранения (P< 0,05).
Активность фермента ЛДГ в семенной плазме хряков достоверно повышается через 48 часов хранения разбавленной спермы и превышает первоначальную в среднем на 31,8%. В семенной плазме баранов активность фермента ЛДГ повышается через 24 часа хранения, превышая первоначальную на 40,2%, в процессе хранения активность фермента увеличивается (P<0,05).
Наибольшую активность проявила щелочная фосфатаза, достоверное повышение которой установлено через 24 часа хранения в семенной плазме разбавленной спермы хряков на 43%, баранов на 30%, (Р<0,05).
Достоверное повышение активности фермента АЛТ в семенной плазме хряков и баранов было зарегистрировано через 72 часа хранения разбавленной спермы в среднем на 12,4% у хряков, и 16,4% у баранов (P<0,05).
Далее мы определяли изменение содержания общего белка, альбумина, мочевины, триглицеридов и холестерина в семенной плазме нативной спермы и в семенной плазме разбавленной спермы хряков и баранов, сохраняемой при температуре 160С, и у баранов, сохраняемой при 40С.
Результаты представлены графически на рисунках 6-10.
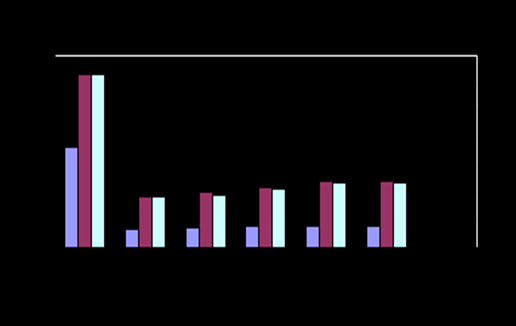

Рис.6- Содержание общего белка Рис.7-Содержание альбумина
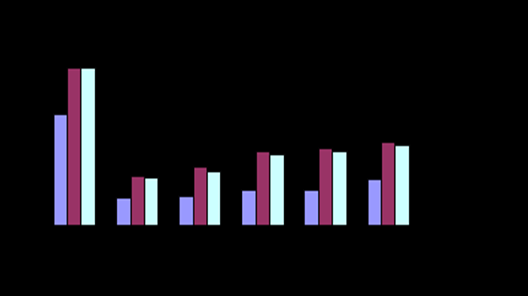
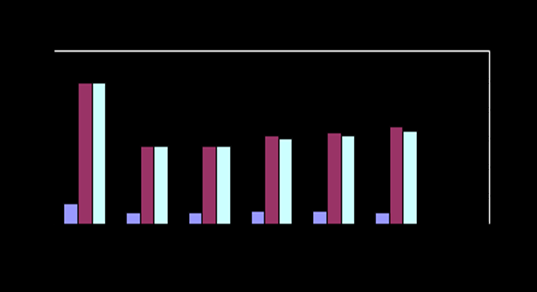
Рис.8- Содержание мочевины Рис.9- Содержание триглицеридов
 семенная плазма хряков инкубация
семенная плазма хряков инкубация при 160С
 семенная плазма баранов инкубация
семенная плазма баранов инкубацияпри 160С
 семенная плазма баранов инкубация
семенная плазма баранов инкубацияпри 40С
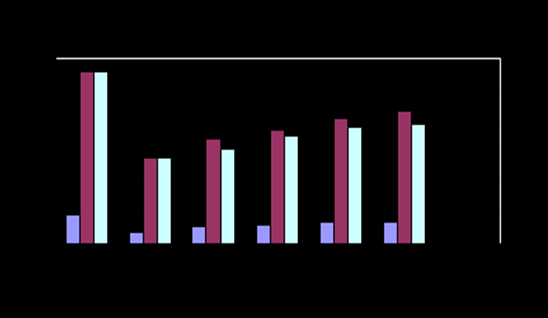
Рис.10- Содержание холестерина
В результате исследований было установлено, что содержание общего белка, альбумина, мочевины, триглицеридов и холестерина в семенной плазме хряков достоверно ниже чем, баранов на 42, 65, 30, 83 и 86% соответственно (Р<0,05).
Хранение разбавленной спермы повлияло на изменение содержания общего белка, альбумина, мочевины и холестерина в семенной плазме животных.
В семенной плазме хряков достоверное повышение общего белка и холестерина зарегистрировано через 72 часа хранения в среднем на 18,2% и 42,8% соответственно, альбумина и мочевины через 120 часов хранения в среднем на 37,58% и на 38,43% соответственно при температуре инкубации 160С.
В семенной плазме баранов достоверное повышение содержания общего белка и мочевины отмечено через 48 часов хранения в среднем на 16,2%, и 37,0% соответственно при температуре инкубации 160С и на 13,8% и 34,52% соответственно при температуре инкубации 40С. Достоверное повышение содержания альбумина и холестерина отмечено через 72 часа хранения в среднем на 36,5% и 34,9% соответственно при температуре инкубации 160С и 40С (Р<0,05).
Анализ биохимических показателей свидетельствуют об изменении метаболизма в половых клетках хряков и баранов при разбавлении и хранении в охлажденном до плюсовых температур состоянии.
Нарушение метаболизма в сперматозоидах, находящихся in vitro, может быть связано с дисбалансом антиокислительных систем с избыточным образованием свободных радикалов и конечных метаболитов типа ТБК (тиобарбитуровая кислота) - реагирующих продуктов.В этой связи, в следующих наших экспериментах мы провели сравнительное исследование влияния хранения спермы животных на концентрацию в ней продуктов пероксидного окисления липидов. Активность свободнорадикального окисления липидов оценивали по накоплению липидных перекисей, которые определяли в форме малонового диальдегида, и определением диеновых конъюгатов (ДК) и кетодиенов (КД) полиненасыщенных жирных кислот.
В результате исследований содержания продуктов ПОЛ в свежеполученной неразбавленной сперме хряков и баранов было установлено, что в сперме животных существует определенный физиологический уровень пероксидации липидов, о чем свидетельствует присутствие в свежеполученной сперме диеновых (кетодиеновых) коньюгатов и малонового диальдегида.
В следующем эксперименте мы изучали накопление продуктов ПОЛ после разбавления ГЖУК-трис-буферной средой, замораживания и оттаивания спермы баранов, анализируя образцы спермы сразу после оттаивания и через определенные интервалы времени при инкубации 180С, таблица 1.
Таблица 1- Концентрация продуктов пероксидного окисления липидов после замораживания-оттаивания и хранения спермы баранов при 180С
| Время инкубации оттаянной спермы при 180С, мин | n | Подвижность сперматозоидов, % | ДК, КД, Ед.опт.пл/мг | МДА, Мкмоль/л |
| 3 | 10 | 38,0 ± 0,65 | 0,357 ± 0,02 | 4,65 ± 0,19 |
| 20 | 10 | 35,4 ± 1,38 | 0,342 ± 0,03 | 4,87 ± 0,13 |
| 40 | 10 | 30,0 ± 1,12х | 0,325 ± 0,01 | 5,96 ± 0,13х |
| 60 | 10 | 24,1 ± 0,92х | 0,321 ± 0,04 | 6,00 ± 0,24х |
| 90 | 10 | 20,0 ± 0,52х | 0,212 ± 0,02х | 6,10 ± 0,20х |
х -P < 0,05
На основании проведенных исследований установлено, что в заморожено-оттаянной сперме баранов активируется процесс пероксидного окисления липидов (ПОЛ).
В процессе инкубации оттаянной спермы при температуре 180С происходит накопление МДА с 4,65 до 6,10 мкмоль/л и понижение концентрации ДК, КД с 0,357 до 0,212 ед/мг (P < 0,05).
Известно, что повышение концентрации диеновых (кетодиеновых) коньюгатов и малонового диальдегида свидетельствует об усилении процессов ПОЛ. Значительное падение концентрации диеновых (кетодиеновых) коньюгатов приводит к более глубоким деструктивным процессам биологических мембран (Кондрахин И.П., Архипов А.В. и др. 2004), что и показали результаты наших исследований. Следовательно, замораживание-оттаивание спермы баранов приводит к более глубоким изменениям метаболизма сперматозоидов.
Для изучения уровня ПОЛ в сперме хряков и баранов сохраняемой при температуре 160С сперму хряков разбавляли ГХЦС средой, сперму баранов ГЦЖ средой в два раза и сохраняли в течение 72 часов при температуре 160С, таблица 2.
Таблица 2- Изменения концентрации продуктов ПОЛ и подвижности
сперматозоидов в зависимости от сроков хранения спермы при 160С
| Время ин-кубации спермы при 160С, час. | Сперма хряков разбавленная ГХЦС средой (1:1) (n=15) | Сперма баранов разбавленная ГЦЖ средой (1:1) (n=15) | ||||
| Подвижность сперматозо- идов, % | ДК,КД ед/мг | МДА, мкмоль/л | Подвижность сперматозо- идов, % | ДК,КД ед/мг | МДА, мкмоль/л | |
| 1 | 80,5 ± 2,10 | 0,210 ± 0,01 | 4,01 ±0,07 | 80,6 ±2,40 | 0,308 ±0,02 | 4,32 ±0,08 |
| 24 | 75,0 ±1,51 | 0,232 ±0,03 | 4,28 ±0,09 | 58,0х ±1,91 | 0,392х ±0,01 | 5,02х ±0,09 |
| 48 | 60,5х ±1,03 | 0,325х ±0,02 | 4,88х ±0,13 | 45,5х ±1,41 | 0,404х ±0,03 | 5,14х ±0,10 |
| 72 | 54,0х ±2,64 | 0,342х ±0,01 | 4,96х ±0,11 | 19,0х ±1,58 | 0,418х ±0,02 | 6,19х ±0,12 |
х -P < 0,05
Данные таблицы показывают, что хранение спермы хряков и баранов при 160С в течение 72 часов, привело к достоверному увеличению концентрации продуктов пероксидации липидов. Выявлены видовые различия в характере изменения концентрации продуктов пероксидного окисления липидов, и влияния их на изменение подвижности сперматозоидов в процессе инкубации спермы. Изменения концентрации продуктов ПОЛ наблюдались в большей степени в сперме баранов, чем хряков, как по скорости протекания, так и по степени их выраженности. Если при хранении спермы хряков через 24 часа изменения были незначительны, то в сперме баранов они были статистически достоверны (ДК,КД-24%, МДА-16%). Подвижность сперматозоидов за это время у баранов снизилась на 22%, составляя 58%, у хряков примерно аналогичная подвижность 60,5% была через 48 часов хранения (Р<0,05).
Проведен анализ корреляционной зависимости между временем инкубации и концентрацией продуктов ПОЛ в разбавленной сперме животных и сохраняемой при температуре 160С. Выявлена прямая достоверная корреляционная связь между концентрацией продуктов ПОЛ и временем инкубации спермы, у хряков по ДК,КД (r = 0,95) и МДА (r = 0,96), у баранов по ДК, КД (r = 0,88) и МДА (r = 0,95).
Подвижность сперматозоидов находится в обратной зависимости от времени инкубации спермы у хряков (r = - 0,98), у баранов (r = - 0,99) и отрицательно коррелирует с концентрацией продуктов ПОЛ у хряков с ДК,КД (r = - 0,99) и МДА (r= - 0,98), у баранов ДК, КД (r = - 0,92) и МДА (r = - 0,98).
Чем выше концентрация продуктов ПОЛ в сперме животных в процессе её хранения, тем ниже подвижность сперматозоидов, что может свидетельствовать об изменении жирнокислотного состава мембран органелл, обеспечивающих эластичность, избирательную проницаемость и регулирующих внутриклеточный обмен веществ.
Повышение концентрации продуктов ПОЛ может быть связано с изменением системы антиоксидантной защиты (АОЗ) сперматозоидов в процессе хранения спермы. Поэтому в следующих наших исследованиях мы определяли уровень содержания антиоксидантных ферментов (АОФ) в семенной плазме сравниваемых видов животных при хранении спермы в охлажденном до температуры 160С состоянии (таблица 3).
Хранение разбавленной спермы животных в охлажденном до 160С состоянии инициировало выход антиоксидантных ферментов из сперматозоидов в семенную плазму, что согласуется с имеющимися литературными данными о выходе антиоксидантных ферментов при хранении спермы хряков и баранов при 40С и при глубоком замораживании до -1960С (Нарижный А.Г. и др., 1995; Ерохин А.С. и др., 1995;1996).
Таблица 3 - Влияние сроков хранения разбавленной спермы при 160С на
активность антиоксидантных ферментов в семенной плазме животных
| Срок хранения спермы при 160С,ч. | Активность ферментов в плазме разбавленной спермы хряков ГХЦС средой (1:1) (n=32) | Активность ферментов в плазме разбавленной спермы баранов ГЦЖ средой (1:1) (n=32) | ||||
| СОД, Е/мг | ГПО, Е/л | ГР, Е/л | СОД, Е/мг | ГПО, Е/л | ГР, Е/л | |
| неразбав- ленная | 12,2± 1,22 | 232,54 ± 8,80 | 36,24 ± 2,44 | 17,64 ± 1,38 | 295,20 ± 8,25 | 310,68 ± 4,34 |
| раз- бавленная | 6,54 ± 0,09 | 126,20 ± 2,10 | 14,12 ± 0,31 | 8,05 ± 0,24 | 148,70 ± 4,36 | 124,25± 5,12 |
| 8 | 6,96 ± 0,12 | 134,80 ± 3,78 | 14,78 ± 0,54 | 9,84 ± 0,36х | 183,64 ± 3,28х | 165,44± 4,30х |
| 24 | 8,48 ± 0,10х | 165,42 ± 4,14х | 15,84 ± 0,12х | 9,96 ± 0,28х | 192,70 ± 2,24х | 172,12± 6,70х |
| 48 | 8,73 ± 0,14х | 170,18 ± 3,24х | 16,15 ± 0,38х | 10,12 ± 0,25х | 200,24 ± 2,68х | 185,15± 4,28х |
| 72 | 8,26 ± 0,17х | 164,58 ± 5,82х | 15,28 ± 0,72х | 12,00 ± 0,20х | 205,32 ± 5,33х | 193,71± 4,36х |
х - Р < 0,05
Выявлены существенные межвидовые различия в увеличении активности антиоксидантных ферментов в семенной плазме животных в процессе хранения разбавленной спермы при температуре 160С.
В семенной плазме хряков, достоверное увеличение активности антиоксидантных ферментов отмечено через 24 часа хранения, баранов через 8 часов.
Активность супероксиддисмутазы в семенной плазме хряков за 24 часа хранения достоверно повысилась с 6,54 до 8,48 Е/л, глутатионпероксидазы со 126,2 до 165,42 Е/л, глутатионредуктазы с 14,12 до 15,84 Е/л оставаясь на таком уровне до конца исследований (P<0,05). В семенной плазме баранов через 8 часов хранения активность супероксиддисмутазы в семенной плазме достоверно повысилась с 8,05 до 9,96 Е/л, глутатионпероксидазы со 148,70 до 183,64 Е/л, глутатионредуктазы со 124,25 до 165,44 Е/л и продолжала увеличиваться в процессе хранения (P<0,05).
Установлена высокодостоверная зависимость между увеличением активности антиоксидантных ферментов в семенной плазме и временем хранения разбавленной спермы животных. У хряков время инкубации спермы коррелирует с активностью супероксиддисмутазы (СОД) (r = 0,76), глутатионпероксидазы (ГПО) (r = 0,71) и глутатионредуктазы (ГР) (r = 0,83), у баранов с СОД (r = 0,89), с ГПО (r = 0,82) и ГР (r = 0,85). Подвижность сперматозоидов хряков находится в обратной связи с активностью СОД (r = -0,97), ГПО (r = -0,96) и ГР (r = -0,98) в семенной плазме животных. Аналогичное наблюдается и с подвижностью сперматозоидов баранов, во всех случаях коэффициент корреляции оказался равен (r = - 0,99).
Выход супероксиддисмутазы и глутатионзависимых ферментов из половых клеток у баранов происходил интенсивнее, чем таковой у хряков. Можно выделить следующие наиболее важные видовые особенности выхода антиоксидантных ферментов из сперматозоидов в процессе хранения спермы хряков и баранов:
- у баранов раньше достигается пороговый уровень выхода ферментов из сперматозоидов, чем у хряков. Имеется в виду уровень повышения, следующий за разбавлением спермы, на статистически достоверную величину. Такой пороговый уровень по супероксиддисмутазе и глутатионзависимым ферментам у баранов был достигнут в 8-часовом интервале инкубации спермы, а у хряков - в 24 часа. Это может быть обусловлено более ранними биодеструктивными изменениями в структуре плазматических мембран сперматозоидов;
- после порогового уровня активность ферментов в семенной плазме у баранов в абсолютном большинстве случаев неуклонно увеличивается, а у хряков до определенного времени увеличивается незначительно, или остается примерно на стабильном уровне;
- у баранов количественный выход ферментов отличается в большей степени, чем у хряков, а, следовательно, идет активнее нарушение клеточных структур и функциональной деятельности белков, чем у хряков.
Потеря половыми клетками антиоксидантных ферментов происходит раньше, чем выход других изученных нами ферментов и компонентов клеточного метаболизма аминокислотно-белкового, углеводного, липидного и липопротеидного обмена. Достоверное увеличение активности ферментов АСТ и АЛТ в семенной плазме хряков выявлено через 72 часа хранения разбавленной спермы, у баранов через 48 и 72 часа, соответственно. Активность фермента ЛДГ в семенной плазме хряков достоверно повышалась через 48 часов хранения разбавленной спермы, у баранов через 24 часа (P<0,05). Тогда как достоверное увеличение активности антиоксидантных ферментов в семенной плазме баранов установлено через 8 часов хранения разбавленной спермы, а у хряков через 24 часа (P<0,05).
В свете современных представлений о роли и функции антиоксидантных ферментов (АОФ), полученные данные с достаточной определенностью показывают, что антиоксидантные ферменты сперматозоидов разных видов сельскохозяйственных животных, обладая видовыми особенностями, определяют их криорезистентность. Защитный эффект антиоксидантных ферментов, а также специфическое изменение их выхода из половых клеток хряков и баранов в процессе хранения указывает на значительную роль этих соединений в поддержании функционального гомеостаза сперматозоидов в экстремальных условиях внешней среды.
Наши исследования показали, что увеличение активности антиоксидантных ферментов в семенной плазме находится в прямой связи с накоплением продкутов ПОЛ при хранении разбавленной спермы.
У хряков активность СОД коррелирует с концентрацией ДК,КД (r = 0,65) и МДА (r = 0,73), у баранов с ДК,КД (r = 0,91) и МДА (r = 0,99).
Активность ГПО у хряков коррелирует с концентрацией ДК,КД (r = 0,69) и МДА (r = 0,77), у баранов ДК,КД (r = 0,83) и МДА (r = 0,99) соответственно.
Активность ГР у хряков коррелирует с концентрацией ДК, КД (r = 0,74) и МДА (r = 0,81), у баранов с ДК, КД (r = 0,99) и МДА (r=0,86) соответственно. Результаты исследований позволяют предположить, что потеря половыми клетками антиоксидантных ферментов влияет на их устойчивость к пероксидному окислению липидов, с чем может быть связана пониженная фертильность спермы хряков и баранов сохраняемой вне организма.
Таким образом, на основе биохимических исследований спермы хряков и баранов показана близость в закономерности изменения метаболизма и защитных свойств сперматозоидов животных разного вида, сохраняемых вне организма во времени, выражающееся в выходе окислительных и гидролитических ферментов и других компонентов клеточного метаболизма из сперматозоидов в семенную плазму, инициацией ПОЛ, и ингибированием ферментативной антиоксидантной активности (АОА).
В этой связи большой практический интерес представляет возможность стабилизировать пероксидацию липидов в сперме животных. При этом может быть применено несколько подходов: использование антиоксидантов и других криопротекторов при создании новых, более усовершенствованных синтетических сред; применение физических способов обработки спермы в частности обработка низкоинтенсивным лазерным излучением; улучшение технологии оттаивания замороженной спермы и другое.
3.2 ИЗУЧЕНИЕ ЗАЩИТНОГО ВЛИЯНИЯ РАЗЛИЧНЫХ ВЕЩЕСТВ В СОСТАВЕ СИНТЕТИЧЕСКИХ СРЕД ДЛЯ РАЗБАВЛЕНИЯ И ХРАНЕНИЯ СПЕРМЫ ХРЯКОВ В ОХЛАЖДЕННОМ СОСТОЯНИИ
В последние годы проводятся интенсивные исследования по совершенствованию синтетических сред для краткосрочного и длительного хранения спермы хряков, охлаждённой до температуры 16-18°С, с целью повышения её биологической полноценности и оплодотворяющей способности.
В этой связи, в задачу наших исследований входило усовершенствование среды для хранения спермы хряков в охлаждённом состоянии с применением различных соединений, в том числе синтетических и натуральных антиоксидантов.
Нами было исследовано защитное влияние новых синтетических жирорастворимых антиоксидантов фенольного ряда, таких как: ИХФГАН-3 (бромид-NN- диметил-N-гексадецил–4–окси–3,5 ди-трет-бутил-бензил-амина); ИХФГАН-4 (бромид-NN- диметил-N- дидецил–4–окси–3,5ди-трет-бутил-бензил-амина); ИХФГАН-5 (бромид-NN- диметил-N-децил–4–окси–3,5ди-трет-бутил-бензил-амина) синтезированных по нашей заявке в Институте химической физики (Москва).
В результате исследований было установлено, что введение антиоксидантов ИХФГАН-3 и ИХФГАН-5 в состав ГХЦС среды в концентрациях 0,002-0,015 мг/мл достоверно увеличивает абсолютный показатель живучести сперматозоидов. При концентрации ИХФГАН-3, равной 0,004 мг/мл и 0,008 мг/мл, живучесть сперматозоидов повышалась по сравнению с контролем на 23,2 и 20,0% соответственно при температуре инкубации 16°С, (P< 0,01).
Однако искусственное осеменение свиней спермой, разбавленной ГХЦС средой с добавлением антиоксиданта ИХФГАН-3 в оптимальной концентрации 0,004 мг/мл, не оказало положительного влияния на оплодотворяемость свиноматок, поэтому данный препарат не может использоваться в составе среды, несмотря на определённое его положительное действие на живучесть сперматозоидов хряков in vitro.
Вероятно, это обусловлено функционально-структурными особенностями половых клеток хряков. Не исключено, что влияние данных антиоксидантов на сперматозоиды других видов животных может оказаться более успешным.
Известно, что этанол, химическая формула – С2Н5ОН, является водорастворимым антиоксидантом. Ранее этиловый спирт в составе сред для спермы животных не использовался. В этой связи, мы решили изучить криозащитное влияние данного препарата на сперму хряков, сохраняемую в охлажденном состоянии при температуре 160С.
В проведенных исследованиях была установлена оптимальная концентрация этанола в составе ГХЦС среды, которая составляла 0,10-0,20%. Введение препарата в данной концентрации достоверно увеличивает абсолютный показатель живучести сперматозоидов на 34-41% (Р<0,05) по сравнению с контролем. В дозах 0,15-0,20% в составе среды этанол препятствует увеличению концентрации МДА в разбавленной сперме хряков в течение трех суток при температуре хранения 160С (Р<0,05), таблица 4.
Таблица 4 – Влияние этанола на изменение концентрации МДА в зависимости от сроков хранения сперм хряков при 160С
| Концентрация этилового спирта, % | Содержание МДА | |||
| Сроки хранения спермы хряков при 160С, часы (n=10) | ||||
| 1 | 24 | 48 | 72 | |
| 0,10 | 4,09 ± 0,15 | 4,18 ± 0,41 | 4,30 ± 0,20 | 5,14 ± 0,20х |
| 0,15 | 4,06 ± 0,26 | 4,18 ± 0,40 | 4,24 ± 0,33 | 4,34 ± 0,15 |
| 0,20 | 4,02 ± 0,22 | 4,16 ± 0,33 | 4,35 ± 0,20 | 4,48 ± 0,28 |
| Контроль | 4,20 ± 0,18 | 4,49 ± 0,44 | 5,19 ± 0,23х | 5,65 ± 0,20х |
х- Р<0,05
Научно - производственные испытания по искусственному осеменению свиноматок спермой хряков разбавленной ГХЦС средой с 0,15% этанола, сохраняемой при температуре 160С показали, что предложенная среда достоверно повышает оплодотворяемость свиноматок на 5,8 % и их многоплодие на 0,3 поросенка по сравнению с контролем (ГХЦС средой без этанола).
В результате была разработана новая синтетическая среда для краткосрочного хранения спермы хряков при следующем соотношении ингредиентов, (мас.%): глюкоза -3,80- 3,90; двуводная динатриевая соль этилендиамин-NNNN-тетрауксусной кислоты - 0,26-0,28; натрий лимоннокислый трехзамещенный пятиводный - 0,36-0,38; аммоний сернокислый - 0,18-0,20; натрий двууглекислый - 0,05-0,06; этиловый спирт - 0,10-0,20; вода дистиллированная - остальное до 100.
Синтетическая среда для хранения спермы хряков с содержанием этанола признана изобретением и на нее выдан патент № 2370033.
Экспериментально установлено, что хитозан представляет собой N-диацетилированную форму хитина, обладает сорбционными, антибактериальными и антиоксидантными свойствами (Скрябин К.Г., и др., 2002; Gorovoj L., Kosjakov V., 1997). В связи с тем, что защитное влияние сукцината хитозана на сперму хряков не изучалось, мы решили выяснить влияние данного препарата на подвижность и живучесть сперматозоидов хряков в составе ГХЦС и ГХЦ сред при температуре хранения 4 и 16°С с целью усовершенствования среды для долгосрочного хранения спермы хряков.
В результате проведенных исследований по изучению влияния сукцината хитозана на биологическую полноценность спермы хряков было установлено, что данный препарат не оказывает положительного влияния на живучесть сперматозоидов хряков, сохраняемых охлажденными до плюсовых температур.
В последние годы проведено большое количество исследований по изучению влияния селена на здоровье и репродуктивные качества сельскохозяйственных животных. Роль селена в организме животных определяется, в первую очередь, тем, что он входит в состав одного из важнейших антиоксидантных ферментов – селенозависимой глутатионпероксидазы, которая защищает клетки от накопления продуктов пероксидного окисления липидов, предупреждая тем самым их повреждение. На сперме хряков защитное влияние препаратов селена ранее не изучалось. В наших экспериментах было установлено, что добавление в состав ГХЦС среды различных дозировок селенита натрия (Na2SеO3) и селеноорганического препарата селекора не оказало положительного влияния на живучесть сперматозоидов хряков при температуре хранения 4 и 17°С.
Имеются данные о мембранотропном действии на сперматозоиды животных такого полисахарида, как гиалуроновая кислота (Handrow R.P. е.а., 1982 Rodriguez-Martinez Н. е.а., 1992). Гиалуроновая кислота представляет собой полимер, состоящий из остатков D-глюкуроновой кислоты и D-N-ацетилглюкозамина, соединенных поочередно β-1,4 и β-1,3 – гликозидными связями (несульфированный гликозаминогликан). Установлено, что гиалуроновая кислота влияет на акросомную реакцию и капацитационные процессы сперматозоидов (Handrow R.P., еt.аl., 1982).
Результаты наших исследований по изучению влияния гиалуроновой кислоты на криоустойчивость спермы хряков, сохраняемой в охлажденном до плюсовых температур состоянии, свидетельствуют об отсутствии защитного действия данного препарата на подвижность и живучесть сперматозоидов.
В литературе имеются сообщения о положительном влиянии бычьего сывороточного альбумина (BSA) и тиоловых соединений на сохранение биологической полноценности сперматозоидов животных. Ряд исследователей полагают, что макромолекулы BSA оказывают протективное действие на ферменты сперматозоидов. (Норре Р.С. et al., 1977; Dalet С. et al., 1982; Upreti G.C. et al., 1991; 1995). Применение бычьего сывороточного альбумина в составе сред для спермы баранов, сохраняемой при температуре 160С, способствовало повышению ее подвижности и живучести (Ерохин А.С. и др.,1997).
Введение тиоловых соединений в состав разбавителей спермы животных позволяет повысить биологическую полноценность и оплодотворяющую способность как охлаждённой, так и замороженной спермы (Корбан Н.В., и др., 1988; Шапиев И.Ш., 1998). По мнению авторов, это связано с тем, что тиоловые соединения предохраняют ферментативные системы сперматозоидов от инактивации, вызванной разрушением сульфгидрильных групп белков.
В связи с этим мы решили подробнее изучить влияние различных концентраций бычьего сывороточного альбумина (ВSA) и восстановленного глутатиона (GSH) в составе ГХЦС среды на подвижность и оплодотворяющую способность охлажденной до температуры 170С спермы хряков.
ВSA - белок плазмы крови крупного рогатого скота, состоящий из 582 аминокислотных остатков (одноцепочечный). Формула восстановленного глутатиона (GSH) - (2-амино-5-{[2-[(карбоксиметил) амино]-1-(меркаптометил)-2-оксоэтиламино}-5-оксопентаноевая кислота.
При изучении влияния различных концентраций бычьего сывороточного альбумина и восстановленного глутатиона на подвижность и переживаемость сперматозоидов хряков была установлена оптимальная их концентрация для ВSA- она составляла от 0,1 до 0,3% , для восстановленного глутатиона – 0,002-0,008%. В исследованиях по определению оптимальной концентрации совместного применения ВSA и восстановленного глутатиона в составе ГХЦС среды, было установлено, что введение в состав ГХЦС среды восстановленного глутатиона в концентрации 0,002% и BSA в концентрации 0,2-0,3% достоверно увеличивает абсолютный показатель живучести сперматозоидов в среднем на 20% (Р<0,05) и препятствует развитию продуктов ПОЛ в разбавленной и сохраняемой при 160С сперме хряков в течение 120 часов. Результаты оплодотворяющей способности спермы хряков разбавленной усовершенствованной ГХЦС средой с восстановленным глутатионом и BSA в концентрации 0,002% и 0,02% соответственно представлены в таблице 5.
Таблица 5 - Результаты искусственного осеменения свиней
| Группа животных | Время хранения спермы, ч | Осеменено маток, голов | Опоросилось | Среднее многоплодие маток, голов | |
| голов | % | ||||
| Опытная | 24 | 208 | 187 | 89,9 | 10,3 ± 1,08 |
| Контрольная | 24 | 200 | 166 | 83,0 | 10,0 ± 1,24 |
| Опытная | 72 | 197 | 170 | 86,3 | 10,5 ± 1,25 |
| Контрольная | 72 | 184 | 145 | 78,8 | 10,0 ± 1,68 |
| Опытная | 120 | 125 | 85 | 68,0 | 10,2± 1,11 |
| Контрольная | 120 | 126 | 70 | 55,5 | 9,7 ± 1,09 |
Из таблицы 5 видно, что введение восстановленного глутатиона и BSA в состав ГХЦС среды достоверно повышает оплодотворяемость свиноматок - при суточном хранении спермы на 6,9 %, при трехсуточном на 7,5%, при пятисуточном на 12,5% (Р<0,05), и их многоплодие соответственно на 0,3 поросенка при суточном хранении спермы, и на 0,5 при 3-х и 5-ти суточном хранении.
В результате была разработана новая синтетическая среда для долговременного хранения спермы хряков при следующем соотношении ингредиентов мас%: глюкоза – 3,8; двуводная динатриевая соль этилендиамин-NNNN-тетрауксусной кислоты - 0,26; натрий лимоннокислый трехзамещенный пятиводный - 0,38; аммоний сернокислый – 0,18 г.; натрий двууглекислый - 0,05; восстановленный глутатион -0,002; ВSA- 0,2; вода дистиллированная - остальное до 100.
Таким образом, анализируя проведенные нами исследования, можно сделать вывод, что защита сперматозоидов хряков от свободнорадикального перокисления липидов зависит не только от особенностей молекулярной структуры антиоксидантов, но и от их противоокислительной активности. Из изученных нами антиоксидантов и ряда других биологически активных веществ перспективными для сохранения сперматозоидов хряков in vitro при температуре 16-170С следует признать этанол, бычий сывороточный альбумин, восстановленный глутатион и совместное применение бычьего сывороточного альбумина с восстановленным глутатионом.
- ИЗУЧЕНИЕ ЗАЩИТНОГО ВЛИЯНИЯ РАЗЛИЧНЫХ ВЕЩЕСТВ В СОСТАВЕ СИНТЕТИЧЕСКИХ СРЕД ДЛЯ РАЗБАВЛЕНИЯ И ХРАНЕНИЯ СПЕРМЫ БАРАНОВ
При создании новых синтетических сред для разбавления и хранения спермы баранов нами были изучены различные вещества.
Изучая защитное влияние синтетических жирорастворимых антиоксидантов фенольного ряда ИХФГАН, мы выявили положительное влияние препаратов ИХФГАН-3 в концентрации 0,008% и ИХФГАН-5 в концентрации 0,004% в составе ГЖУК-трис-буферной среды.
Использование препаратов в данной концентрации позволяет достоверно повысить абсолютный показатель живучести сперматозоидов после оттаивания и оплодотворяемость овцематок спермой замороженной с ИХФГАН-3 на 7,0% с ИХФГАН-5 на 5,0% по сравнению с контрольной группой маток (Р < 0,05).
С целью выяснения механизма защитного влияния антиоксиданта ИХФГАН-3 при глубоком замораживании спермы баранов, нами изучалась его антиокислительная активность в образцах замороженно-оттаянной спермы при индуцировании пероксидации липидов с помощью ионов двухвалентного железа (Владимиров Ю.А., Шерстнев М.П., 1989). Результаты экспериментов представлены на рисунке 11.
Интенсивность ХЛ (J 105 квант с/4П)
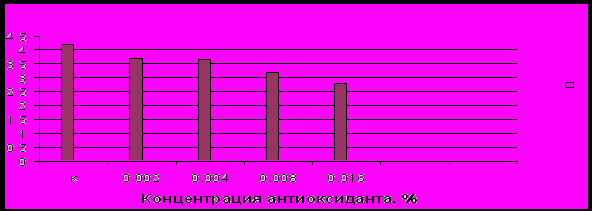
Рисунок 11- Влияние антиоксиданта ИХФГАН-3 на хемилюминесценцию в образцах заморожено – оттаянной спермы баранов.
Из рисунка 11 видно, что введение ИХФГАН-3 в оптимальных дозах в состав криоконсервирующей среды для сперматозоидов баранов привело к ингибированию свободнорадикальной реакции пероксидации липидов, о чем свидетельствует уменьшение амплитуды свечения медленной вспышки ХЛ в образцах с антиоксидантом по сравнению с контролем, где антиоксидант отсутствовал. Доза препарата, равная 0,016% снижала интенсивность ХЛ в образцах оттаянной спермы на 24% по сравнению с контролем (Р < 0,05). Оптимальные концентрации ИХФГАН-3, применяемые для криоконсервации спермы баранов, не ингибировали полностью процесс индуцированного ПОЛ, что необходимо для сохранения физиологического гомеостаза половых клеток, так как стационарная интенсивность ПОЛ в мембранах является немаловажным биологическим регулятором метаболизма клеток (Журавлев А.И., 1989; Aitken R.J., Clarkson J.S., 1978).
Таким образом, результаты наших исследований свидетельствуют об эффективности использования фенольных антиоксидантов ИХФГАН-3 и ИХФГАН-5 в качестве криопротекторов для спермы баранов. На синтетические разбавители для спермы баранов с содержанием фенольных антиоксидантов ИХФГАН-3 и ИХФГАН-5 выданы патенты № 2048796 и № 2083183.
Полученные нами данные свидетельствуют о необходимости дальнейшего поиска более эффективных препаратов антиоксидантного и мембранотропного действия с целью разработки более совершенных синтетических сред для криоконсервации спермы баранов.
Известно, что янтарная кислота обладает определенным антиоксидантным действием, предотвращая нарастание метаболических нарушений, приводящих к пероксидному окислению липидов (Кожевникова Л.К., Кондрашова М.Н. и др., 2002).
В связи с этим нами были проведены опыты по изучению действия солей янтарной кислоты (сукцината натрия, аммония, магния и кальция) в составе ГЖУК-трис-буферной среды на качественные показатели спермы баранов после её замораживания-оттаивания. Результаты экспериментов показали, что из всех изученных препаратов лишь сукцинат натрия (NaOOCCH2CH2COONa6H2O - натрий янтарнокислый 6-водный) в концентрации 0,03% оказал заметное криозащитное действие. Использование сукцината натрия в концентрации 0,03% достоверно увеличивает абсолютный показатель живучести сперматозоидов в среднем - на 20,0% и препятствует увеличению продуктов пероксидации липидов при хранении оттаянной спермы. Научно-производственные опыты по искусственному осеменению овец спермой замороженной в ГЖУК-трис-буферной среде с сукцинатом натрия показали, что усовершенствованная среда достоверно повышает оплодотворяемость овцематок на 11,2%, и их многоплодие на 12 голов (на 100 маток), таб. 6.
Таблица 6 - Влияние сукцинита натрия на результативность осеменения овец криоконсервированной спермой
| Группа животных | Концент-рация препарата, мас.% | Число осемененных овцематок, гол | Объягнилось | Получено ягнят на 100 маток, голов | |
| голов | % | ||||
| Опыт | 0,03 | 192 | 109 | 59,8 | 142 |
| Контроль | - | 183 | 90 | 48,6 | 130 |
В результате была разработана новая синтетическая среда для глубокого замораживания спермы баранов при следующем соотношении ингредиентов, мас.%: лактоза – 6,00; декстрин – 3,60; ксилит – 0,18; трис-(оксиметил)- аминометан – 0,08; динатриевая двуводная соль ЭДТА – 0,10, натрий янтарнокислый 6-ти водный – 0,03; глицерин – 4,3; желток куриного яйца – 14,3; вода дистиллированная – остальное до 100. На данную синтетическую среду Государственным институтом патентной экспертизы выдан патент № 2323702.
Далее нами изучалось влияние сукцината хитозана на качественные показатели спермы баранов, сохраняемой в охлажденном и глубокозамороженном состоянии. Экспериментальные данные по изучению влияния сукцината хитозана на абсолютный показатель живучести сперматозоидов баранов в ГЦЖ среде при 4 и 17°С показали, что сукцинат хитозана в дозах 0,08-0,62 мг/мл среды оказал некоторое защитное влияние на сохранение подвижности сперматозоидов (Р>0,05). При глубоком замораживании спермы баранов в ГЖУК-трис-буферной среде с добавлением сукцината хитозана, препарат не оказал положительного влияния на подвижность и переживаемость сперматозоидов.
В наших исследованиях по изучению защитного влияния гиалуроновой кислоты установлено, что данный препарат не оказал положительного влияния на подвижность и абсолютный показатель живучести охлажденных до температуры 160С и оттаянных после глубокого замороживания сперматозоидов баранов.
В состав ГЖУК-трис-буферной среды для замораживания спермы баранов входит кукурузный декстрин, который получают путем гидролиза крахмала в присутствии катализаторов. В связи с тем, что декстрин в зависимости от сроков его хранения подвергается окислительным процессам (Епишина Т.М., 1995), возникла необходимость дальнейшего поиска более эффективных криопротекторов в составе ГЖУК-трис-буферной среды для разбавления и хранения спермы баранов в глубокозамороженном состоянии.
По нашему мнению на роль криопротекторов могут претендовать соединения, которые обладают свойствами поверхностно-активных сорбентов. Одним из таких сорбентов является костный клей, представляющий собой сложное белковое образование - коллаген, относящийся к группе фибриллярных белков (склеропротеидов).
Введение костного клея в состав среды для замораживания спермы баранов в концентрации 1,8% достоверно увеличивает абсолютный показатель живучести сперматозоидов на 18,7% и повышает оплодотворяемость овцематок на 10,5%. Увеличился срок хранения сухих компонентов синтетической среды более чем на 9 месяцев за счет снижения пероксидации липидов в процессе хранения сухих навесок разбавителя. Новая лактозо-желточно-хелато-коллагеновая среда признана Государственным институтом патентной экспертизы изобретением и на неё выдан патент № 2198622.
Известно, что в составе синтетических сред для замораживания спермы баранов основным криопротективным компонентом является глицерин. Однако наряду с положительным влиянием он может оказывать отрицательное действие на фертильность криоконсервиро-ванной спермы, так как способствует разрушению акросомной и плазматической мембраны сперматозоидов (Борончук Г.В., 1979, Милованов В.К., Соколовская И.И., 1984, Slavik T. 1987).
Целью наших исследований являлось изучение возможности замены глицерина на другие криопротекторы. При исследовании криозащитного действия этиленгликоля на сперматозоиды баранов, была выявлена оптимальная его концентрация в составе ГЖУК-трис-буферной среды, она составляла - 2,5%. Однако подвижность и живучесть оттаянных сперматозоидов при этой дозе препарата была все же несколько ниже, по сравнению с контролем, где использовался глицерин. Комбинированное применение глицерина и этиленгликоля в различных пропорциях также не оказало заметного криозащитного действия.
В исследованиях по изучению криозащитного действия на сперму баранов полиэтиленгликолей (ПЭГ) с различной молекулярной массой было установлено, что более заметным криозащитным действием обладали ПЭГ с низким молекулярным весом, в частности ПЭГ-300. Но при использовании данного вещества, его криозащитное действие было ниже, чем у глицерина.
В последние годы внимание исследователей привлекло изучение криозащитных свойств на клетки и ткани животных некоторых алкиловых эфиров глицерина.
Так как при замораживании спермы баранов защитное действие эфиров глицерина не изучалось, мы поставили своей целью изучить криозащитное действие на сперму баранов таких эфиров глицерина, как монометиловый, моноэтиловый, глицедиметиловый и бутилбензиловый. Данные соединения были синтезированы по нашей заявке в Институте химической физики (Москва).
Результаты замораживания спермы баранов с различными концентрациями эфиров глицерина показали, что из всех испытанных препаратов наиболее криопротективным действием обладает монометиловый эфир глицерина. При замораживании спермы барана с 3,0% данного эфира абсолютный показатель живучести оттаянных сперматозоидов повысился на 45,0% по сравнению с контролем, где использовали глицерин (Р<0,05). Однако результаты научно-производственных опытов по искусственному осеменению овцематок спермой замороженной с оптимальной концентрацией препарата (3,0%) показали, что монометиловый эфир глицерина не превышает по фертильности действие глицерина. Результаты, полученные нами, на сперматозоидах барана, отличаются от данных, установленных ранее при замораживании спермы человека, где криопротективная эффективность монометилового эфира глицерина была сходной с глицерином, (Паращук Ю.С. и др., 1989). Возможно, это связано с различиями структурно-функционального состояния плазматических мембран у сперматозоидов баранов и человека и, следовательно, с различной скоростью интра- и экстрацелюлярной диффузии данного соединения в процессе замораживания-оттаивания клеток.
В своих исследованиях мы разработали способ повышения оплодотворяющей способности глубокозамороженной спермы баранов, за счет введения в состав криоконсервирующей среды, комплекса синтетических аналогов простагландинов, обладающих широким спектром физиологического воздействия не только на сперматозоиды, но и на воспроизводительные способности овцематок.
В работе использовали биологически активный препарат ФЛПГ, содержащий в своем составе несколько видов синтетических аналогов простагландинов: ПГF2α – динопрост; ПГЕ – динопростон; ПГЕ1 - динопростин; ПГЕ2 - простин.
Введение препарата ФЛПГ в состав ГЖУК-трис-буферной среды в концентрации 125 мкг/мл достоверно повышает оплодотворяемость овцематок на 12,6%, их многоплодие – на 13,0%, при Р<0,05.
Применение препарата ФЛПГ, как способа повышения оплодотворяющей способности криоконсервированной спермы баранов признано изобретением и на него выдан патент № 2297197.
- ВЛИЯНИЕ НИЗКОИНТЕНСИВНОГО ЛАЗЕРНОГО ИЗЛУЧЕНИЯ НА БИОЛОГИЧЕСКУЮ ПОЛНОЦЕННОСТЬ И ФЕРТИЛЬНОСТЬ СПЕРМЫ БАРАНОВ И ХРЯКОВ
В последние годы появился интерес к изучению возможности применения в области биологии размножения животных разнообразных физических способов обработки спермы с целью повышения ее биологической полноценности (Николов И., Несторова Ю., 1994; Ерохин А.С. и др., 1997; Добровольский Г.А., 2009; Masuda H., 1995).
Мы изучали сравнительное действие гелий-неонового и арсенид-галлиевого лазеров на биологическую полноценность спермы баранов, сохраняемой при температуре 4 и 160С, и спермы хряков, сохраняемой при 170С. Обработку спермы проводили на лазерном приборе ALIT-3B.
В проведенных нами исследованиях было установлено, что наиболее эффективным оказалось действие арсенид-галлиевого лазера в режимах R8, R16, R32 с временем экспозиции 60-120 секунд и температурой хранения спермы при 40С.
Обработка спермы баранов Ars-Ga лазером, достоверно увеличивает абсолютный показатель живучести сперматозоидов в среднем на 20-30% и более (Р<0,05) (таб. 7) и повышает результативность искусственного осеменения овец на 5,7% спермой, обработанной в режиме R-8 с временем излучения 120 секунд, сохраняемой при температуре 40С.
Таблица 7 - Влияние излучения Ars-Ga лазера на живучесть охлажденной до 40С спермы баранов (n=12)
| Время излучения, секунды | Абсолютный показатель живучести сперматозоидов при 40С, усл.ед., в режиме облучения (R) | ||||
| R2 | R4 | R8 | R16 | R32 | |
| Контроль, без обработки | 674±21,3 | 674±21,3 | 674±21,3 | 674±21,3 | 674±21,3 |
| 30 | 663±23,2 | 600±18,5 | 800±22,6 х | 796±42,9 | 683±22,9 |
| 60 | 749±49,4 | 757±29,8 | 782±21,7х | 929±16,8 х | 827±16,9х |
| 90 | 691±18,1 | 782±44,5 | 921±14,8 х | 906±22,1х | 922±30,8 х |
| 120 | 788±20,6х | 980±20,4х | 916±26,4 х | 946±12,6 х | 869±35,5х |
| 300 | 696±18,4 | 923±14,5х | 783±12,7 | 898±13,1х | 789±42,9 |
х-Р<0,05
Обработка спермы хряков низкоинтенсивным лазерным излучением проводилась совместно с Пухтиновым О.Н. В результате исследований было установлено, что низкоинтенсивное лазерное излучение не оказало положительного влияния на подвижность и живучесть сперматозоидов хряков, сохраняемых при температуре 170С.
Таким образом, обработка спермы сравниваемых видов животных Ars-Ga и He-Ne лазерным излучением оказывает защитное действие на биологическую полноценность спермы баранов и не оказывает на сперму хряков, а действие арсенид-галлиевого лазера более эффективно по сравнению с гелий-неоновым лазером.
3.5. РАЗРАБОТКА ТЕХНОЛОГИИ ОТТАИВАНИЯ СПЕРМЫ БАРАНОВ
В ЭЛЕКТРО- И ГИДРООТТАИВАТЕЛЯХ
Большое значение для биологической полноценности сперматозоидов играет режим оттаивания спермы. В производственных условиях для одновременного оттаивания нужны большие объемы спермы, поэтому применяются водяные или электрические оттаиватели, в которых можно оттаивать одновременно до 10 и более гранул спермы.
В задачу наших исследований входила разработка оптимальных температурных режимов оттаивания спермы баранов в электро – и гидрооттаивателе ОГСБ-2М и ОГСБВ с целью дальнейшего их серийного производства для реализации организациям по искусственному осеменению овец. В эксперименте было предусмотрено изучение влияния на качество оттаянной спермы таких факторов, как количество оттаиваемых гранул, температуры оттаивания и температуры оттаянной спермы, время затраченное на начало и окончание оттаивания гранул спермы, диаметр тубы, и толщины пластины, разделяющей тубу на две части. При этом оценивали подвижность, абсолютный показатель живучести и фертильность оттаянных сперматозоидов.
На основании проведенных исследований было установлено, что лучшие качественные показатели спермы баранов были в электрооттаивателе ОГСБ-2М с диаметром оттаивающей тубы 25 мм., толщиной разделительной пластины в тубе 3,4 мм для одновременно оттаиваемых гранул до 20 штук, при температуре оттаивания 850С.
Лучшие качественные показатели оттаянной спермы в гидрооттаивателе ОГСБВ были зарегистрированы с диаметром внешней тубы 110 мм, внутренней тубы (в которую загружаются гранулы спермы) 20 мм, и температурой горячей воды между стенками туб, (85-90°С).
Результаты научно-производственных опытов по искусственному осеменению овец спермой оттаянной в электро- и гидрооттаивателях при температурном режиме 850С и с оптимальным диаметром туб представлены в таблице 8.
Таблица 8 - Влияние различных оттаивателей и температуры оттаивания на результативность искусственно осеменения овец
| Вид оттаивания | Осеменено овец, голов | Объягнилось овец в среднем | Учтено ягнят на матку, голов | |
| голов | % | |||
| Электрооттаиватель, оттаивание при 850С | 119 | 58 | 48,8 | 1,3 ± 0,21 |
| Гидрооттаиватель, оттаивание при 850С | 112 | 55 | 49,0 | 1,3 ± 0,18 |
| Контроль, при 400С по одной грануле | 86 | 38 | 44,0 | 1,2 ± 0,22 |
Из таблицы 8 видно, что оттаивание спермы в оттаивателях при повышенной температуре 850С не оказало отрицательно влияния на результативность осеменения овцематок по сравнению с контролем (оттаивание по одной грануле при 400С). Результативность осеменения овцематок спермой оттаянной в электро- и гидрооттаивателях при температуре 850С была достоверно выше, чем в контроле на 4,8% и 5,0% соответственно(Р < 0,05). Полученные результаты согласуются с ранее проведенными нами исследованиями (Чернова И.Е., Епишина Т.М., 1991; Чернова И.Е., 1997) по изучению оплодотворяющей способности спермы баранов, оттаянной в электро- и гидрооттаивателях при температуре 800С, когда результативность осеменения была на уровне контроля.
Наши исследования по температурным режимам оттаивания спермы баранов в модифицированных электро- и гидрооттаивателях показали, что оптимальной температурой оттаивания является 85°С.
При этом было установлено, что повышение температуры достоверно ускоряет начало и окончание процесса и не приводит к перегреванию порций оттаянной спермы, так как используемый в приборах принцип отделения жидкой фазы от твердой, позволяет оттаявшим порциям спермы сразу вытекать из тубы без дальнейшего нагрева.
Модифицированные электро- и гидрооттаиватели ОГСБ-2М и ОГСБВ конструкции ВНИИплем нашли свое практическое применение в овцеводческих хозяйствах Российской Федерации.
3.6. ЭФФЕКТИВНОСТЬ ПРИМЕНЕНИЯ ФИЗИЧЕСКИХ И БИОЛОГИЧЕСКИХ СПОСОБОВ СТИМУЛЯЦИИ ЭСТРУСА У СВИНЕЙ
Для стимуляции эструса у свиней используют ряд биотехнологических приемов, в частности, с применением физических способов воздействия на точки акупунктуры (Ерохин А.С, Епишина Т.М., Пухтинов О.Н., 2004).
В нашей работе для электростимуляции биологически активных точек у свиней мы исследовали новый электростимулятор «ДЭНАС», воздействующий на биологически активные точки (БАТ) импульсным током с частотой 10 Гц и напряжением 9 вольт, длительность серий импульсов 4,5 сек., длительность паузы между сериями импульсов 2 сек.
Экспериментальные данные по изучению влияния электростимуляции двух биологически активных точек № 38 и № 41 (Hsia I., Lee L., 1988) у основных свиноматок в послеотъемный период на их репродуктивные показатели приведены в таблице 9.
Таблица 9.- Влияние электростимуляции биологически активных точек на репродуктивную функцию свиноматок
| Изучаемые показатели | Группа свиноматок | |
| Опытная | Контрольная | |
| Общая продолжительность электростимуляции двух точек, мин | 10 | - |
| Количество маток в группе, голов | 158 | 160 |
| Количество маток, проявивших признаки эструса в течение 7 суток после отъема поросят: голов % | 150 94,9 ± 2,48х | 127 79,3 ± 2,24 |
| Средний интервал времени от отъема до наступления эструса, суток | 5,0 ± 0,41х | 6,6±0,38 |
| Опоросилось: голов | 136 | 111 |
| % | 90,7 | 87,4 |
| Среднее многоплодие маток, голов | 10,3 ± 0,2 | 10,2 ± 0,1 |
| Средняя живая масса поросенка при рождении, кг | 1,42 ± 0,07 | 1,37 ± 0,08 |
| Средняя живая масса поросенка при отъеме в 60 дней, кг | 19,1 ± 0,90 | 19,3 ± 0,70 |
| Сохранность поросят к отъему, % | 90,8 | 89,3 |
х- Р <0,05
Результаты данных таблицы 9 свидетельствуют, что однократная последовательная электропунктурная стимуляция двух биологически активных точек на протяжении 10-ти минут клинически здоровым свиноматкам на следующие сутки после отъема поросят способствует достоверному увеличению количества маток, проявивших признаки эструса в течение 7 суток после отъема поросят в среднем - на 15,6%, сокращению интервала от отъема до наступления эструса в среднем на 24,25% (Р <0,05), и повышению оплодотворяемости маток в среднем на 3,3%, по сравнению с их аналогами в контрольной группе.
Наступление эструса у ремонтных свинок происходит не всегда синхронно и в условиях промышленной технологии содержания у них довольно часто отмечается задержка полового созревания и нарушение половой цикличности.
В задачу наших исследований входило изучение возможности индуцирования эструса у ремонтных свинок с помощью электростимулятора «ДЭНАС», воздействующего на точки акупунктуры 38 и 41 импульсным током.
Не пришедшим в охоту клинически здоровым, нормально развитым ремонтным свинкам, в возрасте 8-9 месяцев и живой массой 120-130 кг проводили однократную последовательную электропунктуру двух биологически активных точек на протяжении 10-ти минут. Электростимуляция способствовала достоверному увеличению количества свинок, проявивших признаки эструса в течение 12 суток после стимуляции в среднем на 10,0%, сокращению среднего интервала времени от обработки до наступления эструса в среднем на 25,0% (Р < 0,05) и повышению многоплодия маток на 0,3 поросенка, по сравнению с их аналогами в контрольной группе.
Полученные результаты свидетельствуют об эффективности применения однократной электростимуляции биологически активных точек аппаратом «ДЭНАС» для улучшения репродуктивных качеств у свиней.
Одной из причин удлинения интервала от отъема до наступления эструса, обусловлено стрессовыми ситуациями свиноматок содержащихся в условиях промышленных технологий, что оказывает отрицательное влияние на ритмичность воспроизводства стада. Чаще данная проблема возникает в летние периоды при значительном повышении температуры воздуха, что способствует проявлению теплового стресса. При этом в организме животных может увеличиваться концентрация продуктов пероксидного окисления липидов, оказывающих отрицательное влияние на созревание и овуляцию яйцеклеток.
Мы решили изучить возможность улучшения репродуктивных способностей свиноматок в летний период путем однократной внутримышечной инъекции им на следующие сутки после отъема поросят синтетического водорастворимого антиоксиданта амбиола (2-метил-4-диметил-аминометил- 5-гидроксибензимидазол- дигидрохлорид), синтезированного в Институте химической физики (Москва). Результаты исследований суммированы в таблице 10.
Таблица 10 - Влияние внутримышечного введения синтетического антиоксиданта амбиола на репродуктивные показатели свиноматок
| Показатели | Группа свиноматок | |||
| 1 | 2 | 3 | Контроль | |
| Доза амбиола, мг/животное | 2 | 4 | 8 | - |
| Количество маток в группе | 59 | 54 | 51 | 63 |
| Количество маток, проявивших признаки эструса в течение 7 суток после отъема поросят: голов % | 49 83,0 | 45 83,3 | 47 92,1 | 49 77,7 |
| Средний интервал от отъема до наступления эструса, суток | 6,0±0,8 | 5,8х±0,9 | 5,2х±1,0 | 6,4±0,9 |
| Опоросилось: голов % | 40 81,6 | 37 82,2 | 38 80,8 | 40 81,6 |
| Среднее многоплодие, голов | 10,0±0,7 | 10,2±0,9 | 10,4±0,6 | 10,1±0,8 |
| Мертворожденных поросят, % | 3,7 | 3,4 | 3,8 | 3,9 |
| Сохранность поросят, % | 89,0 | 88,3 | 90,4 | 89,2 |
| Средняя живая масса поросенка при рождении, кг | 1,2±0,06 | 1,3±0,05 | 1,2±0,07 | 1,3±0,04 |
х-Р < 0,05
Однократное внутримышечное введение антиоксиданта амбиола в дозе 4,0 или 8,0 мг на животное клинически здоровым свиноматкам через сутки после отъема поросят способствует достоверному увеличению количества маток проявивших признаки эструса в течение 7 суток после отъема поросят в среднем на 5,6 и 14,4% соответственно, и сокращению интервала от отъема до наступления эструса в среднем на 9,4 и 18,8 % соответственно, при Р <0,05.
Далее в задачу наших исследований входило изучение стимуляции эструса у ремонтных свинок в летний период с помощью однократной внутримышечной инъекции синтетического антиоксиданта амбиола.
Однократная внутримышечная инъекция не пришедшим в охоту клинически здоровым, нормально развитым ремонтных свинкам в возрасте 8-9 месяцев, достигшим 120-130кг синтетического антиоксиданта амбиола в дозе 4,0 или 8,0 мг на животное способствовала достоверному увеличению количества маток проявивших признаки эструса в течение 10 суток после инъекции, в среднем на 13,4 и 18,5% соответственно. Интервал времени от обработки до прихода в охоту достоверно сократился в среднем на 35,6 и 33,4% соответственно по сравнению с контролем (P<0,05).
Положительное действие амбиола на ускорение эструса у свиней в послеотъемный период может быть обусловлено не только его антиоксидантным влиянием, но и рядом других механизмов действия. В частности, имеются данные, что амбиол оказывает адаптогенное, антистрессовое и ганадотропное действие (Гуськов А.М. и др., 1993).
Полученные результаты свидетельствую об эффективности стимуляции половой доминанты у свиноматок и ремонтных свинок с применением однократной электропунктуры аппаратом «ДЭНАС» или однократной внутримышечной инъекции синтетического антиоксиданта амбиола.
