Учебное пособие для учащихся «Русский язык 10-11 классы» Д. Э. Розенталь, М., «Дрофа», 2000 г. Тип программы
| Вид материала | Учебное пособие |
- Мустаева Составитель Мустаева Е. С., учитель русского языка и литературы мноу «Гимназия, 218.38kb.
- Рабочая учебная программа учебного предмета русский язык, 855.15kb.
- Программа по русскому языку. 5-9 классы*, 534.27kb.
- Черниковой Маргариты Владимировны по учебному курсу «Русский язык» 8 класс Базовый, 149.53kb.
- И. В. Абрамова Учебная рабочая программа, 715.44kb.
- Соловьева Ирина Алексеевна 2010- 2011 уч год пояснительная записка, 1237.62kb.
- Пояснительная записка, 1088.13kb.
- Синтаксис словосочетания и простого предложения, 821.61kb.
- Примерные программы отдельных учебных предметов Часть 1: 5-6 классы Русский язык, 3749.51kb.
- Название ресурса, 21.54kb.
| | Спирты, фенолы | §17. упр 1-6,7,15. | |
| 1) Спирты | . Состав и особенности строения; номенклатура; химические и физические св-ва | ||
| 2) Фенолы | Состав и особенности строения; номенклатура; химические и физические св-ва | §18. упр 1-5. | |
Примеры решения задач
Задача 1. Даны вещества: циклобутан, ацетилен, гептан, бутен-1, бутин-2, циклогексан, 2,2,3-триметилбутан, бутадиен. Выберите среди них а) три пары изомеров, б) две пары гомологов.
Решение:
а) Циклобутан и бутен-1 —формула С4Н8:

бутен-1 циклобутан
Гептан и 2,2,3-триметилбутан — формула С7Н16:

Бутин-1 и бутадиен — формула С4Н6:
| CH3 - CH2 - C ≡ CH | CH2 = CH- CH = CH2 |
| бутин - 1 | бутадиен |
б) Циклобутан и циклогексан принадлежат к гомологическому ряду циклоалканов:

циклобутан циклогексан
Ацетилен и бутин-1 принадлежат к гомологическому ряду алкинов:
НС≡СН СН3—СН2—С≡СН
ацетилен бутин-1
Задача 2. Напишите структурную формулу 2,2,5,5-тетраметилгексана. Напишите формулу его изомера, имеющего в качестве заместителей при основной цепи только этильные радикалы.
Решение. Структурная формула 2,2,5,5-тетраметилгексана:

В качестве изомера с этильными радикалами можно взять углеводород, имеющий 6 атомов углерода в главной цепи и два зтильных заместителя в положениях 3 и 4, т.е. 3,4-диэтилгексан:

Примеры решения задач по теме: Алканы.
Задача 1. Напишите структурные формулы всех алканов с пятью атомами углерода в главной цепи, плотность паров которых по водороду равна 50. Назовите их по систематической номенклатуре.
Решение. Молярная масса алканов равна: M(CnH2n+2) = 2*50 = 100 г/моль, откуда n = 7. Из 7 атомов углерода 5 составляют главную цепь, а два входят в состав заместителей: двух групп -СН3 или одной группы -С2Н5. Две группы -СН3 могут находиться в следующих положениях при главной цепи: 2,2-: 2,3-: 2,4-; 3.3-.

2.2-диметилпентан 2.3-диметилпентан

2.4-диметилпентан 3.3-диметилпентан
Одна группа -С2Н5 может находиться только в положении 3. В противных случаях она войдет в состав главной цепи, и длина последней будет превышать пять атомов углерода:

3-этилпентан
Ответ. 5 изомеров состава С7Н16.
Задача 2. Углеводород имеет элементный состав: 82,76% углерода и 17,24% водорода (по массе). При хлорировании (радикальном) углеводород образует два изомерных монохлорида - первичный и третичный. Определите строение исходного углеводорода.
Решение. Пусть формула углеводорода - СхНу (М = 12x+y). Массовая доля водорода в одном моле этого вещества равна:
(H) = y/(12x+y) = O,1724
откуда, y = 2,5x. Это означает, что простейшая формула углеводорода С2Н6. Ей соответствует истинная формула С4Н10. Существует два углеводорода состава С4Н10:

Бутан 2-мстилпропан
Третичные атомы углерода есть только в одном из этих двух изомеров, в 2-метилпропане, поэтому только 2-метилпропан при хлорировании может образовать третичный алкилхлорид:

Ответ. 2-метилпропан.
Задача 3. Газ, образующийся при полном сгорании 0,1 моль предельного углеводорода, пропустили через избыток известковой воды, при этом выпало 60 г осадка. Определите молекулярную формулу и строение предельного углеводорода, если известно, что он содержит один четвертичный атом углерода.
Решение. При сгорании одного моля углеводорода, содержащего и атомов углерода, образуется n моль СО2:
СnН2n+2 + (Зn+1)/2O2 → СO2 + (n+1)Н2О.
При пропускании СО2 через известковую воду образуется карбонат кальция:
Са(ОН)2 + СО2 = СаСО3↓ + Н2О.
v(СаСО3) = 60/100 = 0,6 моль = v(CO2). При сгорании 0,1 моль СnН2n+2 выделилось 0,6 моль СО2, следовательно n = 6. Молекулярная формула углеводорода - С6Н14.
Из пяти углеводородов состава С6Н14 четвертичный атом углерода есть только в 2,2-диметилбутане:

Ответ. С6Н14- 2,2-диметилбутан.
Примеры решения задач по теме: Непредельные соединения.
Задача 1. С помощью каких химических реакций можно очистить пропан от примеси пропена?
Решение. Пропен можно поглотить бромной водой:
СН3-СН=СН2 + Вr2 → СН3-СНВr-СН2Вr
или водным раствором перманганата калия:
СН3-СН=СН2 + [О] + Н2О → СН3-СН(ОН)-СН2ОН.
Пропан с этими веществами не реагирует и улетучивается.
Задача 2. Этиленовый углеводород массой 7,0 г присоединяет 2,24 л (н.у.) бромоводорода. Определите молярную массу и строение этого углеводорода, если известно, что он является цис-изомером.
Решение. Этиленовые углеводороды присоединяют бромоводород по уравнению:
CnH2n + HBr → CnH2n+1Br.
v(HBr) = 2,24/22,4 = 0,1 моль. v(CnH2n) = v(HBr) = 0,1 моль. M(CnH2n) = 7,0/0,1 = 70 г/моль, следовательно, n = 5. Существует 5 структурных изомеров этиленовых углеводородов состава С5Н10:
СН3-СН2-СН2-СН=СН2 СН3-СН2-СН=СН-СН3
пентен-1 пентен-2

2-метилбутен-1 2-метнлбутен-2 З-метилбутен-1
Из этих веществ только пентен-2 имеет цис-транс-нзомеры:

транс-пентен-2 цис-пентен-2
Ответ. Цис-пентен-2.
Задача 3. Сколько существует индивидуальных веществ состава С3Н5Сl. обесцвечивающих бромную воду? Приведите структурные формулы молекул этих веществ.
Решение. С3Н5Сl - это монохлорпроизводное от углеводорода С3Н6. Это вещество обесцвечивает бромную воду, следовательно, имеет в своем составе двойную связь. Три атома углерода могут образовать только неразветвленный углеродный скелет с концевой двойной связью:
С-С = С.
Структурная изомерия возможна только за счет положения атома хлора относительно двойной связи:
СН3-СН = СНСl СН3-ССl = СН2 Сl-СН2-СН = СН2
1-хлорпропен 2-хлорпропен 3-хлорпропен
1-хлорпропен может существовать в виде цис-транс-изомеров:

транс-1 –хлорпропен цис -1-хлорпропен
Ответ. 4 изомера.
Задача4. Напишите структурные формулы изомерных ацетиленовых углеводородов состава С7Н12, главная цепь которых состоит из пяти углеродных атомов, и назовите их.
Решение. Тройная связь в главной цепи может находиться в положениях 1 и 2:
С – С – С – С ≡ С С – С – О ≡ С - С
В первом случае возможны четыре структурных изомера (две группы -СН3 в положениях 3,3; 3,4; 4,4 или одна группа -С2Н5 в положении 3):

3,3-диметилпентин-1 4,4-диметилпентин-1

3.4-диметилпентин-1 3-этилпентин-1
Во втором случае возможен единственный изомер, когда две метильные группы находятся в положении 4:

4,4-диметилпентин-2
Ответ. 5 изомеров.
Задача5. При пропускании смеси пропана и ацетилена через склянку с бромной водой масса склянки увеличилась на 1,3 г. При полном сгорании такого же количества исходной смеси углеводородов выделилось 14 л (н.у.) оксида углерода (IV). Определите массовую долю пропана в исходной смеси.
Решение. Ацетилен поглощается бромной водой:
НC ≡ СH + 2Вr2 → НСВr2 -СНВr2 .
1,3 г - это масса ацетилена. v(C2H2) = 1,3/26 = 0,05 моль. При сгорании этого количества ацетилена по уравнению
2С2Н2 + 5О2 = 4СО2 + 2Н2О
выделилось 2-0,05 = 0,1 моль СО2. Общее количество СО2 равно 14/22,4 = 0,625 моль. При сгорании пропана по уравнению
С3Н8 + 5О2 = ЗСO2 + 4Н2О
выделилось 0,625 - 0,1 = 0,525 моль СО2, при этом в реакцию вступило 0,525/3 = 0,175 моль С3Н8 массой 0,175 - 44 = 7,7 г.
Общая масса смеси углеводородов равна 1,3+7,7 = 9,0 г, а массовая доля пропана составляет: (С3Н8) = 7,7/9,0 = 0,856, или 85,6%.
Ответ. 85,6% пропана.
Задача 6. Как химическим путем выделить бутин-2 из его смеси с бутином-1?
Решение. Смесь следует пропустить через аммиачный раствор оксида серебра. При этом бутин-1 поглотится за счет реакции
СН3 - СН2 - С ≡СН + [Ag(NH3)2]OH → CH3 - CH2 - C ≡CAg↓ + 2NH3 + Н2О.
Бутин-2 не реагирует с [Ag(NH3)2]OH и улетучится в чистом виде.
Примеры решения задач по теме:Кислородосодержащие соединения.
Задача 1. Этиленовый углеводород присоединяет 6,72 л (н.у.) хлороводорода. При гидролизе продукта реакции водным раствором гидроксида натрия при нагревании образуется 22,2 г предельного одноатомного спирта, содержащего три метильные группы. Определите строение исходного углеводорода и полученного спирта.
Решение. Запишем уравнения реакций:
СnН2n + НСl → СnН2n+1Сl,
CnH2n+1Cl + NaOH → CnH2n+1OH + NaCl.
v(HCl) = 6,72/22,4 = 0,3 моль. Согласно уравнениям реакций, v(CnH2n+1OH) = v(CnH2n+1Cl) = v(HCl) = 0.3 моль. Молярная масса спирта равна: M(CnH2n+1OH) = 22,2/0,3 = 74 г/моль, откуда n = 4. Следовательно, молекулярная формула спирта — С4Н9ОН.
Из четырех спиртов состава С4Н9ОН только третичный спирт (2-метилпропанол-2, или трет-бутиловый спирт) содержит три метильные группы. В состав молекулы этого спирта входит разветвленный углеродный скелет, следовательно, исходный алкен состава С4Н8 тоже имел разветвленный скелет. Это 2-метилпропен. Уравнения реакций:

Ответ. 2-метилпропен; трет-бутанол.
Задача2. Как в две стадии из уксусного альдегида получить бромэтан?
Решение. Уксусный альдегид можно восстановить водородом до этанола:
t,Ni
СН3СН=О + Н2 → СН3СН2ОН,
а этанол обработать бромоводородной кислотой:
СН3СН2ОН + НBr → СН3СН2Br + Н2О.
Задача3. Соединение состава С4Н8Сl2 с неразветвленным углеродным скелетом нагрели с водным раствором гидроксида натрия и получили органическое соединение, которое при окислении гидроксидом меди (II) превратилось в соединение состава С4Н8О2. Определите строение исходного соединения.
Решение. Если бы два атома хлора находились у разных атомов углерода, то при обработке щелочью мы получили бы двухатомный спирт, который не окисляется Сu(ОН)2. Если бы два атома хлора находились при одном атоме углерода в середине цепи, то при обработке щелочью мы получили бы кетон, который не окисляется Сu(ОН)2. Следовательно, искомое вещество - 1,1-дихлорбутан, СН3СН2СН2СНСl2. При щелочном гидролизе этого вещества образуется бутановый (масляный) альдегид:
СН3(СН2)2СНСl2 + 2NaOH → СН3(СН2)2СН=О + 2NaCl + Н2O,
который окисляется гидроксидом меди (II) до бутановой (масляной)кислоты:
СН3(СН2)2СН=О + 2Сu(ОН)2 → СН3(СН2)2СООН + Сu2О↓ + 2Н2О.
Ответ. 1,1-дихлорбутан.
Задача4. Для каталитического гидрирования 17,8 г смеси муравьиного и уксусного альдегидов до соответствующих спиртов потребовалось 11,2 л водорода (н.у.). Определите массовые доли альдегидов в смеси.
Решение. Пусть в смеси находилось х моль НСНО и y моль СН3СНО. тогда масса смеси равна: 30.х+44y = 17,8 г. Для полного гидрирования смеси по уравнениям
НСНО + Н2→СН3ОН,
СН3СНО + Н2→СН3СН2ОН
требуется (х+у) моль водорода, или 11,2/22,4 = 0,5 моль. Решая систему двух уравнений для х и у, находим: х = 0,3, У = 0,2.
Массовые доли альдегидов в смеси равны: (НСНО) = 0,3-30 / 17,8 = 0,506, или 50,6%, (СН3СНО) = 0,2-44 / 17,8 = 0,494, или 49,4%.
Ответ. 50,6% муравьиного альдегида, 49,4% уксусного альдегида.
Задача5. Определите структурную формулу соединения, если известно, что оно состоит из 37,7% С, 6,3% Н и 56,0% Cl (по массе). 6,35 г паров этого соединения занимают объем 1,12 л (н.у.). При гидролизе этого соединения образуется вещество, состоящее из С, Н, О, а при восстановлении последнего образуется вторичный спирт.
Решение. В объеме 1,12 л содержится 1,12/22,4 = 0,05 моль данного вещества. Его молярная масса равна 6,35/0,05 = 127 г/моль. В одном моле вещества содержится 127-0,56 = 71 г Cl (два моль), 127-0,377 = 48 г С (четыре моль) и 127-0,063 = 8 г Н (восемь моль). Формула вещества - С4Н8Сl2.
Вторичные спирты образуются при восстановлении кетонов, следовательно при гидролизе С4Н8Сl2 образуется кетон. Это означает, что два атома хлора находятся при одном атоме углерода в середине цепи. Искомое вещество - 2,2-дихлорбутан, СН3-СН2-ССl2-СН3.
Уравнения реакций:

Ответ. 2,2-дихлорбутан, СН3-СН2-ССl2-СН3.
Задача6. Каким образом можно осуществить реакции: ацетат натрия → уксусная кислота → хлоруксусная кислота? Напишите уравнения реакций.
Решение. Уксусная кислота — слабая, поэтому сильные кислоты вытесняют ее из ее солей: CH3COONa + HCl = СН3СООН + NaCl.
Уксусная кислота на свету реагирует с хлором:
СН3СООН + Сl2 = СН2СlСООН + HCl↑.
Задача7. Как можно получить пропионовую кислоту из бромэтана?
Решение. СН3СН2Br → СН3СН2СООН.
В молекуле пропионовой кислоты содержится три атома углерода, а в молекуле бромэтана — два. Дополнительный атом углерода можно ввести в состав молекулы, используя реакцию замещения с цианидом калия:
CH3CH2Br + KCN → CH3CH2CN + КBr.
В этой реакции образуется нитрил пропионовой кислоты (этилцианид), который гидролизуется при нагревании с образованием пропионата аммония:
CH3CH2CN + 2Н2О → СН3СН2СООМН4.
Подкисление раствора пропионата аммония дает пропионовую кислоту:
CH3CH2COONH4 + HCl → СН3СН2СООН + NH4Cl.
Другой способ решения этой задачи связан с использованием магнийорганических соединений и может быть проиллюстрирован схемой:
Мg СО2. Н2О
С2Н5Br → С2Н5МgBr → С2Н5СООМgBr → С2Н5СООН
Задача 8 Напишите схему превращений, с помощью которой из 3,3,3-трихлорпропена можно получить 3-гидроксипропановую кислоту. Укажите условия проведения реакций.
Решение. Хлороводород присоединяется к 3,3,3-трихлорпропену против правила Марковникова за счет -/-эффекта группы ССl3:
ССl3-СН=СН2 + HCl →ССl3-СН2-СН2Сl.
Гидролиз образующегося тетрахлорпроизводного водным раствором КОН дает (после подкисления) гидроксикислоту:
CCl3CH2CH2Cl + 4KOH → НООС-СН2-СН2ОН + 4KCl + Н2О
Задача9. Имеется 148 г смеси двух органических соединений одинакового состава С3Н6О2. Определите строение этих соединений и их массовые доли в смеси, если известно, что одно из них при взаимодействии с избытком гидрокарбоната натрия выделяет 22,4 л (н.у.) оксида углерода (IV), а другое не реагирует с карбонатом натрия и аммиачным раствором оксида серебра, но при нагревании с водным раствором гидроксида натрия образует спирт и соль кислоты.
Решение. Известно, что оксид углерода (IV) выделяется при взаимодействии карбоната натрия с кислотой. Кислота состава С3Н6О2 может быть только одна - пропионовая, СН3СН2СООН.
С2Н5СООН + NаНСО3 → C2H5COONa + CO2↑ + Н2О.
По условию, выделилось 22,4 л СО2, что составляет 1 моль, значит кислоты в смеси также было 1 моль. Молярная масса исходных органических соединений равна: M(С3Н6О2) = 74 г/моль, следовательно 148 г составляют 2 моль.
Второе соединение при гидролизе образует спирт и соль кислоты, значит это - сложный эфир:
RCOOR' + NaOH → RCOONa + R'OH.
Составу С3Н6О2 отвечают два сложных эфира: этилформиат НСООС2Н5 и метилацетат СН3СООСН3. Эфиры муравьиной кислоты реагируют с аммиачным раствором оксида серебра, поэтому первый эфир не удовлетворяет условию задачи. Следовательно, второе вещество в смеси — метилацетат.
Поскольку в смеси было по одному молю соединений с одинаковой молярной массой, то их массовые доли равны и составляют 50%.
Ответ. 50% СН3СН2СООН, 50% СН3СООСН3.
Задача10. Относительная плотность паров сложного эфира по водороду равна 44. При гидролизе этого эфира образуются два соединения, при сгорании равных количеств которых образуются одинаковые объемы углекислого газа (при одинаковых условиях). Приведите структурную формулу этого эфира.
Решение. Общая формула сложных эфиров, образованных предельными спиртами и кислотами, - СnН2nО2. Значение n можно определить из плотности по водороду:
M(СnН2nО2) = 14n + 32 = 44.2 = 88 г/моль,
откуда n = 4, то есть эфир содержит 4 атома углерода. Поскольку при сгорании спирта и кислоты, образующихся при гидролизе эфира, выделяются равные объемы углекислого газа, то кислота и спирт содержат одинаковое число атомов углерода, по два. Таким образом, искомый эфир образован уксусной кислотой и этанолом и называется этилацетат:
| | O | |
| | || | |
| СН3- | C | -О-С2Н5 |
Ответ. Этилацетат, СН3СООС2Н5.
Задача11. Массовая доля крахмала в картофеле составляет 20%. Рассчитайте массу глюкозы, которая может быть получена из картофеля массой 405 кг. Выход продукта равен 70%.
Решение. Составляем уравнение реакции гидролиза крахмала, в результате которой образуется глюкоза:

Рассчитаем массу крахмала в картофеле:

Определяем количество вещества крахмала:

Из уравнения реакции гидролиза крахмала следует

откуда получаем
n(глюкозы) = x∙n (крахмала);

Вычисляем массу глюкозы, которую можно получить при количественном выходе:
m(глюкозы) = n(глюкозы)М(глюкозы); m(глюкозы) = 0,5∙180 кг = 90 кг.
Учитывая массовую долю выхода продукта, рассчитаем массу реально полученной глюкозы:
 ;
; 
Примеры решения задач по теме: Азотсодержащие соединения.
Задача 1. Каким образом можно осуществить превращения: нитробензол → анилин → бромид фениламмония? Приведите уравнения реакций.
Решение. Нитробензол восстанавливается в анилин под действием различных восстановителей, например сульфида аммония (реакция Зинина):
С6Н5 -NO2 + 3(NH4)2S → C6H5-NH2 + 3S + 6NH3 + 2H2O.
Анилин реагирует с сухим бромоводородом с образованием бромида фениламмония:
С6Н5-МН2 + НВr → [ C6H5 - NH3 ] Br .
Задача 2. Через 10 г смеси бензола, фенола и анилина про пустили ток сухого хлороводорода, при этом выпало 2,59 г осадка. Его отфильтровали, а фильтрат обработали водным раствором гидроксида натрия. Верхний органический слой отделили, его масса уменьшилась на 4,7 г. Определите массы веществ в исходной смеси.
Решение. При пропускании через смесь сухого хлороводорода выпадает осадок хлорида фениламмония, который нерастворим в органических растворителях:
C6H5NH2 + HCl → C6H5NH3Cl ↓.
v ( C 6 H 5 NH 3 Cl ) = 2,59/129,5 = 0,02 моль, следовательно v ( C 6 H 5 NH 2 ) = 0,02 моль, m ( C 6 H 5 NH 2 ) = 0,02.93 = 1,86 г.
Уменьшение массы органического слоя на 4,7 г произошло за счет реакции фенола с гидроксидом натрия:
С6Н5ОН + NaOH → C6H5ONa + Н2О.
Фенол перешел в водный раствор в виде фенолята натрия. m (С6Н5ОН) = 4,7 г. Масса бензола в смеси составляет 10 - 4,7 -1,86 = 3,44 г.
Ответ. 1,86 г анилина, 4,7 г фенола, 3,44 г бензола.
Примеры решения задач по теме: Полимеры.
Задача 1. 28,2 г фенола нагрели с избытком формальдегида в присутствии кислоты. При этом образовалось 5,116 г воды. Определите среднюю молярную массу полученного высокомолекулярного продукта реакции, считая, что поликонденсаиия протекает только линейно, и фенол полностью вступает в реакцию.
Решение. Уравнение линейной поликонденсации фенола и формальдегида можно записать следующим образом:

Согласно этому уравнению, отношение количеств воды и фенола равно (и-1)/и, что позволяет найти значение n. v(C6H5OH) = 28,2/94 = 0,300 моль, v(H2O) = 5,116/18 = 0,2842 моль.
v(H2O) / v(C6H5OH) = 0,2842 / 0,300 = (n-1) / n, откуда n = 19. Молярная масса продукта конденсации равна:
М = М(С6Н4ОН) + 17-M(СН2С6Н3ОН) + M(СН2С6Н4ОН) = 93 + 17-106+ 107 = 2002 г/моль.
Ответ. 2002 г/моль.
ФИЗИКА
Календарно-тематическое планирование уроков физики .
Учитель Попов В.Б. Количество часов в неделю 2.
Планирование составлено на основе программы для общеобразовательных школ, автор: Н.Н.Тулькибаева, А.Э.Пушкарев.
Учебное пособие для учащихся «Физика-10» Мякишев Г.Я., Буховцев Б.Б., Н.Н.Сотский
Тип программы базовый .
| № п/п | Тема | Количество часов | Сроки | |
| по программе | по плану | по плану | ||
| | Кинематика | 9 | 9 | 1 четверть |
| | Динамика | 9 | 9 | 1 четверть |
| | Законы сохранения в механике | 9 | 9 | 2 четверть |
| | Молекулярная физика | 19 | 19 | 3 четверть |
| | Электростатика | 10 | 10 | 4 четверть |
| | Закон постоянного тока | 12 | 12 | 4 четверть |
Примерные контрольные работы:
Кинематика.
1. Какая единица времени принята основной в Международной системе?
А. 1 с. Б. 1 мин. В. 1 ч. Г. 1 сут. Д. 1 год.
2. Какие из перечисленных ниже величин векторные?
1) Скорость. 2) Ускорение. 3) Путь.
А. Только 1. Б. Только 2. В. Только 3. Г. 1 и 2. Д. 1 и 3. Е. I, 2 и 3.
3. В какой из двух задач, приведенных ниже, можно считать шар материальной точкой?
1) Измерить время свободного падения шара радиусом 1 см с высоты 100 м.
2) Рассчитать архимедову силу, действующую на этот шар, погруженный в воду.
А. Только в первой задаче. Б. Только во второй задаче. В. В обеих задачах. Г. Ни в первой, ни во второй задаче.
4. Автобус утром вышел на маршрут, а вечером возвратился обратно. Показания его счетчика увеличились за это время на 500 км. Определите путь, пройденный автобусом, и модуль перемещения 5.
А.l=s=500 км. Б.l=s=0. В.l=500 км, s=0. Г. l=0, s=500 км. Д.l= 500 км, s=250 км.
5. На рисунке 1 точками отмечены положения пяти движущихся слева направо тел через равные интервалы времени. Интервалы времени между двумя отметками для всех тел одинаковы. На какой полосе зарегистрировано равномерное движение с наибольшей скоростью?
А. 1. Б. 2. В. 3. Г. 4. Д. 5.

6. Скорость тела, движущегося прямолинейно и равноускоренно, изменилась при перемещении из точки 1 в точку 2 так, как показано на рисунке 3. Какое направление имеет вектор ускорения на этом участке пути?
А. Б. В.
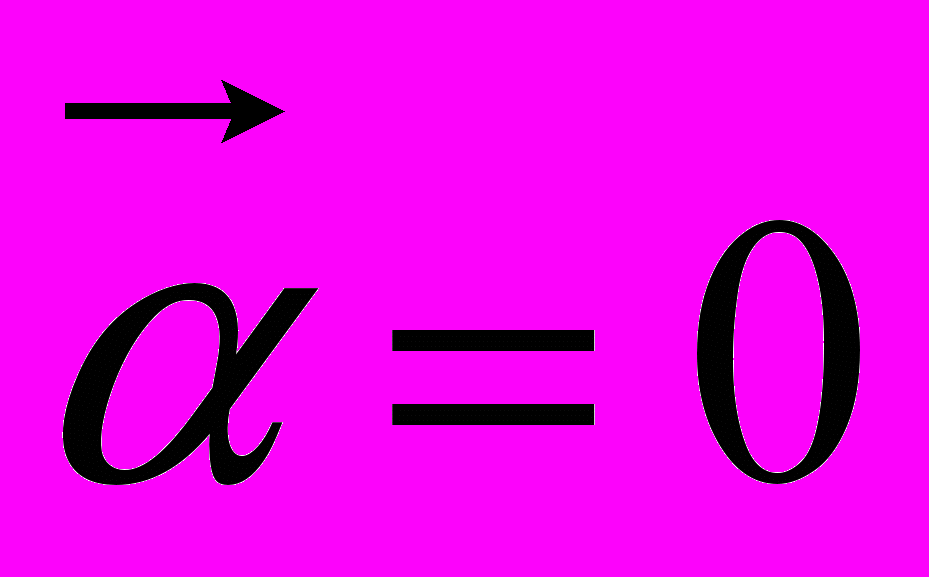 Г. Направление может быть любым. Д. Среди ответов А — Г нет правильного.
Г. Направление может быть любым. Д. Среди ответов А — Г нет правильного.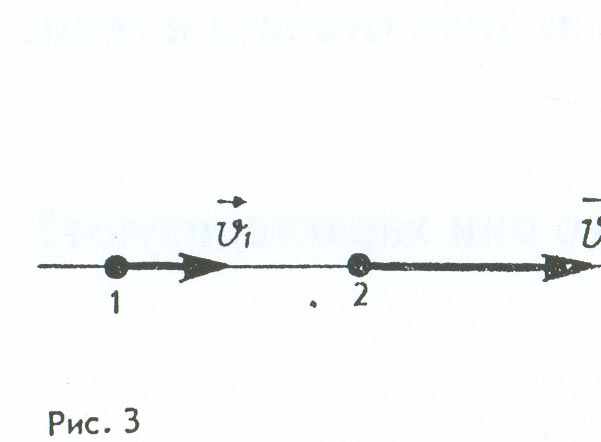
7. Какая из приведенных ниже формул соответствует записи определения скорости?
А.
 Б.
Б. 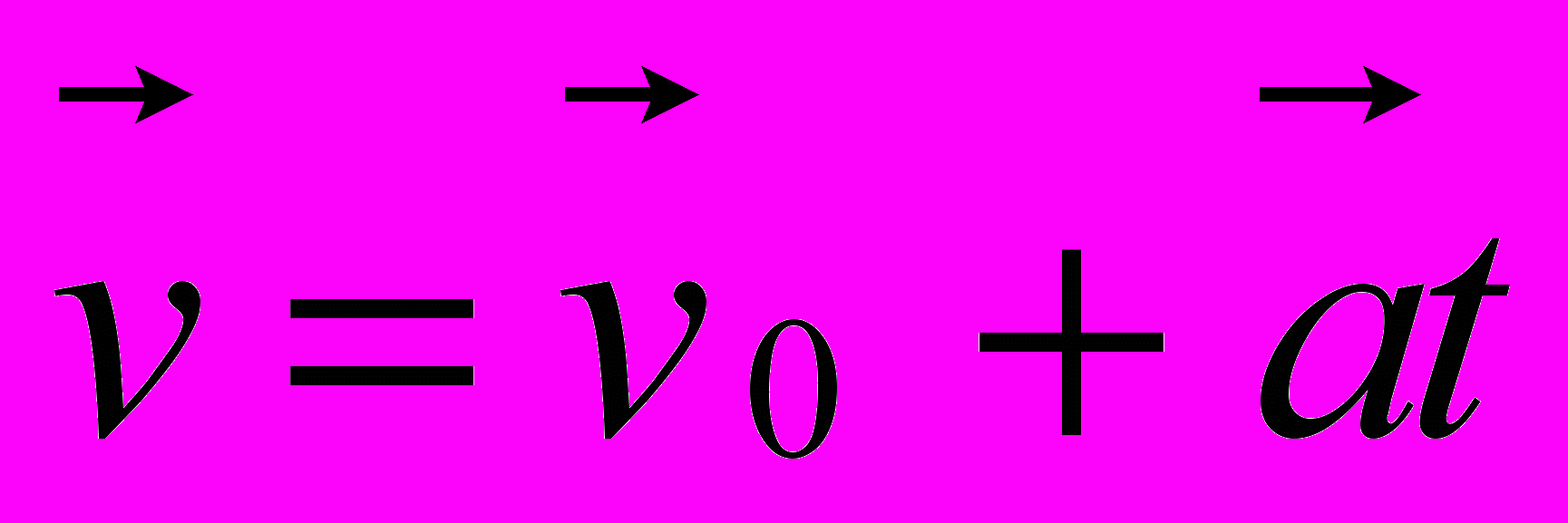 В.
В. 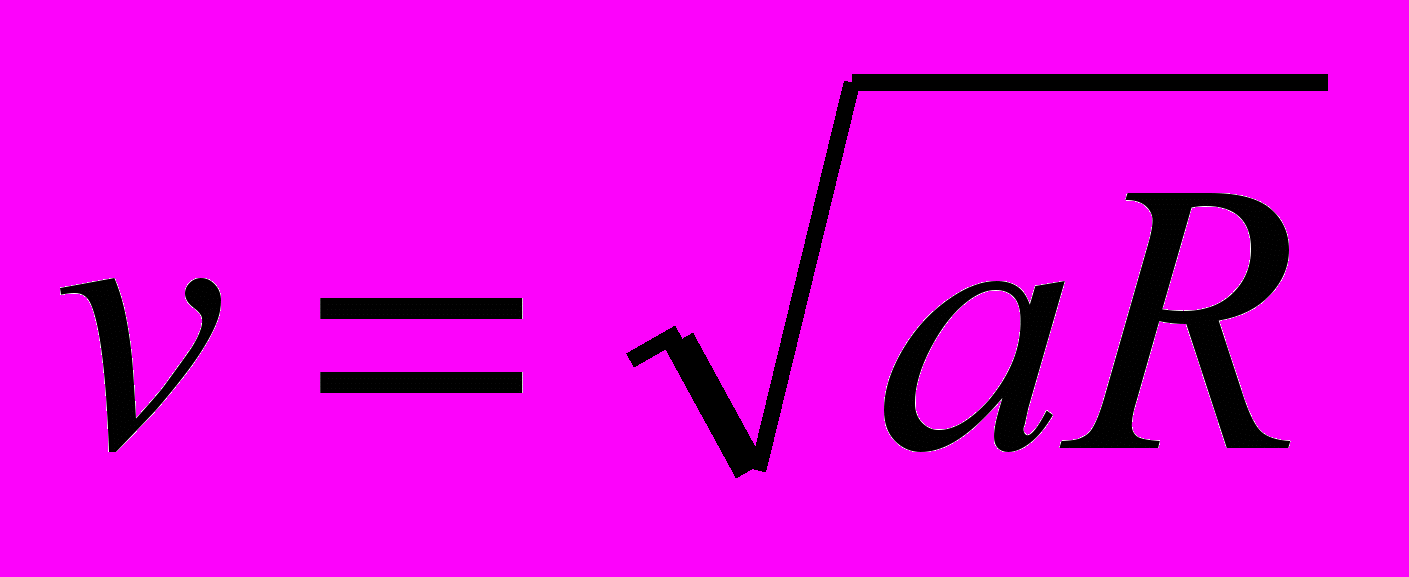 Г.
Г. 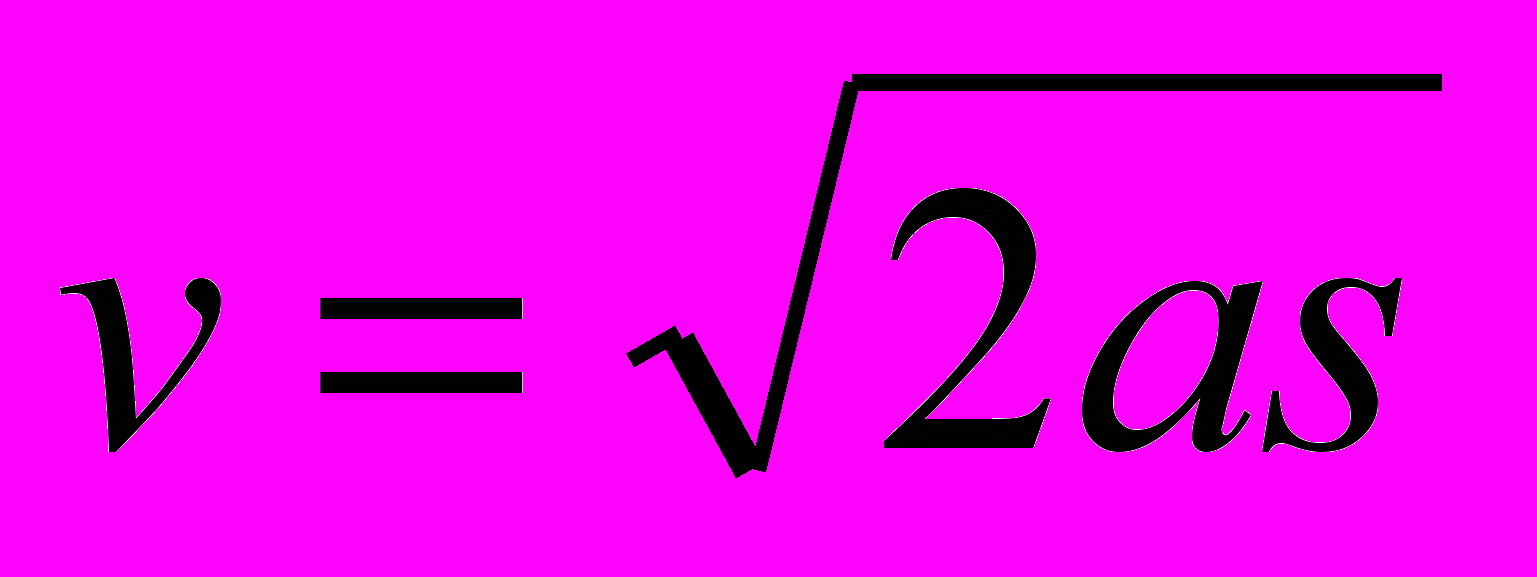 Д. Все формулы, приведенные в ответах А — Г.
Д. Все формулы, приведенные в ответах А — Г.8. Тело движется по окружности в направлении часовой стрелки (рис. 5). Какое направление имеет вектор скорости в точке N?
А. 1. Б. 2. В. 3. Г. 4. Д. Среди ответов А — Г нет правильного.
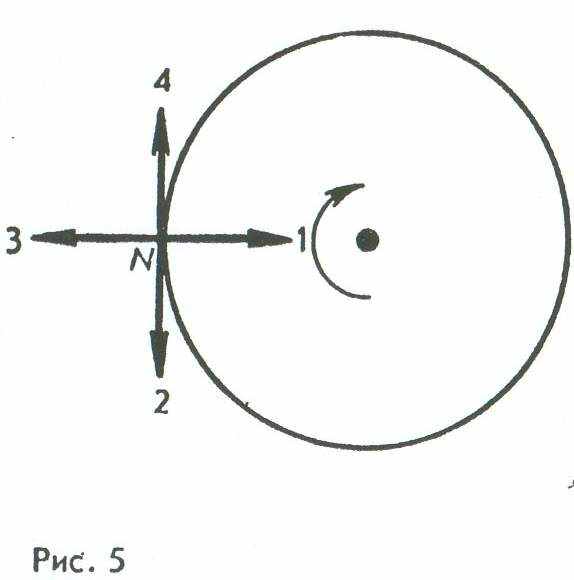
9. Как направлен в точке N (см. рис. 5) вектор ускорения тела, движущегося по окружности в направлении часовой стрелки с постоянной по модулю скоростью?
А. 1. Б. 2. В. 3. Г. 4. Д. Среди ответов А — Г нет правильного.
10.Тело движется по окружности с постоянной по модулю скоростью. Как изменится центростремительное ускорение тела при увеличении скорости в 2 раза, если радиус окружности останется неизменным?
А. Увеличится в 2 раза. Б. Уменьшится в 2 раза. В. Не изменится. Г. Уменьшится в 4 раза. Д. Увеличится в 4 раза.
11. В трубку, из которой откачан воздух, помещены дробинка, пробка и птичье перо. Какое из этих тел будет падать с наибольшим ускорением, если перевернуть трубку?
А. Дробинка. Б. Пробка. В. Птичье перо. Г. Все эти тела будут падать с одинаковым ускорением. Д. Ускорение всех трех тел равно нулю.
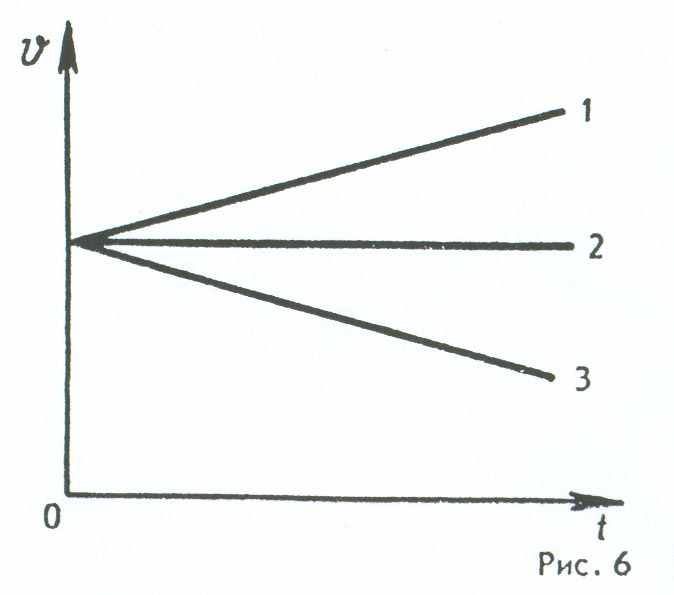
12. На рисунке 6 представлены графики зависимости модулей скорости от времени для трех тел, движущихся прямолинейно. Какой из графиков соответствует равноускоренному движению, при котором направление вектора ускорения совпадает с направлением вектора скорости?
А. 1. Б. 2. В. 3. Г. Все три графика. Д. Ни один из графиков.
13. Вертолет поднимается равномерно вертикально вверх. Какова траектория движения точки на конце лопасти винта вертолета в системе отсчета, связанной с корпусом вертолета?
А. Точка. Б. Прямая. В. Окружность. Г. Винтовая линия. Д. Среди ответов А — Г нет правильного.
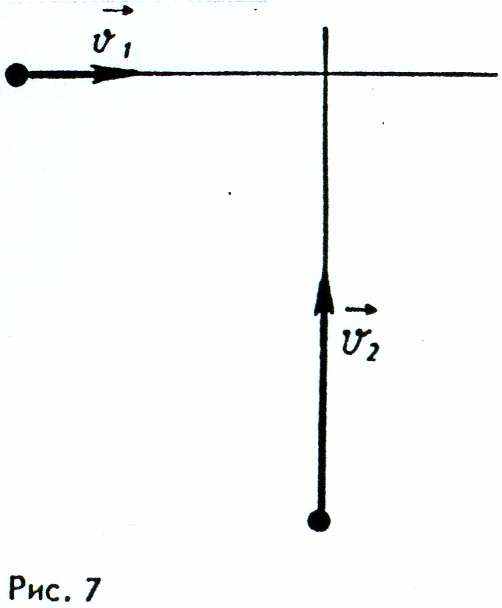
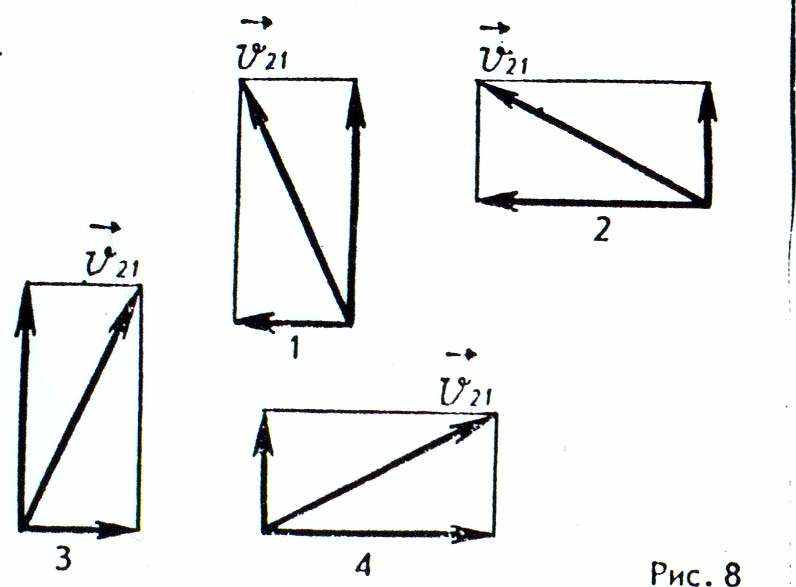
14. К перекрестку приближается грузовая машина со скоростью v1= 10 м/с (рис. 7) и легковая машина со скоростью v2 = 20 м/с. Какое направление имеет вектор скорости у2, легковой машины в системе отсчета грузовика (рис. 8)?
А. 1. Б. 2. В. 3. Г. 4. Д. Среди ответов А — Г нет правильного.
ОСНОВЫ ДИНАМИКИ
Вариант 1
1. В каких единицах принято выражать силу в Международной системе?
А. 1 г. Б. 1 кг. В. 1 Вт. Г. 1 Н. Д. 1 Па.
2. Какая из названных ниже физических величин скалярная?
1) Масса. 2) Сила.
А. Только первая. Б. Только вторая. В. Первая и вторая. Г. Ни первая, ни вторая. Д. Среди ответов А — Г нет правильного.
3. Какая из приведенных ниже формул выражает второй закон Ньютона?
А.
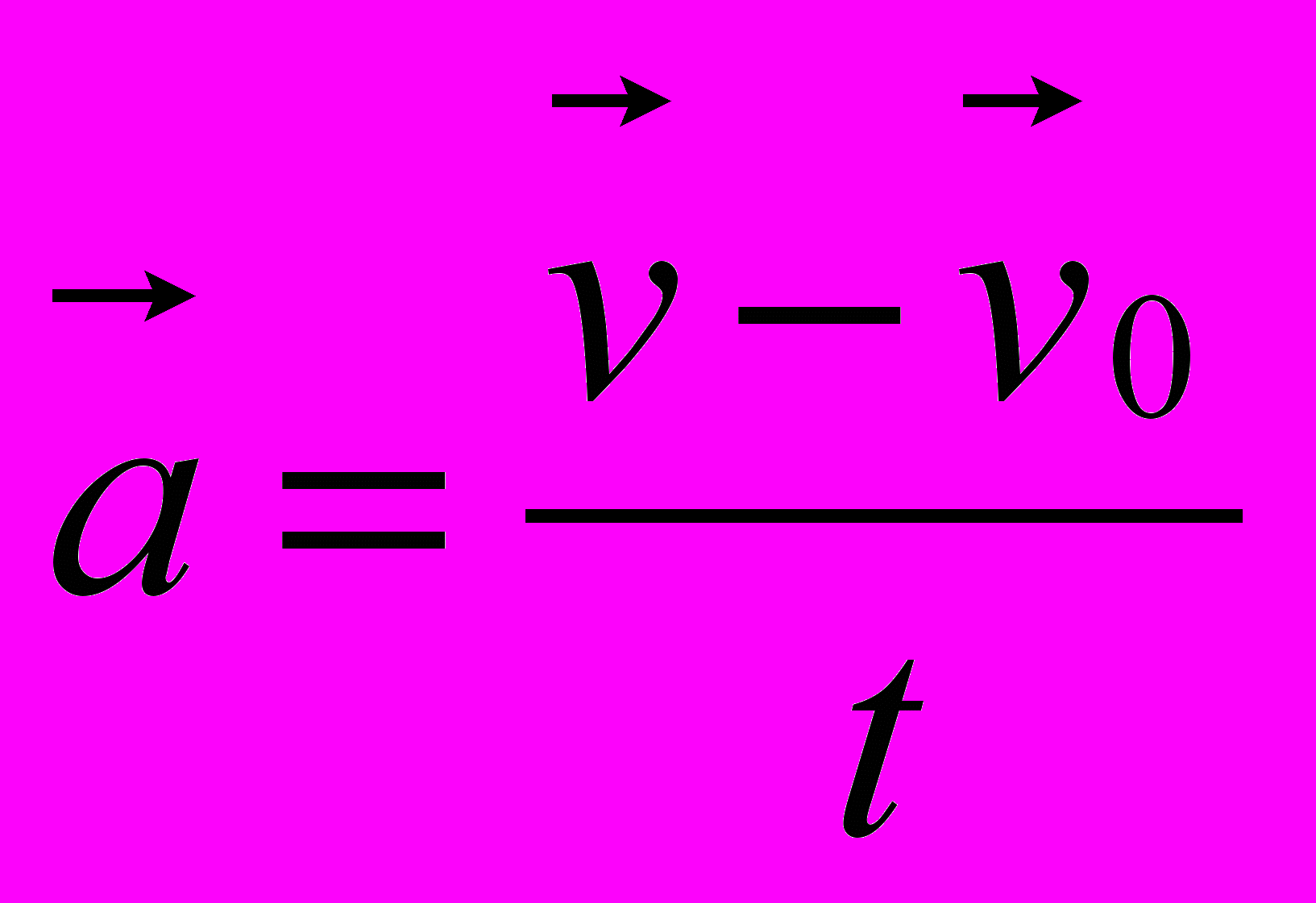 Б.
Б.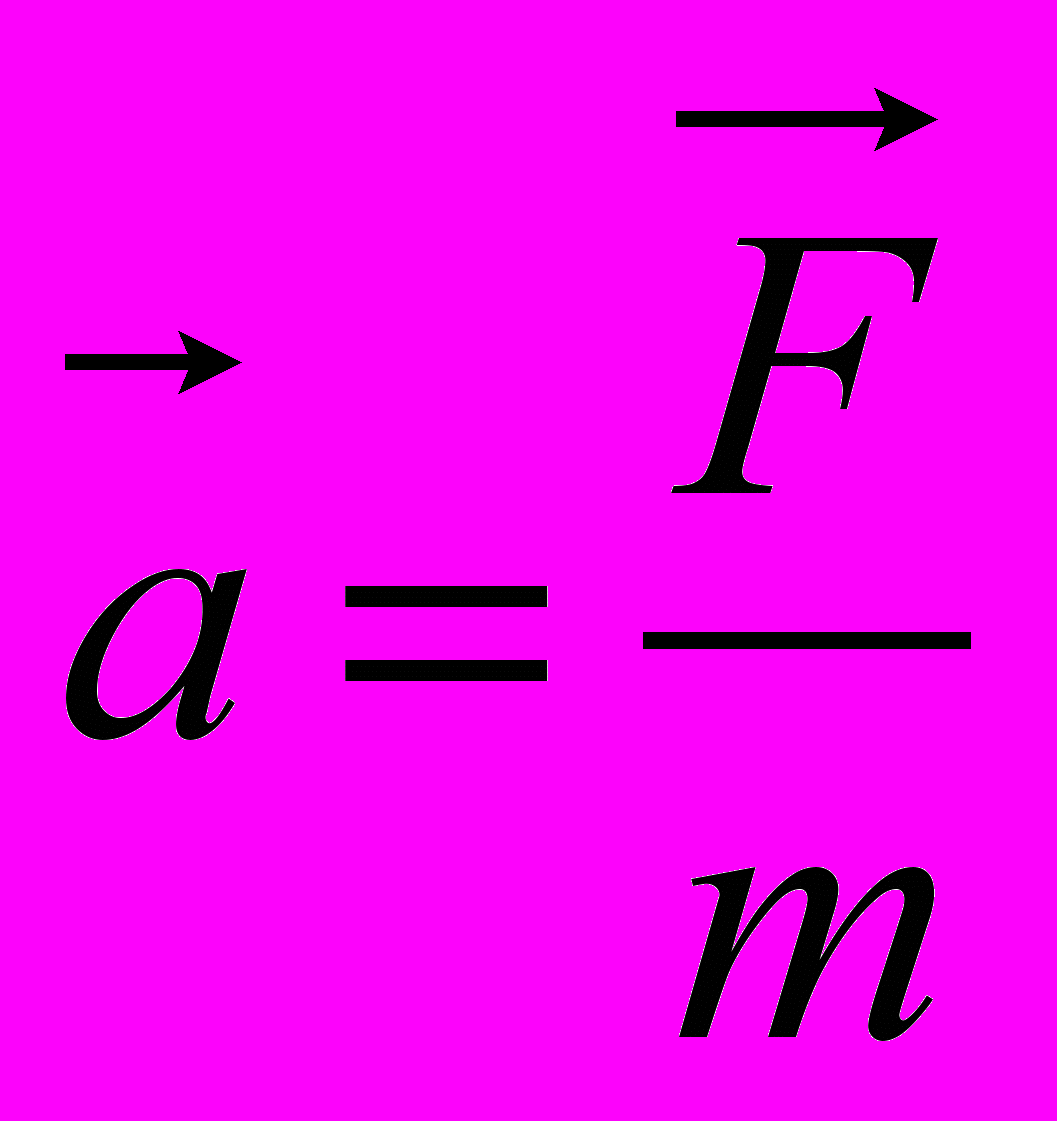 В.
В.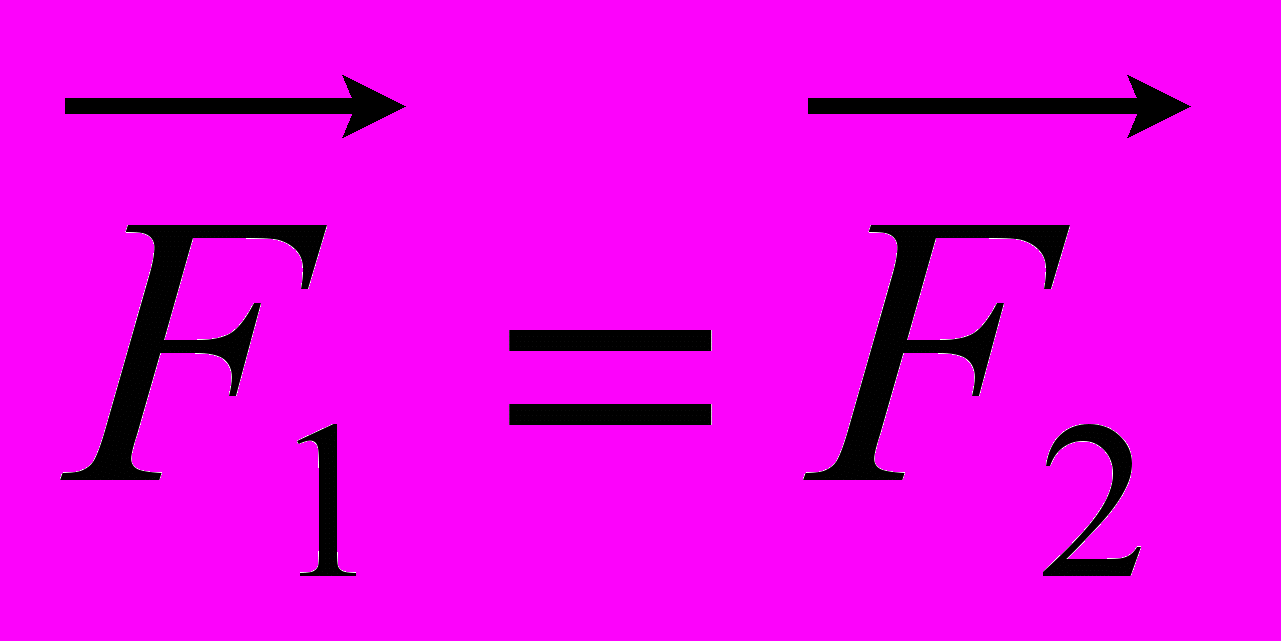
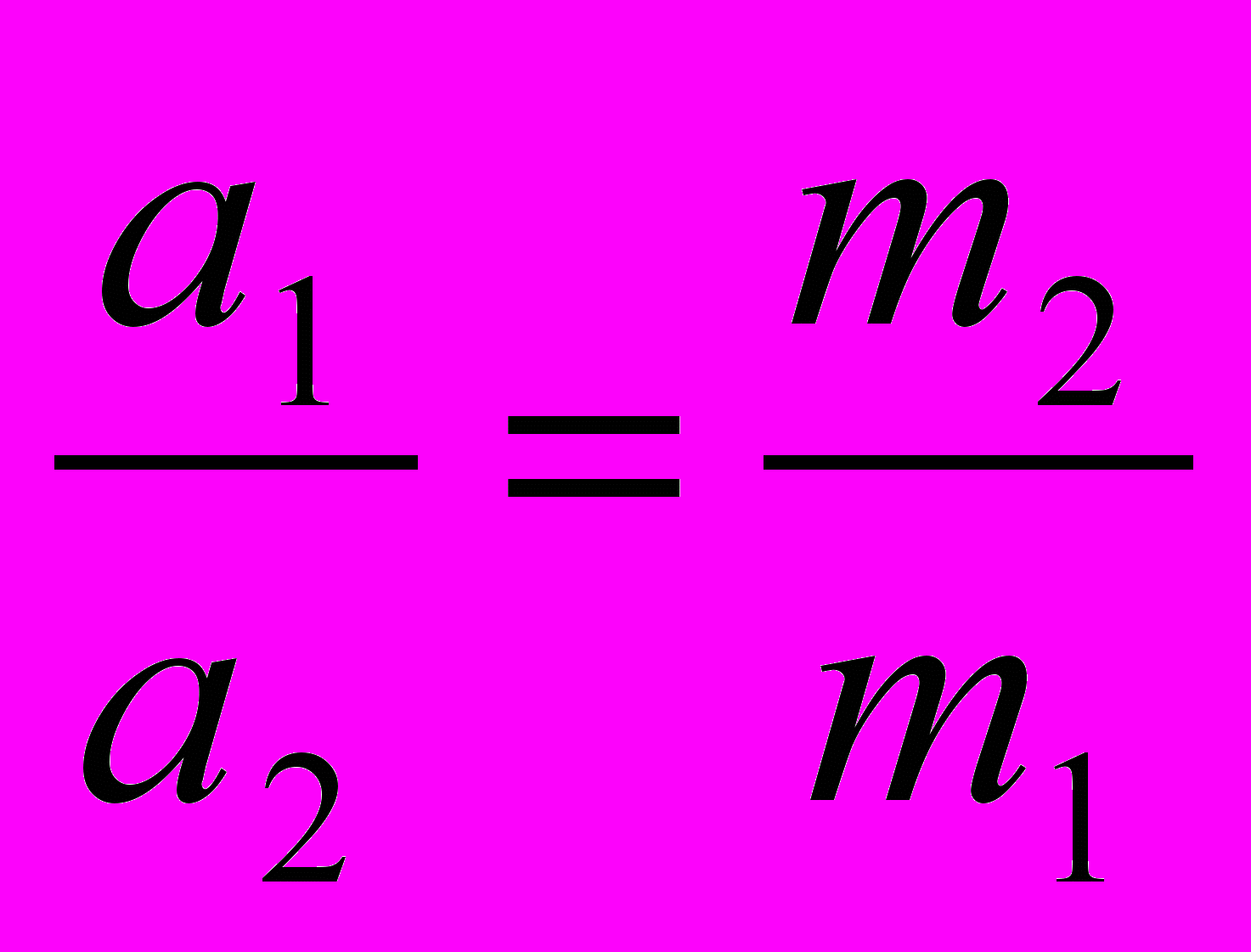 Д.
Д.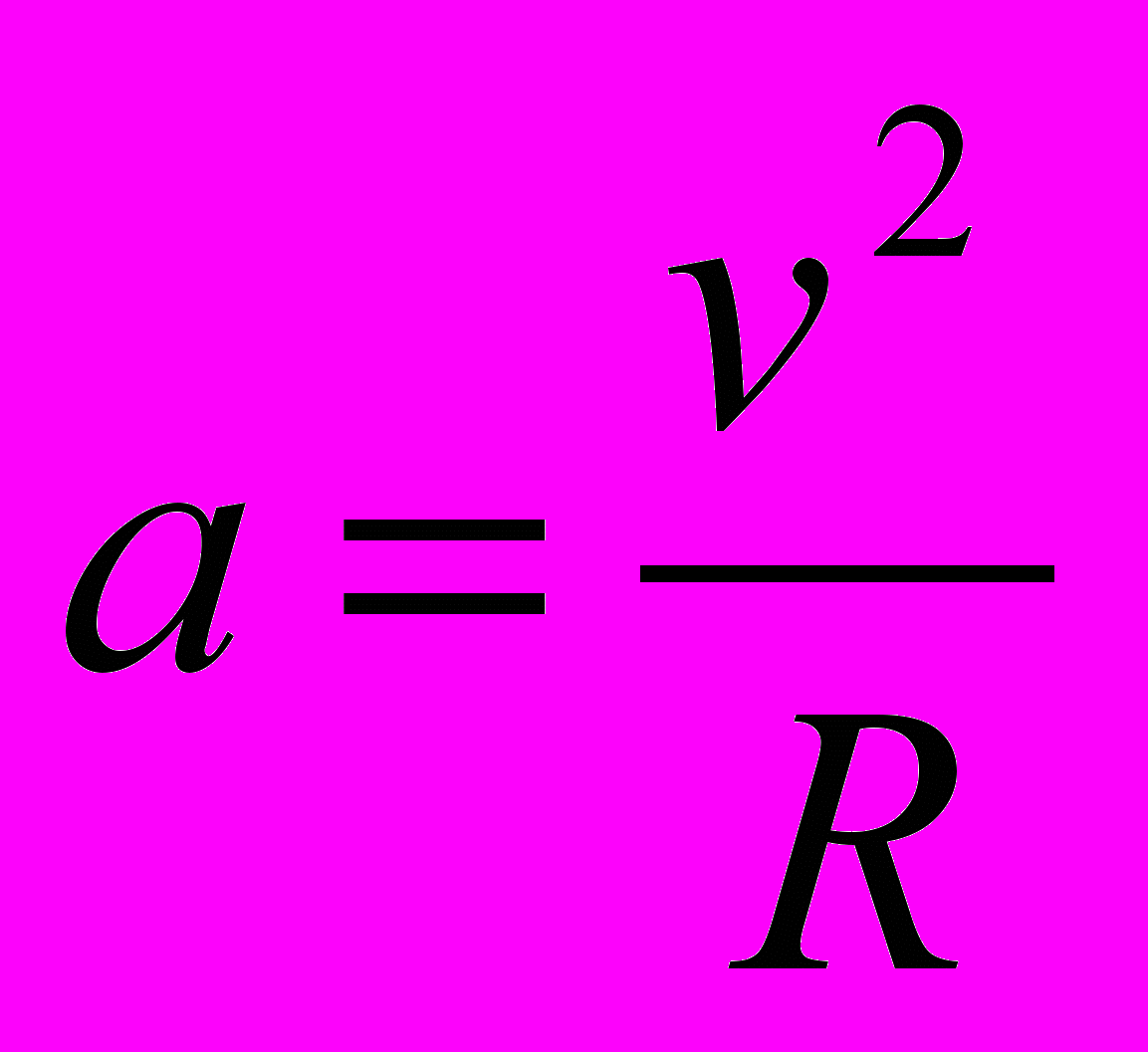
4. Какая из приведенных ниже формул выражает закон всемирного тяготения?
А.
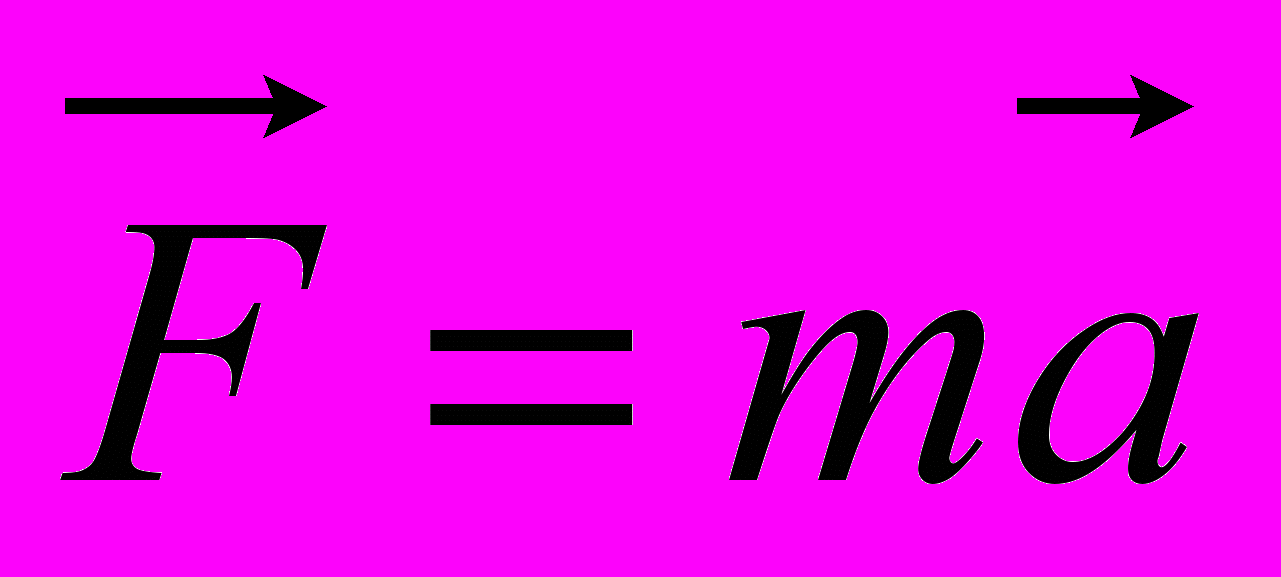 . Б.
. Б. 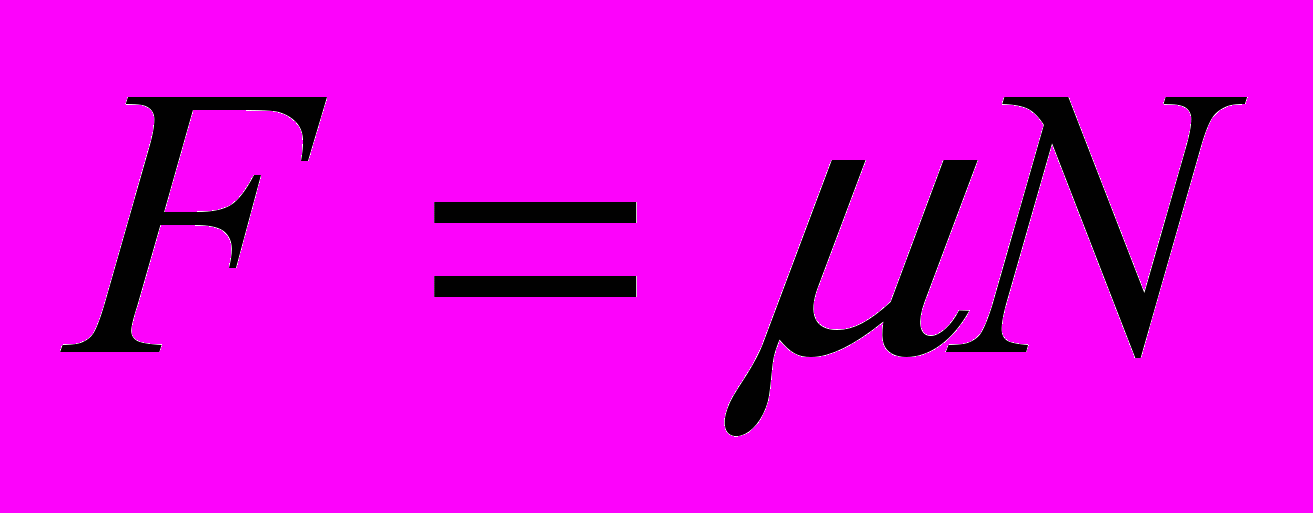 В.
В. 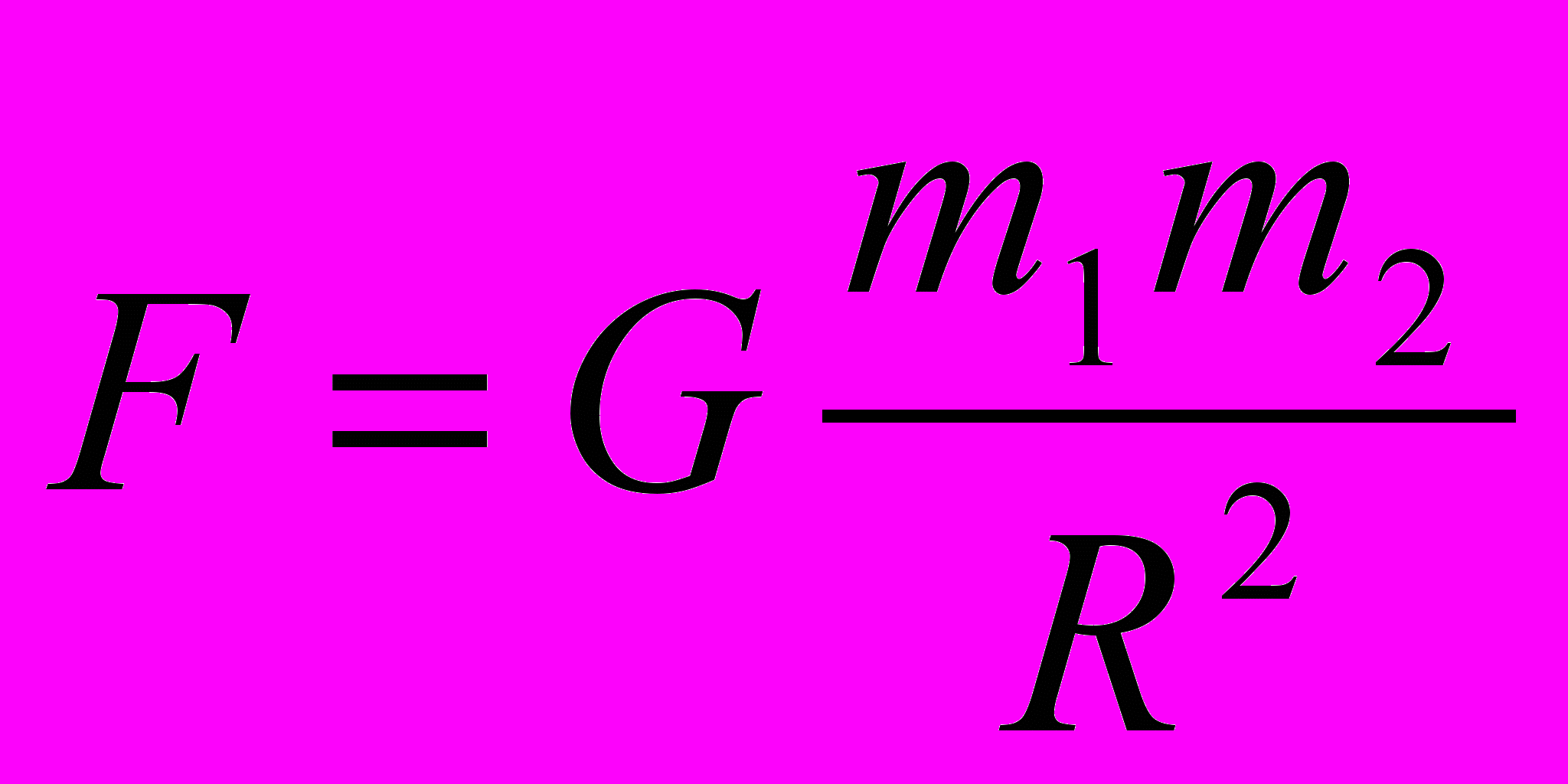 Г.
Г. 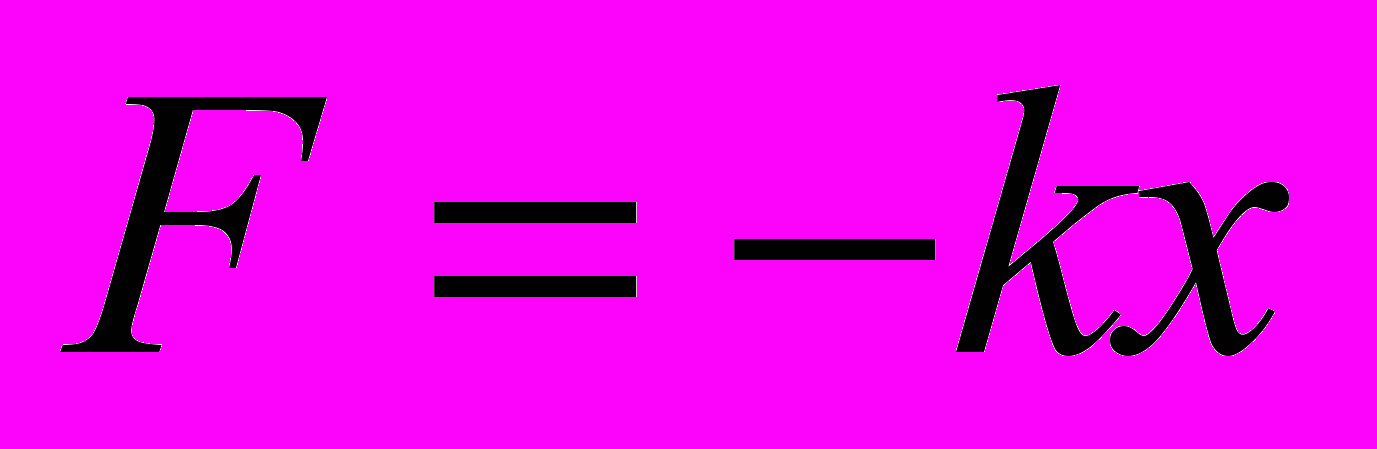 Д. Среди ответов А —Г нет правильного.
Д. Среди ответов А —Г нет правильного.5. Две силы F1=3Н и F2 = 4Н приложены к одной точке тела. Угол между векторами этих сил составляет 90°. Определите модуль равнодействующей сил.
А. 1 Н. Б. 5 Н. В. 7 Н. Г. 25 Н. Д. Среди ответов А — Г нет правильного.
6. Как движется тело, если векторная сумма всех действующих на него сил равна нулю?
А. Скорость может быть равна нулю или отлична от нуля, но обязательно неизменна во времени. Б. Скорость с течением времени возрастает. В. Скорость с течением времени убывает. Г. Скорость тела обязательно равна нулю. Д. Скорость постоянна и не равна нулю.
7. Как будет двигаться тело массой 2 кг под действием силы 4 Н? А. Равномерно, со скоростью 2 м/с. Б. Равномерно, со скоростью 0,5 м/с. В. Равноускоренно, с ускорением 2 м/с2. Г. Равноускоренно, с ускорением 0,5 м/с2. Д. Равноускоренно, с ускорением 18 м/с2.
Рис.2

8. На рисунке 1 показаны направление и точка приложения вектора силы F1, с которой Земля действует на Луну по закону всемирного тяготения. На каком из рисунков (рис. 2) правильно показаны направление и точка приложения силы F2, возникающей при взаимодействии по третьему закону Ньютона? А. 1. Б. 2. В. 3. Г. 4. Д. Среди ответов А — Г нет правильного.
9. Сила гравитационного взаимодействия между двумя шарами, массы которых m1=m2=1 кг, на расстоянии К. равна Р. Определите силу гравитационного взаимодействия между двумя шарами массами 3 и 4кг на таком же расстоянии R друг от друга.
А. F Б. 7F В.12F Г.49F Д. 144F
10. Сила гравитационного взаимодействия между двумя шарами, находящимися на расстоянии 1 м, равна 4 Н. Чему будет равна сила взаимодействия между этими шарами, если расстояние между ними увеличить до 2 м?
А. 1 Н. Б. 2 Н. В. 4 Н. Г. 8 Н. Д. 16 Н.
11. Под действием силы 4 Н пружина удлинилась на 0,02 м. Какова жесткость пружины? А. 2 Н/м. Б. 0,5 Н/м. В. 0,02 Н/м. Г. 500 Н/м. Д. 200 Н/м.
12. Как изменится сила трения скольжения при движении бруска по горизонтальной поверхности, если силу нормального давления увеличить в 2 раза?
А. Не изменится. Б. Увеличится в 2 раза. В. Уменьшится в 2 раза. Г. Увеличится в 4 раза. Д. Уменьшится в 4 раза.
13. Какое из нижеприведенных выражений определяет значение первой космической скорости спутника планеты массой М, если радиус его круговой орбиты?
А.
Д. Среди ответов А — Г нет правильного.
14. На рисунке 3 представлены направления векторов скорости
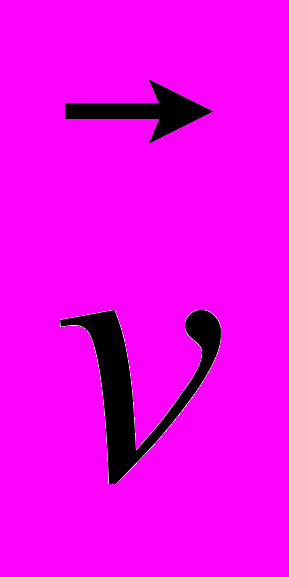 и ускорения
и ускорения 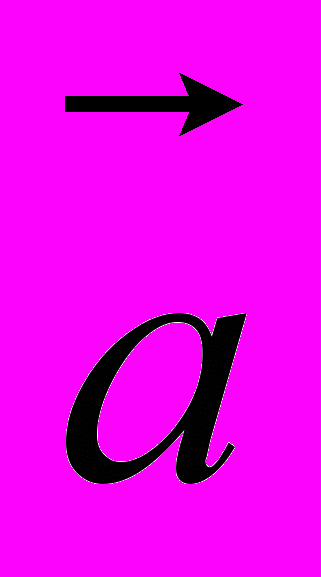 мяча. Какое из представленных на рисунке 4 направлений имеет вектор равнодействующей всех сил, приложенных к мячу?
мяча. Какое из представленных на рисунке 4 направлений имеет вектор равнодействующей всех сил, приложенных к мячу? А. 1. Б. 2. В. 3. Г. 4. Д. 5.

15. Самолет во время выполнения «мертвой петли» движется равномерно по окружности (рис. 5). Какое направление имеет вектор равнодействующей всех сил, приложенных к нему?
А. F=0. Б. 1. В. 2. Г. 3. Д. 4.
16. Лифт поднимается с ускорением, по модулю равным 1 м/с2, вектор ускорения направлен вертикально вниз. Определите вес тела, находящегося в лифте, если масса его 1 кг. Ускорение свободного падения принять равным 10 м/с2.
А. 0. Б. 9Н. В. 10Н. Г. 11Н. Д. Среди ответов А — Г нет правильного.
17. Самолет выполняет фигуру высшего пилотажа «мертвую петлю». В какой из отмеченных на рисунке 6 точек сила упругости, действующая на пилота со стороны кресла, максимальна?
А. В точке 1. Б. В точке 2. В. В точке 3. Г. В точке 4. Д. Во всех точках сила упругости одинакова.
18. Космический корабль после выключения ракетных двигателей движется вертикально вверх, достигает верхней точки траектории и затем опускается вниз. На каком участке траектории сила давления космонавта на кресло равна нулю? Сопротивлением воздуха пренебречь.
А. Только во время движения вверх. Б. Только во время движения вниз. В. Только в момент достижения верхней точки. Г. Во время всего полета не равна нулю. Д. Во время всего полета с неработающими двигателями равна нулю.
19. Как движется тело, если вектор равнодействующей всех сил, действующих на него, отличен от нуля и не изменяется во времени и по направлению?
А. Скорость тела равна нулю. Б. Скорость тела не изменяется во времени. В. Скорость тела обязательно возрастает. Г. Скорость тела обязательно убывает. Д. Скорость тела изменяется во времени по линейному закону.
20. Модуль скорости тела, движущегося прямолинейно, изменялся со временем по закону, графически представленному на рисунке 7. Какой из графиков (рис. 8) выражает зависимость от времени модуля равнодействующих всех сил, действовавших на тело?
А. 1. Б. 2. В. 3. Г. 4. Д. F = 0.

21. У поверхности Земли на тело действует сила всемирного тяготения 36 Н. Чему равна сила тяготения, действующая на это тело, на расстоянии двух радиусов Земли от ее поверхности?
А. 36 Н. Б. 18 Н. В. 12 Н. Г. 9 Н. Д. 4 Н.
22. Тело начинает двигаться из состояния покоя. На рисунке 9 представлен график зависимости от времени модуля равнодействующей сил, действующих на тело. Направление вектора равнодействующей сил не изменяется со временем. Каким было движение в промежутке от четвертой секунды до шестой?
А. Равномерным. Б. Равноускоренным. В. Тело покоилось. Г. Скорость тела возрастала. Д. Скорость тела убывала.
23. Брусок массой т движется по горизонтальной поверхности стола под действием силы F, направленной под углом
 к вектору скорости v (рис. 10). Коэффициент трения скольжения бруска о поверхность стола равен ц. Определите силу трения, действующую на брусок.
к вектору скорости v (рис. 10). Коэффициент трения скольжения бруска о поверхность стола равен ц. Определите силу трения, действующую на брусок.А.
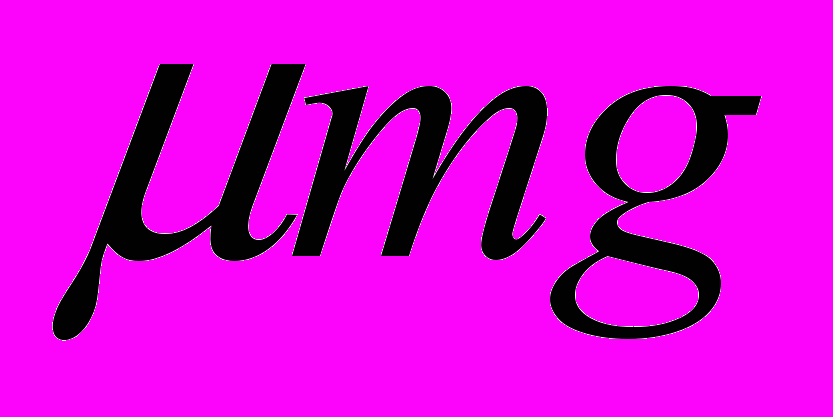 Б.
Б. 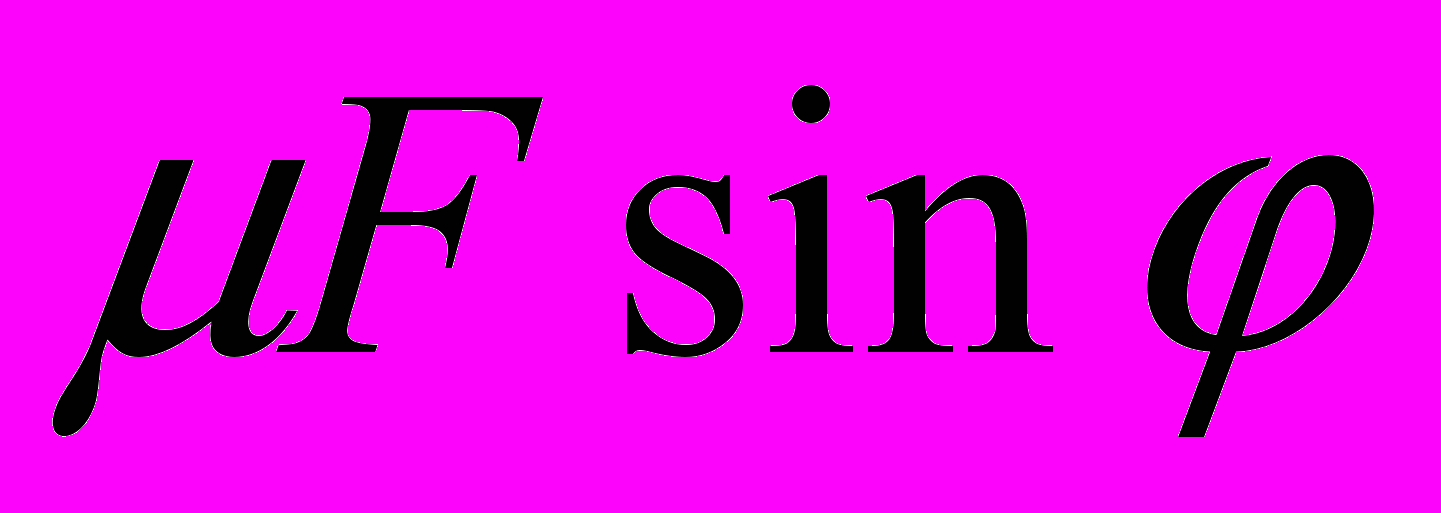 В.
В. 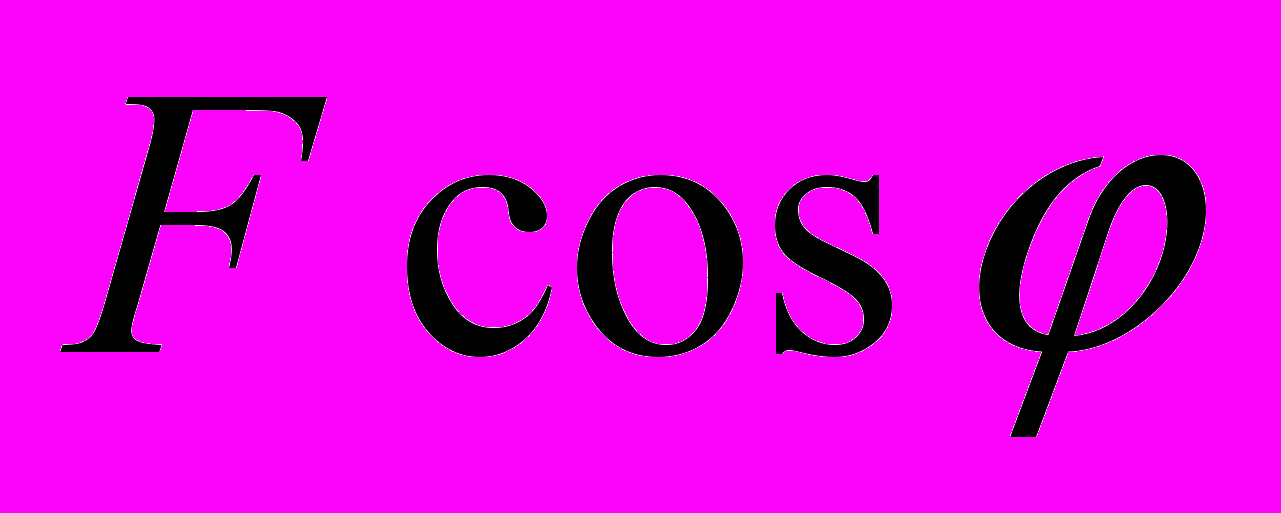 Г.
Г. 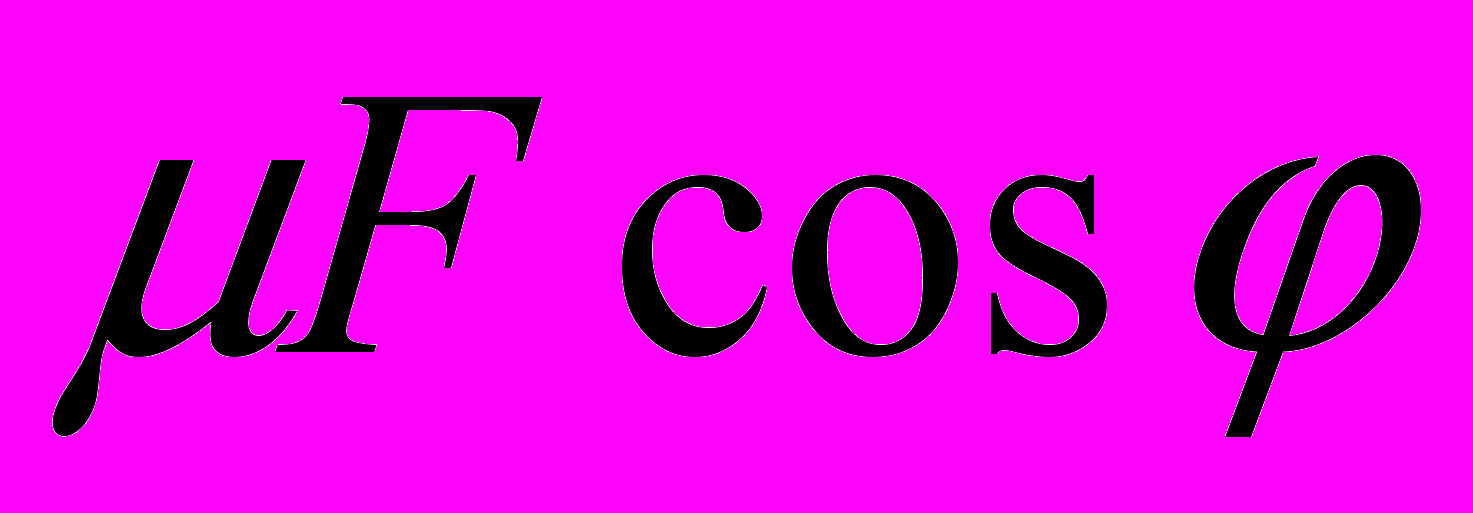 Д.
Д. 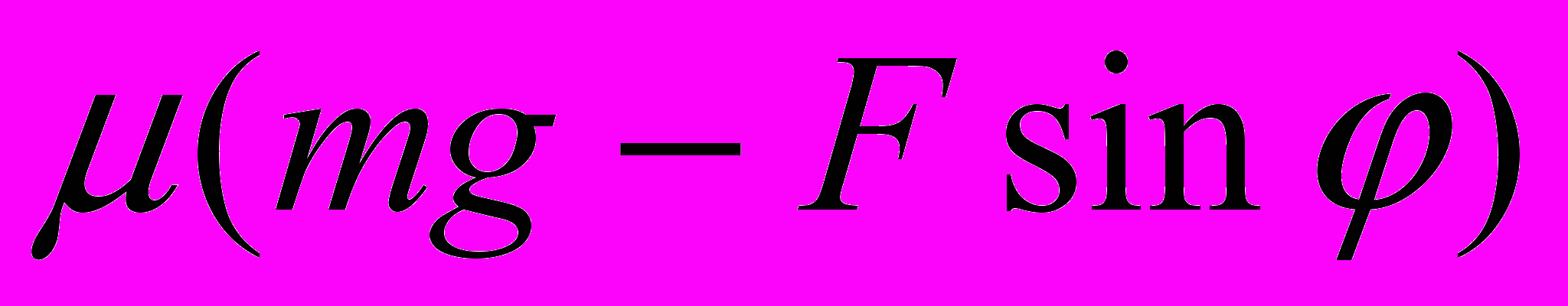

24. На столе лежит брусок массой 1 кг. На брусок в горизонтальном направлении действует сила Р, график зависимости которой от времени показан на рисунке 11. Коэффициент трения бруска о поверхность стола равен 0,3. Какой из графиков (рис. 12) выражает зависимость силы трения
Fтр бруском и поверхностью стола от времени? А. 1. Б. 2. В. 3. Г. 4. Д. 5.
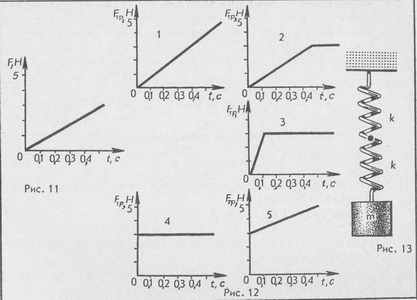
25. Груз массой т подвесили на двух одинаковых пружинах жесткостью & каждая, как показано на рисунке 13. На какое расстояние опустится груз в состоянии равновесия?
А.
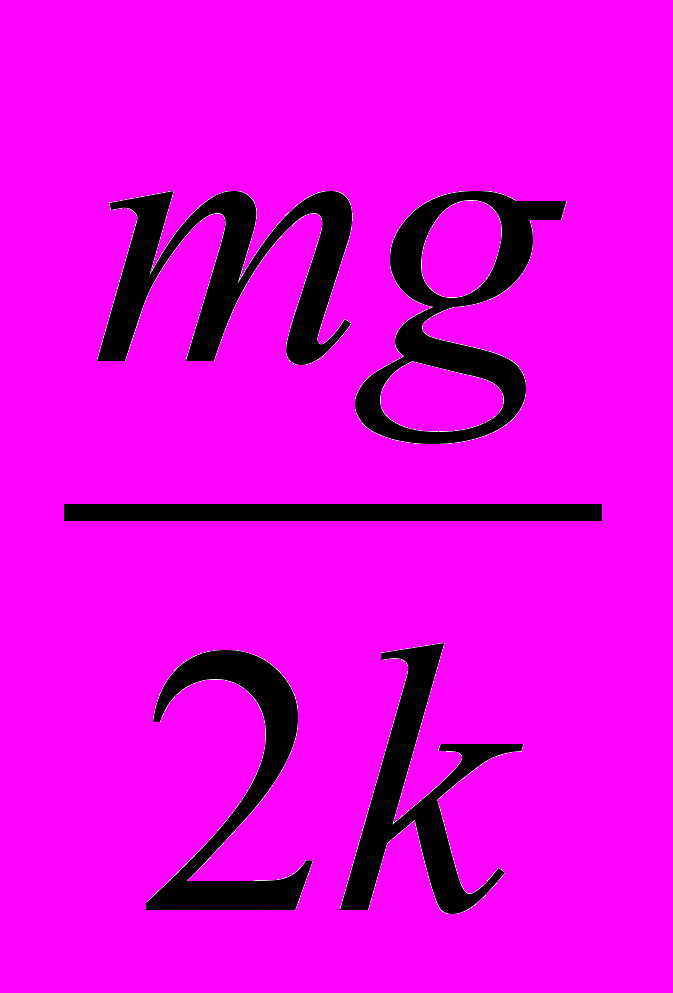 Б.
Б. 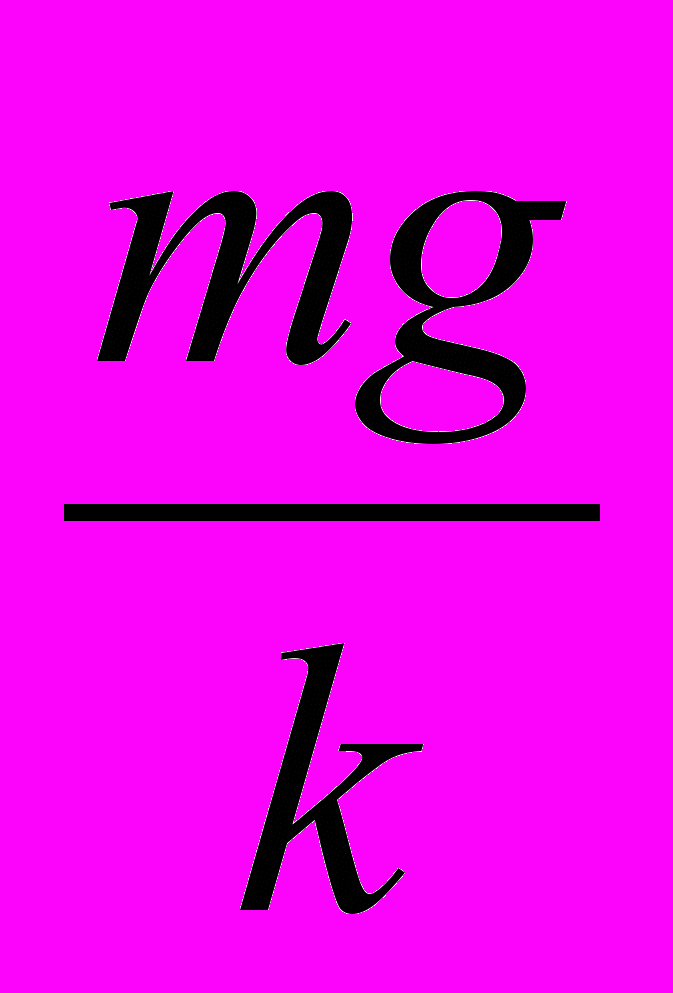 В.
В. 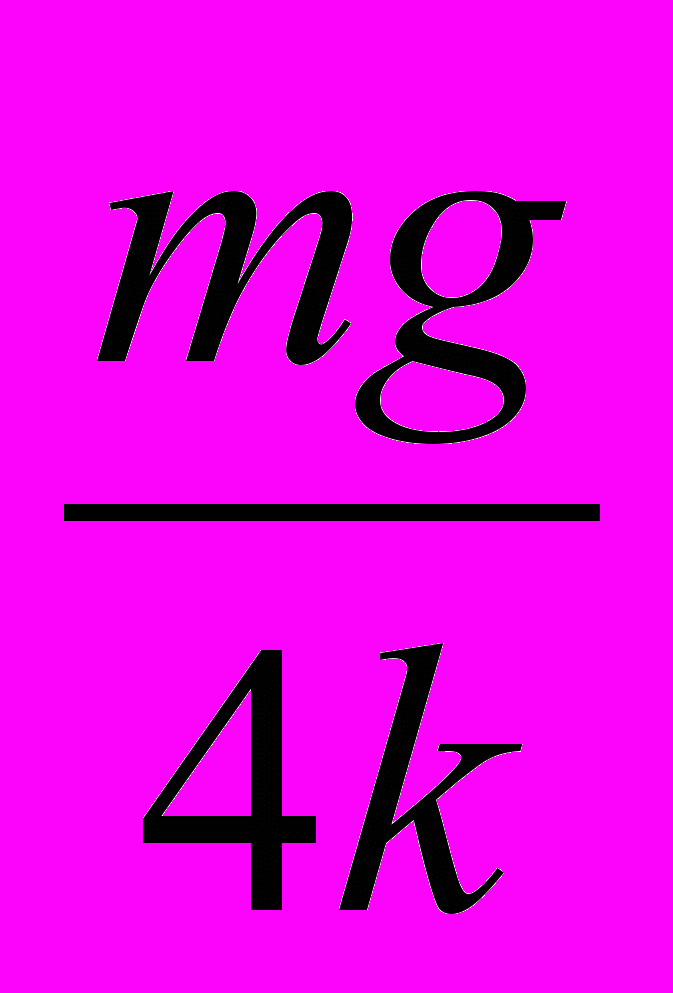 Г.
Г. 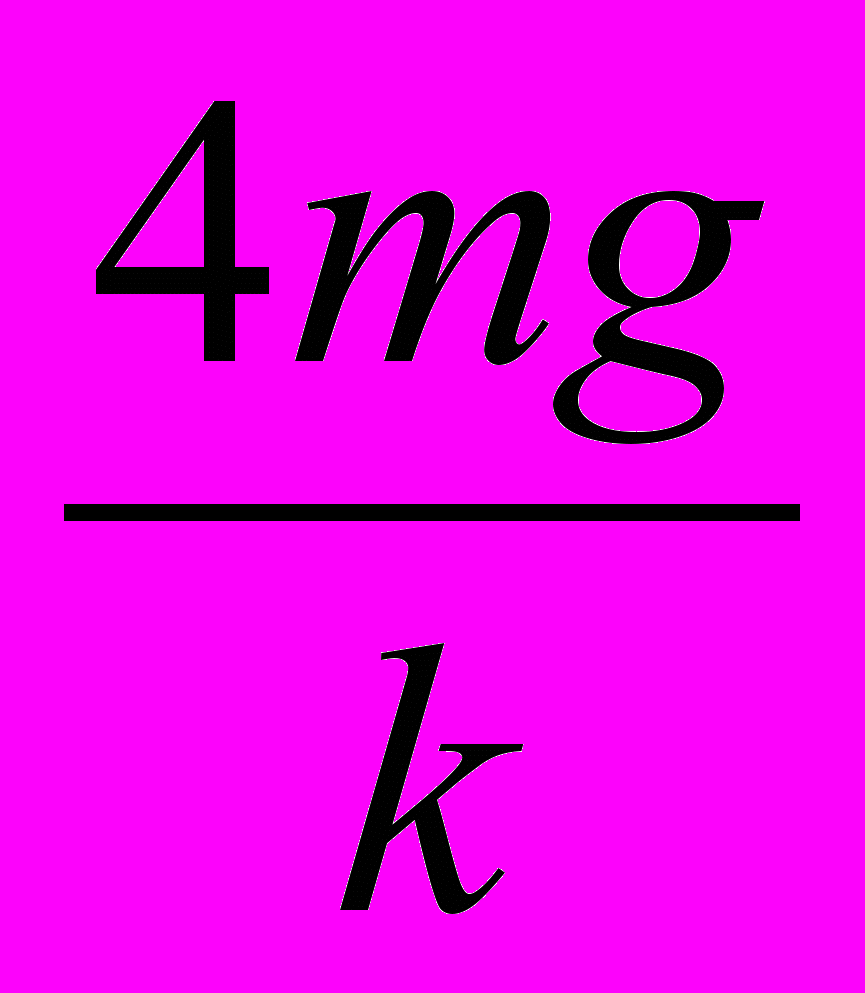 Д. Среди ответов А-Д нет правильного.
Д. Среди ответов А-Д нет правильного.Контрольная работа по теме «Электрическое поле»
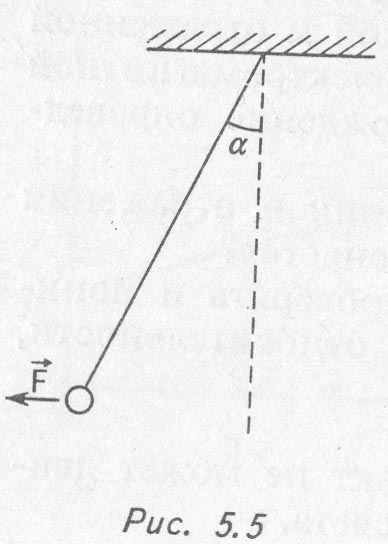
1. В электрическое поле внесли шарик, заряд которого 2 • 10-5 Кл. По углу отклонения шарика (рис. 5.5) определили, что на него действует сила 4 •10-3 Н. Каковы модуль и направление напряженности электрического поля в данной точке?
2. На основании каких опытов мы можем утверждать, что в природе существуют электрические заряды разных знаков?
3. Над столом на нити висит тяжелый металлический шар. Предложите способ, позволяющий проверить, заряжен ли этот шар (или он электрически нейтрален).
4. Под действием электрического поля заряженной пластины положительно заряженный шарик переместился из точки А в точку В (рис. 5.6).
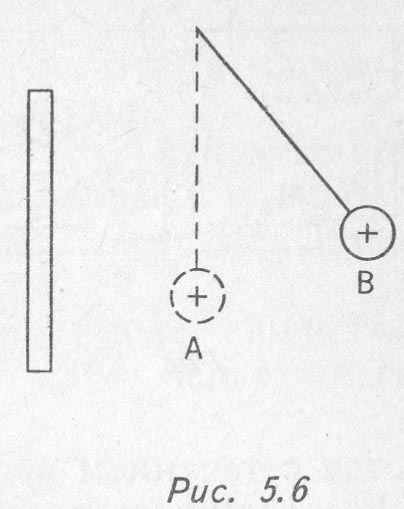
Разность потенциалов электрического поля пластины между этими точками 500 В, электрический заряд шарика 0,002 Кл. На сколько изменилась энергия взаимодействия шарика с пластиной?
5*. Скорость электрона, движущегося в электрическом поле, увеличилась с нуля до 2 • 106 м/с. Какова разность потенциалов электрического поля между точками, где находился электрон? (М = 9,1 • 10-31 кг; е=1,6 • 10-19 Кл.)
Основы МКТ и термодинамики
Вариант 1.
1. Применяя законы механики к модели идеального газа, можно теоретически получить уравнение: р=2/3 nЕ, где p — давление газа, n — концентрация молекул, Е — средняя кинетическая энергия поступательного движения молекул газа. Экспериментально установлено, что давление газа при постоянном объеме пропорционально температуре:
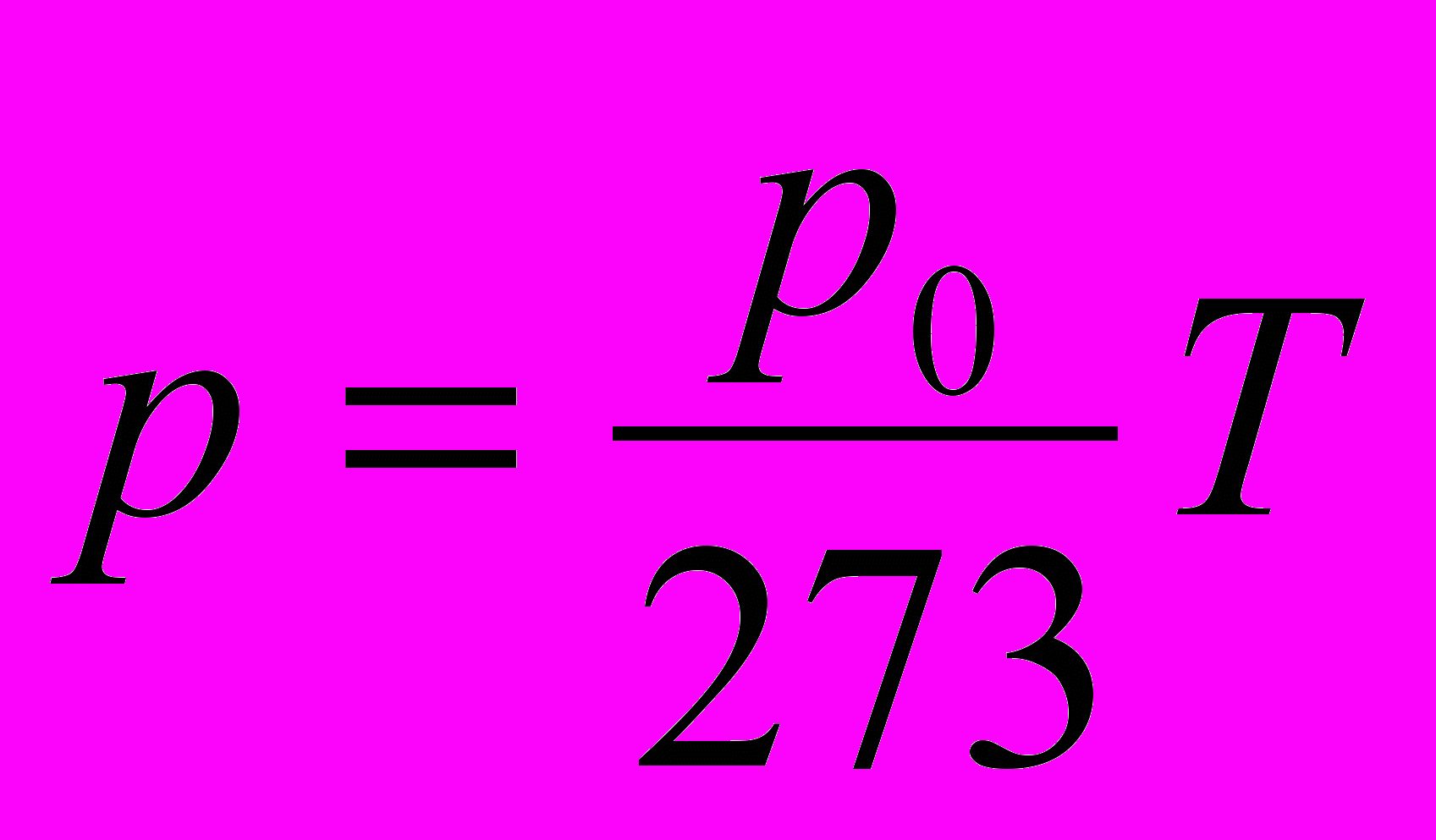 Из этого следует, что …
Из этого следует, что …А. Е пропорциональна Т.
Б. Е обратно пропорциональна Т.
В. Е не зависит от Т.
Г. Никакой связи между Е и Т на основе этих данных установить невозможно.
2. Модель идеального газа предполагает, что:
1) молекулы не притягиваются друг к другу.
2) молекулы не имеют размеров.
А. Только 1
Б. Только 2
В. 1 и 2.
Г. Ни 1, ни 2.
3. Кто из ученых экспериментально оценил скорость атомов вещества?
А. Архимед.
Б. Ньютон.
В. Штерн.
Г. Резерфорд.
4. Размер атомов примерно равен:
А. 10см.
Б. 10мм.
В. 10мкм.
Г. 10 нм.
5 . Температура кипения воды по шкале Кельвина равна
А. ...0 К.
Б. ...100 К.
В. ...273 К.
Г. ...373 К.
6. При испарении жидкость остывает. Молекулярно-кинетическая теория объясняет это тем, что при этом жидкость покидают молекулы с...
А. ...наибольшим размером.
Б. ...наибольшей кинетической энергией.
В. ...наименьшей скоростью.
Г. ...наибольшей массой.
7. Как изменится средняя кинетическая энергия теплового движения молекул идеального газа при уменьшении абсолютной температуры в 4 раза?
А. Уменьшится в 2 раза.
Б. Уменьшится в 4 раза.
В. Уменьшится в 16 раз.
Г. Увеличится в 2 раза.
Д. Увеличится в 4 раза.
Е. Увеличится в 16 раз.
8. Какой из приведенных графиков верно определяет характер зависимости давления газа от объема. Изменение объема проводят медленно, так что температуру газа под поршнем можно считать постоянной (рис.).


9. Два тела находятся в тепловом равновесии между собой. Какие физические параметры их одинаковы?
А. Только температура.
Б. Только давление.
В. Только средний квадрат скорости теплового движения молекул.
Г. Температура и средний квадрат скорости молекул.
Д Температура и давление.
Е. Температура, давление и средний квадрат скорости молекул.
10. В 1905 г. А. Эйнштейну пришла в голову идея о том, что можно все-таки непосредственным наблюдением убедиться в движении невидимых атомов и молекул. Если в газе окажутся достаточно маленькие, но видимые в микроскоп пылинки, то они также будут участвовать в хаотическом движении под действием ударов молекул газа. Вполне можно подобрать такую массу пылинок, что их скорость будет достаточно большой и можно будет заметить их перемещения. Эйнштейн не знал тогда, что предсказанное им явление давно обнаружено. Оно называется...
А. ...диффузией.
Б. …броуновским движением.
В. ...конвекцией.
Г. ...конденсацией.
11. Внутренняя энергия газа — это...
А.. .сумма кинетических энергий хаотического движения его молекул.
Б... .сумма энергий взаимодействия его молекул.
В. ...сумма кинетических энергий хаотического движения его молекул и энергий их взаимодействия.
Г... .понятие, которое для реального газа не имеет смысла
12. Совершив работу, можно изменить внутреннюю энергию...
А... .только газа
Б... .только жидкости.
В... .только твердого тела
Г... .любого тела
13. При таянии льда температура системы «лед—талая вода» не меняется. В этом процессе внутренняя энергия этой системы...
А. ...не изменяется.
Б. ...повышается.
В. ...понижается.
Г... .может повышаться, а может понижаться.
14. Газ, расширяясь, совершает работу 100 Дж. При этом к нему подводится 300 Дж тепла Как изменилась его внутренняя энергия?
А. Не изменилась.
Б. Уменьшилась на 100 Дж.
В. Возросла на 300 Дж.
Г. Возросла на 200 Дж.
15. Вблизи больших водоемов летом днем температура ниже, чем вдали от них, а ночью выше. Это означает, что...
А... .теплоемкость воды больше, чем почвы.
Б... .теплоемкость воды меньше, чем почвы.
В... .теплоемкость воды ночью выше, чем днем.
Г... .это явление никак не связано с теплоемкостью воды.
16. В левой половине сосуда находится 1020 молекул газа, а в правой половине -2 • 1020 молекул. Сколько примерно молекул окажется в левой половине сосуда через длительное время, после того как убрали перегородку между двумя половинами сосуда (рис.).
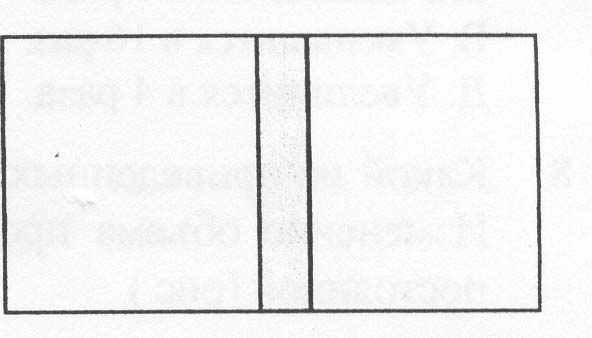
А 1020.
Б. 1,5.1020.
В.2.1020.
Г. 3.1020.
17. Предназначение тепловых двигателей, существенно изменивших облик современной цивилизации...
1) ... нагревать жилище человека
2) ...превращать внутреннюю энергию топлива в механическую работу.
А. Только 1.
Б. Только 2.
В. 1и 2.
Г. Ни 1, ни 2.
18. Примером вредного воздействия тепловых двигателей могут служить...
А. ...выбросы при сжигании отходов органических топлив на химических заводах.
Б. ...выхлопы ракетных двигателей, воздействующих на озоновый слой Земли.
В ...выхлопы хлорсодержащих органических соединений, заполняющих охлаждающие системы бытовых холодильников.
Г. ...выбросы металлургических заводов, приводящие к кислотным дождям.
БИОЛОГИЯ
Учитель: Кузнецов Ю. М.
Учебник: В.Б. Захаров, С.Г. Мамонтов, Н.И. Сонин «Общая биология»
Октябрь- Введение
Раздел: «Происхождение и начальные этапы развития жизни на Земле»
Главы: «Многообразие живого»
«Возникновение жизни»
Декабрь- Раздел: «Учение о клетке»
Главы: «Химическая организация клетки»
«Метаболизм – основа существования живых организмов»
Февраль - Раздел: «Учение о клетке»
Главы: «Функция и строение клетки»
«Размножение и развитие»
«Индивидуальное развитие»
Апрель - Раздел: «Основы генетики и селекции»
Главы: «Основные понятия генетики»
«Закономерности наследования»
Рекомендации к работе по изучению тем с помощью учебника:
Прочитай параграф и главы.
В конце параграфа есть рубрики «Опорные точки» и «Вопросы для повторения».
Запишите их в тетрадь и ответьте.
Завершает каждую главу рубрики:
- «основные положения», необходимые для запоминания;
- «задания» для выполнения в тетради.
Для более углубленного изучения материала рубрики:
- «проблемные вопросы»;
- «прикладные аспекты» (по желанию).
Дорогой друг, выполнив эти задания, ты уже на пути к успеху на зачете.
Зачеты по биологии
Раздел «Общая биология»
Химическая организация клетки, ее строение и функции
Зачет № 1
Вариант 4
Задания с выбором ответа
1. Какая клетка изображена на рис. 16?
А – бактериальная;
Б – растительная;
В – грибная;
Г – животная.
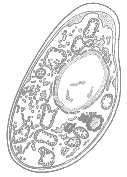
Рис. 16
2. Какой буквой на рис. 17 обозначена эндоплазматическая сеть?
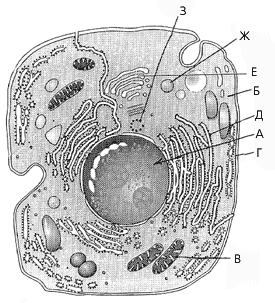
Рис. 17
3. Какой буквой на рис. 17 обозначена структура, от которой зависит поступление веществ в клетку?
4. Какой вид химической связи между азотистыми основаниями молекулы ДНК показан на рис. 18?
А – пептидная;
Б – ионная;
В – водородная;
Г – ковалентная.
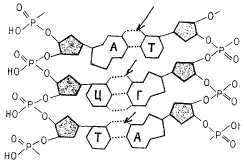
Рис. 18
5. Какой буквой на рис. 19 обозначена молекула белка в состоянии денатурации?

Рис. 19
6. Какой буквой на рис. 20 обозначены структуры, в которых происходит взаимодействие триплетов иРНК и тРНК в процессе биосинтеза белка?
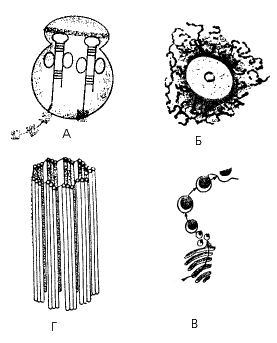
Рис. 20
7. Какой буквой на рис. 17 обозначены структуры, в которых сложные органические вещества под воздействием ферментов расщепляются до более простых с освобождением небольшого количества энергии?
8. Структуру клетки, которая состоит из двух слоев молекул липидов, а также из молекул белков, часть из которых пронизывает липидный слой, называют:
А – рибосомой;
Б – полисомой;
В – плазматической мембраной;
Г – хлоропластом.
9. Клетки организмов прокариот не имеют:
А – оболочки;
Б – цитоплазмы;
В – рибосом;
Г – аппарата Гольджи.
10. Клетка гриба в отличие от клетки растения не имеет:
А – оболочки;
В – цитоплазмы;
В – ядра;
Г – хлоропластов.
11. К организмам, состоящим из сходных клеток, не образующих ткани, относят:
А – моллюсков;
Б – голосеменные растения;
В – покрытосеменные растения;
Г – водоросли.
12. Клеточного строения не имеют:
А – бактериофаг;
Б – синезеленые водоросли;
В – бактерии;
Г – простейшие.
13. Отрезок молекулы ДНК, содержащий информацию о последовательности аминокислот в одной полипептидной цепи, называют:
А – триплетом;
Б – геном;
В – кодом;
Г – пептидом.
14. Нарушение вторичной и третичной структуры молекулы белка, ее развертывание вследствие разрыва связей называют:
А – раздражимостью;
Б – растяжением;
В – денатурацией;
Г – необратимым процессом.
15. Объем и упругость клетке придают:
А – липиды;
Б – вода;
В – углеводы;
Г – белки.
16. Способностью связывать и обеззараживать чужеродные вещества и клетки обладают:
А – белки;
Б – липиды;
В – углеводы;
Г – нуклеиновые кислоты.
17. В состав молекул ДНК входит углевод:
А – глюкоза;
Б – фруктоза;
В – дезоксирибоза;
Г – целлюлоза.
18. В состав молекулы РНК входит углевод:
А – глюкоза;
Б – дезоксирибоза;
В – рибоза;
Г – фруктоза.
Задания со свободным ответом
19. Какие особенности строения молекул ДНК обеспечивает их способность передавать наследственную информацию от клетки к клетке?
20. Что представляют собой водородные связи?
21. Какова роль плазматической мембраны в образовании связей между клетками?
22. Почему вирусы относят к паразитам?
23. В чем проявляется сходство грибной клетки с клетками растений и животных и о чем оно свидетельствует?
24. Почему эволюция живой природы пошла по пути возникновения многоклеточных организмов?
Вариант 4
1–В; 2–Д; 3–Г; 4–В; 5–Г; 6–А; 7–Ж; 8–В; 9–Г; 10–Г; 11–Г; 12–А; 13–Б; 14–В; 15–Б; 16–А; 17–В; 18–В.
