План урока : Организационный момент. Объяснение нового материала. Домашнее задание
| Вид материала | Урок |
- План урока: Организационный момент Объяснение новой темы Подведение итогов Домашнее, 146.54kb.
- План урока: Организационный момент Изложение нового материала. Закрепление изученного., 116.39kb.
- Организационный план : Подготовка к изучению нового материала > Изучение нового материала, 83.57kb.
- План урока: Организационный момент Повторение изученного по теме Объяснение нового, 82.52kb.
- План урока Организационный момент. Объяснение нового материала. Лекция. Тест и ответы, 67.88kb.
- План урока: 1 Организационный момент. 2 Сообщение темы урока и объяснение нового материала, 59kb.
- План урока Организационный момент (1-2 мин). Актуализация знаний (4-6 мин). Беседа, 19.45kb.
- Организационный план урока: Хронометраж: t, мин. Организационный момент. 1 Проверка, 107.78kb.
- План урока: Организационный момент; Актуализация знаний; Объяснение нового материала;, 126.25kb.
- План урока: Организационный момент. Постановка темы и цели урока 5 мин. Изучение нового, 76.57kb.
Оксиды азота
Учитель: Аблисимова В.Н.
Цель урока: познакомиться с кислородными соединениями азота – его оксидами.
Цели по содержанию:
Образовательная:
- Познакомить учащихся с физическими и химическими свойствами оксидов азота;
- Дать понятие о способах получения оксидов и областях их применения;
- Показать взаимосвязь между строением и химическими свойствами.
Развивающая:
- Развивать логическое мышление путем сравнения, обобщения, синтеза;
- развитие мобильности, самостоятельности, умение рефлектировать.
- развитие правильной речи обучающихся.
Воспитательная:
- Способствовать формированию интереса к знаниям, умениям, адекватной оценке своей деятельности;
- Формировать умение работать с книгой;
- Показать учащимся межпредметную связь и практическую направленность изучаемого материала.
Оборудование и реактивы: медь, HNO3 разб., HNO3 конц., газоотводная трубка, пробирки, пробка, кристаллизатор с водой, держалка, спиртовка, спички.
ДЕВИЗ УРОКА: «Мало хотеть, надо и делать
Мало применять, надо и знать.»
Гете.
План урока:
1. Организационный момент.
2. Объяснение нового материала.
3. Домашнее задание.
План изложения нового материала:
1. Общий обзор оксидов азота.
2. Оксид азота (II).
3. Оксид азота (IV).
4. Краткие сведения об оксидах азота (I), (III), (V).
5. Выводы.
6. Упражнения.
Организационный момент:
1. Актуализация знаний.
Приведем свой ум в порядок, поиграем в игру «Антонимы и синонимы»
- Какие слова называют антонимами, синонимами?
- Подберите антонимы к следующим химическим понятиям:
Восстановитель –
Металл –
Экзотермическая-
Соединение –
Обратимая –
Катализатор –
Подберите синонимы следующим химическим понятиям:
Хлороводородная кислота –
Оксид водорода –
Нашатырный спирт –
Нашатырь -
Бинарные соединения кислорода – оксиды, пероксиды.
- А какие бинарные соединения кислорода вы изучали?
- А что такое оксиды ? На какие группы классифицируют оксиды?
- Какие оксиды образуют неметаллы?
Сообщение цели урока.
- Целью нашего занятия- познакомиться с кислородными соединениями азота – его оксидами. Откройте тетради, запишите тему сегодняшнего урока.
«ОКСИДЫ АЗОТА».
Объяснение нового материала.
Оксидов у азота – пять.
И нам давно пора узнать
Их нравы, вкусы, настроенье.
Манеру жизни, поведенье.
Запомнить будет вам легко:
N2 c O2 дает NO.
Про каждого из остальных оксидов
Расскажем мы сейчас. У них
У каждого свой собственный
Способ получения косвенный.
- Расставьте степени окисления в оксидах азота:
N2О, NO, N2O3, NO2, N2O5
1. Общий обзор оксидов азота.
Азот образует шесть кислородных соединений, в которых проявляет степени окисления от +1 до +5.
N2O, NO, N2O3, NO2, N2O4, N2O5
При непосредственном соединении азота с кислородом образуется только оксид азота (II) NO, другие оксиды получаются косвенным путем.
N2O и NO – несолеобразующие оксиды, остальные - солеобразующие.
Из всех оксидов наибольшее значение имеют NO и NO2 как промежуточные продукты в производстве HNO3.
Оксиды азота сильно отличаются по своим физическим и химическим свойствам.
| Показатель | N2O | NO | NO2 | N2O4 | N2O3 | N2O5 |
| Цвет | | | | | | |
| Т. кип.,0С | | | | | | |
| Т. пл.,0С | | | | | | |
| Плотность газа, г/дм3 | | | | | | |
| Плотность жидкости | | | | | | |
2. Оксид азота (II) NO.
Бесцветный газ, плохо растворимый в воде. tпл. = - 1640 C; tкип. = - 1520 C. Токсичен.
Легко окисляется кислородом воздуха, образуя газ бурого цвета оксид азота IV.
В промышленности оксид NO получают каталитическим окислением аммиака:
t0 Pt
4NH3 + 5O2 = 6H2O + 4NO ↑
В лаборатории NO обычно получают взаимодействием разбавленной HNO3 с медью.
t0
3Cu + 8HNO3 = 3Cu(NO3)2 + 4H2O + 2NO ↑
(р)
В природе оксид азота (II) образуется во время грозы под действием электрических разрядов:
30000C
N2 + O2 = 2NO - Q
Под действием кислорода воздуха он легко окисляется в NO2.
2NO + O2 = 2NO2
3. Оксид азота (IV) NO2.
Бурый ядовитый газ с характерным раздражающим запахом, тяжелее воздуха.
tпл. = - 11,20 C; tкип. = 20,7 C. Кислотный. Взаимодействует с водой с образованием азотной и азотистой кислот.
В лаборатории получают взаимодействием концентрированной HNO3 с медью.
Запишите это уравнение, расставьте коэффициенты методом электронного баланса.
Cu + 4HNO3 = Cu(NO3)2 + 2H2O + 2NO2 ↑
(к)
Демонстрация опыта.
А также при прокаливании кристаллического нитрата свинца:
t0
2Pb(NO3)2 = 2PbO + 4NO2 ↑ + O2 ↑
Также образуется из оксида азота (II) при соединении его с кислородом.
Оксид азота (IV) подвергается димеризации, образуя бесцветную жидкость - димер оксида азота (IV).
2NO2 ↔ N2O4
Дайте характеристику данной реакции по всем классификационным признакам.
При - 110С равновесие смещается в сторону образования N2O4.
При 1400С равновесие смещается в сторону образования NO2.
Промежуточным температурам соответствует состояние равновесия между NO2 и N2O4
Оксид азота (IV) при растворении в холодной воде образует две кислоты:
2NO2 + H2O = HNO2 + HNO3
Реакции, идущие с изменением степеней окисления одного и того же химического элемента называются реакциями диспропорционирования или самоокисления - самовосстановления.
Образующаяся азотистая кислота HNO2 малоустойчива, особенно при нагревании. Поэтому при растворении NO2 в теплой воде происходит другая реакция:
t0
3NO2 + H2O = 2HNO3 + NO
В избытке кислорода образуется только азотная кислота:
4NO2 + 2H2O + O2 = 4HNO3
NO2 – сильный окислитель; уголь, фосфор, сера горят в нем, а SO2 окисляется в SO3.
Пары NO2 ядовиты. Вдыхание их вызывает сильное раздражение дыхательных путей и может привести к серьезному отравлению.
4. Краткие сведения об оксидах азота (I), (III), (V).
Кратко познакомимся с остальными оксидами азота.
Оксид азота (I) N2O –закись азота.
Бесцветный газ со слабым запахом и сладковатым вкусом. Плохо растворяется в воде, но хорошо растворяется в этиловом спирте. Является наркотиком, особенно в смеси с кислородом, имеет тривиальное название “веселящий газ”- так как при вдыхании в достаточных количествах наступает возбужденное состояние.
tпл. = - 910 C; tкип. = - 88,50 C.
Неустойчив легко разлагается, проявляет восстановительные свойства.
2N2 O →N2 + О2
Физминутка
Оксид азота (III) N2O3.
Темно-синяя жидкость, кипящая при температуре -400С; tпл. = - 1020 C. При температуре выше температуры кипения разлагается:
N2O3 = NO + NO2
Это кислотный оксид, ему соответствует слабая азотистая кислота HNO2. Взаимодействует со щелочами с образованием нитритов.
N2O3 + 2NaOH = 2NaNO2 + H2O
Оксид азота (V) N2O5.
Белое гигроскопичное кристаллическое взрывчатое вещество. Растворяется в воде с образованием азотной кислоты:
N2O5 + H2O = 2HNO3
Оксид азота (V) – сильный окислитель, многие органические вещества в его присутствии воспламеняются.
5. Вывод: азот образует пять оксидов, из которых наибольшее значение имеют оксид азота (II) и оксид азота (IV) как промежуточные продукты в производстве азотной кислоты.
6. Упражнения.
Как осуществить превращения: N2 → NH3 → NO → NO2 → HNO3?
NH4Cl→NH3 → NO → NO2
N2 → NH3 → NH4Cl
Вывод: Азот один из немногих химических элементов образующих много оксидов, в которых проявляет различные степени окисления.
Оксиды азота зарегистрированы в качестве пищевой добавки Е918.
Задание на дом: п.19.7, 1 – 4, 7.
СВОЙСТВА ОКСИДОВ АЗОТА
| Показатель | N2O | NO | NOi | N2O4 | N2O3 | М;O5 |
| Цвет | Бесцв | Бесцв. | Красно-бурый | Бесцв. | Голубой* | Бесцв. |
| Т. кип., °С | -88,5 | -151,6 | _ | 20,6 | -40°С | 33** |
| Т. пл., °С | -91,0 | -163.7 | — | -11,2 | -101 | 41 |
| Плотность газа. г/дм3 | 1.9778 | 1,3402 | 1,491 (0°С) | — | — | — |
| плотность жидкости или твердого вещества. | 1,226 | 1,332 | | 1,536 | | 2.05 |
| г/см3 ...... | (-88,5 °С) | (-163°С) | | (-20°С) | | (15°С) |
| tкрит- °С . . . . . | 36,45 | -93,0 | — | 158,2 | — | — |
| pкрит МПа . . . . | 7,254 | 6,48 | — | 10,13 | — | — |
| Критич. объем. дм3, /моль . . . | 0,0973 | 0.0580 | _ | 0,167 | _ | _ |
| С2. ДжДмоль*К) . . | 38,63 | 29,86 | 37,18 | 79.2 | 72.7 | 45,3 |
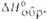 кДж, моль . . кДж, моль . . | 81,6 | 91,26 | 34.2 | 11,1 | 86.6 | 1 3.3 |
| S0298, Дж/(моль*К) | 219,90 | 210,64 | 240,06 | 304,4 | 314,6 | 355,6 |
* Цвет кристаллов. ** Т-ра возгонки.
Закрепление: 1) Какие степени окисления проявляет азот?
2) Сумма всех коэффициентов в уравнении реакции горения аммиака в кислороде равна: а) 19 б) 15 в) 8 г) 4.
3) Сумма всех коэффициентов в уравнении реакции каталитического окисления аммиака кислородом равна: а)19 б)15 в)8 г) 4.
