Биофункциональные полимерно-неорганические носители для инженерии костной ткани 02. 00. 06 высокомолекулярные соединения
| Вид материала | Автореферат |
- Носители противоопухолевых препаратов на основе синтетических полипептидов 02. 00., 548.13kb.
- Ется снижением костной массы, нарушением микроархитектоники костной ткани и сопровождается, 317.69kb.
- Анализ ассоциации костной массы у спортсменов с биохимическими и молекулярно-генетическими, 218.76kb.
- Название факультета, 245.29kb.
- Реферат до последнего времени основным пластическим материалом для замещения костных, 105.35kb.
- Рубрикатор общие вопросы аналитической химии, 36.93kb.
- Тверской государственный технический университет реферат на тему, 430.37kb.
- Природные красители, 84.69kb.
- Н. М. Эмануэля ран защита состоится 27 сентября 2011, 701.9kb.
- Термические превращения полиариленфталидов и их производных 02. 00. 06 Высокомолекулярные, 622.74kb.
Таким образом, использование двух описанных подходов позволило получить новые альдегид-содержащие полимеры, принадлежащие к классу поливинилсахаридов, со значениями ММ, удовлетворяющими требованиям к полимерам-носителям.
3.2. Биофункционализация полученных полимеров-носителей
Согласно предложенной стратегии получения полимерно-неорганических скаффолдов, в его состав должен входить адсорбированный на поверхности компонент, управляющий поведением клеток (так называемый полибиофункциональный полимерный «вектор»). Создание такого «вектора» основано на ковалентном связывании с полученными альдегид-содержащими полимерами специальных биологических молекул (биолигандов), оказывающих различное влияние на клетки.
Для повышения эффективности процесса выращивания костной ткани в лабораторных условиях существует необходимость интенсифицирования стадий прикрепления (адгезии), миграции, роста и дифференциации клеток на поверхности используемых для этой цели каркасов. В данной работе были использованы три типа биолигандов, способных оказывать влияние на перечисленные процессы, а именно: положительно заряженный поли-L-лизин в качестве фактора, повышающего неспецифическую адгезию клеток за счет электростатического взаимодействия с отрицательно заряженными мембранами клеток; GRGDSP-пептид, способствующий специфическому прикреплению клеток посредством комплементарного взаимодействия с поверхностными белками клеточных мембран; фактор роста и дифференциации клеток – костный морфогенетический белок (bone morphogenetic protein, BMP-2). В связи с высокой стоимостью BMP-2, в модельных in vitro экспериментах использовали доступный аналог - рибонуклеазу А (РНКазу), обладающую близкими физико-химическими свойствами (значениями изоэлектрической точки и молекулярной массы).
Конъюгаты с одним лигандом (моноконъюгаты)
Связывание GRGDSP-пептида. Схема ковалентного связывания данного лиганда с окисленной пМАГ и п(МАГ-со-ВП-со-Ак) представлена на Рис. 2.
Для получения количественных данных использовали введение в пептид флуоресцентной метки. На основании полученных результатов сделан вывод о том, что данная реакция контролируется диффузией пептида к СНО-группам полимера.
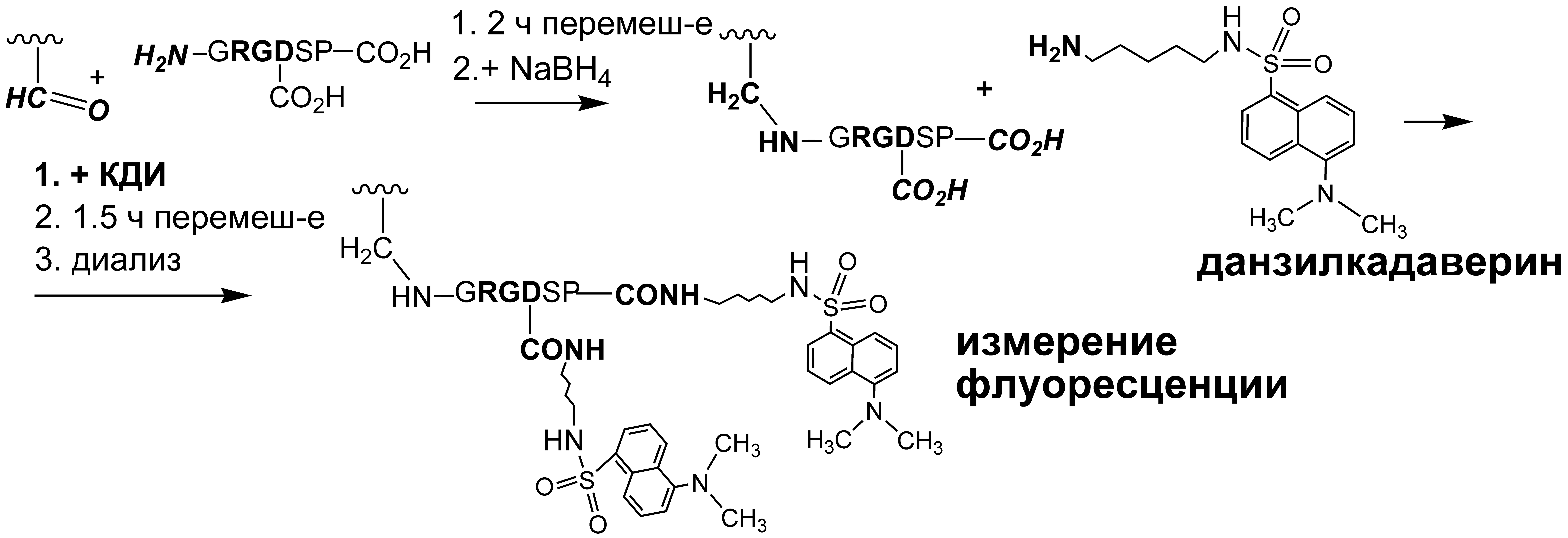 |
| Рис. 2. Экспериментальная схема изучения процесса ковалентного связывания GRGDSP- пептида с альдегид-содержащими полимерами. |
В случае окисленного гомополимера МАГ, практически полная конверсия альдегидных групп достигается при двукратном избытке пептида, тогда как для тройного сополимера тот же результат достигался только при десятикратном избытке лиганда (Таблица 3).
Таким образом, количество введенного в полимер пептидного лиганда можно легко регулировать, подбирая необходимое молярное соотношение [CHO]ПОЛИМЕР : [NH2]ПЕПТИД.
Таблица 3
Модификация пМАГ и п(МАГ-co-ВП-co-Ак) GRGDSP пептидом
| [CHO]полим:[NH2]GRGDSP , моль | Конверсия CHO групп, моль% |
| пМАГ | |
| 1.0 | 75 |
| 0.5 | 94 |
| п(МАГ-co-ВП-co-Ак) | |
| 1.0 | 40 |
| 0.5 | 50 |
| 0.2 | 63 |
| 0.1 | 93 |
пМАГ - 30 моль% CHO-групп, MM 20000; п(МАГ-со-ВП-со-Ак) - 7 моль% CHO-групп, MM 13500. Условия реакции: 0.01 M натрий-боратный буфер, pH 10.0, 25°C, 2 ч при перемешивании (550 rpm). Очистка: ультрафильтрация (MWCO: 3,000) против воды. Конверсия альдегидных групп, измеряемая количеством конъюгированного с полимером пептида, определялась флуорометрически (λex.= 355 нм, λem.= 485 нм), используя значения флуоресценции данзилкадаверина.
Связывание РНКазы (BMP-2) (Рис. 3). Доступность альдегидных групп полимеров для аминогрупп белка ограничена вследствие стерических препятствий, обусловленных структурой реагирующих макромолекул в растворе.
 |
| Рис. 3. Схема, использованная для изучения связывания модельного белка РНКазы с альдегид-содержащими полимерами. |
Кроме того, оба типа реагирующих макромолекул содержат в своем составе достаточное количество реакционно-способных групп (СНО и NH2), способных образовывать межмолекулярные сшивки, в том числе, с образованием нерастворимых продуктов реакции. Исходя из этого, для снижения риска межмолекулярного взаимодействия групп и увеличения конверсии РНКазы использовали избыток полимеров, а, следовательно, альдегидных групп, по отношению к белку.
Из данных Таблицы 4 очевидно, что при одинаковых массовых соотношениях большее количество РНКазы связывается с сополимером п(МАГ-со-ВП-со-Ак), чем с окисленной пМАГ. Данный результат можно объяснить большей стерической доступностью для аминогрупп белка альдегидных групп п(МАГ-со-ВП-со-Ак) по сравнению с окисленной пМАГ.
Полученные данные подтверждают возможность контролируемого введения фактора роста и дифференциации клеток BMP-2 в состав создаваемых скаффолдов путем регулирования избытка альдегидных групп полимера по отношению к белку.
Известно, что для эффективной биофункционализации необходимо введение небольшого количества фактора клеточного роста. Поэтому создание полифункционального полимерного вектора желательно проводить постадийно, с введением в его структуру BMP-2 на первой стадии. С одной стороны, связывание нескольких мкг белка приведет к незначительной конверсии альдегидных групп, а с другой, избыток последних при присоединении BMP-2 на первой стадии создания смешанного конъюгата должен обеспечить наиболее полное связывание фактора роста и дифференциации клеток.
Таблица 4
Количественные характеристики ковалентного связывания РНКазы с окисленной пМАГ и сополимером п(МАГ-со-ВП-со-Ак)
| [полимер]:[РНКаза], масс. соотношение | [CHO]:[РНКаза], мольн. соотношение | Конверсия белка, моль% |
| окисленная пМАГ | ||
| 2 | 33 | 4 |
| 5 | 83 | 7 |
| 10 | 166 | 31 |
| 20 | 337 | 43 |
| п(МАГ-со-ВП-со-Ак) | ||
| 2 | 9 | 13 |
| 5 | 23 | 25 |
| 10 | 45 | 37 |
| 20 | 93 | 85 |
пМАГ: 30 моль% CHO-групп, MM 20000;
п(МАГ-со-ВП-со-Ак): 7 моль% CHO-групп, MM 13 500. Условия реакции: 0.01 M натрий-боратный буфер, pH 10.0, 25°C, перемешивание в течение 2 ч. (550 rpm). Очистка: диализ против воды (MWCO: 20000). Конверсия белка определена методом флуорометрии (λex.= 485 нм, λem.= 538 нм), с использованием флуоресценции ФИТЦ.
Связывание поли-L-лизина. Аналогичным образом было исследовано связывание с полимерами поли-L-лизина (пЛиз, ММ~10000). Как и в случае белка, использовали избыток полимера. Необходимо отметить, что расчет количества связанного лиганда в данном случае проводился на звено лизина, поскольку молекулярная масса полимерного лиганда является средней величиной. Из Таблицы 5 видно, что максимальная конверсия аминогрупп достигается в случае окисленной пМАГ, содержащей наибольшее число альдегидных групп.
С учетом мольных соотношений альдегидных групп полимеров и аминосодержащих звеньев лизина в исходной реакционной смеси, конверсия аминогрупп, а, следовательно, и реакционная способность альдегидных групп, для обоих полимеров практически совпадают. Это можно объяснить наличием в более «рыхлой» по сравнению с белком макромолекуле пЛиз значительного количества стерически доступных ε-аминогрупп, что позволяет преодолеть диффузионные ограничения реакции с альдегидными группами полимера, имеющие место в случае РНКазы.
Полученные данные позволяют сделать вывод о том, что при постадийном синтезе полифункционального полимерного вектора целесообразно введение пЛиз в структуру смешанного конъюгата на второй стадии процесса, после связывания полимера с РНКазой (или BMP-2). В данном случае, достаточно большое число оставшихся после связывания белка альдегидных групп будут обеспечивать конъюгирование необходимого количества пЛиз, но, вместе с этим, после образования бинарного конъюгата полимер-РНКаза-пЛиз, количество свободных альдегидных групп все еще будет достаточным для связывания GRGDSP-пептида.
Таблица 5
Количественные характеристики ковалентного связывания пЛиз с окисленной пМАГ и п(МАГ-со-ВП-со-Ак)
| [полимер] : [пЛиз], масс. соотношение | [CHO] : [звено Лиз], мольн. соотношение | Конверсия NH2-групп, моль% |
| окисленная пМАГ | ||
| 5 | 0.85 | 49 |
| 10 | 1.70 | 59 |
| 20 | 3.39 | 75 |
| 40 | 6.78 | 82 |
| п(МАГ-со-ВП-со-Ак) | ||
| 5 | 0.23 | 23 |
| 10 | 0.47 | 29 |
| 20 | 0.94 | 64 |
| 40 | 1.87 | 68 |
пМАГ: 30 моль% CHO-групп, MM 20 000;
п(МАГ-со-ВП-со-Ак): 7 моль% CHO-групп, MM 13 500. Условия реакции: 0.01 M натрий-боратный буфер, pH 10.0, 25°C, перемешивание в течение 2 ч. (550 rpm). Очистка: диализ против воды (MWCO: 3000). Конверсия белка определена методом флуорометрии (λex.= 485 нм, λem.= 538 нм), с использованием флуоресценции ФИТЦ.
«Смешанные» конъюгаты
На основании полученных данных и разработанных количественных методов для характеристики моноконъюгатов был осуществлен контролируемый количественно синтез «смешанного» конъюгата.
Процесс проводили путем постадийного введения лигандов в структуру полимерного «вектора» (Рис. 4).
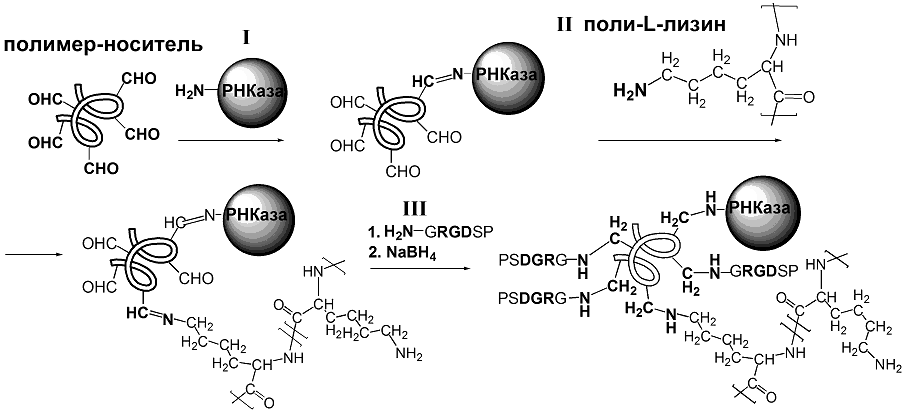 |
| Рис. 4. Экспериментальная схема получения смешанного конъюгата путем последовательного ковалентного связывания биолигандов. |
Обнаруженная конверсия вводимых биомолекул на каждой стадии конъюгирования подтвердила принципиальную возможность получения сложных конъюгатов, содержащих лиганды различной природы и функциональности.
На первых двух стадиях в структуру полимера-носителя вводили макромолекулярные лиганды, а именно, РНКазу и пЛиз, реакции которых с полимерами испытывают пространственные затруднения, а также требуют избытка альдегидных групп. На последней стадии в реакционную смесь, содержащую полимер, модифицированный указанными макромолекулами, вводили избыток низкомолекулярного GRGDSP-пептида.
Количественный контроль процесса смешанного конъюгирования отражен в Таблице 6.
Таблица 6
Количественные характеристики постадийного синтеза смешанного конъюгата,
содержащего РНКазу, пЛиз и GRGDSP-пептид
| Стадия I | Стадия II | Стадия III | |||
| [полимер]:[РНКаза], масс. | Конверсия белка, моль% | [полимер]:[пЛиз], масс. | Конверсия NH2-групп, моль% | [СНО]:[NH2], моль. | Конверсия пептида, моль% |
| окисленная пМАГ | |||||
| 20 : 1 | 47 | 20 : 1 | 33 | 2.11 | 39 |
| п(МАГ-со-ВП-со-Ак) | |||||
| 30 : 1 | 58 | 30 : 1 | 15 | 0.61 | 25 |
Следует отметить, что при образовании «смешанного» конъюгата на каждой стадии модификация используемых полимеров биолигандами подчиняется закономерностям, полученным для моноконъюгатов. Этот факт позволяет контролируемо и воспроизводимо вводить необходимое количество лигандов в создаваемый полифункциональный полимерный «вектор» без дополнительного подбора условий для каждого случая.
3.3. Гидродинамические характеристики полимеров носителей и их конъюгатов с лигандами различного молекулярного размера
Исследование гидродинамических характеристик полимеров-носителей и их конъюгатов с модельными лигандами различного молекулярного размера (глицин и РНКаза) осуществляли методами визкозиметрии, а также динамического и статического светорассеяния.
Величины гидродинамических радиусов, полученные методом вискозиметрии, свидетельствуют о том, что макромолекулы полимеров двух типов альдегидсодержащих полимеров на основе МАГ, а также их конъюгатов с глицином и РНКазой, обладают достаточно свернутой конформацией, обусловленной, по-видимому, внутримолекулярными взаимодействиями. На основании анализа концентрационных зависимостей ηуд/c альдегид-содержащих форм обоих типов полимеров было установлено наличие полиэлектролитного эффекта, а также, в случае окисленной пМАГ, образование ассоциатов при повышении концентрации полимера в растворе. Кроме того, поведение и структура конъюгатов полимер-глицин и полимер-РНКаза в водных растворах существенно зависят от химической структуры полимеров, распределения альдегидных групп в полимерной цепи и количества связанного лиганда (Таблица 7).
Данные, полученные методом светорассеяния (Таблица 8), позволили сделать вывод о наличии ассоциативных структур, как в случае исходных полимеров, так и конъюгатов, вероятно, обусловленных межмолекулярными взаимодействиями звеньев МАГ. При этом введение альдегидных групп и последующее их замещение лигандами различного молекулярного размера приводит к изменению гидродинамических параметров, что является еще одним свидетельством образования конъюгатов.
Таблица 7
Значения характеристической вязкости и рассчитанные гидродинамические параметры исходных и активированных полимеров, а также их конъюгатов с глицином и РНКазой
| № образца | Название образца | Растворитель | [η], дл•г-1 |  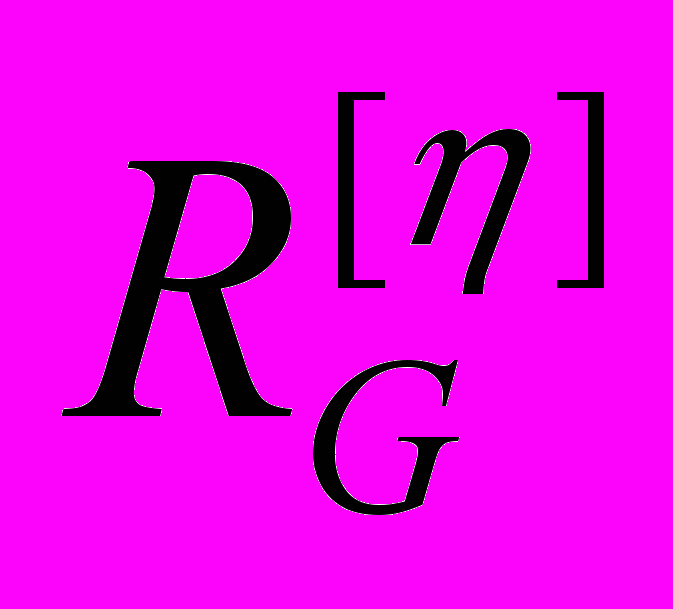 | 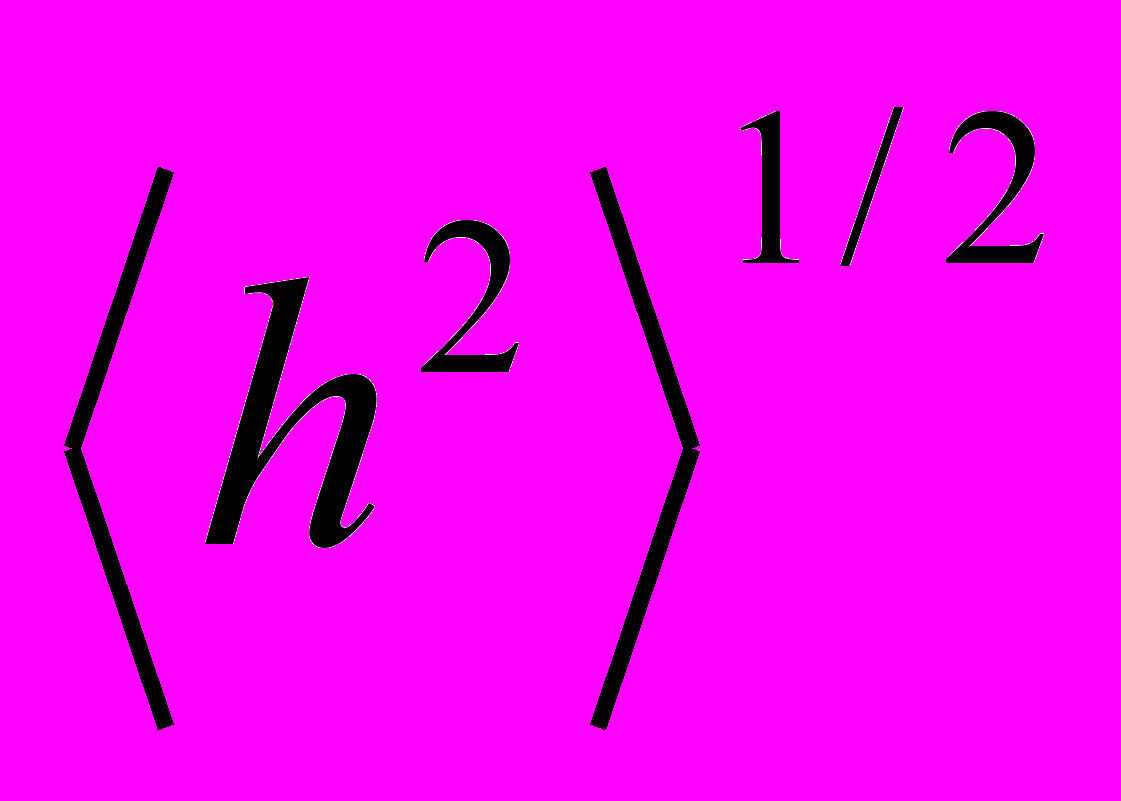 | 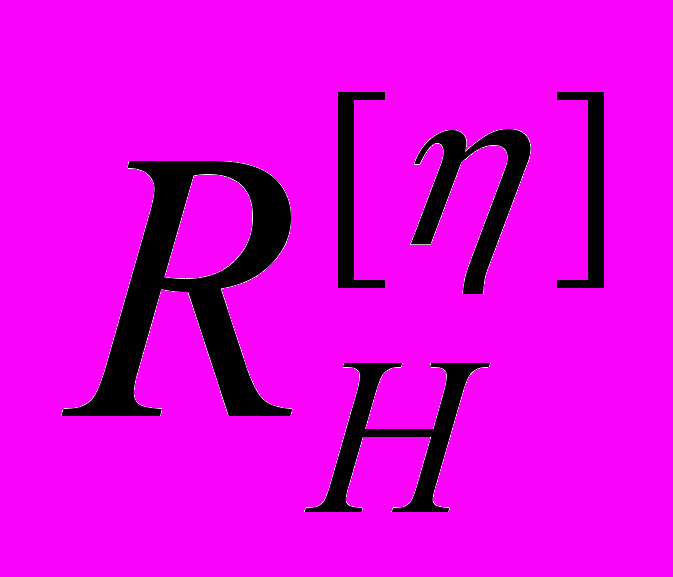 |
| нм | ||||||
| пМАГ | ||||||
| 1 | пМАГ | Na2SO4, 0.1 М | 0.12 | 4.5 | 11.3 | 3.6 |
| 1 | пМАГ | б/б, pH 10.0 | 0.15 | 4.9 | 12.1 | 3.9 |
| 2 | окисленная пМАГ | б/р-р, pH 7.0 | 0.11 | 4.4 | 10.9 | 3.5 |
| 5 | пМАГ-глицин (20 %)* | б/р-р, pH 7.0 | 0.28 | 6.0 | 14.9 | 4.8 |
| 6 | пМАГ-глицин (100 %)* | б/р-р, pH 7.0 | 0.40 | 6.7 | 16.8 | 5.4 |
| 7 | пМАГ-РНКаза | б/р-р, pH 7.0 | 0.24 | 5.8 | 14.5 | 4.7 |
| 8 | пМАГ-РНКаза-глицин | б/р-р, pH 7.0 | 0.22 | 5.6 | 14.1 | 4.5 |
| п(МАГ-ВП-ДААк) | ||||||
| 3 | п(МАГ-ВП-ДААк) | Na2SO4, 0.1 м. | 0.10 | 3.8 | 9.4 | 3.0 |
| 4 | п(МАГ-ВП-Ак) | б/р-р, pH 7.0 | 0.10 | 3.8 | 9.4 | 3.0 |
| 9 | п(МАГ-ВП-Ак)-глицин (15 %)* | б/р-р, pH 7.0 | 0.12 | 4.0 | 10.0 | 3.2 |
| 10 | п(МАГ-ВП-Ак)-глицин (100 %)* | б/р-р, pH 7.0 | 0.18 | 4.6 | 11.4 | 3.7 |
| 11 | п(МАГ-ВП-Ак)-РНКаза | б/р-р, pH 7.0 | 0.21 | 5.0 | 12.4 | 4.0 |
| 12 | п(МАГ-ВП-Ак)-РНКаза-глицин | б/р-р, pH 7.0 | 0.23 | 5.1 | 12.8 | 4.1 |
*- указана степень конверсии альдегидных групп
Обозначения: б/б, pH 10.0 – натрий-боратный буфер, рН 10.0; б/р-р, рН 7.0 - натрий-боратный буфер, рН 10.0, рН которого доведен до 7.0 добавлением борной кислоты
