Муниципальное Бюджетное Общеобразовательное Учереждение Брянский городской лицей №27 Им. Героя Советского Союза И. Е. Кустова» Научно-исследовательская конференция «Первые шаги в науку» Тема: «исследование
| Вид материала | Исследование |
- Урок в 6 классе Тема урока: «Великое княжество Литовское в XIII начале, 82.88kb.
- Программа научно практической конференции: моу «Лицей №24имени Героя Советского Союза, 348.59kb.
- Приказ от «14» марта 2011 г. №42 г. Сосновоборск По итогам проведения городской научно-практической, 391.03kb.
- Героя Советского Союза Калинина Н. Н. Волоконовского района Белгородской области имеет, 2364.13kb.
- На областной конкурс исследовательских и творческих работ обучающихся «Первые шаги, 164.42kb.
- Краевой форум «молодежь и наука» 5-8 апреля 2011г. Список победителей научно-практической, 717.76kb.
- Районная научно-исследовательская конференция школьников «Первые шаги в науку», 348.48kb.
- Героя Советского Союза И. Е. Жукова г. Владимира урок, 178.51kb.
- Городская конференция обучающихся 5 7 классов «Первые шаги в науку 2011», 189.16kb.
- Э. Д. Потапова структурное подразделение-отделение №1 города Мичуринска Городской семинар, 108.43kb.
Муниципальное Бюджетное Общеобразовательное Учереждение "Брянский городской лицей №27 Им. Героя Советского Союза И.Е.Кустова»
Научно-исследовательская конференция «Первые шаги в науку»
Тема: «Исследование адсорбции бензойной кислот на оксиде меди II»
Исследовательская работа
Предметная область –химия
Выполнили:
Орлов Алексей Имамутдинович,
Дудкина Елена Геннадьевна,
Ученики 11 «Б» класса
Проверил:
КХН, доцент кафедры химии
БГУ им.Петровского
Кузнецов Сергей Викторович
Брянск- 2012
Содержание:
Введение……………………………………………….……..3
- Методика эксперимента……………….………………….…4
Экспериментальные данные и их обсуждение………….....5
3.1 Адсорбция бензойной кислоты на оксиде меди (II)…...5
Выводы……………………………………………….………8
- Список литературы…………………………………………..9
1.Введение.
Исследованию адсорбционных процессов на поверхности оксидов уделяется огромное внимание в связи с потребностью в оптимизации технологии растворения и выщелачивания руд, изучением процессов коррозии, изучением оксидов как катализаторов. При этом особое внимание уделяется исследованию процессов адсорбции как одного из методов изучения строения двойного электрического слоя (ДЭС) на границе оксид/раствор.
2.Методика эксперимента.
Все растворы готовили на дистиллированной воде.
В качестве фонового электролита использовался нитрат калия, квалификации «ХЧ» с концентрацией 0,1 моль/л. Исходная концентрация бензойной кислоты равна 0,01 моль/л. Установка значений рН и контроль изменения проводили на рН-метре рН-150мА. Спектральные измерения проводили на спектрофотометре СФ-56.
Навески оксида меди (II) по 0,1 г помещали в раствор объемом 10 мл. Измерения проводились в диапазоне рН от 2,5 до 10,5 повторность равна 3. После установления равновесия (60–90 мин.) измерялось значение рНравн.
Концентрация бензойной кислоты определялась при длинне волны 272 нм в ацетатном буферном растворе с рН 3,5 рис.1.
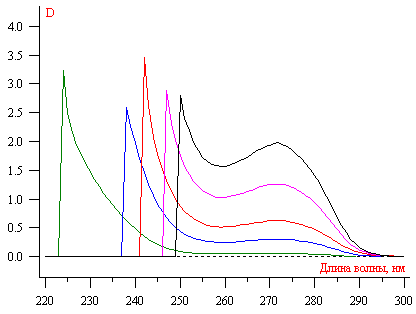 Рис. 1. Графики зависимости оптической плотность от длинны волны (выбирались произвольные концентрации бензойной кислоты).
Рис. 1. Графики зависимости оптической плотность от длинны волны (выбирались произвольные концентрации бензойной кислоты).3.Экспериментальные данные и их обсуждение.
4.3.1. Адсорбция бензойной кислоты на оксиде меди (II).
Изменение значения адсорбции от рН исходного раствора представлено на графике зависимости адсорбции от рН исходного раствора (Рис. 2.).
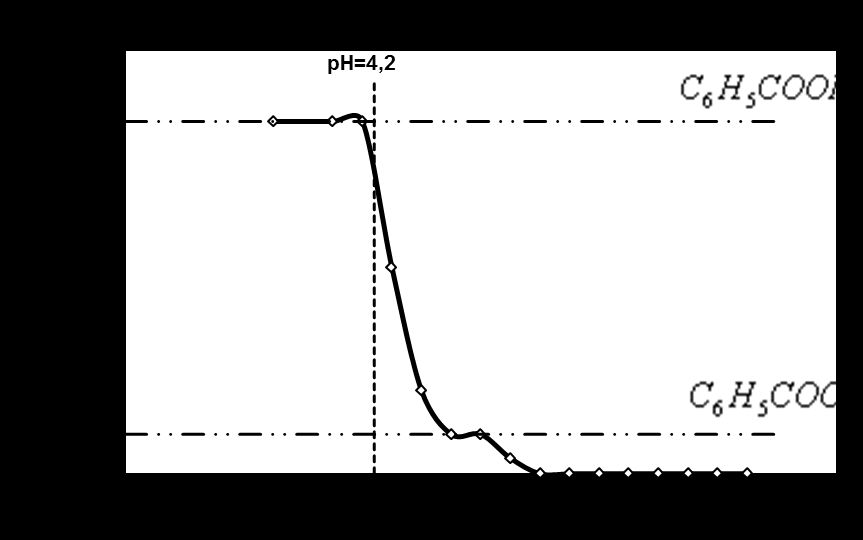
Рис. 2. Зависимость адсорбции бензойной кислоты от рН исходного раствора.
Из графика видно, что адсорбция бензойной кислоты на оксиде меди (II) наблюдается в кислой среде, после рН=7 адсорбции не наблюдается. Для более детального рассмотрения процессов адсорбции необходимо рассмотреть равновесие в растворе до введения оксида меди (II). Соотношение бензойной кислоты и бензоат-иона в растворе описывается константой равновесия Кравн. На рис. 3 представлены графики зависимостей мольных долей от рН данного раствора.
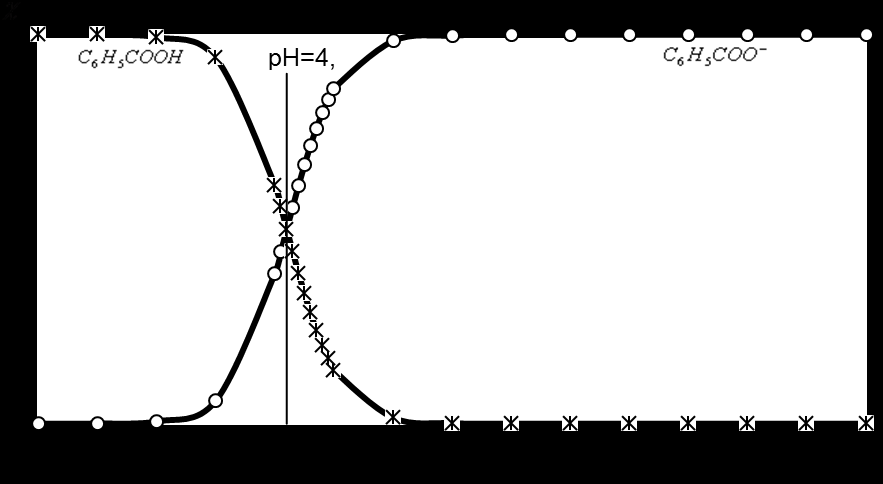
Рис. 3. Зависимость мольных долей бензойной кислоты и бензоат-иона от
рН раствора.
В кислой среде в растворе преобладают молекулы бензойной кислоты, которые и адсорбируются на оксиде меди (II). На адсорбенте имеются различные активные центры, которые осуществляют процесс адсорбции. Их можно представить следующим образом: Cu+, Cu-OH, Cu-O-. В кислой среде эти центры преобразуются:
Cu-O-(s) + H+ = Cu-OH(s)
Cu-OH(s) + H+ = Cu-OH2+(s)
Протонирование активных центров приводит к повышению рН раствора, что можно наблюдать при отсутствии бензойной кислоты в растворе (рис. 4.). В случае отсутствия бензойной кислоты в растворе рН увеличивается в большей степени, но за счет адсорбции концентрация ионов водорода увеличивается, что приводит к более меньшим изменениям рН:
Cu-OH2+(s) + C6H5-COOH = C6H5-COO-Cu(s) + H2O + H+
Cu-OH(s) + C6H5-COOH = C6H5-COO-Cu(s) +H2O
Cu+(s) + C6H5-COOH = C6H5-COO-Cu(s) + H+
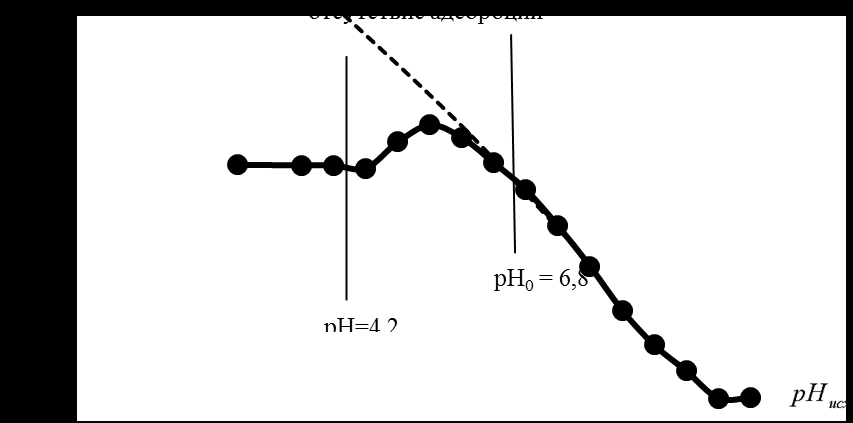 Рис. 4. График зависимости изменения рН от исходного значения рН.
Рис. 4. График зависимости изменения рН от исходного значения рН.Адсорбция молекул бензойной кислоты на оксиде меди (II) идет до значения рН=4,2, после чего начинают адсорбироваться бензоат-ионы:
Cu+(s) + C6H5-COO- = C6H5-COO-Cu(s)
Cu-OH2+(s) + C6H5-COO- = C6H5-COO-Cu(s) + H2O
Бензоат-ионы адсорбируются до значения рН=7. Возможно протекает процесс поверхностной диссоциации, который с увеличением рН раствора уменьшается.
5.Выводы:
Определена области максимума адсорбции бензойной кислоты (рН=2-4).
- Определена форма адсорбируемых частиц и их зависимость от рН (показано, что бензойная кислота адсорбируется в виде бензоат ионов).
6.Список литературы :
1Дункен X., Лыгич В. И. Квантовая химия адсорбции на поверхности твердых тел. Пер. с нем. — М.: Мир, 1980.
2 Киселев А. В., Яшин Я- И. Адсорбционная газовая и жидкостная хроматография.— М.: Химия, 1979.
3 Авгуль Н. П., Киселев А. В., Пошкус Д. П. Адсорбция газов и паров на однородных поверхностях. — М.: Химия, 1975.
4 Айлер Р. К. Химия кремнезема. Пер. с англ. — М.: Мир, 1982.
5 Тарасевич Ю. И., Овчаренко Ф. Д. Адсорбция на глинистых минералах.— Киев: Наукова думка, 1975.
