Семестр Осенний Весенний лекции 36 час. 18 час. Лабораторные з анятия 36 час. 36 час. Практические занятия 18 час. 18 час. Аудиторные занятия 126 час. 90 час самостоятельная работа
| Вид материала | Самостоятельная работа |
- Рабочая программа Специальность 032001 (350800) Документоведение и документационное, 274.91kb.
- Продолжительность программы : 72 ак час. Режим очных занятий : 50 ак час. (5 дней, 34.28kb.
- Рабочая программа Специальность Реклама Статус дисциплины, 133.73kb.
- Рабочая программа специальность 080504 государственное и мунииципальное управление, 167.24kb.
- Рабочая программа Специальность Связи с общественностью Статус дисциплины: опд, 181.84kb.
- История мировой экономики, 250.47kb.
- Рабочая программа Специальность Связи с общественностью Статус дисциплины: опд, 302.75kb.
- Объем учебной нагрузки: 36 час лекции, 36 час лабораторные работы, 36 час самостоятельная, 140.01kb.
- Рабочая программа по дисциплине: опд. Ф. 13. Финансовый менеджмент, 333.43kb.
- Можность патологических кровопотерь, 196.73kb.
1 2
3. Установите соответствие:
тип химической реакции | номер ответа | постоянный параметр |
| изобарный процесс | | 1) T = const |
| изохорный процесс | | 2) V = const |
| изотермический процесс | | 3) U= const |
| адиабатичесий процесс | | 4) Р = const |
4. При растворении 10 г хлорида аммония в 233 мл воды температура повысилась на 2,8 градуса. Теплоемкость полученного раствора равна 4,2
Дж·г–1·К–1. Вычислите с точностью до десятых:
| энтальпию растворения NH4Cl (кДж/моль) | |
| массовую долю NH4Cl в полученном растворе (%) | |
5. Растворы, для которых приведены концентрации гидроксильных ионов:
1) [OH-] = 10-12 моль/л 2) [OH-] = 5×10-12 моль/л
3) [OH-] = 10-7 моль/л 4) [OH-] = 10-4 моль/л
| расположите в порядке возрастания их кислотности | |
6. Укажите, какие из веществ в растворах проявляют :
1) Cl2 2) K2CrO4 3) HClO 4) KMnO4 5) FeSO4 6) MnSO4
| только окислительные свойства | |
| окислительно-восстановительную двойственность | |
7. Из 2,0 г двухвалентного металла образовалось 2,8 г оксида. Определите:
число атомов в химической формуле оксида | |
атомную массу металла | |
8. В системе 2NO2 = 2NO + O2 равновесные концентрации реагирующих веществ составляют соответственно 0,06; 0,24 и 0,12 моль/л. Рассчитайте:
| константу равновесия | |
| исходную концентрацию NO2 | |
9. По термохимическому уравнению:
СН4 (г) + 2О2 (г) = СО2 (г) + 2Н2О (г) + 878 кДж
вычислите, сколько теплоты (кДж) выделится при сгорании:
| 2,24 л метана (н.у.) | |
| 5 моль метана | |
10. Для гальванического элемента Mg|MgSO4 (0,01М)||MgSO4 (2М)|Mg, при известном jо (Mg2+|Mg) = – 2,31 В, определить значение (с точностью до 0,01 В):
| электродвижущей силы | |
| катодного потенциала | |
Контролирующие материалы используемые во втором семестре:
Коллоквиум1. Билет №1
- Получение, применение, влияние на организм человека и окружающую среду брома. Как можно нейтрализовать галогены.
- Приведите формулы соединений, имеющих названия: бертолетовая соль, карбид кальция, гидрофосфат магния.
- Осуществите превращение:
Аl → X → Na[Al(OH)4] → X → Al2(SO4)3+ H2O →X
- Закончите уравнения реакций:
- S + K2Cr2O7 + H2SO4 →
- Na2СO3 + H2O →
- Cu + HNO3 (разб) →
- Какой объем раствора аммиака с массовой долей NH3 23 % и плотностью 0,916 требуется для реакции с 0,75 л шестимолярного раствора соляной кислоты? Какое вещество образуется в реакции и чему равна его масса?
Коллоквиум2. Билет № 1
- Получение и применение алканов.
-
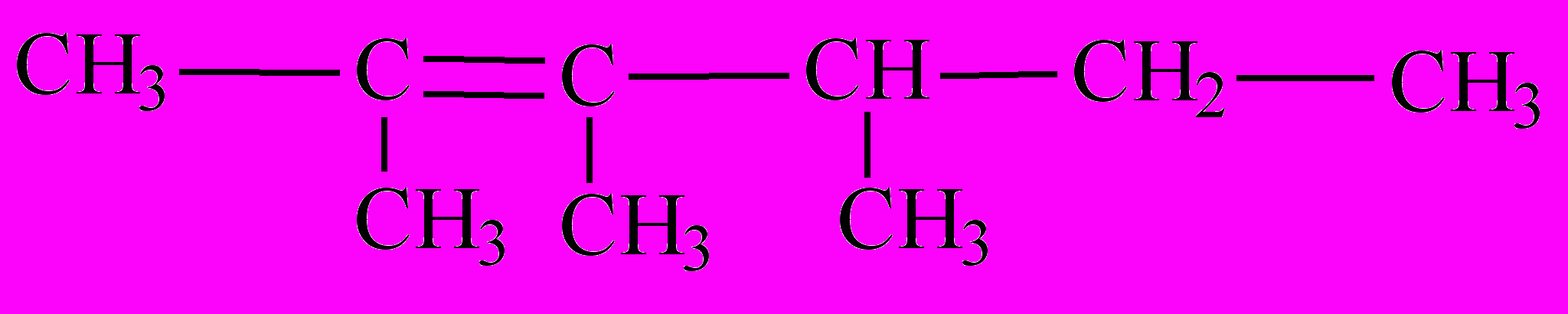
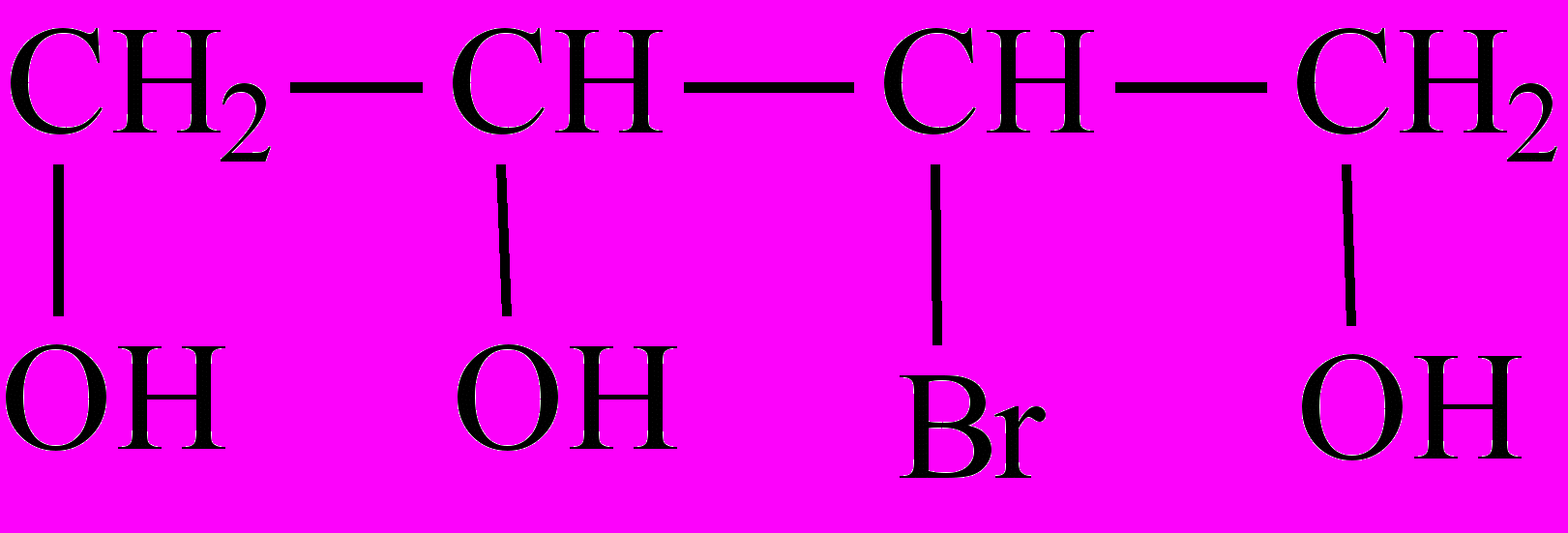
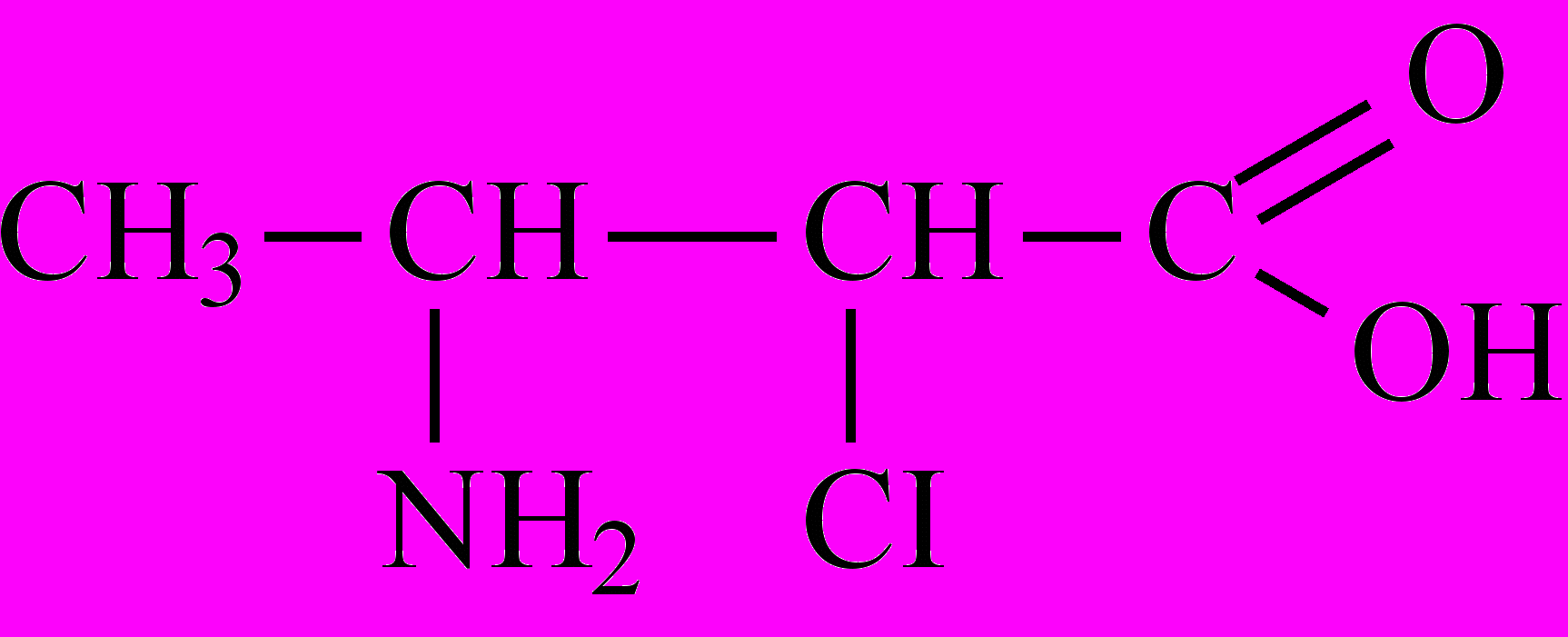
Назовите соединения по систематической номенклатуре и, где возможно, по радикало-функциональной . Укажите класс соединений:
- Постройте соединения, назовите по другой номенклатуре:
- бутилэтиловый эфир d. изопропилпропилкетон
- 2,2-дибромбутандиовая кислота e. 1-метокси-1,1-дихлорэтан
- 3. 2-нитропропан f. диметилфениламин
- Постройте соединения, определите гибридизацию атомов углерода:2,3-диметилпентан.
- Приведите качественные реакции, с помощью которых можно различить бензойную и салициловую кислоты.
- При сгорании газообразного органического вещества, не содержащего кислород, выделилось 2,24 л (н.у.) углекислого газа, 1,8 г воды и 3,65 г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
Э
 кзамен проводится во втором семестре
кзамен проводится во втором семестреЭкзаменационный билет ФТПУ 8.04-1
Томский политехнический университет
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 1
по дисциплине Химия
факультет_____ИНК_
курс______1_____
- Водород. Изотопы водорода. Свойства водорода. Получение и применение водорода. Гидриды.
- Осуществите превращение, продукты реакции назовите:
Са3(PO4)2 → P → H3PO4 → Са(H2PO4)2 → Са3(PO4)2 → H3PO4
- Закончите уравнения реакций:
- H2O2+ KMnO4 + H2SO4 →
- AgCl + NH3 →
- Zn + HNO3 (разб) →
- Na2CO3 + H2O →
- Из галита (минерала содержащего хлорид натрия) массой 350 г при обработке перманганатом калия в кислой среде получен хлор объемом 14,7 л при 286 °С и давлении 4 атм. Определите содержание хлорида натрия (ω, %) в галите.
- Назовите соединения (в,е), напишите химические формулы (а,б,г,д), определите тип гибридизации для атома углерода в соединении (г):
а) малоновая кислота г) трет.бутиловый спирт
б) орто-крезол д) пропилформиат
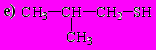
Составил доцент ОНХ _________________ Мирошниченко Ю.Ю.
Утверждаю: зав.кафедрой ОНХ____________ Ильин А.П.
«_______»_____июня____________г.
8.РЕЙТИНГ КАЧЕСТВА ОСВОЕНИЯ ДИСЦИПЛИНЫ.
Рейтинг представлен отдельно в приложении к рабочей программе.
-
УЧЕБНО-МЕТОДИЧЕСКОЕ И ИНФОРМАЦИОННОЕ ОБЕСПЕЧЕНИЕ ДИСЦИПЛИНЫ
Дисциплина «Химия» читается студентам в специализированной аудитории с использованием мультимедийных средств. Краткое содержание лекций, а также программа дисциплины, лабораторный практикум, образцы контролирующих материалов выставлены на личном сайте в портале ТПУ. На сайте библиотеки ТПУ представлены все учебно-методические материалы кафедры ОНХ, лекции по общей и неорганической химии, лабораторный практикум по общей и неорганической химии, индивидуальные домашние задачи, вопросы для самоподготовки к лабораторным и практическим занятиям и т.д.
А) Литература осенний семестр:
1. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. - М.: Химия, 2006.- 632 с.
2. Ахметов Н.С. Общая и неорганическая химия.- М.: Высшая школа, 2005. - 679с.
3. Некрасов Б.В. Основы общей химии. - М.: Химия, 1973.- т. 1,2.
4. Савельев Г.Г., Смолова Л.М. Общая химия. –Томск: изд-во ТПУ, 2004. -142с.
5. Смолова Л.М. Руководство к практическим заняиям по общей химии –Томск: изд-во ТПУ, 2010.
6. Стась Н.Ф., Лисецкий В.Н. Задачи, вопросы и упражнения по общей химии. Томск: изд. ТПУ, 2006.
7. Стась Н.Ф., Плакидкин А.А., Князева Е.М. Лабораторный практикум по общей и неорганической химии. – 2007.
8. Стась Н. Ф. Справочник по общей и неорганической химии. – 2000 - 2006. - 73 с.
Б) Литература на весенний семестр:
- Терней А. Современная органическая Химия. – М.: Мир, 1974. – Т. 1-2
- Ким А.М. Органическая химия. Новосибирск: Сиб. унив. Изд-во, 2004 – 914 с.
- Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. М.: Высшая школа, 2002. – 591 с.
- Нейланд О.Я. Органическая Химия. М.: Высшая школа, 1989. – 750 с.
Слесарев В.И. Химия. Основы химии живого. Санкт-Петербург: химиздат, 2001.-782 с
- Мирошниченко Ю.Ю., Юрмазова Т.А. Химические загрязнения биосферы и их определение. - Томск: изд-во ТПУ, 2010.
В) программное обеспечение и Internet-ресурсы:
u.ru/SHARED/m/myy
10. МАТЕРИАЛЬНО-ТЕХНИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ДИСЦИПЛИНЫ
Дисциплина «Общая и неорганическая химия» полностью обеспечена материально-техническими средствами. Лекции читаются в специализированной аудитории, оснащенной компьютерной техникой, и позволяющей демонстрировать химические опыты. Лабораторные занятия проводятся в химических лабораториях, оборудованных вытяжными шкафами, современными средствами проведения химического эксперимента (электронные весами, фотоколориметры, УЛК и т.д.). Имеется компьютерный класс.
Таблица 4.
| № п/п | Наименование (компьютерные классы, учебные лаборатории, оборудование) | Аудитория, количество установок |
| 1 | Учебная лаборатория, оснащенная компьютерами (8 шт.) | 2 корпус, 207 ауд. |
| 2 | Учебные лаборатории (5) | 2 корпус, 201 ауд. |
| 9 | Установка для определения эквивалентной массы металла (бюретка, колба Вюрца, уравнительный сосуд, резиновая или силиконовая трубка, термостат или водяная баня, пипетки, штатив) | 2 корпус, 201 ауд, 3 шт. |
| 4 | Установка для определения теплоты растворения (калориметр, термометр, мешалка, пластиковый стакан, пробирки) | 2 корпус, 201 ауд, 8 шт. |
| 3 | Установка для определения теплоёмкости и энтропии твердых тел | 2 корпус, 201 ауд, 2 шт. |
| 5 | Установка для термического разложения кристаллогидратов (электроплитка, песчаная баня) | 2 корпус, 201 ауд, 4 шт. |
| 6 | Установка для титрования (бюретка, стаканы, стандартные растворы кислот и щелочей, индикаторы) | 2 корпус, 201 ауд, 16 шт. |
| 7 | Установка для изучения электролиза (выпрямители, стаканы, наборы электродов, милливольтметр, миллиамперметр) | 2 корпус, 201 ауд, 2 шт. |
| 8 | Фотоэлектроколориметры | 2 корп., 201 ауд, 4 шт. |
| 10 | Сушильные шкафы | 2 корп., 201 ауд, 4 шт. |
| 11 | Муфельные печи | 2 корп., 201 ауд, 3 шт. |
| 12 | рН метры | 2 корпус, 201 ауд, 4 шт. |
| 13 | УЛК «Химия», контроллер | 2 корп., 201 ауд, 2 шт. |
| 14 | УЛК «Химия», термостат-калориметр | 2 корп., 201 ауд, 2 шт. |
| 15 | УЛК «Химия», установка для электрохимических измерений | 2 корп., 201 ауд, 2 шт. |
| 16 | УЛК «Химия», установка термического анализа | 2 корп., 201 ауд, 2 шт. |
| 17 | УЛК «Химия» (термодатчики, электроды для измерения электропроводности, электроды для измерения ЭДС стеклянные, хлорсеребряные, серебряные, инертные) | 2 корпус, 201 ауд, 2 шт. |
Программа составлена на основе Стандарта ООП в соответствии с требованиями ФГОС ВПО по направлению 280700 и профилю подготовки: бакалавр.
Программа одобрена на заседании______________
Протокол № ____ от «__» _______20____ г.
Автор ______________ Ю.Ю. Мирошниченко
Рецензент ___________ Е.М. Князева

















стр. из
