Бета-адренореактивные структуры в регуляции адаптационных возможностей системы кровообращения 03. 03. 01 физиология
| Вид материала | Документы |
| Материалы и методы исследования Результаты и их обсуждение Вклад β-адренореактивных структур в регуляциюсердечной деятельности |
- Физиологическая роль сосудистых рефлексогенных зон в интегративной регуляции функций, 653.7kb.
- Психическая адаптация боксеров к тренировочной и соревновательной деятельности. Колодезников, 23kb.
- Физиология центральной нервной системы Цель дисциплины, 20.01kb.
- Разработка способа визуального сопровождения звукового ряда с целью расширения адаптационных, 864.67kb.
- Повышение уровня адаптационных возможностей детей младшего дошкольного возраста посредством, 290.66kb.
- Разработка способа визуального сопровождения звукового ряда с целью расширения адаптационных, 851.21kb.
- Семинарского занятия по теме «Физиология эндокринной системы», 22.12kb.
- Резервные возможности кардиореспираторной системы и физическая работоспособность, 397.18kb.
- Семинарского занятия по теме По теме: «Физиология эндокринной системы», 22.75kb.
- Тематический план практических занятий на 3-й кафедре внутренних болезней для субординаторов, 35.73kb.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования выполнены на 1189-ти белых беспородных крысах-самцах весом 180-230 г. С лабораторными животными работали в соответствии с действующими «Правилами проведения работ с использованием экспериментальных животных» и «Международными рекомендациями по проведению медико-биологических исследований с использованием животных» (1985). Все эксперименты согласно задачам исследования можно разделить на 6 групп: изучение адекватности предложенной модели (60 крыс), изучение выживаемости и продолжительности жизни животных (140 крыс), исследование ВСР (334 крысы), СОК и МОК (235 крыс), изучение влияния исследуемых β-адренергических веществ на биохимические показатели и показатели гемостаза (210 крыс). Каждая группа была разделена на 4 подгруппы: интактные без воздействия β-адренергических веществ, интактные, которым вводили препараты, контрольные дезадаптированные (ХСН) и дезадаптированные, которым вводили препараты. А каждая подгруппа в зависимости от задач включала несколько серий экспериментов.
Оценка предложенной модели дезадаптации хронической сердечной недостаточности была произведена физиологическими и морфологическими методами. С помощью реовазографии определяли ОПСС, СОК и МОК, по ЭКГ – ЧСС, кровавым способом измеряли САД (Исмаилов и др., 1982). Для морфологического изучения модели ХСН у крыс забирали сердце, печень и легкие, проводили макро- и микроскопическое исследование (Меркулов, 1969; Автандилов, 1973).
В качестве β-адренергических веществ были выбраны представители различных классов β адреноблокаторов, наиболее широко применяемые в нашей стране. Из неселективных (действующих на β1- и β2-адренорецепторы) без внутренней симпатомиметической активности (ВСМА) – пропранолол и с ВСМА - пиндолол, из кардиоселективных (действующих преимущественно на β1-адренорецепторы) – атенолол, бисопролол, метопролол, обладающих различными физико-химическими свойствами, и небиволол с вазодилатирующей активностью (табл. 1). В качестве -адреномиметика был выбран селективный 1-адреномиметик – добутамин.
Таблица 1
Характеристика биологически активных веществ выбранных для исследования (Метелица, 2002; Перепеч, Михайлова, 2004)
| Препарат | Доза мг/кг | Коэффициент селективности* |
| Добутамин | 1,0 | - |
| Пропранолол | 10,0 | 0,98 |
| Пиндолол | 2,5 | 1,56 |
| Атенолол | 5,0 | 19 |
| Метопролол | 10,0 | 25 |
| Бисопролол | 0,8 | 50 |
| Небиволол | 0,5 | 297 |
*- коэффициент селективности – аффинитет по отношению β1/ β2
При определении дозы препаратов использовали коэффициент перерасчета – 5.9. β-адреноблокаторы вводились крысам внутрижелудочно в виде растворов в объеме 1 мл. Добутамин вводился внутрибрюшинно. Он применялся только при исследовании ВСР у наркотизированных и бодрствующих иммобилизированных животных, а также при определении СОК и МОК у интактных бодрствующих крыс.
В качестве наркоза использовали гексенал (100 мг/кг массы животного внутрибрюшинно) или нембутал (40 мг/кг). Для морфологических исследований животных забивали под гексеналовым наркозом (150 мг/кг).
Для изучения влияния исследуемых препаратов на ВСР провели 3 серии экспериментов: на интактных крысах, находящихся в состоянии наркоза, на бодрствующих иммобилизированных животных в положении на спине в состоянии кратковременного стресса и на бодрствующих иммобилизированных крысах с экспериментальной ХСН. Регистрацию ЭКГ осуществляли с помощью двухканальной электрофизиологической установки, связанной через АЦП («L-CARD E-440») с компьютером «Pentium II». Частота дискретизации составляла 4.0 кГц. ЭКГ записывалась во II-м стандартном отведении в течение 4-х минут с помощью программы «L-GRAPH», поставляемой вместе с АЦП. Просмотр ЭКГ и первичная обработка ее проводилась с помощью программы «RRMatch», а окончательный расчет показателей ВСР и их графическое отображение в программе «CRGraph».
При анализе ВСР использовали показатели временного анализа: минимальная – Mn (мс) и максимальная – Мх (мс) длительность всех интервалов R-R, ЧСС, среднее квадратичное отклонение – SDNN (мс), коэффициент вариации – CV (%), квадратный корень из суммы квадратов разности величин последовательных пар интервалов R-R – RMSSD (мс); геометрического анализа: вариационный размах – MxDMn (мс), мода – Мо (мс), амплитуда моды – АМо (%), стресс-индекс – SI (усл. ед.); скаттерограммы: площадь скаттерограммы – EllSq (мс2), отношение ширины к длине скаттерограммы – EllAs (%); и спектрального анализа: мощность волн низкой частоты – LF (мс2), мощность волн высокой частоты – НF (мс2), общая мощность спектра TP (мс2), относительное значение мощности волн высокой НF (%) и низкой LF (%) частот, индекс вагосимпатического взаимодействия – LF/НF (усл. ед.). При расчете геометрических показателей шаг гистограммы был равен 2 мс. У наркотизированных крыс диапазон LF составлял 0.02 0.15 Гц, у бодрствующих стрессированных животных 0.02-0.75 Гц. Диапазон НF – 0.15-2.0 Гц у наркотизированных крыс и 0.75-3.0 Гц у бодрствующих.
Регистрация СОК и МОК осуществлялась с помощью модернизированного для мелких лабораторных животных допплеровского анализатора сердечно-сосудистой деятельности «Кроха-М» (г. Тула) с соответствующим программным обеспечением. Использовали датчик диаметром 4 мм и частотой 8.0 МГц. Длительность записи составляла 3 минуты.
Изучение биохимических показателей осуществлялось при помощи спектрофлюориметрических (спектрофлюориметр «Hitachi» MPF-4) и колориметрических (фотоэлектроколориметр КФК-2-УХЛ 4,2) методов. Для исследования у крыс брали кровь, сердце, ткани головного мозга. Определяли концентрацию АД, НА, ДА (Осинская, 1977), 11-ОКС (Панков и др., 1973; Колб, Камышников, 1982), ГТ и СТ (Мещерякова, Герасимова, 1974; Лабораторные методы исследования в клинике, 1987). Вычисляли коэффициенты АД/НА («адреналиновый» коэффициент); ДА/(АД+НА) («дофаминовый» коэффициент); ГТ/СТ. В плазме крови определяли концентрацию ОХС, ХС ЛПВП и ЛПНП, ТГ и ЛПОНП. Рассчитывали коэффициент атерогенности плазмы (Окороков, 2002; Камышников, 2003). Изучались показатели гемостаза, характеризующие активность свертывающей (протромбиновый индекс, содержание фибриногена, растворимых фибрин-мономерных комплексов), противосвертывающей (активность антитромбина III), фибринолитической (фибринолитическая активность) систем. Исследовали спонтанную и индуцированную коллагеном и АДФ агрегацию тромбоцитов, фактор Виллебранда, характеризующий адгезию тромбоцитов (Балуда, Баркаган, 1980; Ройтман, Смоляницкий, 2000; Corriveau, Fritsma, 2001).
Была произведена статистическая обработка результатов. С этой целью использовались статистические программы: «StatPlus 2007», «Statistica 6.0». В случае нормального распределения для оценки достоверности отличий применяли t критерий Стьюдента, для множественных сравнений – критерий Стьюдента с поправкой Бонферрони. Если распределение отличалось от нормального – непараметрический критерий Уилкоксона. Различия считали достоверными при p<0.05. Данные представлены в виде M±m (Гланц, 1999).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Экспериментальная хроническая сердечная недостаточность как модель дезадаптации
При разработке модели ХСН за основу взяли модель ХСН, предложенной Н.Н.Пятницким и Ю.А.Блинковым (1970), для создания которой авторы использовали однократное введение в каждую плевральную полость силиконового масла в объеме 5 мл. В результате чего происходило сдавливание легочных сосудов и повышение давления в области легочной вены, что усиливало нагрузку на правое сердце. При этом также имело место тотальное давление жидкости на все отделы миокарда. Метод легко воспроизводим, не требует специального оборудования, не трудоёмок и разработан специально для мелких лабораторных животных (крысы).
Сущность нашей модификации заключалась в дробном введении силиконового масла в каждую плевральную полость, за счет чего патология развивалась постепенно: первое введение масла – по 1,5 мл/100 г массы крысы в каждую плевральную полость, второе через месяц в дозе по 1 мл/100 г массы, третье введение еще через 2 месяца по 1 мл/100 г, т.о. в зависимости от срока получали ХСН различной степени тяжести (Федоров и др., 2006; Румянцева и др., 2009). Применение β-адреноблокаторов начиналось через сутки после второй инъекции масла.
В физиологических исследованиях было установлено, что при ХСН-2 САД и ЧСС снижались на 16.2%, СОК на 18.1%, МОК на 32.4%, а ОПСС повышалось на 22.9% относительно интактной группы (p<0.05). У крыс с ХСН-3 происходило дальнейшее усугубление нарушений гемодинамики. По сравнению с интактными САД снижалось на 18.5%, ЧСС на 29.1%, СОК на 22.5%, МОК на 44.8%, а ОППС возрастало на 49.0% (p<0.05). ЧСС при ХСН-3 была достоверно меньше, чем при ХСН-2 на 16.2%, а ОПСС соответственно выше на 20.1%.
При морфологическом исследовании выявлялись характерные для ХСН изменения сердца. Сердце было увеличено в размерах, шаровидной формы. Отражением гипертрофии миокарда было возрастание среднего весового коэффициента сердца на 11.6% при ХСН-1, 13.8% при ХСН-2 и 12.7% при ХСН-3 (p<0.05). В сердце у интактных крыс достоверное отличие имела толщина стенки: в правом желудочке она была в 1.2 раза больше по сравнению с левым (p<0.05). При ХСН появились изменения. Так, в правом желудочке толщина задней стенки увеличилась в среднем в 1.5 раза (p>0.05), толщина кардиомиоцитов также в 1.5 раза (p<0.001), а минимальный диаметр их ядер в 1.3 раза (p<0.05). В левом желудочке также произошло увеличение толщины этих структур в среднем в 1.1 раза (p>0.05). Причем, как и у здоровых животных, у крыс с ХСН наблюдались достоверно большая толщина кардиомиоцитов и минимальный диаметр ядра кардиомиоцита в правом желудочке (соответственно в 1.7 и 1.1 раза) по сравнению с левым. Было также установлено, что в части кардиомиоцитов исчезла поперечная исчерченность мышечных волокон.
В печени у крыс с ХСН также были обнаружены патологические изменения, исходя из которых, можно заключить, что в гепатоцитах центральных зон долек преобладали явления набухания и отека. В некоторых дольках выявлены кровоизлияния. Центральные вены и прилежащие к ним отделы синусоидов были расширены. В части долек в центральных отделах не прослеживались печеночные балки, часть клеток имела нечеткие контуры. Отмечалась гибель гепатоцитов.
В легких у животных с ХСН наблюдались изменения: зоны ателектазов, очаги кровоизлияний, множественные диапедезные кровоизлияния, выраженное утолщение межальвеолярных перегородок.
Опираясь на результаты измерения гемодинамических параметров и данные морфологического исследования органов крыс, можно сделать вывод, что представленная модель соответствует тотальной ХСН и сопоставима с существующими моделями, предложенными рядом авторов (Doggrell, Brown, 1998; Einstein, Abdul-Hussein, 1995). Дробное дозированное введение силиконового масла позволяет создавать динамическую модель ХСН, и таким образом, моделировать различную степень ее тяжести. В дальнейшем все эксперименты были проведены на модели ХСН-2.
В исследованиях установлено, что β-адреноблокаторы способны снизить степень дезадаптации системы кровообращения при ХСН (контроль), увеличить выживаемость и продолжительность жизни животных. Шестимесячную выживаемость достоверно повышали в 1.7-2.3 раза все исследуемые соединения, кроме пиндолола (рис.1). Более того, в отличие от контроля, адреноблокаторы способствовали у 15-40% животных переживанию годового рубежа эксперимента (за исключением пиндолола). Длительность жизни подопытных животных достоверно удлиняли все исследуемые β адреноблокаторы на 40.0-94.0%.
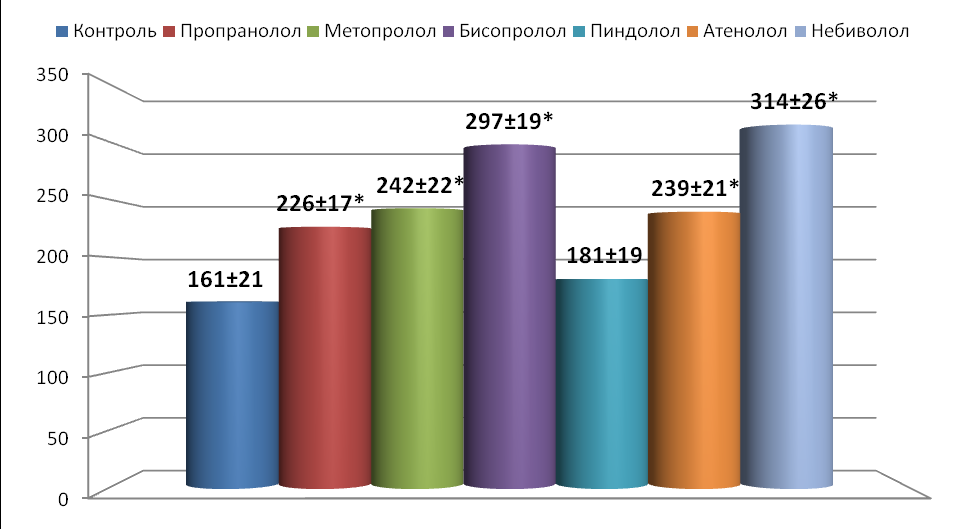
Рис 1. Продолжительность жизни крыс с экспериментальной ХСН при длительном применении -адреноблокаторов (дни).
*- p<0.05 по сравнению с группой контроля.
Вклад β-адренореактивных структур в регуляцию
сердечной деятельности
Несомненный интерес представляет выяснение механизмов функционирования системы кровообращения у крыс с помощью метода определения ВСР в состоянии покоя (под наркозом), при кратковременном иммобилизационном стрессе и при дезадаптации – экспериментальной ХСН, а также при воздействии в этих состояниях изучаемых препаратов.
Проведенное исследование позволило определить особенности механизмов регуляции деятельности ССС у животных при указанных выше состояниях организма и выявить вклад -адренореактивных структур в формировании тех или иных механизмов регуляции за счет уменьшения их активности с помощью различных -адреноблокаторов и стимулирования адреномиметиком добутамином.
Временной анализ. ЧСС у крыс, находящихся в состоянии наркоза, составляла в среднем 3738.4 /мин, у бодрствующих животных при кратковременном иммобилизационном стрессе 4934.3 /мин и, наконец, у бодрствующих иммобилизированных крыс с экспериментальной ХСН 4564.4 /мин, т.е. у иммобилизированных интактных крыс она была достоверно в 1.3 раза больше по сравнению с наркотизированными и в 1.1 раза больше по сравнению с дезадаптированными животными.
Блокада -адренорецепторов всеми исследуемыми препаратами показала, что их введение приводит к достоверному снижению ЧСС во всех группах животных, что согласуется с данными других исследователей (Perlini et al., 1995; Souza Neto et al., 2001; Barbier et al., 2006; Waki, Katahira, 2006). Воздействие -адреноблокаторов на наркотизированных животных привело к снижению ЧСС (рис. 2), максимальное влияние оказали неселективный пропранолол и высокоселективные бисопролол и метопролол (снижение ЧСС на 26.0 %, 30.8 % и 37.3 % соответственно), а минимальное низкоселективный атенолол и неселективный пиндолол с симпатомиметической активностью (снижение ЧСС на 11.5 % и 13.7 % соответственно).
У бодрствующих иммобилизированных животных наблюдалась почти такая же картина (рис. 2). К наибольшему снижению ЧСС приводило однократное воздействие пропранолола (13.0 %), бисопролола (17.4 %), метопролола (26.0 %) и небиволола (15.1 %), а к наименьшему – пиндолола (5.1 %) и атенолола (8.1 %). Т.о. степень воздействия на ЧСС у стрессированных крыс была в целом меньше, чем у наркотизированных.
У крыс с экспериментальной ХСН происходило снижение ЧСС, что согласуется с данными других авторов (Radaelli, Cazzaniga, 2006; Cilliam et al., 2007). Длительное применение -адреноблокаторов привело к еще большему достоверному уменьшению ЧСС по сравнению с контрольными (ХСН) животными только при воздействии пропранолола, пиндолола, атенолола и небиволола (на 6.8 %, 14.9 %, 17.5 % и 4.6 % соответственно) (рис. 2). Максимальное снижение ЧСС по сравнению с интактными крысами было при применении пиндолола (21.3 %) и атенолола (23.7 %), а минимальное – бисопролола (7.7 %) и метопролола (5.5 %).
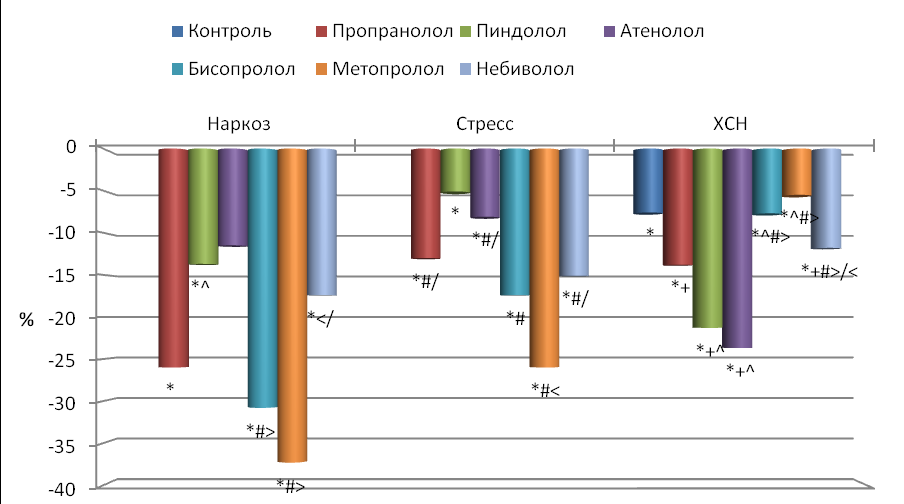
Рис. 2. Влияние -адреноблокаторов на частоту сердечных сокращений (ЧСС) по сравнению с исходным состоянием.
Достоверные отличия: * - по сравнению с интактными, + - по сравнению с контролем, - пропранолол с остальными адреноблокаторами, # - пиндолол с остальными адреноблокаторами, > - атенолол с остальными адреноблокаторами, < - бисопролол с остальными адреноблокаторами, / - метопролол с остальными адреноблокаторами.
Стандартное отклонение кардиоинтервалов (SDNN) у наркотизированных крыс в среднем было равно 2.610.226 мс, у интактных стрессированных животных 1.550.067 мс, а у крыс с моделированной ХСН 2.020.147 мс. Таким образом, SDNN у наркотизированных животных и животных с ХСН было больше соответственно в 1.7 и 1.3 раза (p<0.05), чем у интактных стрессированных крыс, что говорит о преобладании у последних тонуса симпатического отдела АНС (Inagaki et al., 2004). Блокада -адренореактивных структур у интактных наркотизированных, иммобилизированных крыс, а также крыс с ХСН способствовала повышению SDNN. Но у животных под наркозом повышение SDNN при воздействии -адреноблокаторов в 1.3 раза по сравнению с интактной группой было недостоверным.
Напротив, у стрессированных интактных крыс и крыс с ХСН показатель SDNN повышался достоверно при действии всех -адреноблокаторов независимо от длительности их применения. Причем при однократном воздействии на организм интактных иммобилизированных крыс больше остальных увеличивало этот параметр введение бисопролола и метопролола (в среднем в 3.5 раза), затем пропранолола и атенолола (в среднем в 2.2 раза) и, наконец, пиндолола и небиволола (в среднем в 1.7 раза).
У животных с моделированной ХСН, длительно принимавших адреноблокаторы показатель, SDNN был достоверно выше под воздействием всех препаратов, кроме метопролола. Имело место повышение этого показателя в 1.9 раза по сравнению с интактными и в 1.5 раза по сравнению с контрольными животными. Причем картина воздействия изученных адреноблокаторов у дезадаптированных крыс отличалась от таковой у интактных стрессированных. В последнем случае сильнее действовали пропранолол, пиндолол и атенолол, чем бисопролол, метопролол и небиволол.
Геометрический анализ (вариационная пульсометрия). Вариационный размах у наркотизированных крыс составлял 13.60.86 мс, у крыс в состоянии иммобилизации 9.20.39 мс, а при ХСН 13.10.96 мс. У стрессированных животных он был в 1.5 раза меньше, чем у наркотизированных крыс и в 1.4 раза – чем у крыс с ХСН (p<0.001), что указывает на преобладание у них тонуса симпатического отдела АНС.
У животных в состоянии наркоза показатель MxDMn по сравнению с исходным значением достоверно увеличился только при воздействии атенолола (в 1.1 раза), бисопролола (в 1.7 раза), метопролола (в 1.5 раза) и небиволола (в 1.4 раза). Значимых различий между воздействием изучаемых веществ не было выявлено (рис. 3).
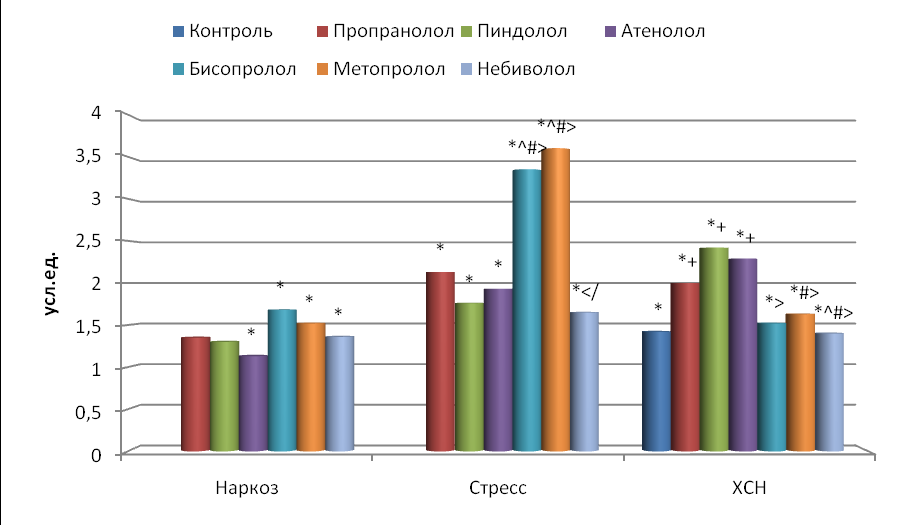
Рис. 3. Влияние -адреноблокаторов на изменение вариационного размаха (MxDMn) по сравнению с исходным состоянием.
Остальные обозначения те же, что и на рис. 2.
У стрессированных крыс, увеличение вариационного размаха по сравнению с интактными животными обнаружено при использовании всех адреноблокаторов (p<0.05). Причем наибольшее повышение MxDMn наблюдалось при применении бисопролола и метопролола в среднем в 3.5 раза, а остальных – в среднем в 1.9 раза.
У животных с ХСН показатель MxDMn был в 1.2 раза больше, чем у наркотизированных крыс (p>0.05) и в 1.4 раза больше по сравнению с иммобилизированными крысами (p<0.001). Применение -адреноблокаторов сопровождалось увеличением вариационного размаха (в среднем в 1.9 раза) по сравнению с интактными животными (p<0.05), а по сравнению с контрольными – только при длительном воздействии пропранолола, пиндолола и атенолола (в среднем в 1.6 раза) (p<0.05).
У наркотизированных крыс стресс-индекс (SI) составил 118141219 усл. ед., у иммобилизированных – 253601819 усл. ед., у животных с ХСН – 169581649 усл. ед. Таким образом, у животных при иммобилизационном стрессе данный показатель был достоверно в 2.1 раза выше, чем у крыс в состоянии наркоза, и в 1.5 раза выше по сравнению с контрольными крысами с ХСН. Это подтверждает высокую чувствительность SI к повышению тонуса симпатического отдела АНС, преобладание которого имеет место при стрессе (Inagaki et al., 2004).
Блокада -адренореактивных структур у наркотизированных крыс отмечалась снижением стресс-индекса по сравнению с исходным состоянием, но достоверно только под влиянием пропранолола на 66.6 %, бисопролола на 62.5 %, метопролола на 72.8 % и небиволола на 65.7 % (рис. 4). При иммобилизационном стрессе все изученные -адреноблокаторы достоверно уменьшали SI: при использовании пропранолола на 70.0 %, пиндолола на 58.8 %, атенолола на 70.8 %, бисопролола на 89.4 %, метопролола на 93.1 % и небиволола на 63.4 %. При этом более выраженным действием обладали бисопролол и метопролол по сравнению с пропранололом, пиндололом, атенололом и небивололом (p<0.05). Снижение SI под действием -адреноблокаторов свидетельствует об увеличении адаптационных возможностей организма у наркотизированных и бодрствующих стрессированных крыс.
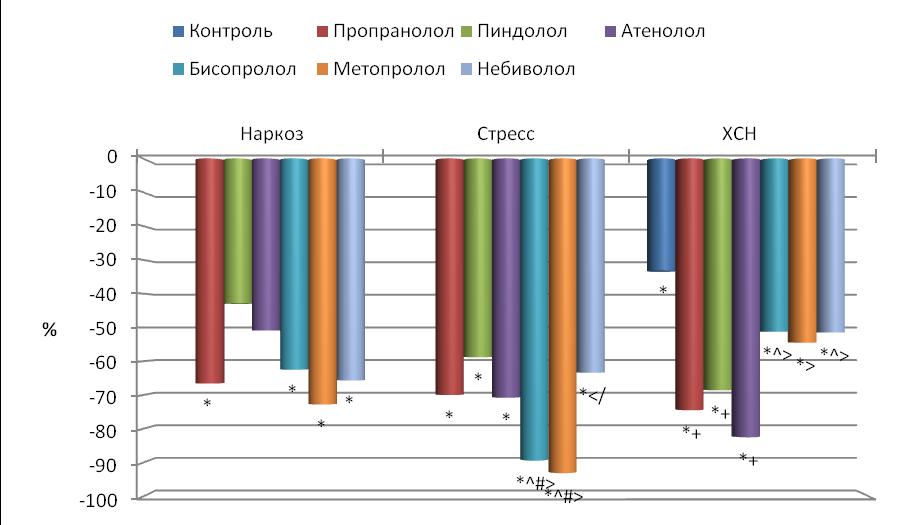
Рис. 4. Влияние -адреноблокаторов на изменение стресс-индекса (SI) по сравнению с исходным состоянием.
Остальные обозначения те же, что и на рис. 2.
ХСН у крыс также привела к уменьшению этого показателя на 33.2 % (p<0.01) по сравнению с интактными животными. Воздействие β адреноблокаторов еще больше снизило SI по сравнению с иммобилизированными интактными крысами: при действии пропранолола, пиндолола и атенолола в среднем на 75.2 %; бисопролола, метопролола и небиволола – в среднем на 52.4 % (p<0.05), по сравнению с контрольными крысами различия были достоверны только при действии пропранолола, пиндолола и атенолола (в среднем снижение на 62.9 %).
Анализируя полученные результаты, можно заключить, что развитие ХСН у крыс сопровождалось увеличением ВСР, а, следовательно, тонуса парасимпатического отдела АНС, что согласуется с результатами ряда авторов (Malliani et al., 1994; Galinier et al., 1999; Flevari et al., 2006). Данные временного и геометрического анализов, характеризующие использование адреноблокаторов у наркотизированных крыс не противоречат результатом других исследователей (Алипов и др., 2005; Souza Neto et al., 2001; Beckers et al., 2006; Sun et al., 2006). Блокада -адренореактивных структур при иммобилизационном стрессе и экспериментальной ХСН вызывала однонаправленные изменения, выражавшиеся в снижении активности симпатического и повышении активности парасимпатического отдела АНС и увеличении общей вариабельности ритма сердца.
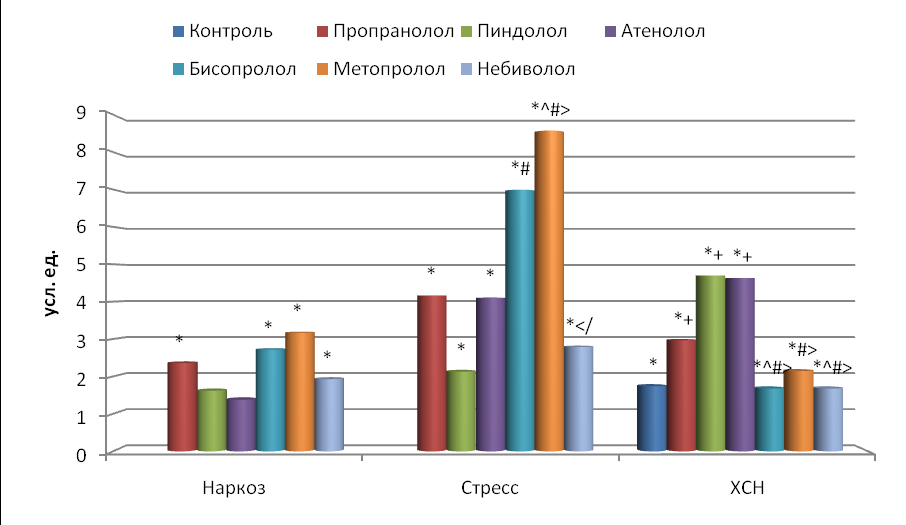
Рис. 5. Влияние -адреноблокаторов на изменение площади скаттерограммы (EllSq) по сравнению с исходным состоянием.
Остальные обозначения те же, что и на рис. 2.
Корреляционная ритмография. Площадь скаттерограммы (EllSq) у интактных наркотизированных животных составляла 118.315.31 мс2, у иммобилизированных крыс 56.03.99 мс2, а у контрольной группы (ХСН) 97.513.18 мс2. Причем у крыс в состоянии наркоза площадь скаттерограммы была в 2.1 раза больше, а с ХСН в 1.7 раза больше, чем у интактных стрессированных крыс (p<0.05). У наркотизированных животных площадь скаттерограммы возрастала на фоне введения пропранолола, бисопролола, метопролола и небиволола в среднем в 2.5 раза (p<0.05), а при введении пиндолола и атенолола увеличение EllSq было недостоверным (рис. 5).
При введении всех β-адреноблокаторов иммобилизированным крысам произошло достоверное увеличение EllSq. Она возросла под воздействием бисопролола и метопролола (в среднем в 7.8 раза), затем пропранолола и атенолола (в среднем в 4.1 раза) и менее всего – пиндолола и небиволола (в среднем в 2.5 раза). Причем влияние бисопролола и метопролола на EllSq было достоверно сильнее, чем пиндолола и небиволола, а метопролола сильнее, чем пропранолола (p<0.05).
У животных с ХСН введение препаратов вызывало дальнейшее достоверное увеличение площади скаттерограммы по сравнению с интактными стрессированными крысами (рис. 5): пропранолола в 3.0 раза, пиндолола и атенолола в среднем в 4.7 раза, а бисопролола, метопролола и небиволола в среднем в 1.8 раза. По сравнению с контрольными крысами достоверно увеличивалась EllSq только при введении пропранолола (в 1.7 раза), пиндолола и атенолола (в среднем в 2.7 раза).
Спектральный анализ. Мощность низкочастотного диапазона LF у наркотизированных животных составляла 0.260.040 мс2, у интактных стрессированных – 0.270.036 мс2 и у контрольных с ХСН – 0.580.110 мс2, мощность высокочастотного диапазона HF - 0.370.056 мс2, 0.230.021 мс2 и 0.270.032 мс2 соответственно, а общая мощность спектра (ТР) – 0.630.084 мс2, 0.500.050 мс2 и 0.850.135 мс2 соответственно. При этом у крыс с ХСН мощности LF и ТР были выше, чем у крыс в состоянии наркоза и у интактных иммобилизированных животных (p<0.05).
Результаты спектрального анализа указывают на то (рис. 6-8), что у наркотизированных крыс при однократном введении исследуемых адреноблокаторов значимо увеличивали мощность LF только пиндолол и бисопролол (соответственно в 3.3 и 3.4 раза), мощность HF – пропранолол, бисопролол и метопролол (соответственно в 4.2, 3.8 и 5.9 раза), а общую мощность ТР – пропранолол, пиндолол, бисопролол и метопролол (соответственно в 2.8, 2.2, 3.6 и 4.2 раза, p<0.05). Индекс вагосимпатического взаимодействия (LF/HF) уменьшился при действии пропранолола (в 5.3 раза, p<0.001), метопролола и атенолола (в среднем в 3.2 раза, p<0.05) бисопролола и небиволола (в среднем в 1.6 раза, p>0.05), а при действии пиндолола произошло незначительное увеличение этого индекса в 1.4 раза (p>0.05).
Полученные результаты полностью согласуются с данными временного и геометрического анализов, свидетельствуя об увеличении общей ВСР и тонуса парасимпатического отдела АНС, а также о снижении симпатических влияний на сердце у крыс в состоянии наркоза (Safa-Tisseront et al., 1989; Souza Neto et al., 2001; Waki et al., 2006).
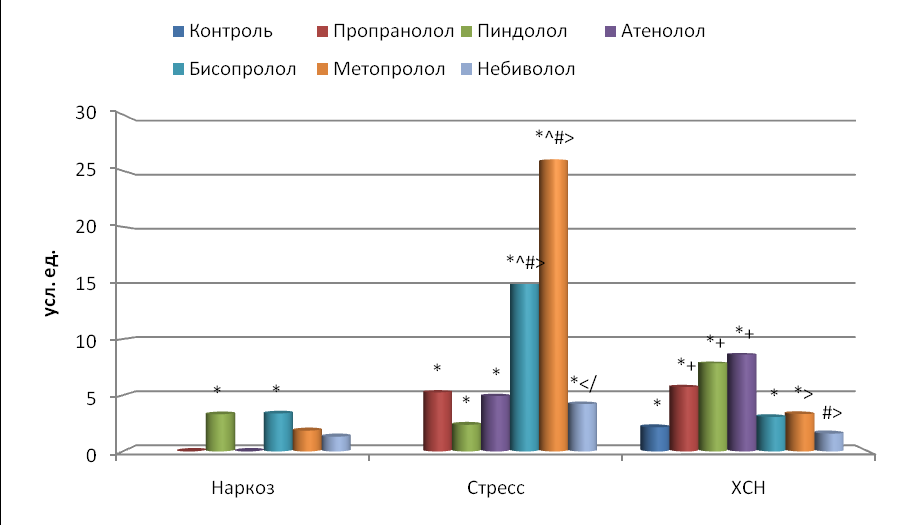
Рис. 6. Влияние -адреноблокаторов на изменение мощности (LF) по сравнению с исходным состоянием.
Остальные обозначения те же, что и на рис. 2.
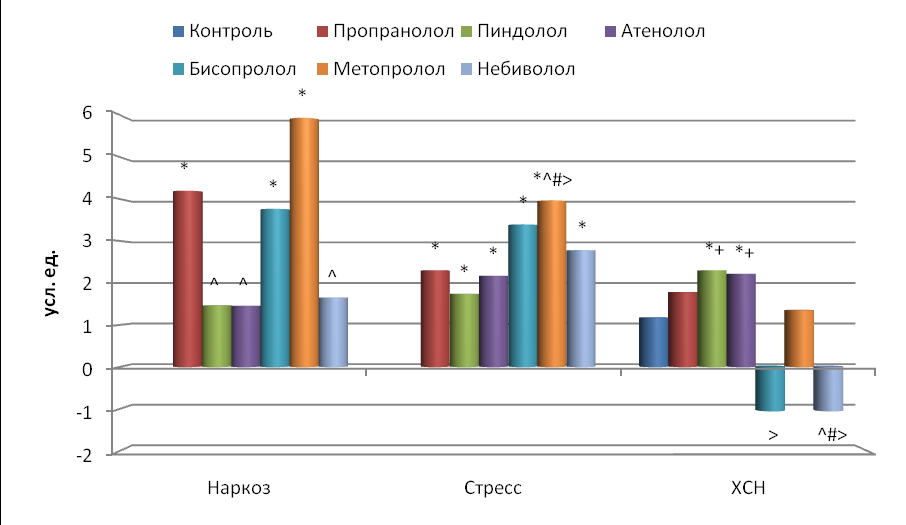
Рис. 7. Влияние -адреноблокаторов на изменение мощности (HF) спектра по сравнению с исходным состоянием.
Остальные обозначения те же, что и на рис. 2.
Введение всех изучаемых блокаторов -адренорецепторов (рис. 6-7). при иммобилизационном стрессе у интактных крыс приводило к достоверному увеличению всех мощностей (LF, HF и ТР) спектра. Так, мощность LF больше возрастала при воздействии бисопролола и метопролола (в 14.9 и 26.0 раз соответственно), тогда как другие β-адреноблокаторы увеличивали ее в среднем всего в 4.2 раза. Мощность HF возрастала при действии пиндолола, атенолола, бисопролола и небиволола в среднем в 2.5 раза, а метопролола – в 4.0 раза. Причем воздействие метопролола было значительно сильнее по сравнению с пропранололом, пиндололом и атенололом (p<0.05).
В связи с тем, что мощность LF возросла больше, чем HF, увеличился и индекс LF/HF при действии бисопролола и метопролола (в среднем в 5.2 раза, p<0.001), пропранолола и атенолола (в среднем в 1.9 раза, p<0.05), пиндолола и небиволола (в среднем в 1.3 раза, p>0.05). Причем бисопролол и метопролол увеличивали этот показатель в большей степени, чем пропранолол, пиндолол, атенолол и небиволол (p<0.05).
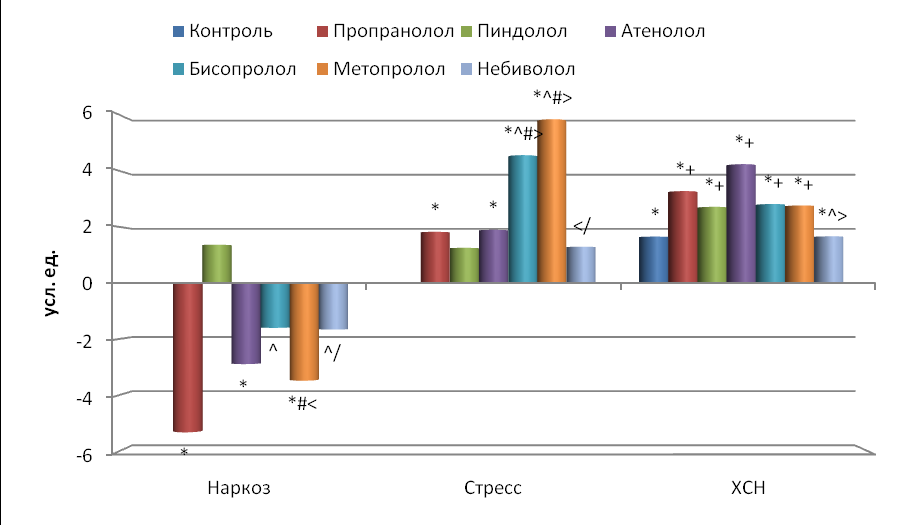
Рис. 8. Влияние -адреноблокаторов на изменение индекса вагосимпатического взаимодействия (LF/HF) по сравнению с исходным состоянием.
Остальные обозначения те же, что и на рис. 2.
У крыс с ХСН повышалась мощность LF в 2.2 раза (p<0.05), незначимо HF в 1.2 раза (p>0.05) и достоверно общая мощность спектра в 1.7 раза (рис. 6-8). Мощность LF возрастала у животных с ХСН при длительном применении всех -адреноблокаторов по сравнению с интактными крысами: более всего при действии пропранолола, пиндолола, атенолола в среднем в 7.4 раза (p<0.001), бисопролола и метопролола в среднем в 3.2 раза (p<0.05), и менее всего небиволола - в 1.6 раза (p>0.05). А по сравнению с контрольными животными достоверное увеличение показателя LF было только при действии пропранолола, пиндолола и атенолола – в среднем в 3.5 раза. Сильнее воздействовал на LF атенолол по сравнению с метопрололом и небивололом, а также пиндолол по сравнению с небивололом (p<0.05).
Изменение же мощности HF у крыс с ХСН при использовании β адреноблокаторов было разнонаправлено и в большинстве случаев недостоверно (рис. 7). Только пиндолол и атенолол значительно повышали показатель HF – в среднем в 2.3 раза (p<0.05) по сравнению с интактными животными, в среднем в 1.9 раза по сравнению с контрольными (p<0.05). Причем пропранолол и пиндолол сильнее влияли на HF, чем небиволол, а атенолол сильнее, чем бисопролол и небиволол.
Индекс вагосимпатического взаимодействия достоверно увеличился как у контрольных животных по сравнению с интактными (в 1.7 раза), так и при воздействии блокаторов -адренорецепторов на крыс с ХСН по сравнению с интактными: пропранолола и атенолола в среднем в 3.8 раза, а остальных – в среднем в 2.8 раза; по сравнению с контрольными - пропранолола и атенолола в среднем в 2.3 раза, пиндолола, бисопролола и метопролола в среднем в 1.7 раза. Небиволол практически не повышал LF/HF (рис. 8). Причем пропранолол и атенолол влияли на этот показатель достоверно сильнее, чем небиволол (p<0.05).
В качестве вещества, возбуждающего -адренореактивные структуры взяли 1-адреномиметик – добутамин (Aronson, Burger, 2004; Chenzbraun et al., 2003; Barletta, 2003). У наркотизированных крыс он вызвал разнонаправленные изменения в показателях ВСР, но все они были недостоверными.
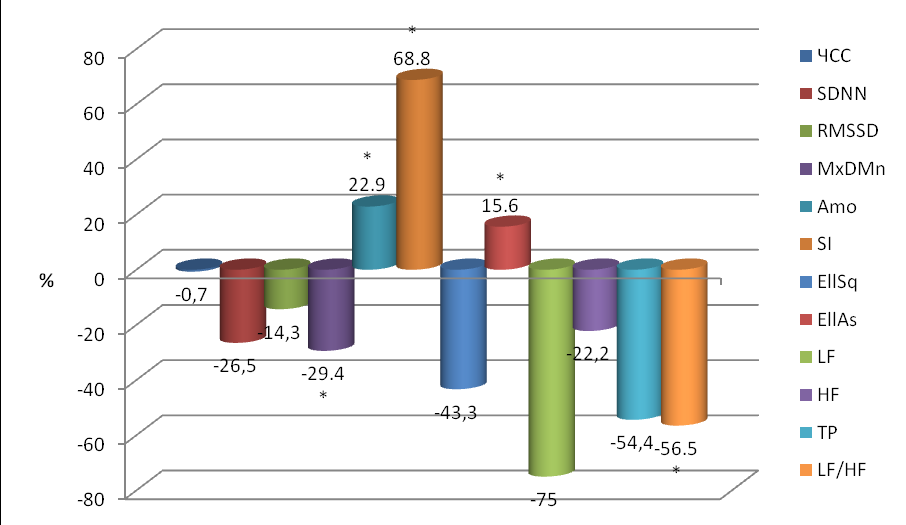
Рис. 9. Динамика изменений основных показателей ВСР у бодрствующих стрессированных крыс при воздействии добутамина по отношению к исходному уровню.
* - p<0.05 по сравнению с исходным уровнем.
У интактных иммобилизированных животных эти изменения также были разнонаправленными. Но удалось выявить достоверные изменения в некоторых показателях ВСР (рис. 9): в MxDMn и LF/HF (уменьшение), AMo, SI и EllAs (увеличение). Причем и в этом случае, как и при воздействии адреноблокаторов, данные временного и геометрического анализов не совпадали со спектральным. По изменению показателей первых двух можно судить о некотором повышении тонуса симпатического отдела АНС, а спектральный анализ показывал увеличение активности ее парасимпатического отдела.
Впервые обнаруженное нами при оценке спектрального анализа большее увеличение мощности низкочастотного диапазона LF наряду с увеличением высокочастотного диапазона HF при действии β адреноблокаторов и, наоборот, большее уменьшение мощности LF по сравнению с HF при действии -адреномиметика добутамина на иммобилизированных животных, указывает на то, что в показателе мощности LF отражается активность не только симпатического отдела АНС, но и включенность других нервно-гуморальных звеньев регуляции ССС (возможно гипоталамического и коркового уровней регуляции, гуморальные механизмы).
Проанализировав полученные результаты, мы пришли к целесообразности введения показателя суммарной степени воздействия (ССВ) того или иного вещества на сердечный ритм. ССВ складывается из суммы показателей RRNN, SDNN, CV, RMSSD, MxDMn, АМо, SI, EllSq, EllAs, LF и HF, выраженных в относительных единицах к одноименным показателям в исходном состоянии (принятых за единицу), деленной на число используемых для определения ССВ показателей:
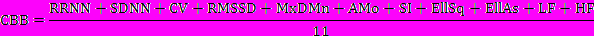
Такие показатели, как Mn и Мх, ЧСС и Мо, LF% и HF% исключили из определения ССВ в связи с тем, что они отражают разнонаправленные одинаковые изменения, ТР – сумму LF и HF и LF/HF (уже является коэффициентом).
По нашему мнению, если значение показателя меньше единицы, это соответствует активации симпатического отдела АНС и катехоламинергической системы, а если больше единицы – активации парасимпатического отдела.
Таким образом (рис. 10), при длительном применении адреноблокаторов влияние на сердечный ритм отличается от влияния при однократном их воздействии на организм как стрессированных, так и наркотизированных животных. Если при однократном воздействии сильнее влияли на ВСР высокоселективные 1-адреноблокаторы, такие как бисопролол и метопролол, то при их длительном использовании на организм дезадаптированных крыс эти вещества, наоборот, менее всего влияли на сердечный ритм. Тогда как неселективный пиндолол с ВСМА и среднеселективный водорастворимый атенолол вызывали наибольшие изменения в ВСР.
Применение -адреноблокаторов привело к изменению СОК и МОК. СОК у интактных крыс составил 0.520.042 мл, а МОК - 25016.9 мл/мин. У животных с ХСН эти значения были равными 0.310.031 мл/мин и 14113.2 мл/мин соответственно. Т.о., при развившейся дезадаптации произошло уменьшение СОК и МОК соответственно на 40.4 % и 43.4 % (p<0.001). У интактных стрессированных крыс -адреномиметик добутамин привел к увеличению СОК на 23.1 % (p<0.05), что согласуется с данными, полученными на человеке (Barletta, 2003).
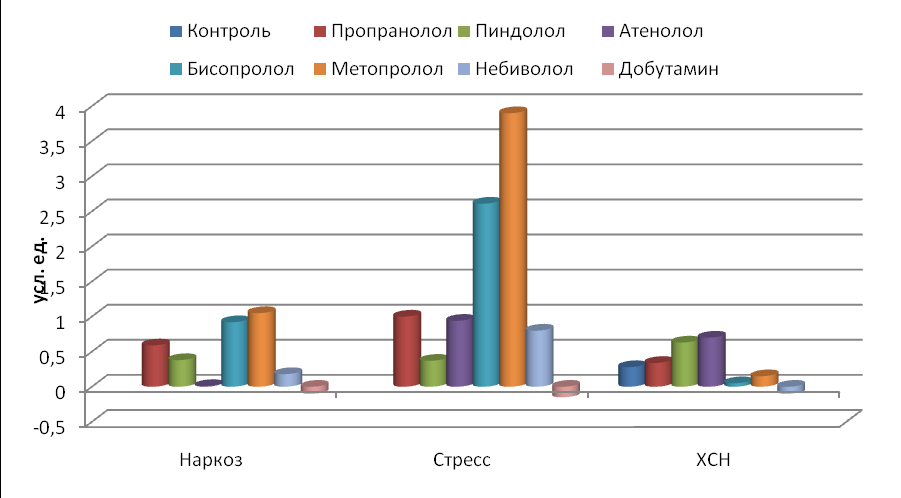
Рис. 10. Изменения суммарной степени воздействия (ССВ) препаратов на сердечный ритм у животных по отношению к исходному состоянию (ССВ=1.0).
-адреноблокаторы мало воздействовали на СОК и МОК (p>0.05) интактных крыс. При длительном применении блокаторов адренорецепторов у животных при дезадаптации (ХСН) неселективные пропранолол и пиндолол с ВСМА и низкоселективный атенолол привели к незначительному повышению СОК и МОК (пиндолол МОК даже несколько уменьшил) по сравнению с контрольными крысами с ХСН. Но все равно эти параметры остались существенно ниже, чем у интактных животных (p<0.05). Напротив, высокоселективные бисопролол, метопролол и небиволол с вазодилатирующей активностью существенно повысили СОК и МОК по сравнению с контрольными животными (СОК в среднем на 41.7 %, МОК – на 41.5 %, p<0.05), и эти показатели практически перестали отличаться от таковых у интактных крыс. Таким образом, длительное воздействие -адреноблокаторов на организм дезадаптированных крыс было более выраженным, чем на организм крыс при однократном их воздействии.
