Павлова Росздрава Маликов А. Я. Уважаемый председатель, уважаемые члены комиссии позвольте Вам представить доклад
| Вид материала | Доклад |
- Уважаемый Фарид Хайруллович! Уважаемые Депутаты Государственного Совета Республики, 36.07kb.
- Уважаемый Николай Владимирович! Уважаемые члены Координационного совета! Позвольте, 96.55kb.
- Доклад по дипломной работе на тему: "Особенности деятельности транспортно-экспедиторских, 56.45kb.
- Михаила Владимировича Шестакова фцб «Развитие территорий» Слайд 1 Уважаемый Михаил, 64.6kb.
- А. И. Касьянова Государственный контроль и надзор за безопасностью движения поездов, 193.08kb.
- «Оценка кредитоспособности заемщика - юридического лица», 47.28kb.
- Уважаемый председатель и члены государственной аттестационной комиссии, уважаемые присутствующие, 48.89kb.
- Доклад руководителя Федерального агентства воздушного транспорта Юрчика Александра, 260.05kb.
- Слайд приветствие добрый день, уважаемый Валерий Александрович, уважаемые члены Правительства, 377.77kb.
- Уважаемый председатель и члены государственной аттестационной комиссии!, 20.63kb.
Доклад
руководителя Отдела доклинических и клинических исследований лекарственных средств и медицинской техники ГОУВПО СПбГМУ им. акад. И.П. Павлова Росздрава Маликов А.Я.

Уважаемый председатель, уважаемые члены комиссии позвольте Вам представить доклад об опыте проведения клинических исследований лекарственных средств СПбГМУ им. акад. И.П. Павлова. Хотелось бы с самого начала подчеркнуть, что клинические исследования это только часть, пусть и весьма значительная, нашей работы. В тему моего доклада сегодня не вошли доклинические исследования ЛС, статистическая и этическая экспертиза всех научных, в том числе и диссертационных, работ, работа с новыми технологиями и многое другое, чем занимается Университет и наш отдел в частности.
В 2004 году в Университете стартовало 70 международных, мультицентровых клинических исследований ЛС. Одномоментно у нас проходит более 100 клинических исследований.
Я хотел бы выделить несколько моментов, приведших к такому показателю.
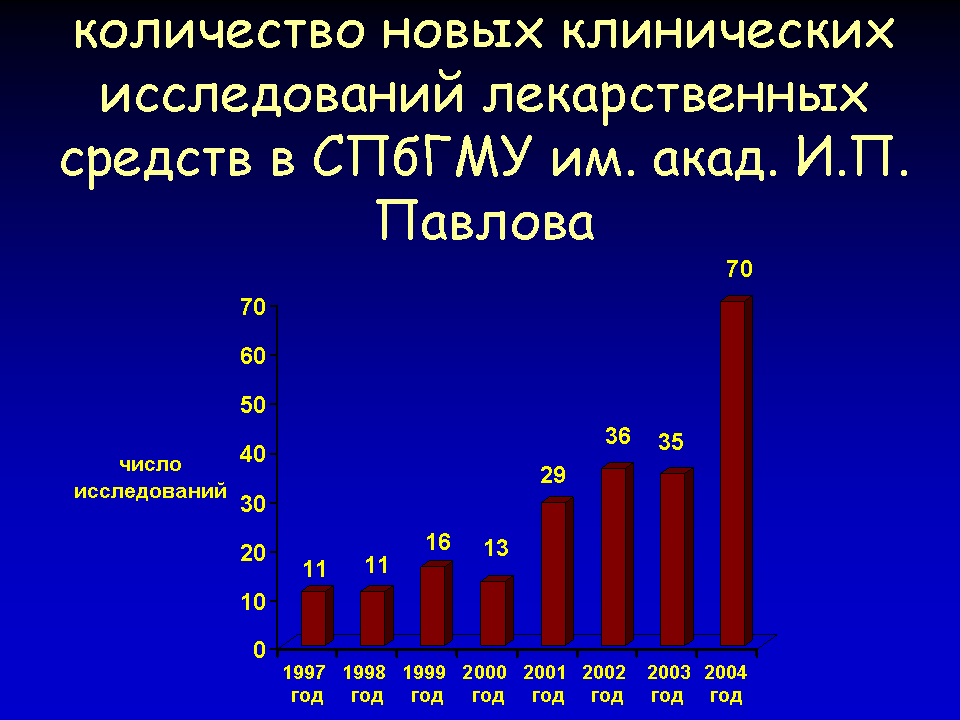

На последних двух пунктах я хотел бы остановиться более подробно.
Нормативная база проведения КИ в Университете включает:

Инструкцию по проведению клинических исследований лекарственных средств в подразделениях СПбГМУ им. акад. И.П. Павлова регламентирующую порядок проведения исследований, взаимодействие различных подразделений. Инструкции о порядке утилизации неиспользованных в ходе клинического исследования лекарственных средств и инструкция о порядке архивирования документов клинических исследований. Положение о внебюджетной деятельности – регламентирует порядок расходования полученных за проведение исследования денежных средств.
Системный подход заключается в отработанном взаимодействии различных задействованных в исследовании структур:

Прежде чем перейти к рассказу обо всех задействованных подразделениях, позвольте мне представить общую схему инициации исследования у нас в Университете.
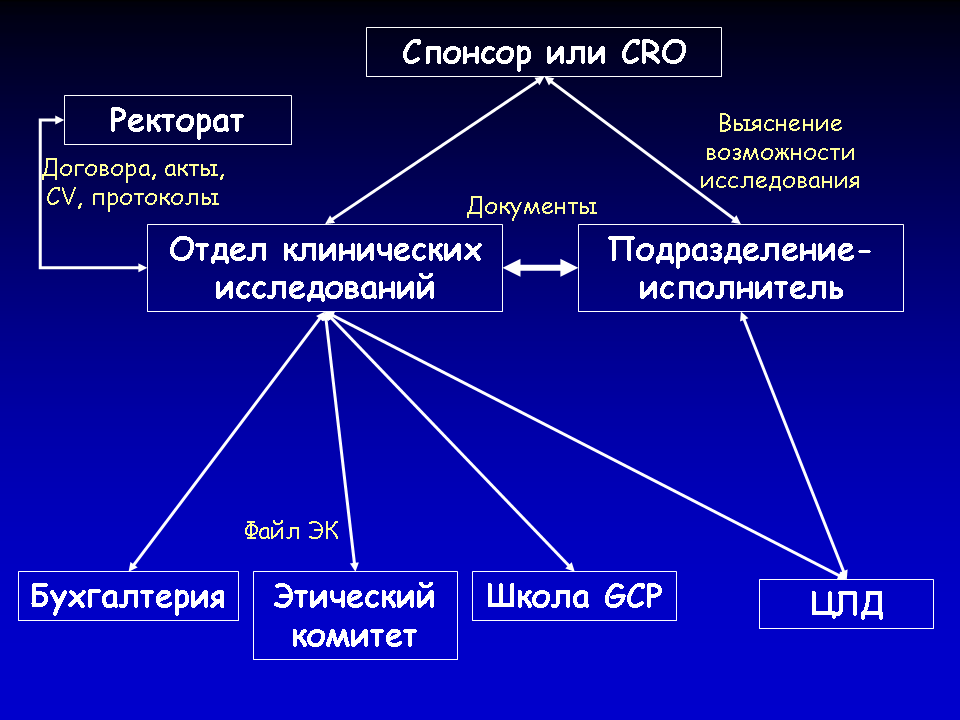
Чаще всего фирма-заказчик исследования, имея опыт работы с конкретной кафедрой, выясняет возможность проведения исследования в данном подразделении и заручившись поддержкой главного исследователя обращается с заявкой в отдел клинических исследований. Если спонсор исследования не работал раньше с Университетом, он может обратиться в отдел клинических исследований, где ему помогут подобрать исследовательский центр с учетом всех возможных пожеланий. Спонсор готовит пакет документов, передает его главному исследователю. Главный исследователь заполняет форму заявки, разработанную нами, и с направительным письмом передает в отдел клинических исследований. В отделе оценивается комплектность файла, наличие разрешительных документов, после чего файл передается в Этический комитет. После одобрения этическим комитетом проведения исследования пакет документов, содержащий протокол, договор и резюме на главного исследователя передается отделом на утверждение ректору. После утверждения ректором этих документов исследование считается начавшимся. В ходе проведения исследования исследователь подает на рассмотрение в Этический комитет все поправки и новые версии документов, отчеты о серьезных нежелательных явлениях, промежуточные и итоговые отчеты.
Теперь немного подробнее о каждом подразделении:
1.

Отдел клинических исследований создан в конце 2000 года с целью организации, координации, осуществления методического руководства и контроля за проведением исследований. В задачи отдела были включены такие пункты как разработка нормативной базы проведения исследований в рамках Университета, организация обучения сотрудников правилам GCP, взаимодействие с регулирующими структурами и фирмами-заказчиками, взаимодействие с Этическим комитетом, контроль за проведением исследований. А также развитие системы проведения доклинических и клинических исследований в Университете в целом. Все поставленные задачи с успехом выполняются.
2.

Подразделения, проводящие исследования. В лицензию на право проведения клинических исследований, выданную в 2000 году были включены 42 клинические базы Университета. В каждом подразделении по согласованию с руководителем подразделения был назначен сотрудник, ответственный за проведение КИ. Список этих сотрудников был утвержден ректором. Хочется отметить высокий профессионализм наших исследователей, который подтверждался в ходе многочисленных аудитов и инспекций FDA.
3.

Этический комитет. Создан в марте 2001 года. Положение и стандартные операционные процедуры комитета полностью соответствуют международным нормам и правилам. В настоящее время проведено 53 заседания Этического комитета. ЭК рассматривает все документы по доклиническим и клиническим исследованиям, а также диссертационные работы. Этическое сопровождение исследований включает не только первоначальное рассмотрение документов, но и постоянный контроль за проведением исследования – рассмотрение всех изменений, вносимых в документы, сообщений о серьезных нежелательных явлениях., промежуточных и итоговых отчетов. Лишним доказательством авторитета и профессионализма работы ЭК является тот факт,

что некоторые медицинские учреждения нашего города обращаются к нам с просьбой включить их в перечень учреждений подотчетных нашему ЭК или помочь с организацией своих ЭК.
4.

Школа качественной клинической практики. Одним из важнейших элементов, обеспечивающих качество данных, получаемых в центрах, является квалификация исследователей. Исследователь может прекрасно знать свою медицинскую область, но из-за недостаточного знания правил GCP допускать различные ошибки и отклонения от протокола. Задачу обучения молодых исследователей правилам проведения КИ решает созданная в 2003 году школа GCP. В настоящее время проведено 3 школы. Обучение прошли 54 человека. Слушатели, успешно закончившие школу получили свидетельство о повышении квалификации государственного образца. Хочу подчеркнуть, что обучаться в школе GCP могут не только сотрудники Университета, но и все желающие.
5.

Центр лабораторной диагностики. Не менее важным в ходе большинства исследований является обеспечение проведения достоверных и своевременных лабораторных анализов. И если большинство анализов в ходе проведения КИ выполняются в центральных лабораториях, то все скрининговые анализы, как правило, выполняются в локальных лабораториях. А ведь на основании именно этих анализов зачастую принимается решение о включении пациентов в исследование. Поэтому весьма часто перед включением пациента его анализы перепроверяются центральными лабораториями. Оптимальное функционирование лабораторной службы позволяет избежать расходов, связанных с несоответствием данных центральных и локальных лабораторий. Особенностями нашего центра лабораторной диагностики является:
- Единый комплекс всей лабораторной службы
- Более 800 определяемых параметров
- Наличие единой компьютеризированной лабораторной системы Lab Track, позволяющей отслеживать каждую пробирку в любой момент времени и находить за минуту результаты анализов пациентов, обращавшихся год назад.
- Участие в международных системах внешнего контроля качества
- Единая система управления качеством, включающая лабораторию контроля качества, подчиненную непосредственно директору центра.
В настоящее время идет работа по подготовке к сертификации по ИСО 9000
- Координация работы бухгалтерии, планово-финансового отдела и исследовательских подразделений, осуществляемая отделом клинических исследований позволяет упростить работу исследовательских подразделений, создать систему одного окна. В то же время хочу подчеркнуть, что исследователь остается свободен в своем праве тратить заработанные им деньги по своему усмотрению.
В то же время существуют определенные проблемы и направления для развития.
Большинство ММКИ проходящих у нас в стране в незначительной области задействуют интеллектуальный потенциал наших исследователей. Наши ученые почти всегда оказываются на положении исполнителей чужих замыслов. Данные, полученные ими обрабатываются, как правило, за рубежом. Говоря о нашем Университете – у нас имеется прекрасная лаборатория биостатистики, лицензионное программное обеспечение - SPSS, определенный опыт обработки результатов КИ. К сожалению, пока это не очень востребовано компаниями - спонсорами и CRO. В то же время имеется опыт работы с грантами NIH, когда наши ученые сами пишут программы КИ, обрабатывают результаты исследований.
Также, на мой взгляд, мало используется наша лаборатория фармакокинетики, хотя у нас есть все возможности для проведения фармакокинетических исследований, в том числе и современное импортное оборудование для высокоэффективной жидкостной хроматографии. Думаю, в будущем все эти ресурсы будут более востребованы заказчиками исследований, и проведение клинических исследований будет способствовать дальнейшей интеграции наших исследователей в большую мировую науку.

