Рабочая программа дисциплины «кристаллохимия полупроводников»
| Вид материала | Рабочая программа |
СодержаниеТребования к уровню освоения курса CsCl. Кристаллы с решеткой поваренной соли. Производные структуры NaCl. III. Распределение часов курса по темам и видам работ |
- Рабочая программа дисциплины «физическое материаловедение полупроводников-1», 98.52kb.
- Составил Усенко Александра Евгеньевна 2011 г рабочая программа, 183.1kb.
- Программа Государственного экзамена по подготовке магистра по направлению «Физика полупроводников., 53.9kb.
- Рабочая программа учебной дисциплины ф тпу 1 -21/01, 102.93kb.
- Рабочая программа, программа дисциплины по дисциплине Культура Китая Аббревиатура специальности, 300.02kb.
- Рабочая программа, программа дисциплины история российско-китайских отношений аббревиатура, 505.79kb.
- Н. И. Лобачевского Физический факультет Кафедра физики полупроводников и оптоэлектроники, 109.99kb.
- Рабочая учебная программа (Syllabus) дисциплины Наименование дисциплины: социальная, 372.74kb.
- Рабочая программа дисциплины Культурология опд. 00 Общепрофессиональные дисциплины, 478.45kb.
- Рабочая программа дисциплины «уголовное право» рабочая программа дисциплины, 543.84kb.
РАБОЧАЯ ПРОГРАММА ДИСЦИПЛИНЫ
«КРИСТАЛЛОХИМИЯ ПОЛУПРОВОДНИКОВ»
Томск – 2005
I. Oрганизационно-методический раздел
- Цель курса
Цель настоящего спецкурса – ознакомить студентов с основами квантовой теории химической связи в твердых телах.
Спецкурс базируется на следующих курсах: квантовая механика, физика твердого тела, физика полупроводников, теория групп, физическая химия.
- Задачи учебного курса
Показать взаимосвязь структуры и свойств полупроводников и других твердых тел с химическими свойствами составляющих атомов. Особое внимание уделяется полупроводниковым кристаллам с алмазоподобной структурой.
- Требования к уровню освоения курса
После изучения курса студенты должны знать основные типы химической связи и их описание на основе квантовой механики, понимание связи между свойствами твердых тел и положением атомов, их образующих, в ПСЭ.
II. Содержание курса
- Темы и краткое содержание
| № | Тема | Содержание |
| | Введение | |
| | Структура электронных оболочек атомов | Атом водорода. Квантовые числа. Радиальные и угловые функции. Многоэлектронные атомы. Электронные оболочки. Электронная конфигурация атомов. Вырождение. Правило Хунда. Корреляционное взаимодействие. Периодическая система Д.И. Менделеева Энергия ионизации. Сродство к электрону. Атомные радиусы |
| | Природа химической связи. Принципы квантово-механического моделирования | Феноменологическое описание.. Энергия связи в приближении Борна - Оппенгеймера. Расчет молекулы водорода по методу Гайтлера - Лондона. Свойства химической связи в молекуле водорода. Метод валентных связей. Спиновая валеность атомов. Приближение молекулярных орбиталей. Молекула водорода. Связывающие и разрыхляющие орбитали. Одноэлектронные, двухэлектронные и трехэлектронные связи |
| | Особенности химической связи на примере простейших молекул | Двухатомные молекулы с одинаковыми атомами. Запреты, обусловлынные симметрией. 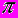 - и - и 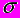 - связи. Кратные связи. Гетерополярные двухатомные молекулы. Ионность связи. Описание возникновения ионности в приближении молекулярных орбиталей. Понятие электроотрицательно-сти. Шкала электроотрицательности по Полингу. Пространственная структура сложных молекул и гибридизация атомных орбиталей. Примеры - связи. Кратные связи. Гетерополярные двухатомные молекулы. Ионность связи. Описание возникновения ионности в приближении молекулярных орбиталей. Понятие электроотрицательно-сти. Шкала электроотрицательности по Полингу. Пространственная структура сложных молекул и гибридизация атомных орбиталей. Примеры |
| | Типы химической связи | Ковалентные связи. Ионные связи. Ван-дер-Ваальсовы связи. Водородные связи, их роль в химии органических соеденений. Металлическая связь |
| | Химическая связь и структура кристаллов | Структура и химическая связь в простых металлах. Переходные и редкоземельные металлы. Кристаллы элементов IIIA - группы. Различные модификации углерода: алмаз, графит, карбин, молекулярные кристаллы на основе С 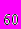 и др. Другие кристаллы IVA - группы. Особенности химических связей и кристаллической структуры элементов VA - группы. Структура молекуляр-ных кристаллов кислорода и серы. Цепочечные структуры селена и теллура. Молекулярные кристаллы элементов VIIA - группы. и др. Другие кристаллы IVA - группы. Особенности химических связей и кристаллической структуры элементов VA - группы. Структура молекуляр-ных кристаллов кислорода и серы. Цепочечные структуры селена и теллура. Молекулярные кристаллы элементов VIIA - группы. Химическая связь в кристаллах, состоящих из нескольких сортов атомов. Ионные кристаллы с решеткой CsCl. Кристаллы с решеткой поваренной соли. Производные структуры NaCl. Cоединения типа А 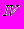 B B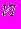 cо структурой NaCl. Химическая связь в структуре цинковой обманки и вюрцита. Производные структуры цинковой обманки: халькопирит, фаматенит, сверхструктуры. cо структурой NaCl. Химическая связь в структуре цинковой обманки и вюрцита. Производные структуры цинковой обманки: халькопирит, фаматенит, сверхструктуры. Твердые растворы соединений с решеткой цинковой обманки. Кислород-содержащие соединения. Кристаллы SiO2 |
| | Электронные состояния и химическая связь в алмазоподобных полупроводниках | Полуэмпирические методы решения задачи об энергетическом спектре электронов. Метод Хюккеля. Взаимодействие двух атомов. Гамильтониан алмазоподобного кристалла в методе Хюккеля. Проблема определения параметров. Параметры Харрисона. Приближение эквивалентных орбиталей. Расширенные связывающие орбитали. Структура энергетических зон. Изменение структуры энергетических зон при переходе от одноатомных кристаллов к двойным и тройным соединениям |
| | Некристаллические полупроводники | Классификация некристаллических материалов. Структура аморфных материалов. Особенности дефектов в аморфных веществах. Химическая связь и электронная структура некоторых аморфных полупроводников. Область применения |
Примерная тематика рефератов, курсовых работ
III. Распределение часов курса по темам и видам работ
| № пп | Наименование темы | Всего часов | Аудиторные занятия (час) | Самостоя-тельная работа | ||
| в том числе | ||||||
| лекции | семинары | лаборатор. занятия | ||||
| 1 | Введение | 2 | 2 | | | |
| 2 | Структура электронных оболочек атомов | 4 | 4 | | | |
| 3 | Природа химической связи. Принципы квантово-механического моделирования | 6 | 6 | | | 4 |
| 4 | Особенности химической связи на примере простейших молекул | 6 | 6 | | | 4 |
| 5 | Типы химической связи | 2 | 2 | | | |
| 6 | Химическая связь и структура кристаллов | 8 | 8 | | | 4 |
| 7 | Электронные состояния и химическая связь в алмазоподобных полупровод-никах | 4 | 4 | | | 2 |
| 8 | Некристаллические полупроводники | 2 | 2 | | | |
| | ИТОГО | 46 | 34 | | | 14 |
IV. Форма итогового контроля
Зачет
V. Учебно-методическое обеспечение курса
- Рекомендуемая литература (основная):
1. Бокий Г.Б. Кристаллохимия. М.:Наука, 1971, 400с.
2. Угай Я.А. Общая химия. М.: Высш. шк., 1984. 440 с.
3. Коулсон Ч. Валентность. М.: Мир, 1965. 426 с.
4. Фларри Р. Квантовая химия М.: Мир, 1985. 472с.
5. Вест А. Химия твердого тела. М.: Мир, 1988. (В двух частях: ч.1 - 558 с., ч.2 - 336 с.)
- Фельц А. Аморфные и стеклообразные неорганические твердые тела. М.: Мир, 1986. 558 с.
- Минкин В.И., Симкин Б.Я. , Миняев Р.М. Теория строения молекул. Изд. «ФЕНИКС», Ростов-на-Дону, 1997, 557 с.
- Грибов Л.А., Муштакова С.П., Квантовая химия, М. Гардарикии, 1999, 390 с.
- Лаврентьева Л.Г. Периодическая система элементов (уч.пос.), Томск. Изд-во ТГУ, 2003, 55с.
- Лаврентьева Л.Г. Элементы кристаллохимии и осеновы кристаллохимической классификации материалов (уч. пос.), Томск, Изд-во ТГУ, 1987, 39с.
- Лаврентьева Л.Г. Основные физико-химические свойства элементарных полупроводников (уч.пос.), Томск, Изд-во ТГУ, 1987, 41с.
- Лаврентьева Л.Г. Основные физико-химические свойства сложных полупроводников (уч.пос.), Томск, Изд-во ТГУ, 1987, 39с.
- Рекомендуемая литература (дополнительная):
1. Ландау Л.Д., Лифшиц Е.М. Квантовая механика. М.: Наука, 1974. 752 с.
2. Левин А.А. Введение в квантовую химию твердого тела. М.: Химия, 1974. 240 с.
3. Кармелл Э., Фоулс Г.В.А. Валентность и строение молекул. М.: Химия, 1979. 360 с.
4. Харрисон У. Электронная структура и свойства твердых тел. М.: Мир, 1983. (В двух томах:
т.1 - 381 с., т.2 - 332 с.).
5. Физико-химические свойствап полупроводниковых веществ. Справочник. Коллектив авторов. М.: Наука, 1978, 340с.
6. Корнилов И.И., Матвеева Н.М., Пряхина Л.И., Полякова Р.С. Металлохимические свойства элементов периодической системы. Справочник. М. :Наука, 1966, 351с.
Автор
Чалдышев Виктор Александрович, к.ф.-м.н., доцент
