Разработка технологии дрожжевых обогатителей пищи на базе молочной сыворотки и растительного сырья
| Вид материала | Автореферат |
- Программа вступительных испытаний в магистратуру по направление 260100. 62 «Продукты, 46.1kb.
- Стандартизация и контроль качества лекарственного растительного сырья стандартизация, 613.27kb.
- Стандартизация и контроль качества лекарственного растительного сырья стандартизация, 615.33kb.
- Совет Министров Республики Беларусь постановляет: Утвердить прилагаемые: Программу, 535.9kb.
- Курсовая работа на тему: «Экстракционные препараты из лекарственного и растительного, 233.13kb.
- Инструкция по применению «Муки рыбной кормовой с добавлением растительного сырья» Описание, 17.05kb.
- Дарья Донцова, 3230.57kb.
- Веденеева Александра Сергеевна, проект «Разработка фитопрепарата антимикробного действия, 26.73kb.
- Планы лекций по органической химии для студентов 1 курса озо специальности «Продукты, 48.91kb.
- Правила промышленной безопасности для взрывопожароопасных производственных объектов, 1414.3kb.
*получен после экстракции витамина Е из пшеничных хлопьев
Результаты опытов по наращиванию биомассы дрожжей на различных твердых растительных субстратах и их композициях, увлажненных молочной сывороткой до 50-55%-й влажности показали (см. табл. 3), что оптимальными для этой цели являются сочетания твердого носителя с пористым разрыхляющим компонентом (вариант 21 и 22 в табл. 3), или же рыхлого формообразующего носителя с дополнительным источником легкодоступных ростовых веществ в соотношении 1:1 (варианты № 7, 11 в табл. 3). Наиболее продуктивным в условиях ТФФ показал себя штамм C. inconspicua А3.
2.2.3. Накопление дрожжевой биомассы в условиях ГФ
Естественной формой существования микроорганизмов в природе является иммобилизованное состояние [Costertton J.W. et al., 1995], поэтому для повышения выхода биомассы было предложено вносить в молочную сыворотку различные твердые растительные субстраты.
Жидкие гетерогенные среды, использованные нами в работе, условно можно разделить на 2 группы: с пористым компонентом и с крупами. Оптимальные значения рН для каждой дрожжевой культуры при развитии на средах данного типа оказались такими же, как и в случае ТФФ. Данные о влиянии содержания твердого пористого компонента на накопление клеток дрожжами суммированы в табл.4.
Таблица 4
Влияние введения твердого растительного компонента в питательную среду на основе кислой молочной сыворотки на накопление клеток дрожжами
| Субстрат | СВ*, % | Дрожжи | ||||
| Candida inconspicua | Debaryo-myces sp | Pichia sp | Torula sp | Candida famata | ||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 6 (контроль) | 0,440 | ед клетки | 0,640 | 0,390 | ед клетки | |
| Отруби | 7 | 0,500 | ед клетки | 0,700 | 0,500 | ед клетки |
| 8 | 0,800 | 0,350 | 0,740 | 0,500 | 0,200 | |
| 9 | 1,060 | 0,370 | 0,790 | 0,500 | 0,200 | |
| 10 | 1,200 | 0,420 | 0,800 | 0,520 | 0,460 | |
| 11 | 1,470 | 0,500 | 0,800 | 0,680 | 0,750 | |
| 12 | 1,500 | 0,520 | 0,890 | 0,700 | 1,110 | |
| 13 | 1,530 | 0,580 | 0,940 | 0,740 | 1,350 | |
| 14 | 1,300 | 0,300 | 0,380 | 0,500 | ед клетки | |
| Солодовые ростки | 7 | 0,450 | ед клетки | 0,650 | 0,400 | ед клетки |
| 8 | 0,570 | 0,050 | 0,680 | 0,400 | 0,130 | |
| 9 | 0,600 | 0,090 | 0,670 | 0,420 | 0,280 | |
| 10 | 0,600 | 0,130 | 0,690 | 0,420 | 0,510 | |
| 11 | 0,620 | 0,200 | 0,700 | 0,450 | 0,700 | |
| 12 | 0,700 | 0,230 | 0,720 | 0,480 | 0,730 | |
| 13 | 0,750 | 0,480 | 0,850 | 0,600 | 1,100 | |
| 14 | 0,700 | ед клетки | 0,800 | 0,530 | 0,980 | |
| Продолжение таблицы 4 | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Соломенная мука | 7 | 0,460 | ед клетки | 0,680 | 0,400 | ед клетки |
| 8 | 0,460 | 0,020 | 0,700 | 0,400 | 0,290 | |
| 9 | 0,500 | 0,090 | 0,710 | 0,420 | 0,330 | |
| 10 | 0,510 | 0,100 | 0,740 | 0,420 | 0,540 | |
| 11 | 0,500 | 0,110 | 0,740 | 0,470 | 0,800 | |
| 12 | 0,570 | 0,170 | 0,740 | 0,480 | 0,900 | |
| 13 | 0,600 | 0,200 | 0,760 | 0,520 | 0,960 | |
| 14 | 0,350 | ед клетки | 0,520 | 0,400 | 0,500 | |
| Пшеничный шрот | 7 | 0,560 | ед клетки | 0,650 | 0,430 | 0,200 |
| 8 | 0,620 | 0,120 | 0,700 | 0,480 | 0,250 | |
| 9 | 0,740 | 0,200 | 0,720 | 0,500 | 0,750 | |
| 10 | 0,760 | 0,290 | 0,800 | 0,500 | 0,750 | |
| 11 | 0,800 | 0,300 | 0,800 | 0,520 | 0,820 | |
| 12 | 0,930 | 0,350 | 0,850 | 0,600 | 0,930 | |
| 13 | 1,250 | 0,400 | 0,900 | 0,670 | 1,200 | |
| 14 | 0,690 | 0,300 | 0,760 | 0,500 | 0,830 | |
* сумма сухих веществ питательной среды, из которых 6% - СВ сыворотки, а остальные – СВ твердого растительного компонента.
Как видно из таблицы 4, выход дрожжевой биомассы увеличивается при увеличении содержания СВ в среде и достигает максимума при содержании СВ 13% (продуктивность возрастает по сравнению с контролем в среднем в 2 - 4 раза в зависимости от штамма), притом наибольшее количество клеток дрожжи накапливают при внесении в среду отрубей и пшеничного шрота. Как и в случае с ТФФ, наиболее продуктивным оказался штамм C. inconspicua А3.
Для обеззараживания питательных сред на основе молочной сыворотки и круп в результате проведенных исследований была выбрана пастеризация при 600С в течение 60 мин: подобная предобработка значительно снижает степень обсемененности посторонней микрофлорой и сравнительно малоэнергоемка (табл. 5).
Таблица 5
Влияние режима обработки питательной среды на основе молочной сыворотки и перловой крупы (25%СВ) на накопление клеток дрожжами Candida inconspicua
| Режим обработки | Степень набухания* | КМАФАнМ, КОЕ/см3 | РВ % | Крахмал % | Продуктивность, млрд кл/см3 | КМАФАнМ, КОЕ/см3 | ||
| По факту | СанПиН 2.3.2.1078-01 | По факту | СанПиН 2.3.2.1078-01 | |||||
| Пастеризация | 0,43 | 1·103 | не более 105 | 3,0 | 2,7 | 1,200 | 2,3·103 | не более 105 |
| Стерилизация | 0,80 | - | 8,9 | 8,1 | 0,100 | - | ||
| Заваривание | 0,67 | 104 | 5,1 | 4,6 | 0,570 | 1,5·105 | ||
*отношение фактически впитанной влаги к максимально возможной
Культивирование дрожжей C. inconspicua А3 на гетерогенных средах, содержащих молочную сыворотку и различные крупы, показало, что увеличение содержания СВ до 14% за счет добавления круп не стимулирует рост дрожжей. Возрастание продуктивности наблюдается при суммарном содержании СВ 15% и достигает максимума при 33%. На среде с перловой крупой дрожжи накапливают несколько больше клеток, чем с пшеничной (1,800 и 1,700 млрд кл/см3 соответственно), и на 20% больше, чем на среде с 13% СВ при добавлении отрубей (1,530 млрд кл/см3).
Одним из важнейших показателей пищевой ценности продукта является содержание белка. Поэтому определяли влияние внесения перловой крупы в питательную среду на основе молочной сыворотки на накопление клеток дрожжами C. inconspicua А3 и содержание белка в жидкой фазе (см. рис. 2).
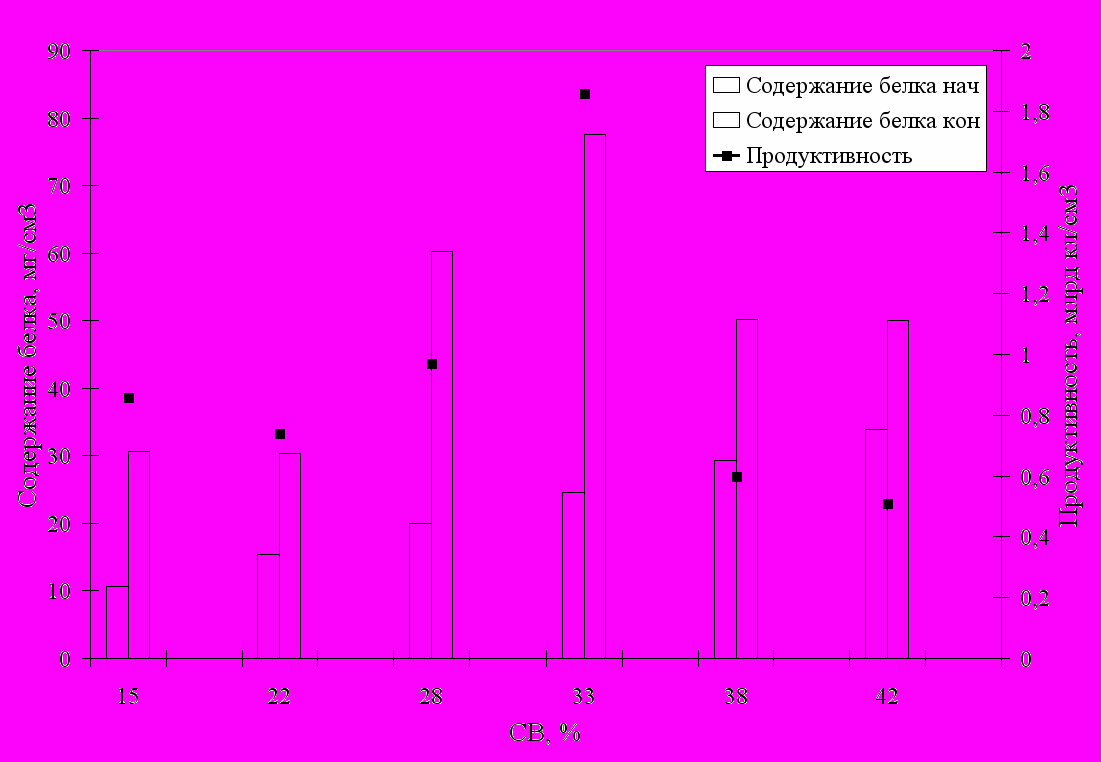
Рис. 2. Влияние внесения перловой крупы в питательную среду на основе молочной сыворотки на накопление клеток дрожжами C. inconspicua А3 и содержание белка в жидкой фазе.
Как видно из рис.2, содержание белка возрастает с увеличением количества дрожжевых клеток. Максимум накопления биомассы (1,860 млрд/см3) и наибольшее
содержание белка (77,53 мг/см3) наблюдается при содержании в среде 33% СВ. При этом содержание белка возрастает по сравнению с начальным более чем в 3 раза.
Следует отметить общую для всех вариантов гетерогенных сред на основе молочной сыворотки тенденцию снижения продуктивности дрожжей при достижении определенного содержания СВ в среде за счет введения твердого компонента: для пористых компонентов это 14%СВ, а для круп – 38%СВ.
Полученные данные (табл. 4, рис.2) полностью подтверждают высказанное выше предположение о стимулирующем влиянии твердых частиц на накопление биомассы (клеток) культурами дрожжей. Такой эффект, по-видимому, может быть в равной степени обусловлен как поступлением дополнительных питательных веществ из твердых субстратов, так и непосредственно иммобилизованным состоянием клеток. Таким образом, для культивирования дрожжей в условиях ГФ на молочной сыворотке представляется целесообразным внесение пористых растительных компонентов (отруби, пшеничный шрот) в количестве 13% СВ или круп в количестве 33% СВ.
2.2.3.1. Подбор и оптимизация состава питательных сред для культивирования дрожжей в условиях ГФ
Для того, чтобы полученная на молочной сыворотке дрожжевая биомасса по своему составу приближалась к молочному белку, в сыворотку вносят минеральные соли: сернокислый аммоний, двузамещенный фосфорнокислый калий, хлористый калий и мочевину [Храмцов А.Г., Нестеренко П.Г., 2004]. Внесение в среду 1,4-1,8 г/дм3 (NH4)2SO4 и 0,6 – 1,0 г/дм3 КН2РО4, в зависимости от штамма позволило увеличить содержание белка на 8-12%, а продуктивность – на 10-13%. Для штамма Candida inconspicua удалось повысить содержание белка до 86,87 мг/см3 и содержание клеток до 2,150 млрд/см3 путем внесения 1,8 г/дм3 сульфата аммония и 1,0 г/дм3 двузамещенного фосфорнокислого калия.
Подбор состава питательных сред (рН, концентрация солей и %СВ) выполнялся с достаточно большим шагом в исследуемом параметре, поэтому мы провели оптимизацию состава питательных сред с помощью метода аддитивно-решетчатого описания объекта. Оптимизация заключалась в выборе уровней каждого фактора, обеспечивающих наибольший эффект. Полученный в результате реализации этого метода состав питательных сред представлен в табл. 6.
Таблица 6
Оптимальный состав питательных сред для культивирования дрожжей в условиях ГФ, полученный реализацией метода аддитивно-решетчатого описания эксперимента
| Дрожжи | Концентрация круп, % CB | рН молочной сыворотки | Концентрация (NH4)2SO4, г/дм3 | Концентрация КН2РО4, г/дм3 |
| Сandida inconspicua | 31 | 4,5 | 1,6 | 1,0 |
| Debaryomyces sp | 31 | 4,5 | 1,8 | 0,8 |
| Pichia sp | 31 | 5,5 | 1,2 | 0,8 |
| Torula sp | 33 | 4,5 | 1,6 | 0,8 |
| Candida famata | 33 | 5,5 | 1,2 | 1,0 |
2.2.4. Определение состава и биологической ценности ДО
Важными показателями биологической ценности пищевых продуктов и различных БАД являются содержание белка, витаминов, пищевых волокон и др. БАВ. Критерием биологической ценности белка является его аминокислотный состав, особенно содержание тех аминокислот, которые находятся в нем в наименьшем количестве. В табл. 7 приведен состав молочной сыворотки и полученного на оптимизированной питательной среде дрожжевого обогатителя пищи на базе молочной сыворотки и перловой крупы с использованием штамма дрожжей C. inconspicua А3, а на рисунке 3 – аминокислотный состав исходной молочной сыворотки и ДО на ее основе.
Таблица 7
Состав молочной сыворотки и ДО на основе молочной сыворотки и перловой крупы
| № п/п | Показатель | Значение | |
| Молочная сыворотка | ДО | ||
| 1 | Титр дрожжевых клеток, 109 кл/см3 | - | 2,15 |
| 2 | Титруемая кислотность, 0Т | 60 | 89 |
| 3 | Лактоза, г/100 см3 | 3,5 | 1,05 |
| 4 | Глюкоза, мг/100 см3 | 70 | - |
| 5 | Галактоза, мг/100 см3 | 63 | - |
| 6 | Сахароза, мг/100 см3 | 200 | - |
| 7 | Белок, г/100 см3 | 0,88 | 8,7 |
| 8 | Витамины, мкг%: В2 В6 РР | 6,64 2,87 0,84 | 23,68 36,25 390,6 |
| 9 | Этиловый спирт, г/100 см3 | - | 0,92 |
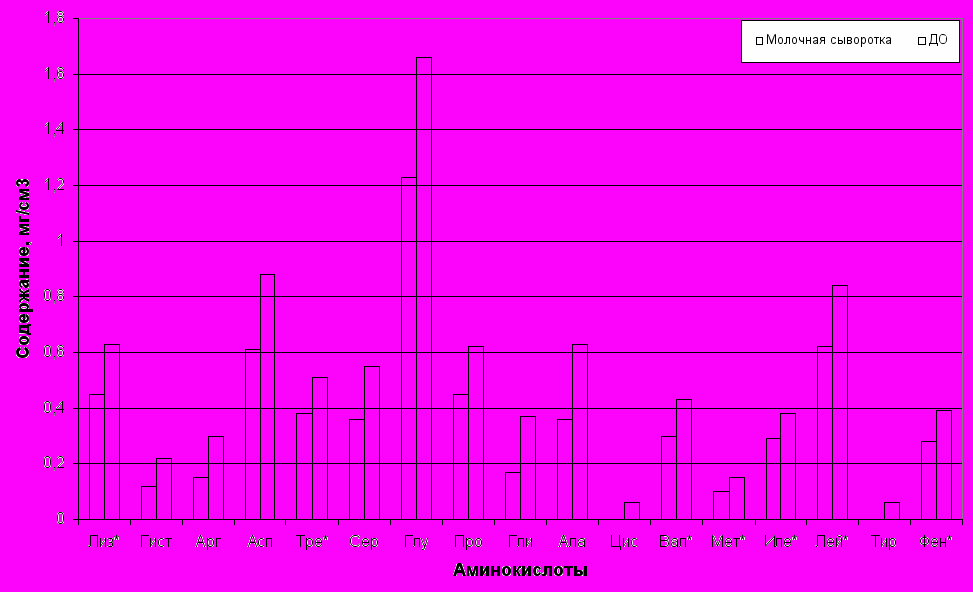
*- незаменимые аминокислоты
Рис. 3. Аминокислотный состав молочной сыворотки и ДО на основе молочной сыворотки и перловой крупы
Из рисунка 3 видно, что в процессе ферментации молочной сыворотки дрожжами Сandida inconspicua происходит увеличение содержания эссенциальных аминокислот. По метионину оно составляет 50%, по валину, лизину и фенилаланину – 40%, а по треонину, изолейцину и лейцину – немногим более 30%. Количество серусодержащих аминокислот (цистин, метионин) невелико в опытном образце, а цистин полностью отсутствует в контрольном. Ароматические аминокислоты представлены тирозином и фенилаланином, причем тирозин отсутствует в исходной молочной сыворотке. Содержание таких аминокислот как серин, пролин, глутаминовая и аспарагиновая кислоты увеличилось в опытном образце по сравнению с контролем в среднем на 42%. Содержание аланина и аргинина возросло на 75 и 83,3 % соответственно, содержание аргинина и глицина – вдвое.
Следует отметить, что по процентному соотношению аминокислот белок полученного ДО мало отличается от исходного сывороточного белка, то есть качественный состав белка ДО близок к сывороточному белку, который является наиболее ценным по скору незаменимых аминокислот
На основании полученных результатов (табл. 7 и рис. 3) можно сделать вывод, что полученный ДО обладает свойствами, позволяющими придавать продуктам свойства лечебно-профилактических и диетических продуктов за счет белка, сбалансированного по аминокислотному составу, и высокого содержания витаминов группы В и РР.
2.2.5. Химический и микробиологический анализ ДО
Действующая нормативная документация предъявляет к молочной сыворотке и ее производным определенные требования по безопасности для потребителя [СанПиН 2.3.2.1078-01, ГОСТ 30178-96, ГОСТ 26927-86, ГОСТ Р 51301-99].
Результаты анализов (табл. 8) и проведенные исследования острой токсичности, показавшие, что ДО относится к классу нетоксичных веществ, свидетельствуют о соответствии полученных ДО требованиям нормативно-технической документации. Таблица 8
Химические и микробиологические показатели полученного ДО
| Наименование | Фактическое значение | Единица измерения | Норматив |
| Токсичные элементы: ртуть мышьяк кадмий свинец | не обнаружен 0,007 не обнаружен 0,03 | мг/л | не более 0,005 не более 0,05 не более 0,03 не более 0,1 |
| Пестициды: ГХЦ ДДТ | не обнаружен не обнаружен | мг/л | не более 0,05 не более 0,05 |
| Радионуклиды: Cs-137 Sr-90 | 0,3 0 | Бк/кг | не более 100 не более 25 |
| КМАФАнМ | 2,3*103 | КОЕ/см3 | не более 2*105 |
| БГКП | не обнаружено | КОЕ/см3 | не доп. в 0,01 см3 |
2.2.6. Определение оптимальных параметров культивирования дрожжей в условиях ферментера
С целью масштабирования результатов, полученных в лабораторных условиях, а также для оценки влияния ряда факторов, таких как обеспеченность культуры кислородом, избыточное давление и регулирование активной кислотности среды на развитие дрожжевой культуры в условиях исследовательской лаборатории ОАО «Вимм-Билль-Данн» были проведены ферментации C. inconspicua А3 в ферментере объемом 40 дм3 с коэффициентом заполнения 0,5 при различных вариантах параметров культивирования (рис. 4). Полученные данные свидетельствуют, что наибольшая продуктивность в накоплении биомассы достигается при наилучшем обеспечении культуры кислородом за счет активного барботирования потоком воздуха (2 дм3/миндм3) и повышенном избыточном давлении (40 кПа), а эффективная стабилизация обсемененности остаточной бактериальной микрофлорой наблюдается при условиях, аналогичных выращиванию в колбах на качалке; при этом рН-статирование не обеспечивает дополнительного увеличения продуктивности дрожжей и стабилизации бактериальной обсемененности.
