Клиническая и морфо-функциональная характеристика опухолей, продуцирующих адренокортикотропный гормон 14. 00. 03 эндокринология 14. 00. 15 патологическая анатомия
| Вид материала | Автореферат |
- Рабочая программа учебной дисциплины патологическая анатомия, клиническая патологическая, 480.03kb.
- Примерная программа наименование дисциплины Патологическая анатомия, клиническая патологическая, 594.5kb.
- 155 Патологическая анатомия опухолей мягких тканей, 5.21kb.
- Общая патологическая анатомия, 283.39kb.
- Патологическая анатомия и дифференциальная диагностика рака большого сосочка двенадцатиперстной, 388.21kb.
- Основные механизмы нарушений в эндокринной системе, 1046.92kb.
- Примерная программа по дисциплине патологическая анатомия для аттестации на категорию., 363.01kb.
- Ф-программа вступительного экзамена в аспирантуру Утверждаю, 254.47kb.
- Морфологические и иммуногистохимические особенности опухолей человека с мутацией рецептора, 353.37kb.
- Патологическая анатомия это медико-биологическая наука, изучающая структурные и морфологические, 1590.52kb.
норма
пг/мл
нмоль/л
нмоль/суткил


норма
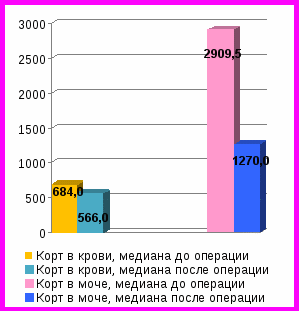
Рис. 2. Динамика уровней АКТГ и кортизола в крови, свободного кортизола в моче у пациентов без ремиссии БИК до и после удаления кортикотропином
У 6 пациентов с активной фазой БИК, а так же у троих с неполной ремиссией заболевания результаты малой пробы с дексаметазоном были отрицательными. У 5 больных во время ремиссии МПД оказалась положительной, однако после развития рецидива во всех случаях МПД стала отрицательной.
При сравнении объема кортикотропином до операции у больных с рецидивом БИК и без него статистических значимых различий не найдено (р=0,8), при том, что медиана объема аденом у больных с ремиссией была больше медианы объема опухолей у пациентов без ремиссии заболевания (175,7 мм3 и 152,2 мм3, соответственно). Так же не выявлено отличий в указанных группах по количеству микро- и макроаденом, эндоселлярных и эндо-экзоселлярных опухолей (р=0,8 и р=0,9 соответственно). Однако в группе больных с ремиссией БИК отсутствует распространение опухолевой ткани в кавернозные синусы в отличие от пациентов без ремиссии заболевания.
Динамическое МР-исследование головного мозга показало, что у 6 (40%) пациентов за период времени от 7 месяцев до 2 лет после нейрохирургического вмешательства были повторно выявлены опухоли гипофиза (5 эндоселлярных микроаденом и 1 эндопараселлярная макроаденома) у 3 больных с рецидивом заболевания и 3 с активной фазой. У 4 (26,7%) пациентов в течение 6 месяцев – 1,4 года после операции наблюдали очаги дополнительной ткани в турецком седле, у 2 из которых они находились в правом кавернозном синусе (у 3 больных с неполной ремиссией, у 1 больного с активной фазой заболевания). У двух (13,3%) пациенток в исходе аденомэктомии за период времени от 1,5 до 3 лет наблюдали ПТС с очагами дополнительной ткани в турецком седле и с односторонним распространением в кавернозные синусы (у одной из пациенток диагностирована неполная ремиссия БИК, у другой – рецидив заболевания). Диффузная неоднородность в структуре аденогипофиза вывялена у 2 (13,3%) пациентов после нейрохирургиечского лечения в течение 6 месяцев – 4 лет (у одного из них наблюдалась активная фаза БИК, у другого – рецидив заболевания). У одной (6,7%) больной диагностирована очаговая неоднородность структуры аденогипофиза, у которой сохранялась активная фаза заболевания через 1 год после удаления опухоли.
Гистологическая и иммуногистохимическая характеристика АКТГ-продуцирующих опухолей гипофиза (кортикотропином)
В таблице 1 отражена сравнительная характеристика кортикотропином у пациентов с ремиссией и без ремиссии заболевания по тинкториальным свойствам, наличию очагов некроза, кровоизлияний, отека стромы, а так же митозам, ангиоматозу и гиперплазии аденогипофиза.
Таблица 1. Особенности морфологии кортикотропином
у пациентов с ремиссией и без ремиссии БИК
| Признак | Кортикотропиномы у больных с ремиссией БИК, n=31 (%) | Кортикотропиномы у больных без ремиссии БИК, n=15 (%) | р, χ2 с поправ-кой Йетса |
| Базофильные клетки Смешанные клетки Хромофобные клетки Оксифильные клетки | 18 (58,0) 10 (32,3) 2 (6,5) 1 (3,2) | 6 (40,0) 9 (60,0) 0 0 | 0,4 0,14 0,8 0,7 |
| Некроз | 16 (51,6) | 10 (66,7) | 0,5 |
| Кровоизлияния | 9 (29,0) | 6 (40,0) | 0,7 |
| Отек | 8 (25,8) | 3 (20,0) | 0,9 |
| Митозы | 8 (25,8) | 3 (20,0) | 0,9 |
| Ангиоматоз | 3 (9,7) | 3 (20,0) | 0,6 |
| Гиперплазия клеток аденогипофиза | 5 (16,1) | 3 (20) | 0,5 |
Примечание: митотический индекс был от 1,2 до 8,7 с медианой равной 2.
Таким образом, в кортикотропиномах из обеих групп имелись клетки с различной окраской с преобладанием базофильно-клеточных опухолей, однако статистический анализ не установил различий ни одного из видов клеток в исследуемых группах аденом. Частота встречаемости некроза, кровоизлияний, отека, митозов, ангиоматоза и гиперплазии аденогипофиза в группах АКТГ-секретирующих опухолей гипофиза у пациентов с ремиссией и без ремиссии БИК не отличалась.
Распределение кортикотропином в зависимости от гормональной экспрессии представлено в таблице 2.
Таблица 2. Распределение кортикотропином по результатам иммуноэкспрессии тропных гормонов
| Экспрессия гормонов | Кортикотропиномы у больных с ремиссией БИК, n=31 | Кортикотропиномы у больных без ремиссии БИК, n=15 |
| Моногормональная | АКТГ, n=16 (51,6%) | АКТГ, n=6 (40,0%) |
| Бигормональная | Всего, n=10 (32,3%): АКТГ-ПРЛ, n=7 АКТГ-ФСГ, n=1 АКТГ-СТГ, n=1 АКТГ-ЛГ, n=1 | Всего, n=5 (33,3%): АКТГ-СТГ, n=3 АКТГ-ЛГ, n=2 |
| Полигормональная | Всего, n=5 (16,1%): АКТГ-СТГ-ПРЛ, n=2 АКТГ-СТГ-ПРЛ-ФСГ, n=1 АКТГ-СТГ-ЛГ-ФСГ, n=1 АКТГ-ПРЛ-ЛГ-ФСГ, n=1 | Всего, n=4 (26,7%): АКТГ-СТГ-ПРЛ, n=2 АКТГ-СТГ-ПРЛ-ЛГ-ФСГ, n=1 АКТГ-ПРЛ-ЛГ, n=1 |
Примечание: на кортикотропиномах ИГХИ с антителами к КРГ не проводили.
У всех пациентов при исследовании уровней гормонов в крови был повышен только АКТГ. Особенностей клинической картины в период манифестации заболевания, секреции АКТГ и кортизола на фоне БПД и периферического теста с ДП, тинкториальных свойств кортикотропином в зависимости от экспрессии различных гормонов гипофиза не установлено.
ИГХИ по методике двойного окрашивания подтвердило результаты исследования с применением 1 антитела на одном срезе и выявило клетки, экспрессирующие различные гормоны на одном срезе в одной и той же опухоли. При анализе частоты встречаемости моно- (р=0,8), би- (р=0,8) и полигормональных (р=0,4) опухолей среди кортикотропином у пациентов с ремиссией и без ремиссии БИК достоверных отличий не установили.
Экспрессия Ki-67 была установлена в 30 (96,8%) кортикотропиномах у больных с ремиссией БИК. Индекс метки этого маркера составлял от 0,07% до 0,24% с медианой на уровне 0,13%. В пределах 0,1 – 0,16% находились 25 – 75% процентили.
Экспрессия Ki-67 была выявлена во всех кортикотропиномах у больных без ремиссии БИК. Индекс метки этого маркера составлял от 0,08% до 0,46% с медианой на уровне 0,16%. В пределах 0,12 – 0,3% находились 25 – 75% процентили. Индекс метки Ki-67 был достоверно больше именно в опухолях у больных без ремиссии БИК (р=0,02).
Распределение кортикотропином, в которых была установлена экспрессия маркера клеточной адгезии и факторов ангиогенеза, представлено в таблице 3.
Таблица 3. Распределение кортикотропином в зависимости от экспрессии галектина-3, CD31 и VEGF
| Маркеры | Кортикотропиномы у больных с ремиссией БИК, n=31 (%) | Кортикотропиномы у больных без ремиссии БИК, n=15 (%) | р, χ2 с поправ-кой Йетса |
| Галектин-3 | 5 (16,1) | 5 (33,3) | 0,07 |
| CD31 | 14 (45,1) | 10 (66,7) | 0,3 |
| VEGF | 12 (38,7) | 6 (40,0) | 0,7 |
Иммуноэкспрессия РС 1-5 подтипов и РД2 обнаружена с различной частотой во всех кортикотропиномах. Результаты определения частоты экспрессии различных подтипов рецепторов в кортикотропиномах в зависимости от исхода заболевания после операции представлены в таблице 4.
Таблица 4. Экспрессия РС и РД2 в кортикотропиномах
| Тип и подтип рецепторов | Кортикотропиномы у больных с ремиссией БИК, n=12 (%) | Кортикотропиномы у больных без ремиссии БИК, n=9 (%) | р, χ2 с поправ-кой Йетса |
| РС 1 РС 2 РС 3 РС 4 РС 5 | 7 (58,3) 2 (16,7) 7 (58,3) 6 (50,0) 3 (25,0) | 5 (55,6) 4 (44,4) 4 (44,4) 3 (33,3) 3 (33,3) | 0,9 0,2 0,5 0,4 0,7 |
| РД2 | 3 (25,0) | 3 (33,3) | 0,7 |
Примечание: ИГХИ с антителами к РС 1-5 и РД2 было выполнено в 21 кортикотропиноме.
В ряде кортикотропином из обеих групп отмечена коэкспрессия двух и более подтипов РС и РД2. Результаты анализа коэкспрессии РС и РД2 показаны в таблице 5.
Таблица 5. Экспрессия одного и более подтипов РС и РД2 в кортикотропиномах
| Экспрессия подтипов РС и РД2 | Кортикотропиномы у больных с ремиссией БИК, n=12 (%) | Кортикотропиномы у больных без ремиссии БИК, n=9 (%) |
| РС, один подтип РС, два подтипа РС, три подтипа РС, четыре подтипа РС, пять подтипов | 2 (16,7) 7 (58,3) 1 (8,3) 0 1 (8,3) | 1 (11,1) 6 (66,7) 1 (11,1) 1 (11,1) 0 |
| РС различных подтипов и РД2 | 3 (25,0) | 3 (33,3) |
Клиническая картина, данные лабораторных и инструментальных методов обследования пациентов с АКТГ - эктопическим синдромом
Основная клиническая симптоматика у больных с АКТГ-ЭС и БИК в целом была сходная: пациенты с АКТГ-ЭС так же жаловались на увеличение массы тела с диспластичным ожирением (83,3%), гиперпигментацию кожи (77,8%), багровые стрии на коже передней брюшной стенки, плечах и бедрах (50,0%), отечность лица и стоп (50,0%), избыточный рост волос на лице, теле, конечностях (16,7%). Кроме вышеуказанных изменений выявлено повышение уровня артериального давления (72,2%), нарушение менструального цикла у женщин (20,0%). Однако в результате изучения клинической картины у пациентов с БИК и АКТГ-ЭС удалось выявить некоторые особенности. У больных с АКТГ-ЭС чаще встречалась меланодермия (в 94,4%), причем оттенок кожи был от дымчатого до черного. У больных с БИК этот симптом встречался реже – в 13% и с меньшей интенсивностью. Мышечная слабость проксимальных отделов конечностей была более выражена и чаще встречалась у пациентов с АКТГ-ЭС – в 44,4% (при БИК – в 23,9%). Некоторых пациентов с БИК (6,5%) отличало снижение остроты зрения, связанное со сдавлением хиазмы зрительного нерва.
В момент манифестации БИК и АКТГ-ЭС уровни АКТГ и кортизола в крови у больных с АКТГ-ЭС были достоверно выше, чем у больных с БИК. Медианы уровней АКТГ и кортизола в крови, кортизола в моче у пациентов АКТГ-ЭС и БИК показаны на рис. 3.
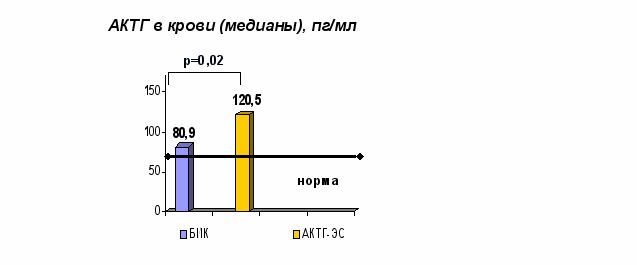
Кортизол в крови (медианы), нмоль/л
Кортизол в моче (медианы),
нмоль/сутки

р=0,0003
р=0,03
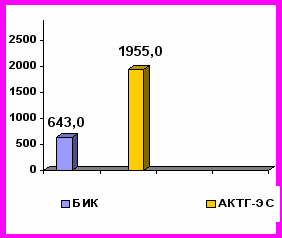
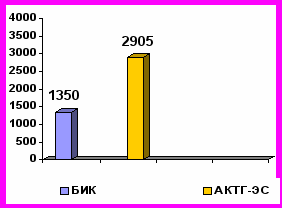


норма
норма


Рис. 3. Уровни АКТГ и кортизола в крови, свободного кортизола в моче у пациентов с БИК и АКТГ-ЭС в период манифестации заболеваний
Результаты малой пробы с дексаметазоном у всех пациентов были отрицательными. Большая проба с дексаметазоном оказалась отрицательной у 12 (66,7%) больных, у 6 (33,3%) – положительной.
После проведения периферического теста с десмопрессином у 13 из 14 больных зарегистрирован незначительный подъем уровней АКТГ. АКТГ вырос не более, чем в 1,5 раза от исходного с максимальным подъемом на 15 минуте после введения ДП (медиана максимального подъема была 75%). У этих пациентов не было установлено увеличения содержания кортизола в крови. Исключение составил 1 больной, у которого был отмечен значительный подъем АКТГ с последующим ростом кортизола. Чувствительность и специфичность БПД при БИК и АКТГ-ЭС составила 78,7% и 66,7% соответственно, а те же диагностические характеристики для периферического теста с ДП достигли 71,4% и 92,9%. Реакция АКТГ и кортизола в крови у больных с положительным периферическим тестом с ДП у пациентов с БИК и отрицательным – с АКТГ-ЭС показана на рис. 4.
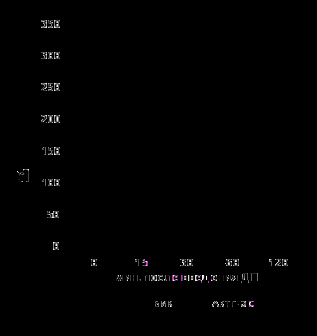
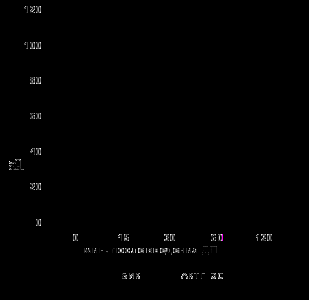
Рис. 4. Динамика уровней АКТГ и кортизола в крови (медиана+75%) на фоне введения десмопрессина у пациентов с БИК и АКТГ-ЭС
При топической диагностике с использованием МСКТ у 15 (83,3%) пациентов были выявлены объемные образования в легких. Из 10 опухолей в правом легком 1 локализовалась в верхней, 4 – в средней и 5 – нижней долях. В левом легком выявили 5 новообразований, из которых 2 были в верхней, 3 – в нижней долях. Все опухоли обнаружили в периферических отделах легких. У двух пациенток диагностировали объемное образование в вилочковой железе, еще у одной – в правой почке. Размеры опухолей составляли от 1,0 до 5,1 см в максимальном измерении, медиана 1,55 см. У одной пациентки с опухолью тимуса по данным МСКТ установлены метастазы в лимфатических узлах переднего средостения.
У всех пациентов данной группы после удаления опухолей с эктопической секрецией АКТГ к концу периода наблюдения диагностировали развитие ремиссии заболевания, у 15 из 18 больных развились клинические признаки недостаточности коры надпочечников, которым проводили заместительную гормональную терапию. После операции в период времени от 2 месяцев до 8 лет у 4 (22,2%) пациентов наблюдалось восстановление секреции глюкокортикоидов на основании клинико-лабораторных данных. Заместительная гормональная терапия этим больным была отменена.
К концу периода наблюдения (от 9 месяцев до 8 лет) в результате гормонального исследования крови в группе пациентов с ремиссией АКТГ-ЭС после удаления эктопических опухолей у всех больных отметили нормализацию уровней АКТГ и кортизола в крови и восстановление суточного ритма секреции этих гормонов. Сравнивая уровни АКТГ и кортизола в крови, кортизола в суточной моче у пациентов после удаления кортикотропином и эктопических АКТГ-продуцирующих опухолей было определено, что у больных без ремиссии БИК уровни этих гормонов оставались повышенными по сравнению с пациентами с ремиссией БИК и АКТГ-ЭС, у которых достоверных различий уровней АКТГ и кортизола не найдено. Изменения содержания гормонов у пациентов с БИК и АКТГ-ЭС после удаления опухолей показаны на рис. 5.
АКТГ в крови (медианы), пг/мл
р = 0,06
    р < 0,0001 р < 0,0001 р = 0,8 Кортизол в моче (медианы), нмоль/сутки Кортизол в крови (медианы), нмоль/л  норма | |
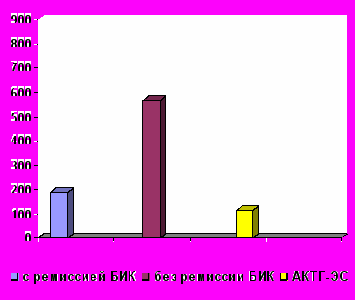 р < 0,0001    р = 0,0004 норма  | р < 0,0001 р = 0,005 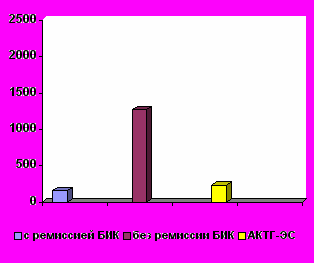 р < 0,0001 р = 0,5     норма  |
Рис. 5. Уровни АКТГ и кортизола в крови, свободного кортизола в моче у пациентов с БИК и АКТГ-ЭС после удаления опухолей
Для подтверждения нормального функционирования гипоталамо-гипофизарно-надпочечниковой системы всем пациентам выполняли МПД, в результате которой во всех случаях отмечен положительный результат.
После проведения динамической МСКТ ни у кого из больных данных за наличие эктопических опухолей или их продолженный рост, а так же распространение метастазов не получено.
Таким образом, данные клинического обследования и лабораторно-инструментальных методов показали динамические изменения у пациентов с АКТГ-ЭС до и после удаления эктопических опухолей и подтвердили наличие клинико-лабораторной ремиссии у всех этих больных. У пациентов с АКТГ-ЭС в период манифестации заболевания уровни АКТГ и кортизола в крови были достоверно выше, чем у пациентов с БИК (р=0,01 для АКТГ и р=0,001 для кортизола). После удаления АКТГ-секретирующих опухолей самые высокие уровни АКТГ и кортизола в крови, свободного кортизола в моче сохранялись у пациентов без ремиссии БИК (р<0,0001 для АКТГ и кортизола в крови, свободного кортизола в моче), тогда как содержание этих гормонов не отличалось у пациентов с ремиссией БИК и АКТГ-ЭС.
Гистологическая и иммуногистохимическая характеристика эктопических АКТГ-продуцирующих опухолей
При гистологическом исследовании большинство удаленных опухолей было представлено типичными и атипичными карциноидами (АК и ТК) и одним случаем мелкоклеточного рака легкого (МКРЛ). Гистологическая характеристика опухолей с эктопической продукцией АКТГ отражена в таблице 6.
