Морфологические и иммуногистохимические особенности опухолей человека с мутацией рецептора эпидермального фактора роста 14. 03. 02 Патологическая анатомия 14. 01. 12 Онкология
| Вид материала | Автореферат диссертации |
- 155 Патологическая анатомия опухолей мягких тканей, 5.21kb.
- Клинико-морфологические особенности мультицентрического роста и рецидивирования при, 809.82kb.
- Морфологические и молекулярно-биологические факторы прогноза рака мочевого пузыря 14., 376.97kb.
- Патологическая анатомия это медико-биологическая наука, изучающая структурные и морфологические, 1590.52kb.
- Рабочая программа учебной дисциплины патологическая анатомия, клиническая патологическая, 480.03kb.
- Клинико-морфологические проявления опухолей и опухолеподобных состояний молочной железы, 371.11kb.
- Клинико-морфологические аспекты стеноза большого сосочка двенадцатиперстной кишки 14., 262.6kb.
- В. Д. Ермилова доктор медицинских наук, 1948.7kb.
- Общая патологическая анатомия, 283.39kb.
- Патологическая анатомия и дифференциальная диагностика рака большого сосочка двенадцатиперстной, 388.21kb.
На правах рукописи
ИВАНЦОВ АЛЕКСАНДР ОЛЕГОВИЧ
МОРФОЛОГИЧЕСКИЕ И ИММУНОГИСТОХИМИЧЕСКИЕ
ОСОБЕННОСТИ ОПУХОЛЕЙ ЧЕЛОВЕКА С МУТАЦИЕЙ
РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА
14.03.02 – Патологическая анатомия
14.01.12 – Онкология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Санкт-Петербург
2011
Работа выполнена в ФГУ «Научно-исследовательский институт онкологии им. Н.Н. Петрова» Министерства здравоохранения и социального развития Российской Федерации
| Научные руководители: | доктор медицинских наук, профессор |
| | Мацко Дмитрий Евгеньевич |
| | доктор медицинских наук, профессор |
| | Имянитов Евгений Наумович |
| | |
| Официальные оппоненты: | доктор медицинских наук, профессор |
| | Хмельницкая Наталия Михайловна |
| | доктор медицинских наук, профессор |
| | Топузов Эльдар Эскендерович |
| | |
| Ведущая организация: | Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Санкт- Петербургский университет» |
Защита диссертации состоится « 6 » июня 2011 г. в 14 часов на заседании диссертационного совета Д 215.002.02 при ФГВОУ ВПО «Военно-медицинская академия им. С. М. Кирова» МО РФ по адресу: 194044, Санкт – Петербург, ул. Академика Лебедева, д. 6.
С диссертацией можно ознакомиться в библиотеке института и на сайте (www.vmeda.spb.ru) с 26.04.2011
Автореферат разослан «___»_________2011 г.
Ученый секретарь диссертационного совета
доктор медицинских наук, Чирский Вадим Семенович
Общая характеристика работы
Актуальность темы
В настоящее время во всем мире, в том числе и в России, онкологические заболевания являются одной из самых частых причин инвалидизации и смертности трудоспособного населения. В связи с этим, в настоящее время многие исследования сосредоточены на поиске новых подходов к противоопухолевой терапии.
В последние годы в качестве лекарственной мишени (таргетная терапия) изучается рецептор эпидермального фактора роста (epidermal growth factor receptor – EGFR), как молекулярный фактор, ответственный за митогенную активность опухолевого роста. EGFR – трансмембранный гликопротеин молекулярной массой 170 kD, обладающий тирозинкиназной активностью. EGFR (или HER1) относится к семейству рецепторов эпидермального фактора роста, которое также представлено другими его видами: erbB2/HER2–neu; erbB3/HER3 и erbB4/HER4. EGFR экспрессируется на поверхности как нормальных, так и трансформированных эпителиальных клеток, а также участвует в регуляции клеточного роста и дифференцировки. Гиперэкспрессия EGFR опухолевыми клетками ассоциируется с поздними стадиями и метастатическим фенотипом заболевания, коррелирует с плохим прогнозом, резистентностью к проводимой лекарственной и лучевой терапии. Наиболее хорошо гиперэкспрессия EGFR изучены в бронхиолоальвеолярных аденокарциномах легких, инвазивном раке молочной железы, раке толстой кишки, раке предстательной железы.
Ингибиторы EGFR – группа препаратов, которые конкурентно связываясь с активными точками тирозинкиназы С (интрацеллюлярная часть) блокируют процесс фосфорилирования, и тем самым препятствуют фосфорилированию белков–переносчиков сигналов. Одним из ингибиторов EGFR является Гефитиниб (Иресса). Он одобрен в 2003 г. Управлением по контролю качества продуктов и лекарств США для лечения химиорезистентного диссеминированного немелкоклеточного рака лёгкого. Ответ на терапию гефитинибом в общей популяции больных наблюдается лишь у 10–20 % пациентов (Fukuoka M., 2003). В то же время исследования, в которые были включены больные с мутацией гена EGFR, выявили невиданную ранее для этого заболевания частоту объективных ответов (от 55 до 100 %), при этом медиана времени до прогрессирования опухоли почти вдвое превышала исторический контроль (Lynch T. J., 2004). Несравненно высокая эффективность терапии ингибиторами тирозинкиназных рецепторов у больных с активирующей мутацией гена EGFR требует обязательного определения данной мутации у больных с аденокарциномой лёгкого.
Многие исследователи указывают на зависимость между выраженным клиническим ответом к ингибиторам EGFR и наличием соматических мутаций внутри тирозинкиназного домена EGFR при многих опухолях эпителиальной природы (Blons H., 2006; Zakowski M.F., 2009). Наиболее подробно изучены мутации EGFR при бронхиолоальвеолярном раке легкого в группе немелкоклеточных раков легкого. Выявлены наиболее часто встречающиеся мутации EGFR (экзоны 19 и 21), изменяющие пространственную структуру центров связывания тирозинкиназной части EGFR (Cohen S., 1974; Cohen D., 2007). Большинство исследователей указывают на молекулярную гетерогенность мутаций (Cohen S., 1974; Blons H., 2006; Zakowski M.F., 2009).
Часть исследователей указывают на отсутствие стандартов в области иммуногистохимического определения сверхэкспрессии EGFR, так как результаты определения мембранного и цитоплазматического EGFR достоверно отличаются друг от друга, но не коррелируют с общей выживаемостью и рецидивированием заболевания (Cohen S., 1974; Cohen D., 2007).
В некоторых статьях указывается на различия в количестве и интенсивности окрашивания при иммуногистохимическом методе исследования опухолевых клеток с сверхэкспрессией EGFR в первичной опухоли и метастазах, в частности, при светлоклеточном раке почки (Badalian G., 2007).
Работ содержащих описание иммунофенотипа с мутацией гена EGFR светлоклеточным раком почки нам не встретилось, хотя имеются публикации, описывающие иммунофенотипический статус (Ki–67, P–53, Bcl–2) как при светлоклеточном раке почки (Suzuki K., 2002), так и при немелкоклеточном раке легкого (Radović S., 2007).
Таким образом, анализ морфологических и иммуногистохимических особенностей опухолей с мутацией EGFR, в частности светлоклеточного рака почки, бронхиолоальвеолярного рака легкого, способен выявить те морфологические и иммуногистохимические критерии, которые могут способствовать как определению прогноза заболевания, так и выбора адекватного метода лечения.
Цель исследования. Сравнительный анализ морфологических и иммуногистохимических особенностей опухолей у больных с мутацией гена EGFR и без неё.
Задачи исследования:
- Изучить частоту наиболее часто встречаемых мутаций в гене EGFR у больных с аденокарциномой лёгких Северо–Западного региона РФ.
- Оценить возможную роль экспрессии Ki–67, P–53, Bcl–2, рецепторов эстрогена альфа (ER–α), EGFR, в выявлении мутации гена EGFR у пациентов с аденокарциномой лёгких.
- Выявить различия иммуногистохимической экспрессии Ki–67, P–53, Bcl–2, ER–α, EGFR у больных с аденокарциномой лёгких с различными активирующими мутациями гена EGFR.
- Изучить частоту наиболее часто встречаемых мутаций в гене EGFR у пациентов со светлоклеточным раком Северо–Западного региона РФ.
- Оценить роль экспрессии Ki–67, P–53, Bcl–2, ER–α, EGFR в выявлении мутации гена EGFR у больных со светлоклеточным раком почки, и определить особенности экспрессии иммуногистохимических маркеров.
Научная новизна
Впервые проведено исследование по выявлению активирующих мутаций гена EGFR у больных со светлоклеточным раком почки Северо–Западного региона РФ. Были изучены иммуногистохимические особенности аденокарцином лёгких и светлоклеточного рака почки с мутацией в гене EGFR у пациентов Северо–Западного региона РФ. Выявлены принципиальные различия в частоте и выраженности экспрессии маркеров пролиферации и апоптоза. Показано, что иммуногистохимические маркеры пролиферации и апоптоза не связаны с частотой мутации EGFR при аденокарциноме лёгких.
Практическая значимость
Нецелесообразно использовать иммуногистохимические маркеры Ki–67, P–53, Bcl–2, ER–α, EGFR для выявления групп с высокой вероятностью наличия мутации гена EGFR.
Положения выносимые на защиту
1. У больных с аденокарциномой лёгких и светлоклеточным раком почки Северо–Западного региона РФ встречаются мутации гена EGFR (20,3 % и 1,2 % соответственно).
2. У больных аденокарциномой лёгких с мутацией гена EGFR в 61 % встречается делеция 19 экзона, в 39 % – мутация L858R в 21 экзоне, а у больных светлоклеточным раком почки выявляется только делеция в 19 экзоне гена EGFR.
3. Гиперэкспрессия EGFR на мембране опухолевой клетки не зависит от статуса гена EGFR у больных с аденокарциномой лёгких.
4. Экспрессия Ki–67, P–53, Bcl–2, ER–α не способствуют выявлению мутации гена EGFR в светлоклеточном раке почки.
Апробация диссертации
Результаты исследования были представлены в докладах на: 4–ой Российской конференции по фундаментальной онкологии (Санкт–Петербург, Россия, 2008); 20–ой конференции Европейской ассоциации исследования рака (Лион, Франция, 2008); 20–ом международном конгрессе противоракового лечения (Париж, Франция, 2009); 6–ом съезде онкологов и радиологов СНГ (Душанбе, Таджикистан, 2010).
Структура и объём диссертации
Диссертация изложена на 106 страницах машинописного текста и состоит из введения, литературного обзора, описания материала и методов, результатов собственного исследования, обсуждения полученных данных и выводов. Текст иллюстрирован 7 таблицами, 28 рисунками. Список литературы содержит 157 наименований, из которых 13 отечественных и 144 иностранных.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Было изучено 202 случая больных аденокарциномой лёгких, оперированных в ФГУ НИИ онкологии им. Н. Н. Петрова с 1998 по 2004 г. Больные плоскоклеточным, мелкоклеточным, крупноклеточным раком, оперированные в этом же промежутке времени в исследование не включены. Определён гистологический тип опухоли и степень дифференцировки, затем выполнено молекулярно–генетическое исследование экзонов 19, L858R в 21 экзоне гена EGFR парафиновых образцов опухоли, с последующей оценкой степени экспрессии EGFR и выявлением случаев с альтерацией экзонов 19, L858R в 21 экзоне. Исследование проводилось с использованием микроскопа Leica DM 2000, микросъёмка проводилась с помощью цифровой фотокамеры Leica DFC 320. Обработку цифровых изображений проводили на персональном компьютере с использованием пакета прикладных программ «Adobe Photoshop CS». Анализируемые наблюдения были разделены на 3 группы:
1 группа– 25 случаев аденокарцином лёгкого с мутацией EGFR в экзоне 19.
2 группа – 16 случаев аденокарцином лёгкого с мутацией EGFR L858R в 21 экзоне.
3 группа – 170 случаев аденокарцином лёгкого без мутации EGFR.
Проведено рутинное гистологическое исследование и иммуногистохимическое определение Ki–67, Bcl–2, P–53, а также выраженности экспрессии EGFR и ER.
Также произведён анализ 336 случаев больных светлоклеточным раком почки, наблюдавшихся в ФГУ НИИ онкологии им. Н.Н. Петрова в 2000–2008 гг. Определён гистологический тип опухоли и степень дифференцировки по Fuhrman. Во всех анализируемых наблюдениях выполнено молекулярно–генетическое исследование экзонов 19, L858R в 21 экзоне гена EGFR. В выявленных случаях с мутацией EGFR (выявлено 5 случаев с мутацией EGFR в 19 экзоне, для иммуногистохимического исследования представлены парафиновые блоки 4 случаев) проведено иммуногистохимическое исследование уровня экспрессии Ki–67, Bcl–2, P–53, ER–α.
Для морфологического исследования срезы толщиной 3 мкм окрашивали гематоксилином и эозином по общепринятой методике.
Для иммуногистохимического исследования использовано 5 коммерческих антител: Ki–67, Bcl–2, P–53, ER–α, EGFR.
Интерпретация результатов иммуногистохимического исследования.
Уровень пролиферации Ki–67, Р–53 оценивался при помощи подсчёта позитивно окрашенных ядер в 1000 опухолевых клеток. Ядерная реакция любой интенсивности фиксировалась как позитивная.
Уровень экспрессии Bcl–2 расценивался как позитивный, если более 5 % опухолевых клеток имели цитоплазматическое окрашивание любой степени интенсивности.
Экспрессия ER оценивались полуколичественно при помощи Allred scoring system. Оценивалась только ядерная реакция. Результат представляется в виде суммы двух величин, первая – интенсивность окрашивания опухолевых клеток (0 – отсутствует, 1 – слабая, 2 – умеренная, 3 – выраженная), вторая – количество позитивных опухолевых клеток (0=нет окрашивания; 1 – при <1%; 2 – 1 – 10 %; 3 – 11 – 33 %; 4 – 34 – 66 %; 5 – 67 – 100 %).
Уровень экспрессии EGFR осуществлялся путём суммарной оценки выраженности окрашивания мембраны опухолевой клетки и общего числа позитивно окрашенных клеток. Случай расценивался как позитивный, если имело место любое по интенсивности окрашивание более 10 % опухолевых клеток. При окрашивании менее 10 % опухолевых клеток результат расценивался как нулевой. Слабая реакция более, чем у 10 % опухолевых клеток с мембраной окрашенной не полностью расценивалась как «1+», при слабом или умеренном окрашивании всей мембраны более, чем у 10 % опухолевых клеток – «2+», интенсивное окрашивание всей мембраны более, чем 10 % опухолевых клеток – «3+».
Определение мутации EGFR.
Для проведения анализа на наличие мутации были использованы парафиновые блоки, полученные из первичной опухоли. Срезы 15 мкм с парафиновых блоков, прошедших морфологическую верификацию на наличие опухолевой ткани, наносились на предметные стекла. Выделение опухолевых клеток производилось методом стереотактической диссекции под контролем световой микроскопии со срезов, содержавших более 40 % опухолевых клеток. Для получения ДНК из срезов парафиновых блоков использовалась следующая методика (Imyanitov E., 2001):
Для определения делеции в экзоне 19 гена, кодирующего EGFR, производилась амплификация всей последовательности экзона. Были использованы праймеры со следующими последовательностями: прямой 5’-CTGTCATAGGGACTCTGGAT-3’, обратный 5’-CAGCAAAGCAGAAACTCACAT-3’.
Другим видом мутации, определение которого производилось в рамках данного исследования, были миссенс-мутации в экзоне 21 гена EGFR. В данной позиции выявлялась замена L на G. Данный тест производился методом аллель-специфической ПЦР в режиме реального времени. Для амплификации искомых последовательностей были использованы следующие последовательности праймеров: праймер, специфичный для последовательности дикого типа 5’-CACCCAGCAGTTTGGCCA-3’, специфичный для последовательности с заменой нуклеотида - 5’-CACCCAGCAGTTTGGCCC-3’, и общий праймер - 5’-GCATGAACTACTTGGAGGAC-3’.
Статистическая обработка материала.
Статистический анализ проводили на персональном компьютере с использованием пакета прикладных программ «SPSS 13.0», парные групповые сравнения проводились непараметрическим методом Mann–Whitney. Различия считались статистически достоверными при p< 0,05.
Результаты исследования и их обсуждение
Сравнительный анализ экспрессии иммуногистохимических маркеров пролиферации и апоптоза, таргетных маркеров в аденокарциномах лёгких с мутацией и без мутации EGFR
Клинические данные
Исследованы клинические данные и операционный материал 202 больных прооперированных в НИИ онкологии им. Н. Н. Петрова по поводу периферического рака лёгких. Средний возраст больных 60,6 лет (от 36 до 81 года). В 124 случаях больные мужчины (61,4%), 78 женщины (38,6%).
В 182 случаях опухоль гистологически определена как аденокарцинома (90,1 %), в 20 случаях опухоль определена как бронхиолоальвеолярный рак (9,9 %).
Определение мутационного статуса гена EGFR
При проведении молекулярно–генетического анализа мутация рецептора эпидермального фактора роста выявлена в 41 случае (20,3 %). В 17 случаях (41,5 %) – мужчины, и в 24 случаях (58,5 %) женщины. В 39 случаях из 41 с выявленной мутацией гистологический тип соответствовал аденокарциноме (без учёта степени дифференцировки).
Делеция экзона 19 выявлена у 25 больных (61 %, из них 12 женщины (48 %), 13 мужчины (52 %)), точковая мутация в кодоне 858 встречена у 16 больных (39 %, из них 11 женщины (68,75 %) и 5 мужчины (31,25%)).
В 23 случаях аденокарцином (в 21 случае – умеренно дифференцированная, 2 случаях низко дифференцированная) выявлена мутация EGFR в экзоне 19.
В 2 случаях подтверждён бронхиолоальвеолярный рак и выявлена мутация EGFR в экзоне 19.
В 16 случаях аденокарцином (в 15 случаях – умеренно дифференцированная аденокарцинома, в 1 – низко дифференцированная) выявлена мутация гена EGFR L858R в 21 экзоне.
Выявленная в нашем исследовании частота мутаций гена EGFR, которая составила 20,3 % (41/202), позволяет говорить о сходстве в частоте возникновения мутации больше с белым населением Европы и Северной Америки, чем с больными азиатского происхождения, так как при анализе опухолей у больных в Тайване, частота мутированных вариантов гена суммарно составила 26 % (Kobayashi S., 2005), при исследовании больных в Испании и Северной Америке показатели мутации составили 12 % и 16 % соответственно (Furge K., 2000; Cortes–Funes H., 2005)..
Экспрессия Ki–67
Для иммуногистохимического исследования образцы разделены в 3 группы. 1 группа – 18 случаев умеренно дифференцированных аденокарцином с мутацией EGFR в экзоне 19. 2 группа – 12 случаев умеренно дифференцированных аденокарцином с мутацией EGFR L858R в 21 экзоне. 3 группа – 7 случаев умеренно дифференцированных аденокарцином без мутации EGFR, случаи были выбраны случайным образом, необходимыми критериями служили гистологический тип (аденокарцинома) и степень дифференцировки (умеренно дифференцированная); без учёта пола и возраста больных.
В группе аденокарцином лёгких с мутацией EGFR в экзоне 19 минимальное значение Ki–67 составило 4 %, максимальное значение 49 %, медиана 22 %.
В группе аденокарцином лёгких с мутацией EGFR L858R в 21 экзоне минимальное значение Ki–67 составило 5 %, максимальное значение 20 %, медиана 13 %.
В группе аденокарцином лёгких с мутацией EGFR (мутация EGFR в экзоне 19 + мутация EGFR L858R в 21 экзоне) минимальное значение Ki–67 составило 4 %, максимальное значение 49 %, медиана 14 %.
В группе больных аденокарциномой лёгких без мутации EGFR минимальное значение Ki–67 составило 26 %, максимальное значение 48 %, медиана 37 %.
При статистической обработке данных производили парные групповые сравнения уровня экспрессии Ki–67 непараметрическим методом Mann–Whitney, так как значения в сравниваемых выборках не соответствуют закону нормального распределения.
При сравнении уровня экспрессии Ki–67 в группе аденокарцином лёгких с мутацией EGFR в экзоне 19 (медиана 22 %) с группой аденокарцином лёгких с мутацией EGFR L858R в 21 экзоне (медиана 13 %) выявлено статистически достоверное различие (p=0,036) (рис. 1).
При сравнении уровня экспрессии Ki–67 в группе аденокарцином лёгких без мутации EGFR (медиана 37 %) с группой аденокарцином лёгких с мутацией EGFR L858R в 21 экзоне (медиана 13 %) выявлено статистически достоверное различие (p=0,0001).
При сравнении уровня экспрессии Ki–67 в группе аденокарцином лёгких без мутации EGFR (медиана 37 %) с группой аденокарцином лёгких с мутацией EGFR вообще (мутация EGFR в экзоне 19 + мутация EGFR L858R в 21 экзоне) (медиана 14 %) выявлено статистически достоверное различие (p=0,006).
G. Scagliotti с соавт. (1993) пороговым уровнем экспрессии Ki–67 определили 25 %, при котором статистически достоверно отличается безрецидивная выживаемость для операбельного варианта немелкоклеточного рака лёгких.
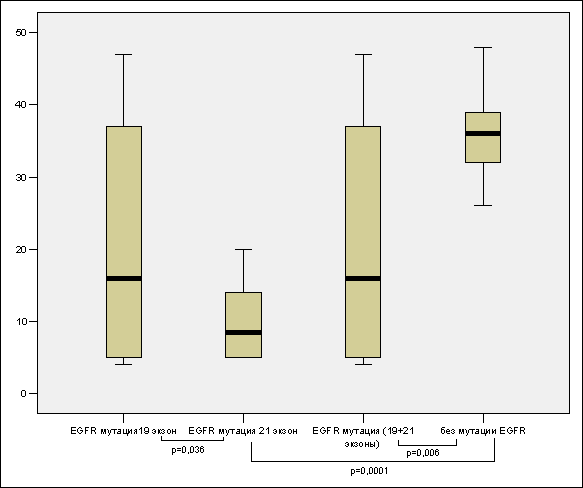
Рис. 1. Сравнение уровня экспрессии Ki-67 в группах больных с аденокарциномой лёгких с мутацией гена EGFR в 19 экзоне, L858R в 21 экзоне, с мутацией вообще и без мутации гена EGFR. Верхняя и нижняя границы прямоугольников на диаграммах соответствуют первому и третьему квартилям (внутрь прямоугольника попадает 50 % наблюдений). Линия внутри прямоугольника соответствует медиане. Линиями сверху и снизу от прямоугольников отмечены максимальные и минимальные значения. Ось Y – уровень экспрессии Ki–67, %; ось X – анализируемые группы
Медианы значений Ki–67 у больных с аденокарциномой лёгких с мутацией EGFR в экзоне 19, с мутацией EGFR L858R в 21 экзоне, с мутацией EGFR в сумме не превышают 25 %, а медиана значений Ki–67 аденокарцином лёгкого без мутации EGFR составило 37 %. То есть можно утверждать, с ссылкой на G. Scagliotti с соавт. (1993), что прогностически группы опухолей лёгкого с мутацией EGFR вообще и по отдельности, более благоприятны по сравнению с опухолями лёгких без мутации EGFR. Также аденокарциномы лёгкого с мутацией EGFR L858R в 21 экзоне – группа с наиболее благоприятным прогнозом, так как они обладают статистически достоверной наименьшей пролиферативной активностью, а так же характеризуются более высокой безрецидивной выживаемостью в операбельных случаях немелкоклеточного рака лёгкого по данным G. Scagliotti (1993).
Экспрессия Р–53
Для иммуногистохимического исследования использован прежний принцип разделения на 3 группы (1 группа – 18 случаев умеренно дифференцированных аденокарцином с мутацией EGFR в экзоне 19; 2 группа – 12 случаев умеренно дифференцированных аденокарцином с мутацией EGFR L858R в 21 экзоне; 3 группа – 7 случаев умеренно дифференцированных аденокарцином без мутации EGFR).
В группе аденокарцином лёгких с мутацией EGFR L858R в 21 экзоне минимальное значение P–53 составило 0 %, максимальное значение 96 %, медиана 59 %.
В группе аденокарцином лёгких с мутацией EGFR в экзоне 19 минимальное значение P–53 составило 0 %, максимальное значение 94 %, медиана 2 %.
В группе аденокарцином лёгких с мутацией EGFR (мутация EGFR в экзоне 19 + мутация EGFR L858R в 21 экзоне) минимальное значение P–53 составило 0 %, максимальное значение 96 %, медиана 22 %.
В группе аденокарцином лёгких без мутации EGFR минимальное значение P–53 составило 2 %, максимальное значение 68 %, медиана 45 %.
При статистической обработке данных производили парные групповые сравнения уровня экспрессии P–53 непараметрическим методом Mann–Whitney.
Анализ экспрессии Р–53 с 20 % порогом экспрессии.
В группе аденокарцином лёгких с мутацией EGFR в экзоне 19 экспрессия P–53 равна или выше 20 % в 7 из 18 случаев (38,8 %).
В группе аденокарцином лёгких без мутации EGFR экспрессия P–53 равна или выше 20 % в 4 из 7 случаев (57,1 %).
В группе аденокарцином лёгких с мутацией EGFR L858R в 21 экзоне экспрессия P–53 равна или выше 20 % в 9 из 12 случаев (75 %).
В группе аденокарцином лёгких с мутацией EGFR (мутация EGFR в экзоне 19 + мутация EGFR L858R в 21 экзоне) экспрессия P–53 равна или выше 20 % в 16 из 30 случаев (53,3 %).
При сравнении частоты экспрессии Р–53 в группе аденокарцином лёгких с мутацией EGFR в экзоне 19 с группой аденокарцином лёгких с мутацией EGFR L858R в 21 экзоне выявлено статистически достоверное различие (p=0,046).
По мнению H. Ishida с соавт. (1997) положительная экспрессия P–53 (окрашивание ядер более чем в 20 % опухолевых клеток) ассоциируется с более худшим прогнозом. Нами выявлено статистически достоверное различие в частоте экспрессии между аденокарциномой лёгких с мутацией EGFR в экзоне 19 и с мутацией EGFR L858R в 21 экзоне. Это свидетельствует о наличии иммунофенотипических перепадов между двумя типами мутаций, хотя прямой связи между мутацией EGFR и экспрессией Р–53 нет, так как это несвязанные между собой молекулярные пути. J. Lee с соавт. (1995) установили, что больные аденокарциномой лёгких с высокой степенью экспрессии Р–53 (более 50 %) обладают в два раза большей выживаемостью, чем с низкой степенью экспрессии Р–53. Также методом регрессии Кокса показано, что экспрессия Р–53 более чем в 50 % опухолевых клеток является положительным независимым прогностическим фактором для оценки общей выживаемости. Мы продемонстрировали полжительную экспрессию Р–53: у больных с аденокарциномой лёгких с мутацией EGFR в экзоне 19 в 27,8 % случаев; у пациентов с аденокарциномой лёгких с мутацией EGFR L858R в 21 экзоне в 58,3 % случаев; больные с мутацией EGFR (мутация EGFR в экзоне 19 + мутация EGFR L858R в 21 экзоне) в 40 % случаев; у больных с аденокарциномой лёгких без мутации EGFR в 14,3 % случаев. При сравнении частот положительной экспрессии Р–53 (50 % порог) всех сравниваемых групп статистически достоверных различий не выявлено.
Экспрессия Bcl–2
Для иммуногистохимического исследования все больные с умереннодифференцированной аденокарциномой лёгких разделены в 3 группы: 1 группа – 18 случаев с мутацией EGFR в экзоне 19; 2 группа – 12 случаев с мутацией EGFR L858R в 21 экзоне; 3 группа – 7 случаев без мутации EGFR.
В группе аденокарцином лёгких с мутацией EGFR в экзоне 19 экспрессия Bcl–2 равна или выше 5 % в 1 из 18 случаев (5,5 %).
В группе аденокарцином лёгких с мутацией EGFR L858R в 21 экзоне экспрессия Bcl–2 равна или выше 5 % ни в одном из 12 случаев (0 %).
В группе аденокарцином лёгких с мутацией EGFR (мутация EGFR в экзоне 19 + мутация EGFR L858R в 21 экзоне) экспрессия Bcl–2 равна или выше 5 % в 1 из 30 случаев (3,3 %).
В группе аденокарцином лёгких без мутации EGFR экспрессия Bcl–2 равна или выше 5 % в 3 из 7 случаев (42,9 %).
При статистической обработке данных частоты экспрессии Bcl–2 производили парные групповые сравнения непараметрическим методом Mann–Whitney, так как значения в сравниваемых выборках не соответствуют закону нормального распределения.
При сравнении частоты экспрессии Bcl–2 в группе аденокарцином лёгких без мутации EGFR с группой аденокарцином лёгких с мутацией EGFR L858R в 21 экзоне выявлено статистически достоверное различие (p=0,017).
При сравнении частоты экспрессии Bcl–2 в группе аденокарцином лёгких без мутации EGFR с группой аденокарцином лёгких с мутацией EGFR вообще (мутация EGFR в экзоне 19 + мутация EGFR L858R в 21 экзоне) выявлено статистически достоверное различие (p=0,003).
H. Ishida с соавт. (1997) показали значимую связь экспрессии BCL–2 с благоприятным прогнозом (90 % против 68 % за 5 лет, Р < 0,05), показателем Т по классификации TNM, малым размером опухоли (менее 2 см). D. Renouf с соавт. (2009) приводят данные о положительном окрашивании BCL–2 в 59 из 194 аденокарцином (30,4 %). Частота встречаемости экспрессии Bcl–2 среди больных с аденокарциномой лёгких составила 13 %, что гораздо ниже в сравнении с результатами D. Renouf с соавт. (2009). Также экспрессия Bcl–2 не встречалась среди пациентов с аденокарциномой лёгких с мутацией EGFR L858R в 21 экзоне, среди больных с аденокарциномой лёгких с мутацией в 19 экзоне выявлена единичная экспрессия, в то время как в группе больных без мутации EGFR определялась экспрессия Bcl–2 почти в половине случаев. Данная особенность подчёркивает уникальность состояния системы апоптоза при аденокарциноме лёгких с мутацией EGFR, и достаточно однозначно характеризует иммуногистохимический статус Bcl–2.
Экспрессия ER–α
Для иммуногистохимического исследования все больные с умереннодифференцированной аденокарциномой лёгких разделены в 3 группы: 1 группа – 18 случаев с мутацией EGFR в экзоне 19; 2 группа – 12 случаев с мутацией EGFR L858R в 21 экзоне; 3 группа – 7 случаев без мутации EGFR.
У пациентов с мутацией EGFR в экзоне 19 экспрессия ER–α положительная в 4 из 18 случаев (22,2 %), максимальное значение – 4 балла по Allred scoring system.
У больных с мутацией EGFR L858R в 21 экзоне экспрессия ER–α положительная в 2 из 12 случаев (16,6 %), максимальное значение – 2 балла по Allred scoring system.
У пациентов с мутацией EGFR (мутация EGFR в экзоне 19 + мутация EGFR L858R) экспрессия ER–α положительная в 6 из 30 случаев (30%), максимальное значение – 4 балла по Allred scoring system.
У больных без мутации EGFR экспрессия ER–α положительная в 3 из 7 случаев (42,9 %), максимальное значение – 6 баллов по Allred scoring system.
При статистической обработке данных производили парные групповые сравнения частоты экспрессии ER–α непараметрическим методом Mann–Whitney.
H. Kawai с соавт. (2005) показали, что ER–β, в основном, экспрессируются в ядре, а ER–α, в основном, экспрессируются в цитоплазме опухолевых клеток рака лёгкого. Оценивая функции ER и EGFR, пришли к выводу, что стимуляция ER приводит к повышению активности сигнального пути EGFR, и, наоборот, сигнал EGFR повышает активность ER (Pietras R., 2007). Y. Omoto с соавт. (2001) описывают экспрессию ER–β у больных немелкоклеточным раком лёгкого и отсутствие экспрессии ER–α. Мы встретили только ядерное окрашивание ER–α в опухолевых клетках, цитоплазматическое окрашивание отсутствовало. Во всех группах экспрессия рецептора эстрогена альфа встречается как у мужчин, так и у женщин. В группе контроля экспрессия ER–α встречается чаще у женщин. Все парные сравнения количества окрашенных клеток и интенсивности окрашивания ER–α во всех группах сравнения (с мутацией и без мутации) статистически достоверных различий не выявили.
Экспрессия EGFR
Для иммуногистохимического исследования все больные с умереннодифференцированной аденокарциномой лёгких разделены в 3 группы: 1 группа – 18 случаев с мутацией EGFR в экзоне 19; 2 группа – 12 случаев с мутацией EGFR L858R в 21 экзоне; 3 группа – 7 случаев без мутации EGFR.
Исходя из методики подсчёта экспрессии EGFR изложенной в материалах и методах, все случаи позитивны в отношении EGFR, незначительно варьирует интенсивность окрашивания, поэтому в ходе работы было решено расширить критерии оценки.
При статистической обработке данных производили парные групповые сравнения частоты экспрессии EGFR непараметрическим методом Mann–Whitney.
Все парные сравнения количества окрашенных клеток и интенсивности окрашивания во всех группах сравнения (с мутацией и без мутации, без учета выраженности мембранного компонента) статистически достоверных различий не выявили.
Также мы произвели количественный подсчёт тех аденокарцином, в которых отчётливо присутствует мембранный компонент, без учёта цитоплазматического компонента.
У больных с аденокарциномой лёгких с мутацией EGFR в экзоне 19 мембранная экспрессия EGFR выявлена в 8 из 18 случаев (44,4 %).
В группе пациентов с аденокарциномой лёгких с мутацией EGFR L858R в 21 экзоне мембранная экспрессия EGFR присутствовала в 2 из 12 случаев (16,6 %).
В группе больных с аденокарциномой лёгких с мутацией EGFR (мутация EGFR в экзоне 19 + мутация EGFR L858R в 21 экзоне) мембранная экспрессия EGFR наблюдалась в 10 из 30 случаев (33,3 %).
В группе больных с аденокарциномой лёгких без мутации EGFR мембранная экспрессия EGFR выявлена в 5 из 7 случаев (71,4 %).
При сравнении частоты мембранной экспрессии EGFR в группе больных с аденокарциномой лёгких без мутации EGFR с группой больных с аденокарциномой лёгких с мутацией EGFR L858R в 21 экзоне выявлено статистически достоверное различие (p=0,026).
Таким образом, оценка EGFR, по нашему мнению, мало информативна, оптимально проводить оценку статуса гена EGFR молекулярно–генетическими методами. Тотальное окрашивание EGFR всех образцов не позволяет утверждать, что имеет место корреляция между наличием мутации и экспрессией EGFR.
Сравнительный анализ экспрессии иммуногистохимических маркеров пролиферации и апоптоза, таргетных маркеров в светлоклеточном раке почки с мутацией EGFR
Клинические данные
Исследован операционный материал и клинические данные 336 больных прооперированных в НИИ онкологии им. Н.Н. Петрова по поводу рака почки. Средний возраст больных 59,5 лет (от 17 до 85 лет). В 201 случае больные были мужчины (59,8 %), и в 135 – женщины (40,2 %). Во всех случаях опухоль гистологически определена как почечноклеточный рак, светлоклеточный тип (100 %). Определение гистологического типа опухоли проведены в соответствии с требованиями и критериями классификации опухолей почек ВОЗ 2004 года.
Определение мутационного статуса гена EGFR
При проведении молекулярно–генетического анализа мутация EGFR выявлена в 4 случаях из 336 (1,2 %). В 3 случаях (75 %)– мужчины, и в 1 случае женщина(25 %). Возраст мужчин составил: 50; 54; 60 лет. Возраст женщины – 54 года. Во всех случаях с выявленной мутацией гистологический тип определен как почечноклеточный рак, светлоклеточный тип. Степень дифференцировки по Fuhrman у всех мужчин расценена как «2» и у женщины «3». Во всех 4 случаях выявлена делеция в 19 экзоне.
Экспрессия иммуногистохимических маркеров (Ki–67, P–53, Bcl–2, рецепторы эстрогена альфа) в светлоклеточном почечноклеточном раке почки с мутацией EGFR в 19 экзоне
Во всех 4 случаях было проведено иммуногистохимическое исследование Ki–67, P–53, Bcl–2, ER–α, что отображено в табл. 1.
У больных светлоклеточным раком почки с мутацией EGFR в экзоне 19 минимальное значение Ki–67 составило 4 %, максимальное значение 23 %, а минимальное и максимальное значение Bcl–2 и Р–53 составило 0 %.
В группе светлоклеточных почечноклеточных раков почки с мутацией EGFR в экзоне 19 в 1 из 4 случаев отмечена умеренная экспрессия ER–α в 12 % опухолевых клеток.
Таблица 1
Экспрессия иммуногистохимических маркеров (Ki–67, P–53, Bcl–2, ER–α) в светлоклеточном раке почки с мутацией EGFR в 19 экзоне
| Больные | Пол/возраст | Степень по Fuhrman | Ki–67 | Bcl–2 | P–53 | ER–α |
| 1 | М/50 | 2 | 4 % | 0 | 0 | 5 (2+3) |
| 2 | М/54 | 2 | 23 % | 0 | 0 | 0 |
| 3 | М/60 | 2 | 12 % | 0 | 0 | 0 |
| 4 | Ж/54 | 3 | 20 % | 0 | 0 | 0 |
Мутация EGFR в почечноклеточном раке почки, светлоклеточном варианте явление редкое, исключительное, но имеющее значимую перспективу с точки зрения лечения и прогноза заболевания. В литературе встречена статья с описанием одного случая рака почки с мутацией EGFR, авторы подчёркивали казуистичность наблюдения.
Экспрессия Ki–67 колебалась от 4 до 23 %, экспрессия P–53, Bcl–2 во всех 4 случаях была отрицательной. В 1 из 4 случаев (25 %) отмечена умеренная экспрессия ER–α в 12 % опухолевых клеток. C. Langner с соавт. (2004) провели иммуногистохимический анализ 182 образцов рака почки. Экспрессия рецепторов эстрогенов и прогестерона была отмечена только в 2 случаях (1,1 %) с числом окрашенных клеток менее 10 %. Это наводит на мысль, что подобная редкость экспрессии ER, возможно, каким–то образом, связана с мутацией EGFR. Исключительное событие экспрессия ER в раке почки встречающееся в 1,1 % случаев, среди светлоклеточных раков почки с мутацией EGFR в 19 экзоне встретилось в 25 % случаев. E. Nakano с соавт. (1984) продемонстрировали достоверно большую выживаемость у больных с положительным рецепторным статусом, чем с отрицательным рецепторным статусом.
ВЫВОДЫ
- Частота активирующих мутаций в гене EGFR у больных с аденокарциномой лёгких Северо–Западного региона РФ, составляет 20,3 %. Делеции экзона 19 (61 %) являются основной разновидностью выявленных мутаций; мутации L858R в 21 экзоне встречаются несколько реже (39 %).
- Наличие и степень выраженности иммуногистохимических маркеров Ki–67, P–53, Bcl–2, ER–α, EGFR не способствуют выявлению мутации гена EGFR у больных с аденокарциномой лёгких, основное значение имеет молекулярно–генетический анализ мутации EGFR.
- Аденокарциномы лёгких с мутацией гена EGFR L858R в 21 экзоне характеризуется наиболее низкой пролиферативной активностью среди всех вариантов аденокарцином, отсутствием экспрессии Bcl–2.
- Частота мутаций в гене EGFR у больных со светлоклеточным раком почки Северо–Западного региона РФ составляет 1,2 %. Делеции экзона 19 является основной разновидностью выявленной мутации; мутация L858R в 21 экзоне не встречена.
- Иммуногистохимические маркеры Ki–67, P–53, Bcl–2, ER–α, их степень и характер экспрессии не способствуют выявлению мутации гена EGFR в светлоклеточном раке почки. В 1 из 4 случаев светлоклеточного рака почки с мутацией EGFR (25 %) встречена умеренная экспрессия рецепторов эстрогена.
СПИСОК ОПУБЛИКОВАННЫХ РАБОТ ПО ТЕМЕ ДИССЕРТАЦИИ
- Иванцов, А.О. Лечение больного распространенным раком почки с мутацией EGFR гефитинибом: описание клинического случая / В.М. Моисеенко, А.В. Новик, А.О. Иванцов и соавт. // Сибирск. онкол. журн. – 2008. – № 6.– С. 76-9.
- Иванцов, А.О. Мутация EGFR при раке почки и терапия гефитинибом: описание клинического случая / А.Г. Иевлева, А.В. Новик, А.О. Иванцов и соавт. // 4-й Рос. конф. по фундаментальной онкологии. – СПб., 2008. – Вып. 38. – С. 11.
- Ivantsov, A.O. Down-staging of EGFR mutation-positive stage IV lung carcinoma by gefitinib provides an opportunity for surgical treatment of the disease: report of 2 cases / E.V. Levchenko, V.M. Moiseyenko, A.O. Ivantsov et al. // J thorac oncol. – 2008. – Vol. 3, № 4, suppl. 1. – P. S69.
- Иванцов, А.О. Исследование II фазы по применению гефитиниба в первой линии лекарственного лечения больных неоперабельным немелкоклеточным раком лёгкого с мутацией гена эпидермального фактора роста / Ф.В. Моисеенко, А.О. Иванцов, А.Г. Иевлева и соавт. // Совершенствование медицинской помощи при онкологических заболеваниях, включая актуальные проблемы детской гематологии и онкологии: Сб. материалов.– М., 2009. – Т. I. – С. 166.
- Иванцов, А.О. Мутация EGFR при раке почки и терапия гефитинибом: описание клинического случая / А.Г. Иевлева, А.В. Новик, А.О. Иванцов и соавт. // Совершенствование медицинской помощи при онкологических заболеваниях, включая актуальные проблемы детской гематологии и онкологии: Сб. материалов.– М., 2009. – Т. I. – С. 163.
- Иванцов, А.О. Особенности экспрессии молекулярно-биологических маркеров пролиферации и апоптоза у больных раком лёгкого с мутацией рецептора эпидермального фактора роста / А.О. Иванцов, Е.Н. Имянитов, В.М. Моисеенко и соавт.// Арх. патол. – 2009. –№ 6. – С. 9-12.
- Иванцов, А.О. Частота мутаций эпидермального фактора роста в популяции больных аденокарциномой лёгкого / Ф.В. Моисеенко, А.О. Иванцов, А.Г. Иевлева и соавт. // Совершенствование медицинской помощи при онкологических заболеваниях, включая актуальные проблемы детской гематологии и онкологии: Сб. материалов.– М., 2009. – Т. I. – С. 72.
- Ivantsov, A.O. EGFR mutations in renal cell cancer: noticeable frequency and association with sensitivity to gefitinib / E.N. Imyanitov, A. Sokolenko, A.O. Ivantsov et al. // Ann oncol. – 2009. – Vol. 20, suppl. 3. – P. 300.
- Ivantsov, A.O. Down-staging of EGFR mutation-positive advanced lung carcinoma with gefitinib followed by surgical intervention: follow-up of two cases E.V. Levchenko, V.M. Moiseyenko, A.O. Ivantsov et al. // Onkologie. – 2009. –№ 32. – P. 674-7.
- Иванцов, А.О. Конверсия неоперабельной стадии рака легкого в операбельную у EGFR-позитивных пациентов на фоне лечения гефитинибом: два клинических случая / Е.В.Левченко, В.М. Моисеенко, А.О. Иванцов и соавт. // Совр. онкол. – 2010. – Т. 12, № 2. – С. 44-47.
- Иванцов, А.О. Митотический индекс светлоклеточного рака почки с мутацией рецептора эпидермального фактора роста / А.С. Артемьева, А.Г. Иевлева, А.О. Иванцов и соавт. // Материалы VI съезд онкологов и радиологов стран СНГ. – Душанбе, 2010. – С. 55.
- Иванцов, А.О. Применение Ирессы (гефитиниба) в качестве терапии первой линии для лечения неоперабельных аденокарцином легкого, содержащих мутацию в гене EGFR / В.М. Моисеенко, С.А. Проценко, А.О. Иванцов и соавт. // Совр. онкол. – 2010. – Т.12, № 1. – С. 74-80.
- Иванцов, А.О. Эффективность гефитиниба (ирессы) в первой линии терапии неоперабельных больных аденокарциномой лёгкого, содержащей мутацию в гене EGFR: исследование II фазы) / А.С. Барчук, Е.Н. Имянитов, А.О. Иванцов и соавт. // Вопр. онкол.– 2010.– Т. 56, № 1.– С. 20-23.
- Ivantsov, A.O. High efficacy of first-line gefitinib in non-Asian patients with EGFR-mutated lung adenocarcinoma / V.M. Moiseyenko, S.A. Procenko, A.O. Ivantsov et al. // Onkologie. – 2010. – № 33. – P. 231-8.
- Ivantsov, A.O. High efficacy of first-line gefitinib in non-Asian patients with EGFR-mutated lung adenocarcinoma / E.N. Imyanitov, S.A. Procenko, A.O. Ivantsov et al. // ICACT 21st International Congr. anti-cancer treatment. – Paris; France, 2010. – P. 441.
- Иванцов, А.О. Экспрессия KI-67, P-53, BCL-2, рецепторов эстрогена альфа у больных светлоклеточным раком почки с мутацией рецептора эпидермального фактора роста / А.О. Иванцов, Е.Н. Имянитов, В.М. Моисеенко и соавт. // Арх. патол. – 2011. –№ 2. – С. 6-7.
