Клиническая и морфо-функциональная характеристика опухолей, продуцирующих адренокортикотропный гормон 14. 00. 03 эндокринология 14. 00. 15 патологическая анатомия
| Вид материала | Автореферат |
- Рабочая программа учебной дисциплины патологическая анатомия, клиническая патологическая, 480.03kb.
- Примерная программа наименование дисциплины Патологическая анатомия, клиническая патологическая, 594.5kb.
- 155 Патологическая анатомия опухолей мягких тканей, 5.21kb.
- Общая патологическая анатомия, 283.39kb.
- Патологическая анатомия и дифференциальная диагностика рака большого сосочка двенадцатиперстной, 388.21kb.
- Основные механизмы нарушений в эндокринной системе, 1046.92kb.
- Примерная программа по дисциплине патологическая анатомия для аттестации на категорию., 363.01kb.
- Ф-программа вступительного экзамена в аспирантуру Утверждаю, 254.47kb.
- Морфологические и иммуногистохимические особенности опухолей человека с мутацией рецептора, 353.37kb.
- Патологическая анатомия это медико-биологическая наука, изучающая структурные и морфологические, 1590.52kb.
На правах рукописи
Лапшина Анастасия Михайловна
КЛИНИЧЕСКАЯ И МОРФО-ФУНКЦИОНАЛЬНАЯ ХАРАКТЕРИСТИКА ОПУХОЛЕЙ, ПРОДУЦИРУЮЩИХ АДРЕНОКОРТИКОТРОПНЫЙ ГОРМОН
14.00.03 – эндокринология
14.00.15 – патологическая анатомия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2009
Работа выполнена в ФГУ Эндокринологический научный центр
(директор – академик РАН и РАМН, профессор,
доктор медицинских наук Дедов Иван Иванович)
Научные руководители:
доктор медицинских наук, профессор Марова Евгения Ивановна
доктор медицинских наук Абросимов Александр Юрьевич
Официальные оппоненты:
доктор медицинских наук Бельцевич Дмитрий Германович
доктор медицинских наук, профессор Мацко Дмитрий Евгеньевич
Ведущая организация:
ГОУ ДПО Российская медицинская академия последипломного образования
Защита диссертации состоится « __ » __________ 2009 г. в ___ часов на заседании диссертационного совета Д 208.126.01 при ФГУ Эндокринологический научный центр (117036, Москва, ул. Дм. Ульянова, д. 11).
С диссертацией можно ознакомиться в библиотеке ФГУ Эндокринологический научный центр.
Автореферат разослан « __ » __________ 2009 г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Е.А. Трошина
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
В структуре эндокринных заболеваний, характеризующихся избыточной продукцией адренокортикотропного гормона (АКТГ), главной составляющей является болезнь Иценко-Кушинга (БИК), которая встречается в 85% случаев. АКТГ-эктопический синдром (АКТГ-ЭС) диагностируют реже – до 15% случаев (Марова Е.И., 1999; Дедов И.И., 2000). Причиной БИК являются АКТГ-секретирующие опухоли гипофиза (кортикотропиномы). АКТГ-ЭС обусловлен возникновением различных по локализации и потенциалу злокачественности новообразований (карциноиды легких, тимуса и органов желудочно-кишечного тракта, мелкоклеточный рак легкого, медуллярный рак щитовидной железы и другие), которые также могут продуцировать АКТГ в избыточном количестве (Wajchenberg B.L., 1994).
Клинические проявления столь разнообразных по характеру и локализации опухолей, уровни АКТГ в периферической крови, кортизола в крови и в моче мало отличаются. Особенно сложно установить причину АКТГ-зависимого гиперкортицизма, если не удается выявить источник избыточной секреции АКТГ. Поэтому вопросы дифференциальной диагностики БИК и АКТГ-ЭС являются актуальными (Salgado L.R., 2006).
АКТГ-секретирующие опухоли разнообразны по локализации, морфологическому строению и степени злокачественности (Пальцев М.А. и соавт., 2002; Гуревич Л.Е., 2005). Однако, учитывая общее происхождение указанных новообразований (из клеток диффузной нейроэндокринной системы), отечественные и зарубежные авторы (Мацко Д.Е., 1998; Cortegano L., 1998; Turner H.E., 2003) указывают на сходные гистологические и иммуногистохимические черты кортикотропином и эктопических АКТГ-секретирующих новообразований. В связи с этим необходимо проведение сравнительного анализа гистологических и иммуногистохимических особенностей опухолей для уточнения их функциональной активности, прогнозирования рецидива или продолженного опухолевого роста после хирургического лечения.
Изучению рецепторов соматостатина 1-5 подтипов (РС 1-5), рецепторов дофамина 2 подтипа (РД2) в АКТГ-продуцирующих опухолях гипофиза и негипофизарной локализации в доступной литературе уделено недостаточно внимания, однако имеющиеся данные свидетельствуют, что выявление данных типов рецепторов может влиять на коррекцию лечебной тактики (целесообразность назначения аналогов соматостатина и агонистов дофамина пациентам с БИК и АКТГ-ЭС, у которых не достигнута ремиссия заболевания после удаления вышеуказанных новообразований) (Райхлин Н.Т., 2007; Pivonello R., 2005, 2007).
Таким образом, исследование клинических, гормональных и морфофункциональных особенностей опухолей, продуцирующих АКТГ, является актуальной проблемой, решение которой способствует улучшению клинической диагностики, прогнозированию результатов хирургического вмешательства и оптимизации медикаментозного лечения.
Цель работы
Оценить клинические, гормональные и морфо-функциональные особенности опухолей гипофизарной и негипофизарной локализации у пациентов с БИК и АКТГ-ЭС для разработки критериев клинико-лабораторной и морфологической диагностики, прогнозирования результатов хирургического лечения и теоретического обоснования показаний к назначению аналогов соматостатина и агонистов дофамина.
В соответствии с целью работы поставлены следующие задачи:
- Показать особенности клинической картины, уточнить критерии дифференциальной диагностики и проанализировать результаты хирургического лечения пациентов с БИК и АКТГ-ЭС.
- Представить морфологическую характеристику АКТГ-секретирующих опухолей гипофизарной и негипофизарной локализаций (размер, клеточный состав, митотическая активность, инвазивные и метастатические свойства новообразований) и провести их сравнительный анализ.
- Сравнить кортикотропиномы и эктопические АКТГ-секретирующие опухоли по функциональной активности на основании результатов иммуногистохимических реакций опухолевых клеток с антителами к АКТГ, кортикотропин-рилизинг-гормону (КРГ), пролактину (ПРЛ), соматотропному гормону (СТГ), лютеинизирующему гормону (ЛГ), фолликулостимулирующему гормону (ФСГ).
- Провести сравнительный анализ экспрессии маркера пролиферативной активности (Ki-67), факторов клеточной адгезии (галектин-3) и ангиогенеза (сосудистого эндотелиального ростового фактора - VEGF и CD31) в кортикотропиномах у пациентов с ремиссией и без ремиссии заболевания и эктопических АКТГ-секретирующих опухолях.
- Изучить иммуноэкспрессию рецепторов соматостатина 1-5 подтипов и дофамина 2 подтипа в клетках АКТГ-продуцирующих опухолей гипофиза и негипофизарной локализации.
Научная новизна
Представленная работа является первым в Российской Федерации исследованием, в ходе которого проведено сравнительное изучение кортикотропином и АКТГ-эктопических опухолей во взаимосвязи с их гормональной активностью, экспрессией маркера пролиферации клеток (Ki-67), факторов ангиогенеза (CD31 и VEGF) и клеточной адгезии (галектин-3), а также рецепторов соматостатина 1-5 подтипов и дофамина 2 подтипа с использованием иммуногистохимического исследования (ИГХИ) и в сопоставлении с клинической симптоматикой различных форм АКТГ-зависимого гиперкортицизма и гистологическими особенностями новообразований.
Практическая значимость
Уточнены дифференциально-диагностические признаки различных форм АКТГ-зависимого гиперкортицизма по результатам пробы с десмопрессином.
Установлено прогностическое значение маркера пролиферации клеток Ki-67 для послеоперационного течения болезни Иценко-Кушинга и АКТГ-эктопического синдрома.
Обоснована целесообразность определения иммуноэкспрессии рецепторов соматостатина 1-5 подтипов и дофамина 2 подтипа в опухолях у больных с БИК и АКТГ-эктопическим синдромом для определения показаний к назначению аналогов соматостатина и агонистов дофамина при развитии рецидива заболевания или неполном хирургическом удалении опухолей.
Апробация работы
Апробация диссертации состоялась на межотделенческой научной конференции в ФГУ Эндокринологический научный центр 21 апреля 2009 года.
Результаты исследования были представлены в виде устных докладов на Европейской нейроэндокринологической ассоциации (Афины, 21-24 октября 2006 г.), Балтийском форуме современной эндокринологии (Санкт-Петербург, 1-2 июня 2008 г.) и в виде стендовых докладов на Европейском Конгрессе по эндокринологии (Будапешт, 28 апреля – 2 мая 2007 г.) и Европейской нейроэндокринологической ассоциации (Анталия, 17-20 октября 2008 г.).
Публикации
По теме диссертации опубликовано 6 печатных работ в отечественных и зарубежных изданиях, из них 2 в рецензируемых отечественных научных журналах, рекомендованных ВАК для публикации материалов диссертаций.
Объем и структура диссертации
Диссертация изложена на 123 страницах машинописного текста, состоит из введения, обзора литературы, главы, освещающей материал и методы исследования, двух глав результатов собственных исследований, обсуждения результатов, заключения, выводов, практических рекомендаций и списка литературы, включающего 29 отечественных и 87 зарубежных источников. Работа иллюстрирована 21 рисунком и 19 таблицами.
Внедрение результатов исследования
Результаты работы внедрены в клиническую практику нейроэндокринологического и хирургического отделений ФГУ Эндокринологический научный центр.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
В исследование включены 64 пациента, оперированных по поводу АКТГ-секретирующих опухолей в период с 2000 по 2009 гг., объем удаленных тканей которых был достаточен для гистологического и иммуногистохимического исследований.
В зависимости от локализации новообразований (гипофизарная и негипофизарная) больные были распределены на 2 группы: 46 – с болезнью Иценко-Кушинга и 18 – с АКТГ-эктопическим синдромом. Больные с БИК были разделены в зависимости от наличия или отсутствия ремиссии заболевания: 31 – с ремиссией в течение наблюдаемого периода, 15 – с отсутствием ремиссии.
Обследование больных проводилось на базе отделения нейроэндокринологии ФГУ Эндокринологический научный центр Росмедтехнологий (зав. – д.м.н. Л.Я. Рожинская). Всем пациентам было проведено клиническое обследование, включающее сбор жалоб и анамнестических данных, неврологическое обследование, осмотр офтальмолога для пациентов с БИК и торакального хирурга для пациентов с АКТГ-ЭС (с опухолями легких).
Исследования гормонов в крови и в суточной моче проведены в гормональной лаборатории ФГУ ЭНЦ Росмедтехнологий (руководитель д.м.н., профессор Н.П. Гончаров). Для подтверждения АКТГ-зависимого гиперкортицизма изучили суточный ритм секреции АКТГ в цельной крови с EDTA и кортизола в сыворотке крови в 8.00 и 23.00 часа при помощи радиоиммунного (Immunotech, Чехия) и иммуноферментного методов (Jhonson and Jhonson, Великобритания) соответственно. Избыточными уровнями АКТГ считали выше 66,0 пг/мл в 8.00 и 23.00 часа, кортизола – выше 626,0 нмоль/л в 8.00 и 270 нмоль/л в 23.00 часа. Нарушением ритма суточной секреции АКТГ и кортизола было повышение их концентраций в периферической крови, взятой с 23.00 до 24.00 часов, в 2 и более раза по сравнению с утренними значениями. При анализе уровней АКТГ и кортизола в крови в группах больных рассчитывали их среднесуточные значения (повышением среднесуточного уровня АКТГ считали уровень более 66 пг/мл и кортизола более 448 нмоль/л). Определение суточной экскреции свободного кортизола в моче проводили с использованием иммуноферментного метода. Избыточным уровнем свободного кортизола в моче считали уровень более, чем 413 нмоль в сутки.
Пробы с дексаметазоном (малая и большая) проводили следующим образом. В первый день функционального теста пациенту с БИК или АКТГ-ЭС натощак с 8.00 до 9.00 часов производили забор периферической крови для определения исходного уровня кортизола. В 23.00 часа тех же суток назначали 1 мг дексаметазона (2 таблетки) для малой пробы. На следующий день в 8.00 повторно брали кровь для определения кортизола. Снижение кортизола в крови после проведения теста на 60 и более процентов от исходного уровня считали положительным результатом. Отсутствие значительного снижения кортизола (менее, чем на 60%) в крови после введения 1 мг дексаметазона расценивали как отрицательный результат и наличие гиперкортицизма. Далее проводили большую пробу с дексаметазоном (протокол проведения тот же, что и при малой пробе, только вводимая доза дексаметазона увеличивалась до 8 мг – 16 таблеток). Снижение уровня кортизола после введения 8 мг дексаметазона более, чем на 60% от исходного, расценивали как центральную форму гиперкортицизма, отсутствие значительного снижения уровня кортизола (менее, чем 60%) – как АКТГ-ЭС.
Для изучения особенностей секреции АКТГ и кортизола в крови проводили периферический тест с десмопрессином (ДП) у 21 пациента с БИК и 14 – с АКТГ-ЭС. Контрольная группа состояла из 11 здоровых человек в возрасте от 22 до 49 лет, которым так же выполнили тест с ДП.
Утром натощак пациентам производили забор образцов периферической крови до и через 15, 30, 60 и 120 минут после внутривенного введения 10 мкг ДП. Тест с ДП расценивали как положительный в том случае, если АКТГ повышался более, чем на 100%, а кортизол – на 30% от исходных уровней.
Определение локализации АКТГ-секретирующих опухолей проводилось в отделе лучевой диагностики ЭНЦ (руководитель д.м.н. А.В. Воронцов) Для выявления новообразований всем пациентам проводили магнитно-резонансную томографию (МРТ) головного мозга. Объем (V) опухоли гипофиза вычисляли по формуле объема эллипса, предложенной Bruneton в 1985 г. для определения объема яичников и щитовидной железы: V=0,523xLxWxT, где L – высота гипофиза, W – его ширина, T – переднезадний размер (толщина). В случае отсутствия опухоли в гипофизе проводили дальнейший поиск новообразования, секретирующего АКТГ. Таким пациентам выполнили мультиспиральную компьютерную томографию (МСКТ) органов грудной клетки и/или органов брюшной полости.
МРТ-исследования выполняли на аппаратах «Magnetom Harmony» (фирмы Siemens). Стандартная программа обследования пациента на МРТ состояла из получения МР изображения в 3-х плоскостях как минимум, в режимах Т1 и Т2. МСКТ проводили на аппарате «Somatom Emotion» 16 спиральный (фирмы Siemens).
Всем пациентам с БИК была выполнена трансназальная транссфеноидальная аденомэктомия гипофиза в отделе эндокринной хирургии ФГУ ЭНЦ Росмедтехнологий (руководитель д.м.н., профессор Н.С. Кузнецов). Период наблюдения пациентов после нейрохирургического лечения составил от 10 месяцев до 4 лет.
Пациентам с АКТГ-эктопическими опухолями легких выполнена лобэктомия или резекция доли, в которой находилось новообразование, в хирургическом торакальном отделении Национального Медико-хирургического центра им. Н. И. Пирогова (руководитель д.м.н., профессор А.Ю. Аблицов), пациентке с опухолью почки – нефрэктомия, больным с опухолями тимуса – удаление новообразований переднего средостения в отделении эндокринной хирургии ФГУ ЭНЦ Росмедтехнологий (руководитель д.м.н., профессор Н.С. Кузнецов). Период наблюдения пациентов после хирургического вмешательства составил от 9 месяцев до 8 лет.
Морфологические исследования проведены в отделении патоморфологии ФГУ ЭНЦ Росмедтехнологий (зав. – д.м.н. А.Ю. Абросимов). Морфологический анализ операционного материала включал гистологический и иммуногистохимический методы исследования.
Морфологическую верификацию диагноза аденом гипофиза (базофильные, оксифильные, хромофобные и смешанные) проводили в соответствии с критериями, рекомендованными экспертами ВОЗ (1993 г.), а карциноидных опухолей (типичных, атипичных) легких и бронхов, почек, вилочковой железы, мелкоклеточного рака легкого в соответствии с гистологической классификацией ВОЗ (2004 г.). В аденомах гипофиза подсчитывали митотический индекс следующим образом: в 10 полях зрения по 100 клеток в каждом при увеличении х400 считали количество фигур митоза, затем вычисляли среднюю арифметическую величину подсчитанных фигур митоза во всех полях зрения микроскопа (Автандилов Г.Г., 1990).
ИГХИ проводили на срезах 46 кортикотропином и 18 опухолей, ассоциированных с АКТГ-эктопическим синдромом, с антителами к АКТГ, КРГ, СТГ, ПРЛ, ЛГ, ФСГ, Ki-67, галектину-3, CD31 и VEGF, РС 1-5 и РД2 по стандартной методике. Экспрессия Ki-67 была выявлена в ядрах опухолевых клеток, галектин-3, сосудистый эндотелиальный ростовой фактор (VEGF), РС и РД – в цитоплазме опухолевых клеток, CD31 – в эндотелиальных клетках сосудов опухолей. В 6 кортикотропиномах и 3 опухолях, ассоциированных с АКТГ-ЭС, выполнено ИГХИ по методике двойного окрашивания для выявления двух гормонов в одном срезе опухоли.
Экспрессию АКТГ, КРГ, ПРЛ, СТГ, ЛГ, ФСГ оценивали в 10 полях зрения при увеличении микроскопа х400 как положительную (окрашено более 10% опухолевых клеток) или отрицательную (менее 10%). Экспрессию рецепторов соматостатина, дофамина, галектина-3, VEGF, CD31 оценивали в 10 полях зрения при увеличении микроскопа х400 как положительную (окрашено более 30% клеток опухоли, для CD31 – окраска более 30% эндотелиальных клеток) или отрицательную (менее 30%). Индекс метки (ИМ) Ki-67 исследовали в 5 полях зрения при увеличении микроскопа х400 и рассчитывали как процентное соотношение числа позитивно окрашенных ядер к общему числу ядер в опухоли (общая выборка составила 1000 ядер).
В качестве положительного контроля использовали: для галектина-3, CD31, VEGF – ткань папиллярного рака щитовидной железы, для Ki-67 – ткань лимфоузла, для РС – ткань инсулиномы, для РД2 – ткань соматотропиномы.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Клиническая картина, результаты лабораторных и инструментальных методов обследования у пациентов с болезнью Иценко-Кушинга до нейрохирургического лечения
Проведенный анализ показал, что чаще всего больные с БИК предъявляли жалобы на увеличение массы тела с диспластичным ожирением (87,0%), избыточный рост волос на лице, теле, конечностях (41,3%), багровые стрии на коже передней брюшной стенки, плечах и бедрах (37,0%), отечность лица и стоп (26,1%), гиперпигментацию кожи (13,0%). Кроме того, выявлено повышение уровня артериального давления (82,6%), нарушение менструального цикла у женщин (75,7%) и снижение половой функции у мужчин (40,0%), мышечная слабость проксимальных отделов нижних конечностей (23,9%), снижение остроты зрения в связи со сдавлением хиазмы зрительного нерва (6,5%).
При клиническом обследовании среднесуточные уровни АКТГ в крови составили от 27,5 до 310 пг/мл, медиана 80,9 пг/мл. Среднесуточные уровни кортизола в крови были от 413,5 до 1392 нмоль/л, медиана 624 нмоль/л. Уровень свободного кортизола в суточной моче был повышен у всех больных (от 421 до 6530 нмоль/сутки, медиана 1350,5 нмоль/сутки).
Результаты малой пробы с дексаметазоном (МПД) у 44 (95,7%) пациентов расценили как отрицательные, у остальных 2 больных (4,3%) – как положительные. Большая проба с дексаметазоном (ПБД) оказалась положительной у 36 (78,3%) больных, у остальных 10 (21,7%) – отрицательной.
После проведения периферического теста с десмопрессином у 15 (71,4%) больных была достигнута адекватная стимуляция секреции АКТГ и кортизола. Значения АКТГ выросли в 3-9 раз от исходного уровня с максимальным подъемом на 15 минуте после введения десмопрессина (медиана максимального подъема составила 266%). Содержание кортизола в крови увеличилось в 1,4 – 3 раза от исходного через 15 – 30 минут после повышения АКТГ (медиана максимального уровня кортизола составила 95,5%). К 120 минуте теста было отмечено снижение АКТГ и кортизол.
После проведения МР-исследования головного мозга объем опухолей гипофиза составил от 11 до 7594 мм3, медиана 169,5 мм3. У 31 (67,4%) пациента выявили микроаденомы гипофиза. Топографически большинство кортикотропином являлись эндоселлярными новообразованиями (n=36, 78,3%), 10 (21,7%) – селлярно-экстраселлярными, из которых 5 (10,9%) были эндосупраселлярными опухолями, 2 (4,3%) эндопараселлярными (одна из них распространялась в кавернозный синус), 1 (2,8%) – параселлярной, 1 (2,8%) эндосупрапараселлярной и 1 (2,8%) парасупраселлярной с прорастанием в правый кавернозный синус и прилежанием к хиазме.
Динамика симптоматики, лабораторных и инструментальных данных у пациентов с болезнью Иценко-Кушинга после нейрохирургического лечения
П
норма
пг/мл
нмоль/л
нмоль/суткил


норма
осле удаления кортикотропином в течение периода времени от 10 месяцев до 4 лет было установлено, что у 31 (67,4%) пациента развилась ремиссия заболевания, у которых отмечено исчезновение указанных симптомов гиперкортицизма. У 30 человек из 31 возникли клинические признаки недостаточности коры надпочечников, у 28 из них сразу после хирургического лечения, у остальных – через 2 и 11 месяцев. У этих больных появились жалобы на выраженную слабость, головокружение, тошноту, что потребовало назначения заместительной гормональной терапии глюкокортикоидами. При дальнейшем наблюдении в сроки от 3 месяцев до 3 лет у 14 (45,2%) пациентов наблюдалось восстановление секреции глюкокортикоидов на основании клинико-лабораторных данных. Заместительная гормональная терапия этим больным была отменена. Динамика уровней АКТГ и кортизола показана на рис. 1.
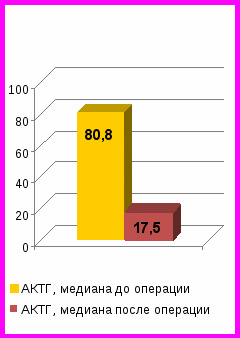
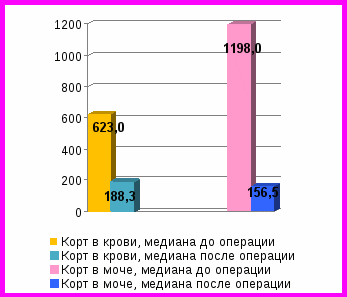
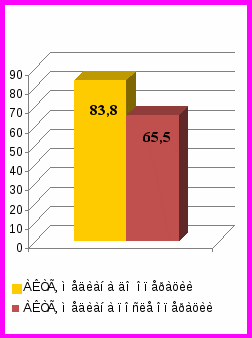
Рис. 1. Динамика среднесуточных уровней АКТГ и кортизола в крови, свободного кортизола в моче у пациентов с ремиссией БИК до и после удаления опухолей гипофиза
У всех пациентов с ремиссией заболевания МПД была положительной.
Динамическое МР-исследование показало, что у 10 (32,3%) пациентов после нейрохирургического вмешательства имелся синдром вторичного "пустого" турецкого седла (ПТС), у одного из них – ПТС с кистозными изменениями в структуре аденогипофиза, у одного – ПТС с очагом дополнительной ткани в турецком седле. В 8 (25,8%) случаях наблюдали кистозные изменения в структуре аденогипофиза, среди которых так же присутствовали дополнительная ткань (1) и рубцовые изменения (1). У 4 (12,9%) больных данное исследование не определило изменений гипофиза. У 4 (12,9%) человек выявили очаговую, у 3 (9,7%) – диффузную неоднородности гипофиза, у одного (3,2%) – деформацию гипофиза, у одного (3,2%) – очаг дополнительной ткани в турецком седле.
В исходе аденомэктомии у 15 (32,6%) пациентов полной ремиссии не наблюдалось: у 6 (13,0%) человек улучшения состояния не выявили в связи с сохранением активной фазы заболевания, у 4 (8,7%) установили уменьшение или исчезновение одних и сохранение других симптомов гиперкотицизма (неполная ремиссия). У 5 (10,9%) больных было отмечено исчезновение признаков гиперкортицизма, из них у 4 развились клинические признаки надпочечниковой недостаточности. В сроки от 6 месяцев до 4 лет у этих пациентов диагностирован рецидив клиники БИК. Динамика уровней АКТГ и кортизола после хирургического лечения показана на рис. 2.