Разработка технологии электролиза гранулированного медно-никелевого файнштейна
| Вид материала | Автореферат диссертации |
СодержаниеВ третьей главе В четвертой главе |
- Задачи : Изучить теоретический материал по способам добычи полезных ископаемых. Изучить, 201.4kb.
- Ёнович минералого-геохимические особенности рудоносных метасоматитов и перспективы, 260.03kb.
- Разработка ресурсосберегающей технологии получения и использования никелевого концентрата, 307.93kb.
- Разработка технологии плавки сульфидных медно-никелевых концентратов с оптимальными, 234.68kb.
- Применение нестационарного электролиза в технологии анодной обработки алюминиевой фольги, 188.99kb.
- 5 сентября 2012 г. 7 сентября 2012 г., срок заявок: 15 августа 2012, 24.29kb.
- В. О. Чуканов московский инженерно-физический институт (государственный университет), 95.21kb.
- Разработка технологии выращивания ярового, 230.03kb.
- Разработка технологии очистки нефтесодержащих сточных вод с использованием смешанного, 309.65kb.
- Исследование закономерностей и разработка технологии окатывания медьсодержащих материалов, 378.14kb.
В третьей главе рассмотрены особенности электрохимического окисления сульфидов меди, никеля и файнштейнов, охлажденных с различными скоростями. Пояснена последовательность электрохимического окисления фазовых составляющих файнштенйна. Рассчитаны скорости окисления сульфидов меди, никеля и файнштейнов.
Электрохимическое окисление сульфидных медных и никелевых сплавов в растворе серной кислоты протекает с образованием промежуточных и конечных труднорастворимых продуктов по реакциям:
Ni3S2 - 6e¯ = 3Ni2+ + 2S0, (1)
Ni3S2 - 2e¯ = 2NiS + Ni2+, (2)
2NiS - 4e¯ = 2Ni2+ +2 S0, (3)
Cu2-хS - 2e¯= CuS + (1-х)Cu2+, (4)
CuS - 2e¯ = Cu2+ + S0 . (5)
Согласно данным термодинамического моделирования, в системе Cu-S-H2O в интервалах pH от 0 до 2 и потенциалах до 0,5 В устойчивыми формами являются сульфидные соединения. При потенциале около 0,5 В возможно окисление Cu2S до CuS и Cu2+, а выше 0,5 В - переход катионов меди из CuS в раствор. В системе Ni-S-H2O при pH от 0 до 1 и потенциалах до 0,25 В окисление Ni3S2 протекает с образованием элементной серы, а при pH от 1 до 2 – с образованием NiS. При потенциале выше 0,5 В в интервалах pH до 7 окисление Ni3S2 вероятно с образованием NiS и NiS2. Полный переход никеля из сульфидов в раствор возможен при потенциале анода выше 0,5 В. Область выделения элементной серы находится в интервале потенциалов до 0,5 В и pH до 2. С одной стороны область ограничена стабильностью сульфат-ионов при потенциале выше 0,5 В, с другой – условиями окисления сульфидов. При потенциале выше 2,0 В возможно образование тиосульфат-иона.
Для уточнения химизма процессов электрохимического окисления сульфидов меди, никеля и файнштейнов, изучены твердые продукты формирующиеся на поверхности при наложении потенциала. Формирование пассивирующего слоя труднорастворимых продуктов на поверхности сульфидов, охлажденных со скоростью 10 град/с, проводили в течение 15-240 минут при плотности тока 1000 А/м2 в растворе серной кислоты 100 г/дм3. По данным РФА и МРСА (рис. 4), сульфиды окисляются с образованием промежуточных сульфидов и серы, формирующих пассивирующую пленку. При электрохимическом окислении медно-никелевого файнштейна, основными продуктами, образующимися на поверхности анода, являются элементная сера, сульфиды меди - CuS, Cu1,8S, Cu1,75S и сульфиды никеля - NiS, Ni7S6 . Процесс окисления протекает ступенчато: Cu1,96S→ Cu1,8S → Cu1,75S → CuS → CuSO4 + S; Ni3S2 → NiS → NiSO4 + S.
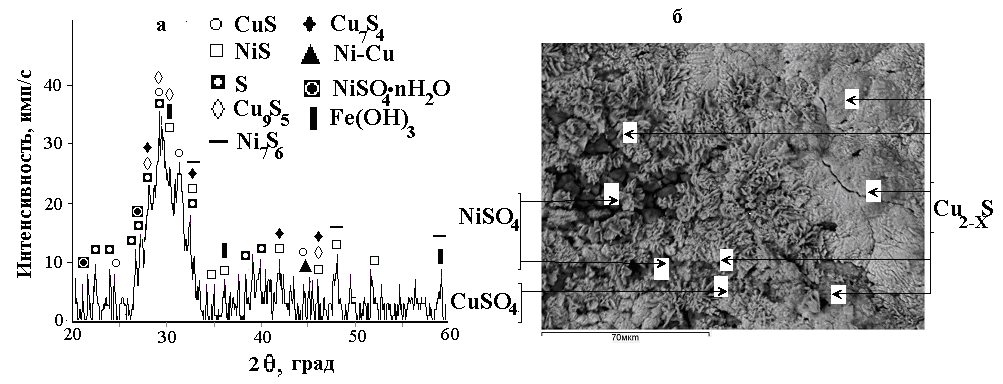
Рисунок 4 - Рентгенограмма (а) и вид (б) поверхности электрода из медно-никелевого файнштейна после электрохимического окисления
Методом вольтамперометрии с линейной разверткой потенциала исследовано анодное окисление индивидуальных сульфидов никеля, меди и файнштейнов, охлажденных с различными скоростями. Определены потенциалы начала окисления фаз (табл. 4), токи и последовательность окисления фазовых составляющих медно-никелевых сульфидных сплавов.
Таблица 4 – Потенциалы (φ) и токи (i) окисления сульфидов, охлажденных с различными скоростями (н – начало, п – экстремум)
| Фаза | Никель- медь | Сульфид меди | Сульфид никеля | |||||||
| Образец | Охлаждение 10 град/с | |||||||||
| φн/φп, мВ | iн/ iп, А/м2 | φн/φп, мВ | iн/ iп, А/м2 | φн/φп, мВ | iн/ iп, А/м2 | φн/φп, мВ | iн/ iп, А/м2 | |||
| Сульфид никеля | | | | | 770/1290 | 25/3715 | -/1465 | -/3315 | ||
| Сульфид меди | | | 190/795 | 165/2655 | | | | | ||
| Никелевый файнштейн | 95/370 | 308/2100 | | | 78/1180 | 130/3900 | -/1300 | -/4000 | ||
| Медно– никелевый файнштейн | 170/450 | 165/2160 | -/550 | -/2250 | 875/1225 | 830 | -/1300 | -/4115 | ||
| Охлаждение 103 град/с | ||||||||||
| Сульфид никеля | | | | | 910/1310 | 15/3620 | -/1480 | -/3410 | ||
| Сульфид меди | | | 210/920 | 1,5/5355 | | | | | ||
| Никелевый файнштейн | - | - | | | 860/1130 | 85/2070 | -/1360 | -3780 | ||
| Медно–никелевый файнштейн | - | - | 110/725 | 0/1665 | 850/1470 | 400/2130 | | | ||
Согласно вольтамперометрическим данным электрохимическое окисление медленно охлажденного сульфида никеля начинается при потенциале 0,770 В (рис. 5), достигает максимума, затем процесс переходит в состояние пассивации, сопровождаемое снижением скорости окисления. Появление излома на потенциометрической кривой объяснено окислением Ni3S2 с образованием NiS. Гранулированный образец начинает окисляться при большем потенциале и имеет два максимума на кривой φ - i, что связано со ступенчатым механизмом окисления хизлевудита. Электрохимическое окисление кристаллизованного и гранулированного сульфидов меди начинается при близких потенциалах. Экстремумы на кривых φ - i соответствуют окислению Cu1,96S до CuS, затем CuS до Cu2+ и S.
Нахождение сульфидных и металлических фаз в виде сплава (файнштейна) также влияет на потенциалы их окисления (рис. 6). Потенциалы начала окисления фазовых составляющих гранулированных никелевого и медно-никелевого файнштйенов имеют сдвиг в сторону более положительных значений, относительно кристаллизованных образцов.
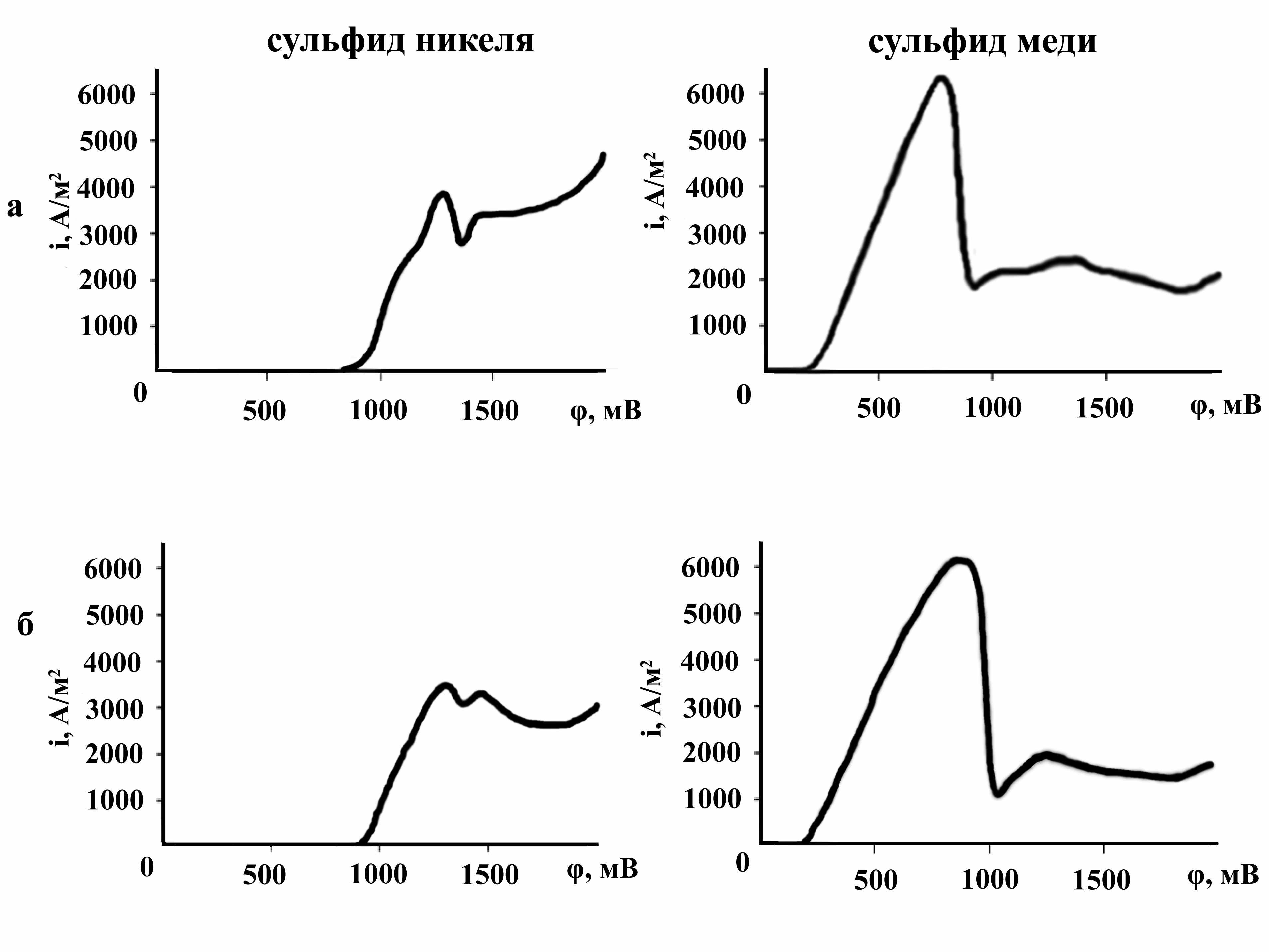
Рисунок 5 - Вольтамперометрические кривые электрохимического окисления кристаллизованных (а) и гранулированных (б) образцов сульфидов
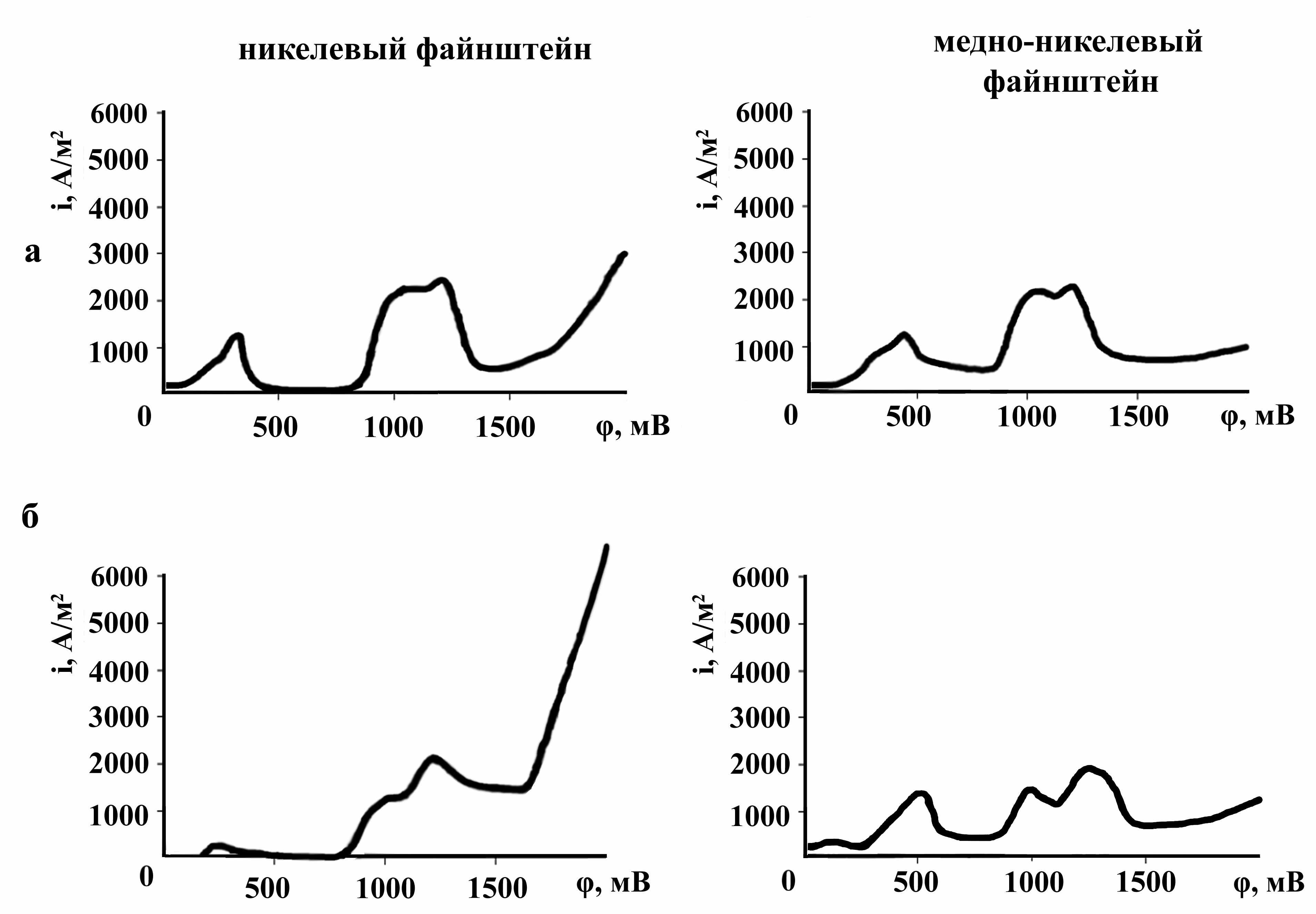
Рисунок 6 - Вольтамперометрические кривые электрохимического окисления кристаллизованных (а) и гранулированных (б) файнштейнов
Сдвиг потенциалов начала окисления фаз и изменение форм потенциометрических кривых окисления файнштейнов, полученных при различных скоростях охлаждения, связаны со структурой образцов и формами нахождения металлов. С поверхности образца медленно охлажденного файнштейна первоначально протекает окисление металлизированной фазы, а затем - сульфидов. С поверхности гранулированного образца происходит окисление сульфидной серы с образованием промежуточных продуктов реакции (Ni1+xS, Cu1+xS), а затем сульфидной серы с переводом металлов в раствор.
Удельная скорость окисления сульфидов определена из хроноамперометрических кривых (рис. 7) как отношение массы окисленного вещества (m) к площади анода (S) и продолжительности окисления (τ): v = m/τ·S, г/с∙мм2. Масса окисленного вещества определена интегрированием площади под амперометрической кривой, г:
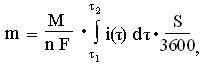 (8)
(8)где M – молярная масса окисляемого элемента, г/моль; n – число электронов, участвующих в реакции окисления; F – постоянная Фарадя, А·ч; τ1, τ 2 – время начала и окончания окисления, соответственно, с; i – плотность тока, А/м2.
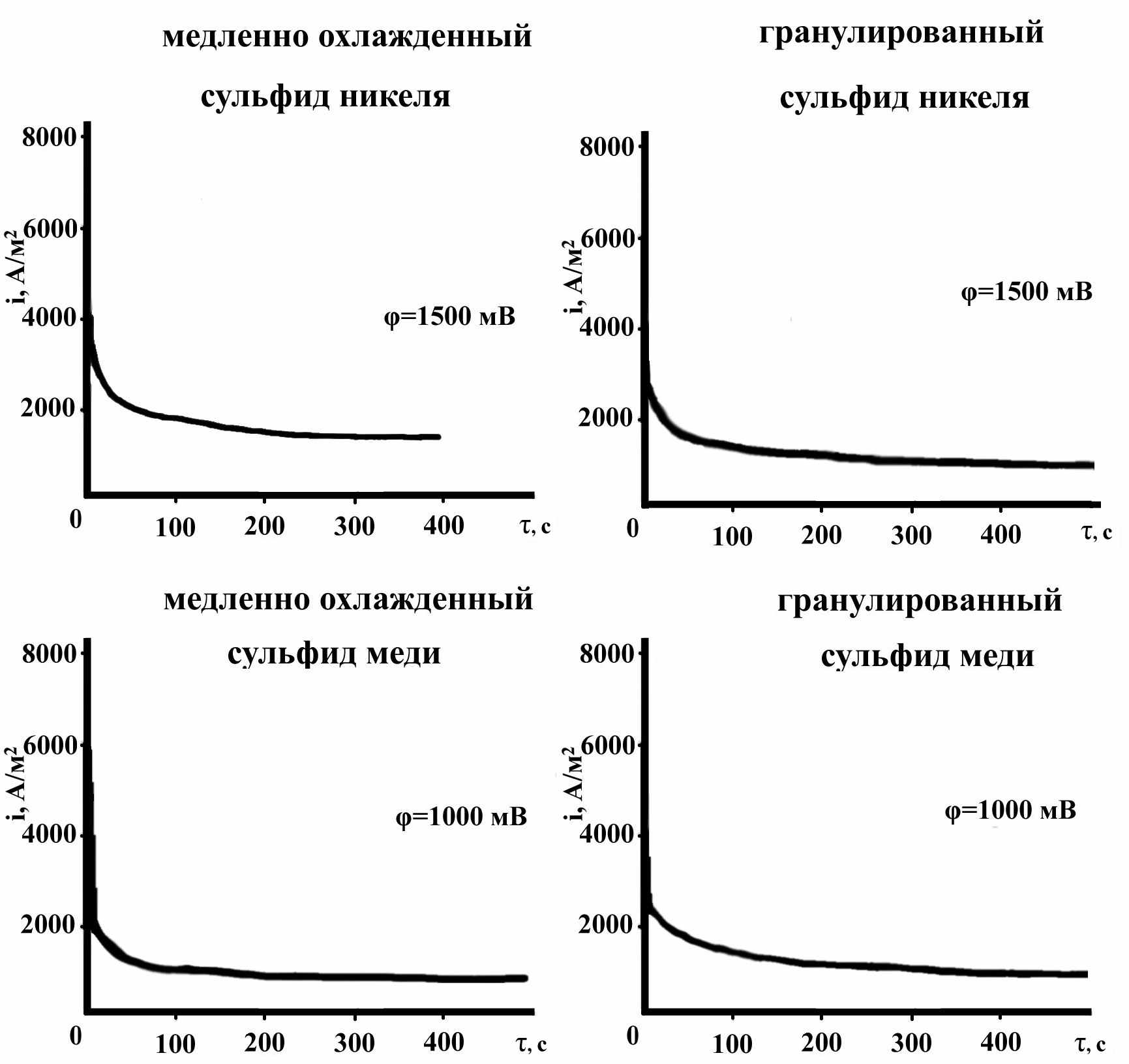
Рисунок 7 - Хроноамперометрические кривые электрохимического окисления сульфидов
Как следует из полученных данных, скорости окисления гранулированных сульфидов меди (табл. 5) и никеля, превышают значения, характерные для кристаллизованных образцов почти в два раза. В начальный период скорость окисления кристаллизованного медно-никелевого файнштейна имеет большее значение, чем гранулированного. Это связано с преимущественным окислением металлической составляющей файнштейна. В соответствие с полученными данными можно полагать, что после пассивации поверхности медно-никелевого файнштейна растворение анода лимитируется диффузией ионов через пассивирующий слой.
Таблица 5 – Скорости электрохимического окисления кристаллизованных и гранулированных сульфидов, г/с∙мм2
| Образец | vохл =10 град/c | vохл =103 град/c |
| Сульфид никеля | 8,8∙10-8 (φ = 1500 мВ) | 1,3∙10-7 (φ = 1500 мВ) |
| Сульфид меди | 2,8∙10-8 (φ = 1000 мВ) | 4,3∙10-8 (φ = 1000 мВ) |
| Медно-никелевый файнштейн | 1,6∙10-7 (φ = 1000 мВ) | 5,5∙10-8 (φ = 1000 мВ) |
Таким образом, предельные скорости электрохимического окисления гранулированных и медленно охлажденных образцов определяются растворением промежуточных сульфидов и диффузией через пассивирующий слой реагентов и продуктов реакций. Исходя из того, что поверхность литого анода и гранулированного файнштейна различаются на несколько порядков, можно полагать, что диффузионные ограничения, связанные с пассивацией поверхности в последнем случае будут существенно меньше.
В четвертой главе проведено обоснование параметров электролиза гранулированного файнштейна. Показана возможность ведения электролиза гранулированных сульфидных медно-никелевых сплавов в растворе серной кислоты.
Эксперименты по электролизу выполнены на лабораторном электролизере (рис. 8), изготовленном из оргстекла. Токоподводящие электроды имели площадь 0,01 м2. Анодная плотность тока (iа) определена как отношение подводимого тока к поверхности загружаемых гранул исходя из их среднего диаметра. Эксперименты проведены (табл. 6) при варьировании анодной плотности тока от 13 до 86 А/м2, катодной (iк) – 300 ÷ 600 А/м2 и напряжении на электродах 1,4 ÷ 3,8 В. В качестве исходного электролита взят водный раствор серной кислоты (100 г/дм3). Продолжительность опытов - 8-11 часов. Эксперименты проведены без циркуляции и без очистки электролита. В качестве исходного материала был использован гранулированный медно-никелевый файнштейн с крупностью гранул 0,63-5 мм.
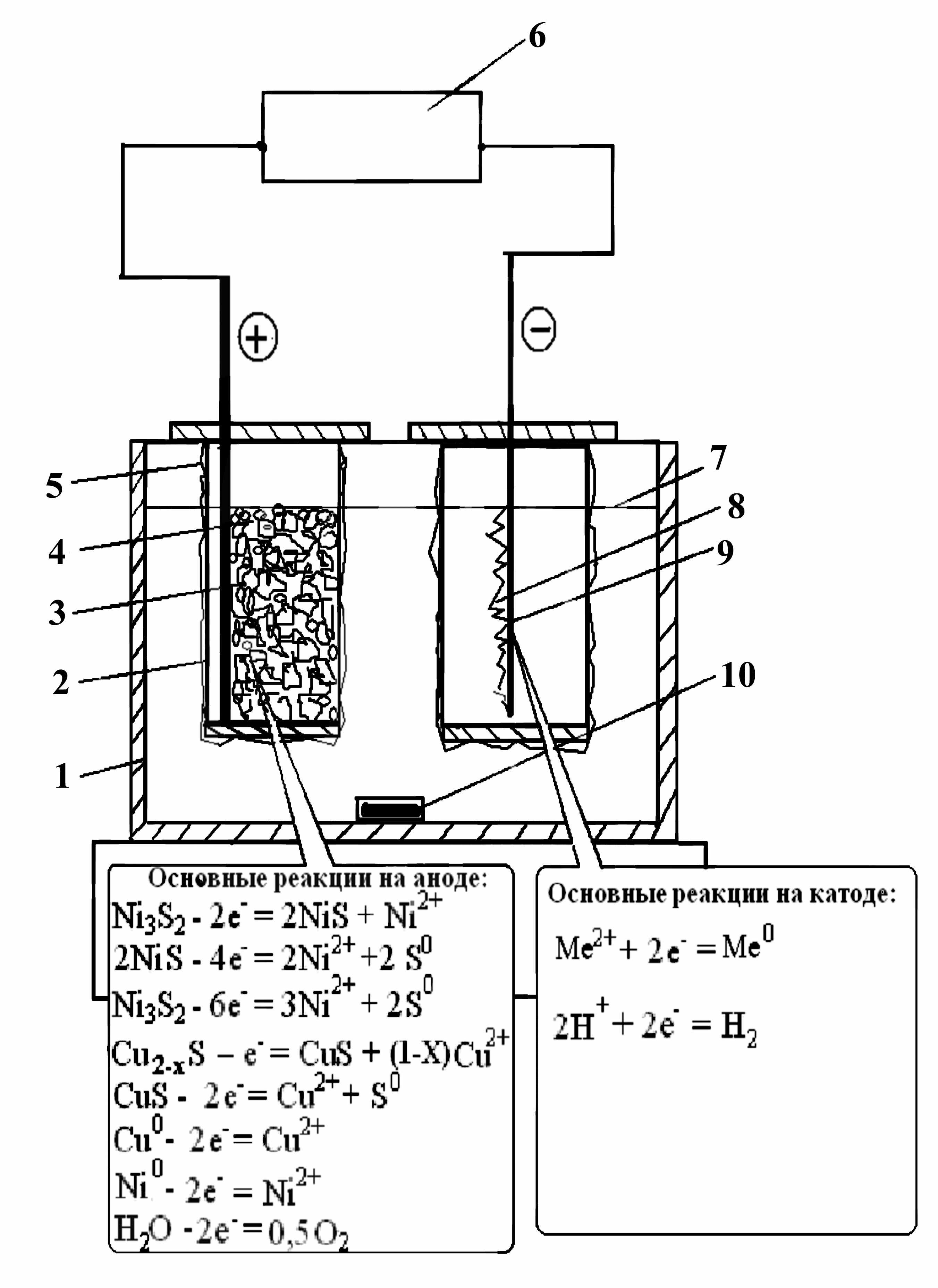
1 - корпус электролизера,
2 - анодная камера,
3 - анод из платинированного
титана,
4 - гранулированный
файнштейн,
5 - фильтроткань,
6 - источник питания,
7 - уровень электролита,
8 - катодный осадок,
9 - катод из нержавеющей
стали,
10 - магнитная мешалка
Рисунок 8 - Схема установки для электролиза гранулированного файнштейна
Таблица 6 - Параметры и показатели электролиза файнштейна
| № опыта | mн,г | iа, А/м2 | iк, А/м2 | U,В | Q, А·ч | ηаs,% | ηаCu,% | ηаNi,% | ηкCu,% |
| 1 | 400 | 13,0 | 300 | 1,4 | 30,0 | 68,8 | 22,3 | 19,7 | 37,7 |
| 2 | 400 | 26,0 | 600 | 2,4 | 66,0 | 54,3 | 23,8 | 12,9 | 42,3 |
| 3 | 200 | 38,8 | 450 | 3,0 | 40,5 | 46,9 | 27,0 | 8,1 | 41,5 |
| 4 | 100 | 86,4 | 500 | 3,8 | 45,0 | 8,24 | 5,42 | 0,8 | 4,2 |
Электролиз гранулированного файнштейна сопровождается насыщением раствора ионами металлов, выделением меди на катоде и шламообразованием. Полагая, что процессы на аноде сопряжены с окислением металлов и серы, а также разложения воды с образованием кислорода принято, что анодный выход (ηа) по току составит: ηа = ηаCu + ηаNi + ηаS + ηаО. Катодный выход по току принят из затрат электричества на осаждение меди и образование водорода: ηк = ηкCu + ηкH.
Согласно полученным данным (рис. 9), повышение напряжения и плотности тока снижают показатели процесса. Согласно данным химического анализа проб катодных осадков (табл. 7) и электролита по завершению опытов, существует взаимосвязь между составом продуктов и энергетическими характеристиками электролиза. В ходе растворения происходит рост содержания примесных элементов в электролите и, соответственно, в катодном осадке. Для получения на катоде качественного порошка меди, концентрации примесей в электролите не должны превышать, г/дм3: 20,0 Ni, 3 Fe и 0,5 Co.
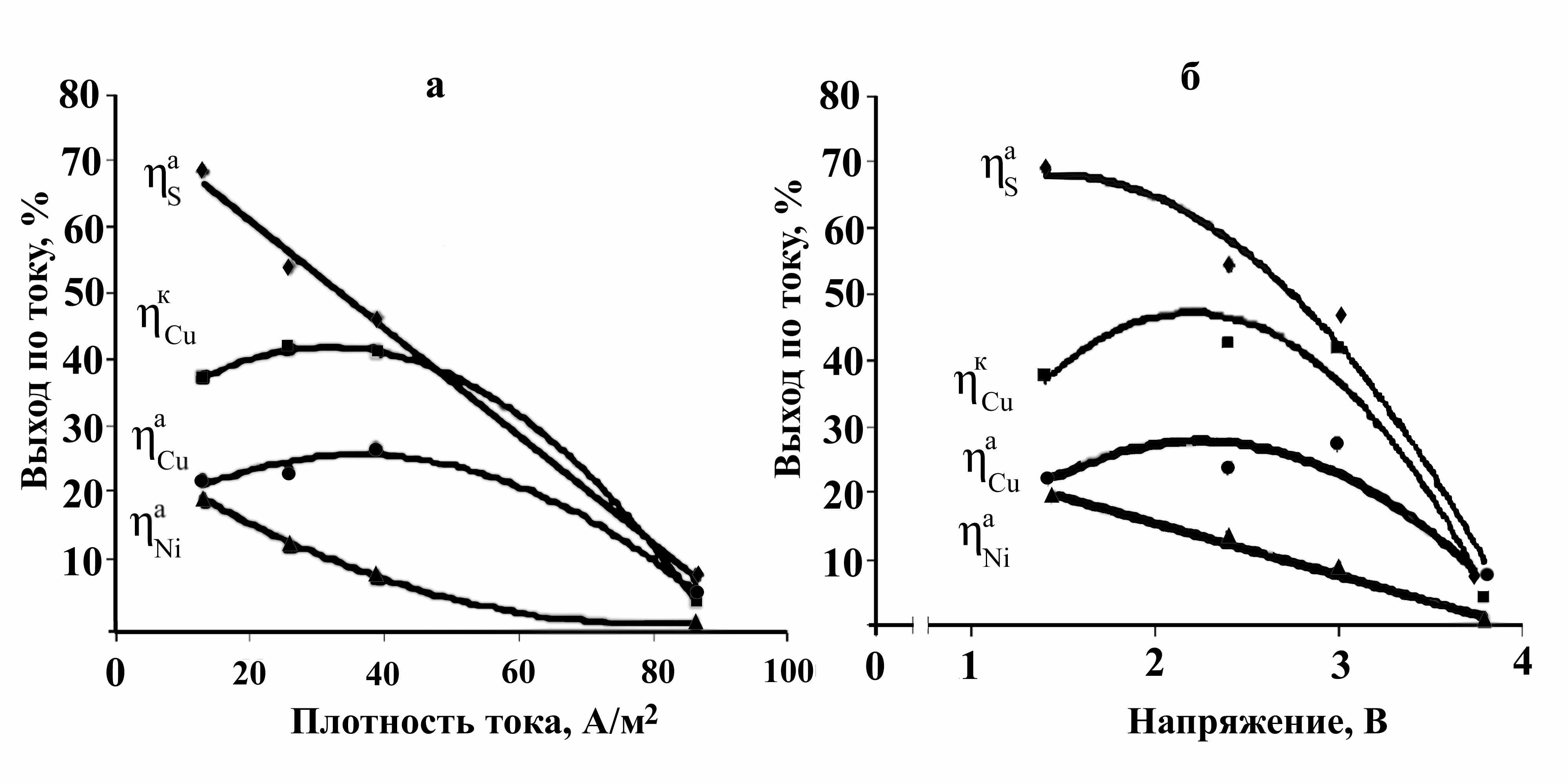
Рисунок 9 - Зависимости анодных и катодных выходов по току от анодной плотности тока (а) и напряжения на ванне (б)
Таблица 7 – Содержание примесей в катодной меди и составы электролита при электролизе файнштейна
| № опыта | Содержание в катодной меди, % | Содержание в растворе, г/дм3 | |||||
| Ni | Fe | Co | Ni | Сu | Fe | Co | |
| 1 | 1,50 | 0,11 | 0,032 | 10,6 | 2,2 | 1,0 | 0,2 |
| 2 | 1,42 | 0,11 | 0,032 | 30,3 | 4,6 | 2,9 | 0,5 |
| 3 | 0,09 | 0,24 | 0,004 | 0,1 | 5,9 | 1,1 | 0,2 |
| 4 | 0,01 | 0,01 | 0,013 | 3,82 | 1,2 | 0,5 | 0,0 |
Увеличение плотности тока с одной стороны, ведет к интенсификации электрохимического окисления файнштейна, с другой - способствует образованию промежуточных сульфидов и элементной серы. Если скорость растворения промежуточных сульфидов ниже скорости окисления файнштейна, происходит пассивация гранул не только конечным продуктом – элементной серой, но и промежуточными сульфидами. При напряжении более 3 В происходит разложение воды, что ведет к снижению выходов по току для металлов и серы.
Длительный эксперимент по электролизу файнштейна выполнен при анодной плотности тока 25 А/м2, катодной - 600 А/м2 и напряжении на ванне 2,5 В. Согласно полученным данным, до насыщения электролита по примесным металлам, катодный осадок, содержит, %: не менее 99,69 Cu и не более 0,29 Ni, 0,008 Fe, 0,001 Co, 0,008 S. Содержание металлов в электролите при этом не превышало, г/дм3: 23,1 Ni, 4,74 Cu, 3,03 Fe, 0,510 Co. Анодный шлам содержал, %: 2,55 Cu, 9,71 Ni, Fe 0,22, 80,0 S, 0,24 Co и драгоценные металлы. Согласно данным РФА и МРСА шлам анодного растворения образован продуктами электроокисления файнштейна до 70% - элементная сера, сульфиды CuS, NiS и незначительное количество недоокисленных исходных сульфидов - Ni3S2 и Cu1,96S (от наиболее крупных гранул).
Для масштабирования процесса, предложена конструкция укрупненного электролизера (рис. 10) производительностью 1 кг файнштейна в час. Согласно тепловому балансу, электролиз в таком аппарате сопровождается разогревом. Для поддержания заданных концентраций примесных элементов и температуры электролита около 40 oC, скорость циркуляции электролита должна составлять 10 дм3/ч.
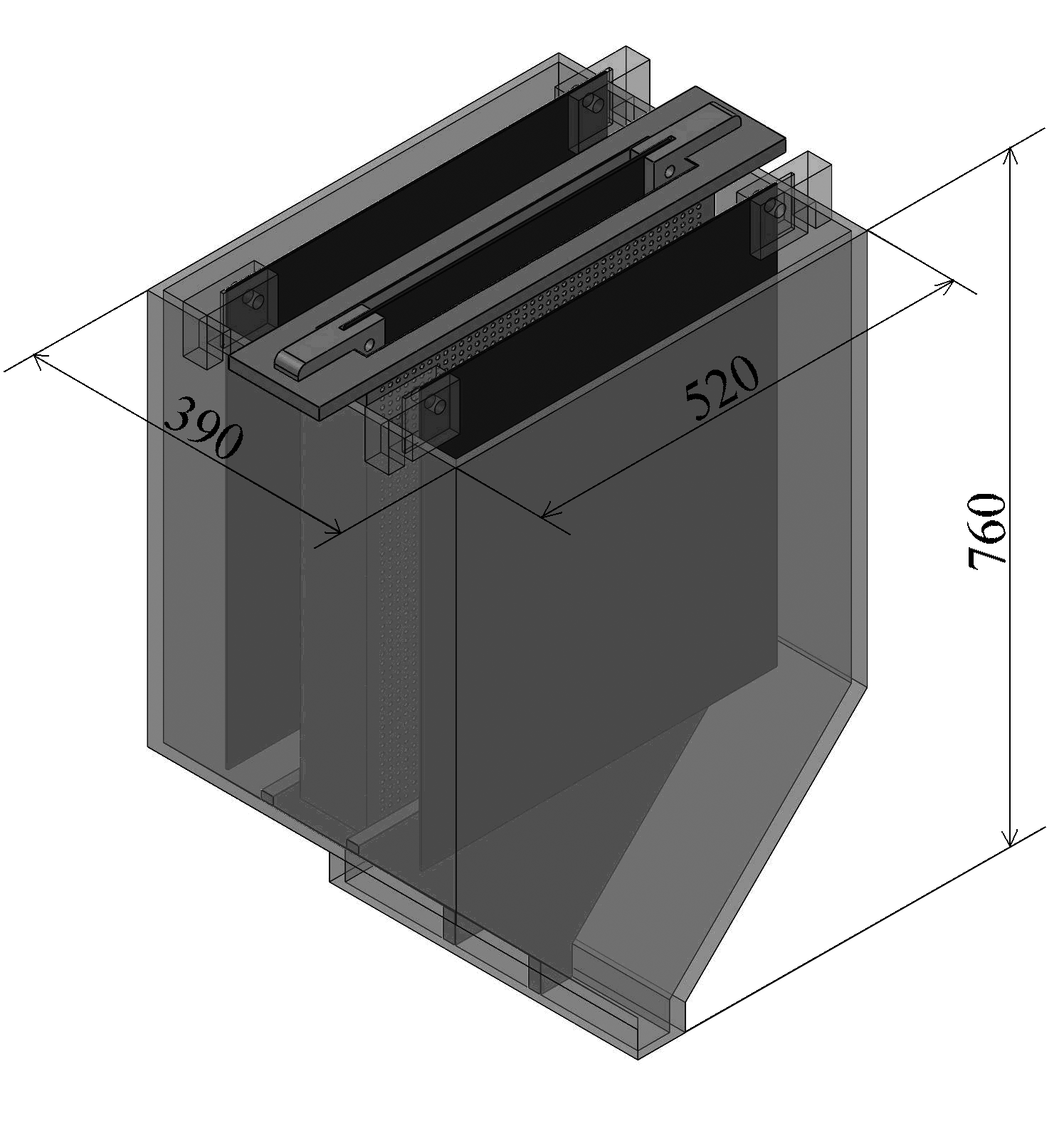
Рисунок 10 – Предлагаемая модель электролизера для переработки гранулированного медно-никелевого файнштейна
По данным материального баланса, прямое извлечение меди в товарный продукт составляет 89 %, никеля в электролит – 99,5 %, а серы в шлам – 97,3% (68,1 % в элементном состоянии).
Процесс электролиза имеет следующие показатели: анодная плотность тока (iа ) - 25 A/м2, катодная плотность тока (iк ) - 400 A/м2, напряжение на ванне (U) - 2,5 ÷ 2,8 В, скорость циркуляции электролита (υ) - 10 дм3/ч, температура электролита (t) - 40oC, удельный расход электроэнергии (W) - 2250 кВт·ч на тонну файнштейна, анодный выход по току (ηа) - 90 %, катодный выход по току (ηк) - 60 %.
