Образовательный стандарт высшего профессионального образования Алтгту. Образовательный стандарт
| Вид материала | Образовательный стандарт |
Содержание4.2 Организация самостоятельной работы студентов по дисциплине 4.3 Элементы научного поиска при изучении дисциплины Стандарт согласован C – ch-ch Hc≡c-c − ch Приложение б |
- Образовательный стандарт высшего профессионального образования Алтгту. Образовательный, 498.42kb.
- Образовательный стандарт высшего профессионального образования Алтгту. Образовательный, 370.41kb.
- Образовательный стандарт высшего профессионального образования Алтгту. Образовательный, 475.64kb.
- Образовательный стандарт высшего профессионального образования Алтгту. Образовательный, 478.33kb.
- Образовательный стандарт высшего профессионального образования Алтгту. Образовательный, 228.36kb.
- Образовательный стандарт высшего профессионального образования Алтгту. Образовательный, 368.96kb.
- Образовательный стандарт высшего профессионального образования Алтгту. Образовательный, 272.82kb.
- Образовательный стандарт высшего профессионального образования Алтгту. Образовательный, 591.7kb.
- Образовательный стандарт высшего профессионального образования Алтгту образовательный, 252.98kb.
- Образовательный стандарт высшего профессионального образования Алтгту образовательный, 360.24kb.
4.2 Организация самостоятельной работы студентов по дисциплине
- Для обеспечения выполнения студентами самостоятельного изучения теоретических вопросов предложена основная и дополнительная литература.
- Для решения индивидуальных заданий на практических занятиях приводятся примеры решения задач, проводятся консультации не реже 1 раз в 2 недели.
4.3 Элементы научного поиска при изучении дисциплины
При изучении дисциплины используются следующие формы и методы привлечения студентов к самостоятельной творческой деятельности:
элементы творчества являются обязательными при выполнении индивидуальных контрольных заданий, по которым студенты используют справочную литературу по тематике курса;
желающим студентам в качестве дополнительной творческой работы предлагается реферирование научной и периодической литературы по наиболее сложным и актуальным темам дисциплины.
Разработчик:
Ст.преподаватель кафедры ФиТКМ ________________Н.Б.Холодова
должность подпись инициалы и фамилия
Стандарт согласован:
Зав. кафедрой ФиТКМ ________________ В.Б.Маркин
должность подпись инициалы и фамилия
Председатель ФКМКО ________________Ю.А.Осокин
должность подпись инициалы и фамилия
Декан ФИТиБ ________________ В.Б.Маркин
должность подпись инициалы и фамилия
Начальник ОМКО АлтГТУ ________________Н.П.Щербаков
должность подпись инициалы и фамилия
ПРИЛОЖЕНИЕ А
Контролирующие материалы по дисциплине «Органическая химия»
Вопросы текущего контроля знаний по темам «Номенклатура органическихсоединений»
(2 семестр)
- Напишите структурную формулу тетраметилметана и назовите его по международной номенклатуре.
- Назовите по международной номенклатуре H3C-CH-CH2-C≡CH

C2H5
- Напишите структурную формулу диметилпропилметана и назовите его по международной номенклатуре.
- Назовите по международной номенклатуре
CH3-CH=CH-CH=CH2
- Напишите структурную формулу несимметричного диэтилэтилена и назовите его по международной номенклатуре.
- Назовите по международной номенклатуре
CH3 CH3

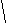
CH3-CH- CH2- CH2-C-CH3
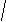
CH3
- Напишите структурную формулу 2,2-диметил-5-этилгептана.
- Назовите по рациональной номенклатуре
CH3
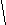
HC≡C-CH
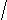
CH3
- Напишите структурную формулу изобутилацетилена.
- Назовите по международной номенклатуре
(H3C)2C=CH-CH=C(CH3)2
- Напишите структурную формулу 2,2,4-триметилпентана и укажите его эмпирическое название.
- Назовите по рациональной номенклатуре
HC≡C-CH-CH2-CH3

CH3
- Напишите структурную формулу дипропилизопропилметана.
- Назовите по международной номенклатуре
H3C-CH-CH=CH-CH3

CH3
- Напишите структурную формулу изопропилацетилена.
- Назовите по международной номенклатуре
H
 3C-CH-CH-CH3
3C-CH-CH-CH3
CH3 CH2

CH3
- Напишите структурную формулу 1,3-гексадиена.
- Назовите по рациональной номенклатуре
H
 3C
3CCH-CH=CH2

H3C
- Напишите структурную формулу симметричного диизопропилэтилена.
- Назовите по международной номенклатуре
CH3

H
 3C - CH2 – C – CH - CH3
3C - CH2 – C – CH - CH3
 CH3 CH2
CH3 CH2CH3
- Напишите структурную формулу 2,3-диметилпентана.
- Назовите по рациональной номенклатуре
H2C=CH-CH=CH2
- Напишите структурную формулу 4-метилпентена-2.
- Назовите по рациональной номенклатуре
CH3

H3C – C (C2H5)

H3 C – CH-CH3
- Напишите структурную формулу 1,3-гексадиен-5-ина.
- Назовите по рациональной номенклатуре
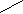 (C2H5)
(C2H5)H2C=C
(
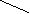 C2H5)
C2H5)- Напишите структурную формулу 3-метилбутина-1.
- Назовите по рациональной номенклатуре
H3C−CH−CH3
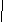
CH3
- Напишите структурную формулу изопропилацетилена.
- Назовите по международной номенклатуре
H3C-CH2-CH-CH3
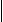
CH2
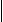
CH3
- Напишите структурную формулу трет-бутилацетилена.
- Назовите по международной номенклатуре
H3C – CH2 – CH2 – CH – CH2 – CH2 – CH3

H3C – CH – CH3
- Напишите структурную формулу 4-метилгексина-1.
- Назовите по рациональной номенклатуре
CH3

H3C – C – CH3

CH3
- Напишите структурную формулу 1,3-пентадиена.
- Назовите по рациональной номенклатуре
H3C – CH – CH2 – CH2 – CH3

CH3
- Напишите структурную формулу 2,2,5-триметилгексана.
- Назовите по рациональной номенклатуре
H3C – CH2

C=CH2

H3C – CH2
- Напишите структурную формулу 2,2,5-триметилгексана.
- Назовите по рациональной номенклатуре
CH3
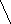
H3C – C – CH2 – CH2 – CH – CH2 – CH3
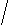
 CH3 CH2CH3
CH3 CH2CH3- Напишите структурную формулу 2,5-диметилгексадиена-2,4.
- Назовите по рациональной номенклатуре
CH3

HC≡C – CH2 – CH
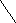
CH3
- Напишите структурную формулу вторбутилацетилена.
- Назовите по международной номенклатуре
CH3

H3C – CH – CH2 – C – CH3

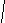
CH3 CH3
- Напишите структурную формулу 4-метилпентена-2.
- Назовите по рациональной номенклатуре
H3C – CH2 – CH2 – CH – CH2 – CH2 – CH3

H3C – CH – CH3
- Напишите структурную формулу изопропилэтилена.
- Назовите по международной номенклатуре
H2C=CH – CH=CH – CH2 – CH3
- Напишите структурную формулу 3,3,4-триметилгексана.
- Назовите по рациональной номенклатуре
H
 3C CH3
3C CH3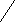
CH – CH=CH – HC
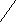

H3C CH3
- Напишите структурную формулу несимметричного диэтилэтилена.
- Назовите по международной номенклатуре
H2C=CH – CH=CH – C≡CH
- Напишите структурную формулу триметилметана.
- Назовите по международной номенклатуре
HC≡C – CH – CH3
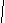
CH3
- Напишите структурную формулу 4-изопропилгептана.
- Назовите по международной и рациональной номенклатуре
CH3
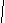
HC≡C-C − CH3
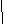
CH3
Вопросы текущего контроля знаний
по темам «Строение,получениеи химические свойства
алканов,алкенов, алкинов»
(2семестр)
- Укажите тип гибридизации орбиталей углеродных атомов, связанных тройной связью в ацетиленовых углеводородах. Изобразите схематично строение связей ацетилена и укажите длину C≡C-связи и энергию ее образования.
- Напишите схему взаимодействия 1,3-бутадиена с одной молекулой брома.
- Напишите схему получения изобутилена из соответствующего галогенопроизводного.
- Дайте определение, что такое σ- и π-связи.
- Напишите схему реакции Кучерова для ацетилена. Назовите продукты.
- Напишите схему получения ацетилена из соответствующего дигалогенопроизводного.
- В чем состоит сущность эффекта сопряжения в соединениях с сопряженными двойными связями? Покажите на схеме на примере бутадиена-1,3.
- Напишите схему взаимодействия пропилена с серной кислотой
- Наипшите схему получения 1,3-бутадиена из этилового спирта (по методу Лебедева).
- Что такое конформации? Какие конформации этана вы знаете?
- Напишите схему получения этана из соли соответствующей кислоты.
- Какие типы связей характеризуют электронное строение этилена? (Изобразите схематично). Укажите длину связи и энергию ее образования.
- Напишите схему получения бутана по реакции Вюрца.
- Покажите механизм присоединения брома к 1,3-бутадиену.
- Напишите схему получения бутадиена из бутана. Назовите тип реакции.
- Напишите схему присоединения хлористого водорода к пропилену. Объясните правило Марковникова с позиций электронной теории
- Напишите схему получения пропилена из пропилового спирта. Покажите механизм реакции.
- Напишите схему полного взаимодействия метана с хлором. Назовите продукты реакции.
- Напишите схему восстановления нормального иодистого бутила.
- Покажите механизм реакции присоединения брома к этилену. Как называются реакции присоединения такого типа?
- Напишите схему гидратации бутина-1.
- Напишите схему получения хлоропрена из ацетилена через винилацетилен.
- В чем заключается отрицательный и положительный индукционный эффект? Приведите примеры с +I и – I -эффектом.
- Напишите схему окисления пропилена раствором марганцовокислого калия в мягких условиях (реакция Вагнера).
- Напишите схему получения гексана по реакции Вюрца. Укажите в полученном соединении первичные и вторичные атомы углерода.
- Напишите схему взаимодействия 1-бутена с водой.
- Какой реакцией можно отличить метилацетилен от метилэтилена? Приведите схему реакции.
- Напишите схему полимеризации этилена. Каково промышленное значение данной реакции.
- Напишите структурные формулы углеводородов с общей формулой C5H8, содержащих тройную связь.
- Напишите схему взаимодействия дивинила с одной молекулой бромистого водорода. Какой продукт образуется в большем количестве?
- Напишите схему получения метилацетилена из 1,1-дибромпропана.
- Какие вы знаете типы гибридизации орбиталей атома углерода и соответствующие им углы между валентностями углеродных атомов?
- Какое из двух указанных соединений H3C – CH = CH – CH3 и
CH3 – CH2 – CH2 – CH3 окисляется раствором перманганата калия? Назовите его по международной номенклатуре и приведите схему реакции.
- Покажите механизм реакции получения этилена из соответствующего галогенопроизводного в присутствии спиртового раствора щелочи.
- Напишите схему полимеризации изопрена.
- Напишите схему последовательного присоединения двух молекул хлористого водорода к ацетилену.
- Какой тип связей (σ-, π-) имеется в метане? Какова длина и энергия C – C - связи?
- Напишите схему получения изобутилена из соответствующего спирта.
- Укажите качественные реакции на двойную связь. Напишите схемы реакций.
- Напишите формулы 4-6 атомов или групп атомов, имеющих отрицательный индуктивный эффект.
- Приведите схему электронного строения бутадиена-1,3.
- Напишите схему жесткого окисления симметричного диметилэтилена.
- Как осуществляются σ- и π- связи. Покажите схематично.
- Напишите схему взаимодействия одной молекулы дивинила с одной молекулой брома.
- Поясните сущность эффекта сопряжения на примере молекулы дивинила.
- Напишите схему получения гексана по реакции Вюрца.
- Какие типы связей характеризуют электронное строение этина? (Изобразите схематично.) Укажите длину связи.
- Напишите схему взаимодействия пропена с одной молекулой иодистого водорода. По какому правилу протекает реакция? Сформулируйте.
- Укажите тип гибридизации орбиталей углеродных атомов, связанных двойной связью в этиленовых углеводородах. Изобразите схематично строение связей этилена и укажите длину C=C - связи.
- Напишите схему реакции дегидрогенизации бутана. Назовите конечный продукт.
- Укажите тип гибридизации атомных орбиталей в молекуле метана. Изобразите схематично строение связей. Укажите длину и энергию образования углерод-углеродной связи.
- Напишите схему взаимодействия пропилена с одной молекулой бромистого водорода. По какому правилу протекает реакция? Сформулируйте.
Вопросы текущего контроля знаний
по темам 7-14
(3семестр)
- Дополните схему реакции
Целлюлоза +3nHNO3 → ?
- Полиэтилен. Способы получения. Свойства. Область применения.
- Допишите схему реакции
Целлюлоза + 3n(RCO)2O → ?
- Полипропилен. Способы получения. Свойства. Область применения.
- Дополните схему реакции
Целлюлоза +3nCH3OH → ?
- Полиизобутилен. Способы получения. Свойства. Область применения.
- Напишите реакцию каталитического восстановления полистирола.
- Поливинилхлорид. Способы получения. Свойства. Область применения.
- Напишите реакцию синтеза поливинилового спирта из поливинилацетата.
- Полистирол. Способы получения. Свойства. Область применения.
- Дополните схему реакции
Поливиниловый спирт + nNa→ ? + nR – Br → ?
- Поливинилацетат. Способы получения. Свойства. Область применения.
- Напишите схему реакции хлорсульфирования полиэтилена. Для чего используется продукт реакции.
- Поливиниловый спирт. Способы получения. Свойства. Область применения.
- Напишите схему полного гидрирования полиизопрена. Как изменятся свойства полимера в результате реакции?
- Плексиглас. Способы получения. Свойства. Область применения.
- Напишите схему превращения полистирола в полиаминостирол. Для чего используется данная реакция?
- Полимеры акриловой кислоты. Способы получения. Свойства. Область применения.
- Поясните понятие «полимераналогичные превращения». Приведите примеры.
- Эпоксидные полимеры. Способы получения. Свойства. Область применения (перечислить наиболее распространенные марки).
- Поясните понятие «макромолекулярные реакции». Приведите примеры.
- Полиэфирные полимеры. Способы получения. Свойства. Область применения.
- Поясните понятие деструкции, ее плюсы и минусы.
- Полиуретаны. Способы получения. Свойства. Область применения.
- Охарактеризуйте явление химической деструкции.
- Фенолоальдегидные полимеры. Способы получения. Свойства. Область применения.
- Охарактеризуйте процесс механической деструкции.
- Мочевиноформальдегидные (карбамидные) полимеры. Способы получения. Свойства. Область применения.
- Охарактеризуйте явление окислительной деструкции.
- Меламиноформальдегидные полимеры. Способы получения. Свойства. Область применения.
- Охарактеризуйте процесс термической деструкции.
- Кремнийорганические полимеры. Способы получения. Свойства. Область применения.
- Охарактеризуйте процесс фотохимической деструкции.
- Фураноыве полимеры. Способы получения. Свойства. Область применения (перечислить основные марки).
- Охарактеризуйте процесс радиационной деструкции.
- Полисульфидные каучуки. Способы получения. Свойства. Область применения.
- Опишите влияние биологических факторов на процесс деструкции полимеров.
- Кумароно-инденовые полимеры. Способы получения. Свойства. Область применения.
- Какие вы знаете способы стабилизации полимеров?
- Альтины. Способы получения. Свойства. Область применения.
- Поясните роль антиоксидантов в процессе стабилизации полимеров.
- Полимерцементы. Способы получения. Свойства. Область применения.
- Полихлорвинил. Способы получения. Свойства. Область применения.
- Реакции звеньев полимерной цепи. Дать определение. Пояснить на примерах.
- ПВА (поверхностно-активные вещества). Способы получения. Свойства. Область применения.
- Пояснить отличия макромолекулярных реакций от полимераналогичных преращений.
- Полиметилметакрилат. Способы получения. Свойства. Область применения.
- Дайте определение процесса деструкции, перечислите основные виды деструкции полимеров.
- Фенолоформальдегидные полимеры. Способы получения. Свойства. Область применения.
- Что называют антирадами? Для чего применяются, какие соединения к ним относятся?
- Полиорганосилоксаны. Способы получения. Свойства. Область применения.
- Что представляют собой антипирены, для чего и где используются?
Вопросы итогового контроля знаний по дисциплине
(2 семестр)
- Сущность теории химического строения Бутлерова.
- Октетная теория Льюиса и Косселя.
- Типы МО. Перечислить, охарактеризовать.
- Понятие о - и -связях. Показать графически, привести примеры.
- Концепция Полинга о гибридизации атомов углерода; sp-, sp2, sp3 – гибридные состояния атомов углерода, азота, кислорода.
- Простые углерод-углеродные связи. Показать существование конформеров на примере молекулы этана.
- Двойные углерод-углеродные связи. Механизм образования, длина, угол тип гибридизации. Показать на примере молекулы этилена.
- Тройные углерод-углеродные связи. Тип гибридизации атомов углерода в молекуле ацетилена. Длина связи, угол.
- Понятие о сопряженных молекулах. Рассмотреть эффект сопряжении на примере молекулы бутадиена – 1,3.
- Взаимное влияние атомов в молекуле или факторы, влияющие на доступность электронов в связях и отдельных атомах.
- Определение, обозначение, примеры, механизм действия индуктивного и мезомерного эффектов. Провести сравнение этих эффектов.
- Эффекты, изменяющиеся во времени, стерические эффекты.
- Сверхсопряжение. Рассмотреть на примерах (в том числе кислородосодержащих соединений).
- Классификация реакций органических соединений по характеру химических превращений (перечислить типы реакций, для каких соединений характерны, привести примеры).
- Классификация реакций органических соединений по механизму протекания в зависимости от характера атакующей частицы.
- Гетеролиз связи и образование органических ионов.
- Гомолиз связи и образование свободных радикалов. Реакции свободных радикалов.
- Кислоты. Определение Аррениуса. Кислоты Льюиса. Выражение константы кислотности.
- Влияние растворителя на диссоциацию кислот. Явление сольватации.
- Факторы, влияющие на кислотность органических соединений. Рассмотреть на примерах алифатических спиртов, фенолов, замещенных и незамещенных алифатических кислот, ароматических карбоновых кислот.
- Основания. Определение Аррениуса. Определение Льюиса. Выражение константы кислотности.
- Факторы, влияющие на повышение основности алифатических оснований, ароматических оснований, гетероциклических оснований. Рассмотреть на примерах.
- Бензол и ароматичность. Современные электронные представления о строении бензольного кольца. Структуры Кекуле. Теория ароматичности. Признаки и условия ароматичности, правило Хюккеля. Причины устойчивости молекулы бензола. Характерные реакции.
Вопросы итогового контроля знаний по дисциплине
(3 семестр)
- Процесс полимеризации: определение, классификация, механизм, основные стадии.
- Условия протекания реакции. Влияние электронных и стерических эффектов.
- Радикальная полимеризация. Пояснить механизм стадии инициирования. Скорость процесса.
- Радикальная полимеризация. Пояснить механизм роста цепи. Факторы, влияющие на скорость роста цепи.
- Радикальная полимеризация. Пояснить механизм процесса обрыва цепи. Характеристики данной стадии: энергия активации, скорость процесса. Роль ингибиторов.
- Радикальная полимеризация. Механизм реакции передачи цепи. Роль регуляторов. Факторы, влияющие на скорость процесса.
- Скорость реакции полимеризации. Степень полимеризации. Способы регулирования скорости процесса и молекулярной массы полимера.
- Факторы, влияющие на процесс протекания ЦРП(цепной радикальной полимеризации).
- Сополимеризация. Определение, выражение скорости. Факторы, влияющие на состав сополимера. Уравнение Майо.
- Ионная полимеризация. Характерные особенности, механизм протекания. Отличия от радикальной полимеризации. «Живущие полимеры».
- Катионная полимеризация. Характерные мономеры. Механизм, катализаторы, скорость процесса, степень полимеризации. «Живущие полимеры».
- Катионная полимеризация. Характерные мономеры. Факторы, влияющие на катионную полимеризацию. Понятие «живущих полимеров».
- Анионная полимеризация. Характерные мономеры. Катализаторы, механизм процесса, факторы, определяющие анионную полимеризацию. Понятие «живущих полимеров».
- Ступенчатая полимеризация. Характерные мономеры. условия протекания процесса. Характерные особенности.
- Особенности ступенчатой полимеризации. Способы регулирования молекулярного веса полимеров.
- Ионно-координационная полимеризация. Характерные мономеры. Катализаторы. Влияние примесей.
- Поликонденсация. Определение. Классификация. Характерные мономеры. Дать характеристику основных стадий процесса.
- Равновесная поликонденсация. Константа равновесия. Механизм протекания. Деструкция полимеров. Алкоголиз. Аминолиз.
- Факторы, влияющие на значение молекулярной массы полимера в процессе равновесной поликонденсации.
- Равновесная поликонденсация. Влияние примесей в мономере на степень полимеризации. Зависимость молекулярной массы от глубины превращения.
- Неравновесная поликонденсация. Причины возникновения. Характерные особенности. Преимущества и недостатки. Условия образования линейных термопластов, реактопластов.
- Неравномерная поликонденсация. Характерные особенности. Преимущества и недостатки. Условия образования полимеров различного вида.
- Дать сравнительную характеристику процессов полимеризации и поликонденсации.
- Отверждение. Понятие, типы механизмов, стадии. Привести пример процесса отверждения по одному из механизмов.
- Роль отвердителей, инициаторов, катализаторов в процессе отверждения. Преимущества применения эпоксидных смол в качестве связующего.
- Роль процесса отверждения в формировании лакокрасочных покрытий.
- Полиэтилен, полипропилен,
Вопросы контроля остаточных знаний по дисциплине
- Понятие о - и -связях. Показать графически, привести примеры.
- Концепция Полинга о гибридизации атомов углерода; sp-, sp2, sp3 – гибридные состояния атомов углерода, азота, кислорода.
- Простые углерод-углеродные связи. Показать существование конформеров на примере молекулы этана.
- Двойные углерод-углеродные связи. Механизм образования, длина, угол тип гибридизации. Показать на примере молекулы этилена.
- Тройные углерод-углеродные связи. Тип гибридизации атомов углерода в молекуле ацетилена. Длина связи, угол.
- Понятие о сопряженных молекулах. Рассмотреть эффект сопряжении на примере молекулы бутадиена – 1,3.
- Взаимное влияние атомов в молекуле или факторы, влияющие на доступность электронов в связях и отдельных атомах.
- Определение, обозначение, примеры, механизм действия индуктивного и мезомерного эффектов. Провести сравнение этих эффектов.
- Эффекты, изменяющиеся во времени, стерические эффекты.
- Сверхсопряжение. Рассмотреть на примерах (в том числе кислородосодержащих соединений).
- Бензол и ароматичность. Современные электронные представления о строении бензольного кольца. Структуры Кекуле. Теория ароматичности. Признаки и условия ароматичности, правило Хюккеля. Причины устойчивости молекулы бензола. Характерные реакции.
- Процесс полимеризации: определение, классификация, механизм, основные стадии.
- Условия протекания реакции. Влияние электронных и стерических эффектов.
- Радикальная полимеризация. Основные стадии процесса.
- Ионнаяполимеризация (катионная, анионная, ионно-координационная), основные стадии процессов. Катализаторы Циглера-Натта.
- Поликонденсация. Определение. Классификация. Характерные мономеры. Дать характеристику основных стадий процесса.
- Дать сравнительную характеристику процессов полимеризации и поликонденсации.
- Отверждение. Понятие, типы механизмов, стадии. Привести пример процесса отверждения по одному из механизмов.
- Роль отвердителей, инициаторов, катализаторов в процессе отверждения. Преимущества применения эпоксидных смол в качестве связующего.
«__» ______________2005г.
Разработчик ___________________ст.преподаватель Н.Б.Холодова
Зав. кафедрой ФиТКМ ____________________ д.т.н., профессор В.Б.Маркин
ПРИЛОЖЕНИЕ Б
Памятка для студентов групп ПКМ по изучению дисциплины
"Органическая химия" (2 семестр)
