Лабораторная работа №6
| Вид материала | Лабораторная работа |
СодержаниеАлкены - это углеводороды с одной двойной связью в открытой углеродной цепи. Их еще называют углеводородами ряда этилена или оле Химические свойства. |
- Методические указания к лабораторным работам Лабораторная работа, 357.24kb.
- Лабораторная работа №3 кпк лабораторная работа №3 Тема: карманный персональный компьютер, 173.34kb.
- Методические возможности стенда Особенности работы на стендах уилс-1 Ознакомительное, 1487.3kb.
- Лабораторная работа по курсу «Физические основы микроэлектроники», 136.21kb.
- Лабораторная работа, 166.92kb.
- Самостоятельная работа по учебным пособиям, 471.48kb.
- Конспект урока в 9 классе по теме: «Магний», 84.54kb.
- Лабораторная работа №1 Введение в Windows. Работа с окнами и приложениями в Windows, 67.41kb.
- Знакомство c Excel, 1212.51kb.
- Лабораторная работа, 105.21kb.
| | | Лабораторная работа № 6. Получение этилена и опыты с ним. |
 Цель работы:
Цель работы:- знать лабораторный способ получения этилена, правила по технике безопасности при работе с органическими веществами и концентрированной серной кислотой.
- уметь практически получать этилен и доказывать его непредельные свойства характерными реакциями;
- практически ознакомиться с важными свойствами полиэтилена - термопластичностью, высокой химической стойкостью;
- уметь составлять уравнения реакций, доказывающих свойства этилена, проводить наблюдения, делать выводы, соблюдать правила техники безопасности при работе в кабинете химии.
Краткие теоретические сведения.
Непредельные углеводороды. Рассмотрим углеводороды, содержащие в молекуле одну или несколько двойных связей (алкены и алкадиены) и тройную связь (алкины).
Алкены - это углеводороды с одной двойной связью в открытой углеродной цепи. Их еще называют углеводородами ряда этилена или олефинами.
Изомерия. В дополнение к изомерии углеродной цепи у алкенов возможна изомерия, связанная с положением в цепи двойной связи и пространственная цис-, транс-изомерия положения заместителей относительно двойной связи.
Номенклатура. Названия алкенов происходит от названия соответствующего алкана, только суффикс -ан заменяется на -ен.
Получение. Промышленные способы получения алкенов:
- дегидрирование алканов с использованием катализаторов (Cr2O3) и при нагревании (450oC):
CH3-CH2-CH2-CH3 CH2=CH-CH2-CH3 + H2 или CH3-CH2-CH2-CH3 CH3-CH=CH-CH3 + H2
2) крекинг алканов, например из бутана при 6000С образуются: CH3-CH2-CH2-CH3 CH4 + CH2=CH-CH3 (48%)
CH3-CH2-CH2-CH3 C2H6 + CH2=CH2 (36%) и CH3-CH2-CH2-CH3 H2 + CH3-CH=CH-CH3 (16%)
Лабораторные способы получения алкенов:
- дегидратация спиртов под действием серной или фосфорной кислот: CH3-CH2ОН H2О+ CH2=CH2
2) отщепление двух атомов галогенов от соседних углеродных атомов (дегалогенирование): CH3-CHBr-CH2BrCH3-CH=CH2+Br2
3) отщепление атома галогена и атома водорода от соседних углеродных атомов: CH3-CHBr-CH3 CH3-CH=CH2+HBr
Отщепление идет по правилу Зайцева.
Физические свойства. CH2=CH2 – газ, без цвета, с чуть сладковатым запахом, плохо растворим в воде. С2-С4 газы, без цвета; С5-С18 жидкости; С19 твёрдые, ρ<1г/см3, мало растворимы в воде, t кип(н) t кип(разв), t кип(цис) t кип(транс).
Химические свойства. Реакционная способность двойной связи в молекулах алкенов настолько превосходит химическую активность насыщенных радикалов, что только о ней обычно и идет речь.
π -связь непрочная, легко разрывается и для алкенов наиболее характерны реакции:
- присоединения при взаимодействии
- с водородом: CH3-CH=CH2 + H2 CH3-CH2-CH3
- с бромной водой: CH3-CH=CH2 + Br2 CH3-CHBr-CH2Br (1,2-дибромпропан)
- с галогеноводородами: CH3-CH=CH2 + HBr CH3-CHBr-CH3 (2-бромпропан)
- с водой (гидратация в присутствии сильных кислот как катализаторов): CH3-CH=CH2 + H2О CH3-CHОН-CH3 (пропанол-2)
В двух последнем случае реакция идет с соблюдением правила Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода).
- Важным свойством непредельных углеводородов является полимеризация. При этом образуются высокомолекулярные
соединения, широко известные в виде разнообразных пластмасс (полиэтилен, полипропилен, поливинилхлорид, полистирол), волокон, каучуков и т.д. При этом атомы углерода из состояния sp2-гибридизации переходят в более устойчивое состояние sp3-гибридизации, а вместо слабой π -связи, появляются устойчивые σ-связи. Существуют два основных синтетических способа получения высокомолекулярных веществ - полимеризация и поликонденсация.
Низкомолекулярные вещества, из которых синтезируются полимеры, называются мономерами. Этилен, пропилен, изопрен - мономеры. Молекулы полимеров носят еще название макромолекул ("макрос" - означает "большой", "длинный"). Многократно повторяющиеся в макромолекуле группы атомов называются структурными звеньями.
| Этилен | CH2 = CH2 | Пропилен | CH2 = CH - CH3 |
| Структурное звено полиэтилена | - CH2 - CH2 - | Структурное звено полипропилена | - CH2 - CH - CH3 │ |
Число, показывающее в формуле полимера, сколько молекул мономера соединяется в макромолекулу, называется степенью полимеризации, n CH2 = CH2 (- CH2 - CH2 -) n , мономер - низкомолекулярное вещество, полимер - высокомолекулярное соединение, n - степень полимеризации - число молекул мономера или число структурных звеньев в макромолекуле полимера.
- Алкены сравнительно легко окисляются.
- Они могут просто гореть: 2CnH2n + 3nO2 = 2nCO2 + 2nH2O
- При окислении этилена перманганатом калия образуется этиленгликоль (реакция Вагнера):
3CH2=CH2 + 2KMnO4 + 4H2O 2MnO2↑ + 2KOH + 3CH2OH-CH2OH
- Перманганат калия в кислой среде и при нагревании приводит к разрыву молекулы алкена по месту двойной связи с
образованием карбонильных или карбоксильных групп: CH3-CH2-CH=CH-CH3 + 4[O] CH3-COOH + CH3-CH2-COOH
Применение. Алкены - важные исходные вещества для получения полимеров, этилового спирта и очень многих кислородосодержащих органических веществ.
Реактивы и оборудование:
- этиловый спирт, серная кислота (конц.), песок, растворы гидроксида натрия и перманганат калия (KMnO4), полиэтилен;
- штатив с пробирками, пипетка, держатель для пробирок, щипцы, стеклянная палочка, горелка, спички, железный штатив, стакан, газоотводная трубка, прибор для изучения электропроводности.
Опыт № 1. Получение этилена в лаборатории.
Этилен в лаборатории получают при нагревании этилового спирта с концентрированной серной кислотой.
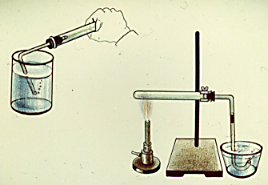
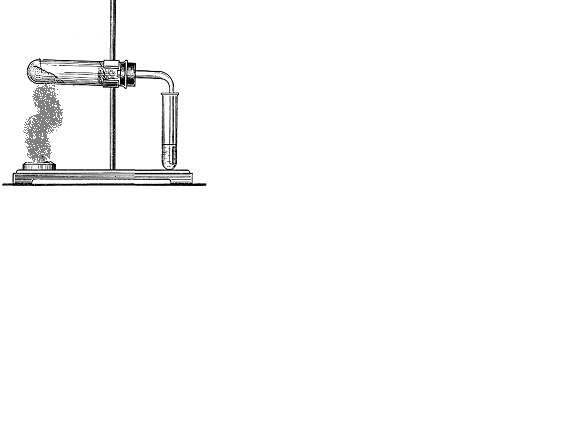
1. Соберите прибор. Проверьте его герметичность (Рис. 1). Налейте широкую пробирку 5 мл смеси серной кислоты и этилового спирта, поместите сухого песка в смесь. Закройте пробирку пробкой с газоотводной трубкой и укрепите в штативе (Рис. 2). ОСТОРОЖНО! Нагрейте смесь.
2. Когда начнется реакция, пропускайте газ в пробирку с 2 - 3 мл (не более) перманганата калия, опустив газоотводную трубку до дна пробирки. Следите при этом, чтобы нагревание смеси не прекратилось, иначе жидкость из пробирки переносится в прибор. Что наблюдаете?
3. Вынув газоотводную трубку из раствора и повернув ее вверх отверстием, подожгите выделяющийся газ. Светящимся или несветящимся пламенем горит этилен? Потушите горелку. Выделение этилена прекратится. Записать наблюдения. Объясните наблюдавшиеся явления.
Задание.
1. Составьте уравнения химических реакций.
2. Какой вывод о химических свойствах этилена можно сделать?
3. Какие углеводороды называются непредельными?
4. Для каких целей используется этилен?
5. Чем отличаются свойства этилена от свойств предельных углеводородов?
Опыт № 2. Опыты с полиэтиленом.
Практически наиболее важными свойствами полиэтилена (- СН2 - СН2 -)n являются его термопластичность, высокая химическая стойкость, нерастворимость в растворителях и отсутствие электропроводности.
1) Изделие из полиэтилена нагреть (при помощи щипцов) над пламенем горелки. Заметьте, что материал быстро размягчается, а затем плавиться. Стеклянной палочкой измените его форму и дайте изделию остыть. Попытайтесь изменить форму образца при обычной температуре. Приданная ему при этом форма прочно закрепляется.
Задание. Какое свойство полиэтилена лежит в основе наблюдаемых явлений? При каких условиях это свойство проявляется? Какое практическое значение оно имеет?
2) Подожгите образец полиэтилена.
Задание. Обратите внимание, горит ли этилен вне пламени? Какого цвета пламя? Образуется ли при этом копоть? Обладают ли продукты сгорания запахом?
3)* Кусочки полиэтилена поместить в пробирки с концентрированной серной кислотой, раствором щелочи и раствором перманганата калия.
Задание. Наблюдайте, происходит ли изменение окраски растворов? Действуют ли эти вещества на полимер? Объясните наблюдения.
4)* Кусочки полиэтилена поместить в пробирки с ацетоном и этиловым спиртом. За время урока ни в одной из жидкостей не происходит растворение полиэтилена.
5)* К палочке, пластинке или пленке из полиэтилена прикоснуться электродами от прибора для изучения электропроводности. Убедиться, что полиэтилен не проводит электрического тока.
Ответь на контрольные вопросы.
- В чем различие между свойством "эластичность" и свойством "пластичность"?
- Запишите структурные формулы следующих алкенов: бутен-1, 2-метилпропен-1, 4-метилпентен-1,
2-этилпентен-1.
- Напишите уравнение реакции получения полиэтилена из этилена.
- Что общего и в чем различие между молекулой мономера и структурным звеном образуемого им полимера?
- Осуществите превращения: метан этилен этан.
- Полимеризацией хлоропрена CH2 = C - CH = CH2 получают хлоропреновый каучук, высокой устойчивостью
|
Cl
к действию света, теплоты и растворителей. Составить уравнение полимеризации хлоропрена.
Выводы к работе.
1. Указать, какие соединения являются высокомолекулярными, чем они отличаются от низкомолекулярных соединений.
2. Какой вывод о химических свойствах полиэтилена можно сделать на основании проделанных опытов?
Список литературы.
Ю. М. Ерохин. Химия: Учебник для средних специальных учебных заведений. - М.: Асадема, 2005. с. 275-283.