Курс I хімія Викладач доцент Шевченко Л. В. Лекція на тему
| Вид материала | Лекція |
- Курс: 1 Статус дисципліни: обов’язкова Стаціонарне навчання Години на тиждень Триместр, 432.82kb.
- Удк 338. 43: 331. 5 Кузьмак О. І. к е. н., доцент, Сістук Г.І. ст викладач, 176.37kb.
- Курс Викладач Жук Л. П. Дисципліна Хімія, 233.91kb.
- Короткий курс лекцій з курсу "історія економічних вчень" Склав: ст викладач Бортнікова, 921.6kb.
- Лекція на тему „Основи теорії держави І права" > Лекція на тему, 3538.68kb.
- Курс лекцій для студентів денної І заочної форми навчання спеціальності 050301 „Товарознавство, 1137.66kb.
- Робоча програма навчальної дисципліни екоаналітична хімія напряму підготовки 040101, 154.06kb.
- Робоча програма навчальної дисципліни математичне моделювання аналітичних систем напряму, 172.48kb.
- Т. Г. Шевченко Экономический факультет Кафедра экономической теории Утверждаю, 237.16kb.
- Програма державного комплексного екзамену з дисципліни, 362.11kb.
Лужну реакцію має розчин будь-якої солі, утвореної сильною основою і слабкою кислотою, а кислу - має розчин будь-якої солі утворена ними.
Хлорид натрію в розчині не гідролізується, оскільки іони Na+ і Cl-, що є в його водному розчині у взаємодію з водою не вступають. Тому він є нейтральним.
Здебільшого гідроліз солі відбувається оборотно, при чому взаємодію з водою вступає невелика кількість відповідних іонів.
Коли з водою взаємодіють багатозарядні катіони чи аніони багатоосновних кислот, сіль гідролізується з однією молекулою води.
Як за складом солі зробити висновок про можливість її гідролізу і реакцію розчину, що утворився?
Нерозчинні у воді солі, навіть утворені слабкими основами чи кислотами, практично негідролізуються.
Якщо сіль у волі розчиняється, то слід з'ясувати, чи є в її складі катіон, який відповідає слабкій основі, або аніон, що відповідає слабкій кислоті.
Візьмемо розчинну у воді сіль сульфат цинку ZnSO4. Ця сіль утворена слабкою основою Zn(OH)2 і сильною кислотою H2SO4.
Отже, в розчині іони Zn2+ взаємодіють з водою:
Zn2+ + H2O ↔ Zn(OH) + + H+;
а іони SO42 - - ні.
В результаті гідролізу розчин сульфату цинку за рахунок іонів H+ матиме кислу реакцію.
Таким чином, сіль сильної основи і слабкої кислоти гідролізується зі збільшенням концентрації йонів гідроксила в реакції. Сіль слабкої основи ї сильної кислоти гідролізується зі збільшенням концентрації йонів гідрогену в реакції. Тобто, реакція середовища в результаті гідроліза визначається тим продуктом гідроліза, який є сильним електролітом.
Гідроліз солі слабкоі основи та слабкої кислоти перебігає практично до кінця :
(NH4)2S + 2 H2O ↔ 2 NH4OH + H2S
2NH4+ + S2- + 2H2O ↔ 2 NH4OH + H2S
Реакція середовища визначається відносною силою кислоти та основи ( Кд(NH4ОН) = 1,79 . 10 -5 , Кд(Н2S) = 1,3 . 10 -13 )-в даному випадку – лужна.
З кількісної точки зору гідроліз в розбавлених розчинах можно характеризувати константою та ступінню гідроліза.
Константа гідролиза
Константа гідролиза — константа рівноваги гидролитичної реакції.
Виведемо рівняння константи гідролиза солі, утвореної слабкою кислотою та сильною основою:
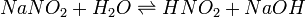
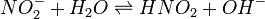
рівняння константи рівноваги для данной реакції буде мати вигляд:
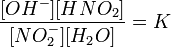 або
або 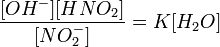
Оскільки концентрація молекул води в розчині постійна, то добуток двох сталих
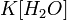 можно замінити однією новою — константою гідролиза:
можно замінити однією новою — константою гідролиза: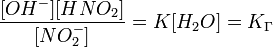
Численне значення константи гідролиза отримаємо, використовуючи йонний добуток води
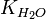 та константу дисоціації азотистої кислоти
та константу дисоціації азотистої кислоти 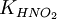 :
: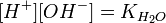
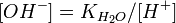
підставимо в рівняння константи гідролиза:
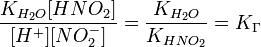
В загальному випадку для солі, утвореної слабкою кислотою та сильною основою:
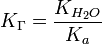 , де Ka — константа диссоціації слабкої кислоти, яка утворилася при гідролізі.
, де Ka — константа диссоціації слабкої кислоти, яка утворилася при гідролізі.Константа гідроліза солі, утвореної слабкою кислотою та сильною основою виражається відношенням йонного добутку води до константи дисоціації кислоти
Для солі, утвореної сильною кислотою та слабкою основою:
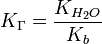 , де Kb — константа диссоциации слабкої основи, яка утворилася при гідролізі .
, де Kb — константа диссоциации слабкої основи, яка утворилася при гідролізі . Константа гідроліза солі, утвореної слабкою основою та сильною кислотою виражається відношенням йонного добутку води до константи дисоціації основи.
Для солі, , утвореної слабкою кислотою и слабкою основою:
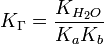 .
.Константа гідроліза солі, утвореної слабкою кислотою та слабкою сновою виражається відношенням йонного добутку води до добутку констант дисоціації кислоти та основи.
Ступінь гідроліза характеризується відношенням концентрації йонів, що піддалися гідролізу до концентрації розчиненої солі ( % ). Ступінь гідроліза залежить від природи солі, її концентрації та температури розчину.
Підсилення гідроліза можна досягнути збільшенням температури розчину, та його розбавленням , а в концентрованих прохолодних розчинах гідроліз пригнічен. Цому ж сприяє підкислення або підлужування розчину в залежності від типа гідролітичної взаємодії.
Семінарське заняття
Приклади різних вариантів гідролиза солей:
- 1. Гідроліз солі слабкої кислоти та сильної основи:
К2CO3 + Н2О = КHCO3 + NaOH
CO32- + H2O = HCO3- + OН-
(розчин має лужну реакцію, реакція перебігає зворотньо)
- 2. Гідроліз солі сильної кислоти та слабкої основи:
СuСl2 + Н2О = CuOHCl + HCl
Cu2+ + Н2 О = CuOH+ + Н+
(розчин має кислу реакцію, реакція перебігає зворотньо)
- 3. Гідроліз солі слабкої кислоти та слабкої основи:
Al2S3 + 6H2O = 2Al(OН)3 + 3H2S
2Аl3+ + 3S2- + 6Н2О = 2Аl(OН)3(осадок) + ЗН2S(газ)
(Гідроліз в цьому випадку перебігає практично повністю, оскільки обидва продукта гідролиза лишають сферу реакції у вигляді осада або газа).
Сіль сильної кислоти та сильної основи не підлягає гідролизу, і розчин нейтральний.
Н.Л.Глинка Задачи и упражнения по общей химии.Л. “Химия” 1985. № 585 – 598.
Завдання для самостійної роботи
Н.Л.Глинка Задачи и упражнения по общей химии.Л. “Химия” 1985. № 603 – 607.
Лабораторна робота
| | |
| Гідроліз солей | |
 | Необхідні прилади і реактиви: штатив з пробірками, розчини: Ba(NO3)2, K2SO4, Na2SO4, ZnSO4, CuSO4, HCl, Zn(NO3)2, ZnCl2, AlCl3, Al2(SO4)3, Na2CO3, K2S, K2CO3, NaCl, SbCl3; індикатори: фенолфталеїн, метилоранж, лакмус. |
| Дослід 1. Дослідження реакцій розчинів солей В окремі пробірки налийте по 1 мл наявних у лабораторії розчинів солей, утворених: а) сильною кислотою і слабкою основою; б) слабкою кислотою і сильною основою; в)сильною кислотою і сильною основою. У кожну з пробірок додайте по 2-3 краплі індикатора (лакмусу або метилоранжу), щоб визначити реакцію середовища. Поясніть, чому середовище у взятих розчинах солей різне? Складіть рівняння гідролізу у молекулярному і іонно-молекулярному вигляді. Яка сіль не піддається гідролізу? Дослід 2. Повний гідроліз. Виберіть розчини двох солей, при зливанні яких повинна утворитися сіль, що піддається повному гідролізу. Злийте їх. Що спостерігається? Яка речовина в осаді? Складіть рівняння реакцій між взятими розчинами солей у молекулярному і іонно-молекулярному вигляді. Дослід 3. Зміщення процесу гідролізу Налийте в пробірку близько 1 мл розчину хлориду Сурми SbCI3 і додавайте до нього по краплях дистильовану воду до появи суспензії білого кольору. Напишіть рівняння гідролізу взятої солі в молекулярному та іонно-молекулярному вигляді. Подумайте, яку речовину треба додати в пробірку, щоб змістити вліво рівновагу гідролізу? Додайте цю речовину. Що спостерігається? Поясніть явища, що відбуваються, на основі принципу Ле-Шательє. | |
.
