Непредельные углеводороды (7 часов). Цели модуля
| Вид материала | Документы |
- Лабораторная работа, 221.5kb.
- Предельные и непредельные углеводороды, 29.39kb.
- Систематическая номенклатура непредельные углеводороды, 30.7kb.
- Всего часов, 159.54kb.
- Занятие Теория строения органических веществ, 24.9kb.
- Самостоятельная работа по теме: «Алкадиены. Каучук», 51.05kb.
- 1. Криминология: цели и задачи дисциплины, 498.49kb.
- Рабочая программа дисциплины (модуля), 219.5kb.
- 1. автомобильные топлива, 866.47kb.
- Учебной дисциплины (модуля) Наименование дисциплины (модуля) Стилистика основного изучаемого, 282.06kb.
Модуль 3. Непредельные углеводороды (7 часов).
Цели модуля: Систематизировать и обобщить знания о непредельных углеводородах.
Задачи:
1. Знать состав и химическое строение алкенов. Гомологический ряд алкенов. Виды изомерии алкенов, тип гибридизации (Sp2 ). Знать химические свойства алкенов, уметь писать реакции присоединения, окисления, полимеризации, горения. Уметь применять правило Марковникова. Знать основные способы получения и применение алкенов.
2. Знать химическое и электронное строение алкадиенов с сопряженными связями, их химические свойства. Знать натуральный каучук, его строение и свойства.
3. Знать химическое и электронное строение алкинов. Sp- гибридизацию. Свойства ацетилена. Промышленные способы получения ацетилена и его применение
| | Тема | Всего часов | Теория | Прак-тика | Материалы |
| | 1. Непредельные углеводороды | 7 | 3 | 4 | |
| №1 | Этиленовые углеводороды (алкены). Состав и химическое строение алкенов. Гомологический ряд алкенов. Изомерия алкенов. Sp2- гибридизация. Геометрическая изомерия. Химические свойства алкенов: реакции присоединения, окисления, полимеризации, горения. Правило Марковникова. Получение и применение алкенов. | 2 | 1 | 1 | Лекция № 1, тест № 1, лабораторная работа №1 |
| №2 | Диеновые углеводороды. Химическое и электронное строение алкадиенов с сопряженными связями. Химические свойства алкадиенов. Натуральный каучук, его строение и свойства. | 2 | 1 | 1 | Лекция № 2, тест № 2 |
| №3 | Ацетиленовые углеводороды (алкины). Химическое и электронное строение алкинов. Sp- гибридизация. Свойства ацетилена. Промышленные способы получения ацетилена и его применение. | 2 | 1 | 1 | Лекция № 3, тест № 3, лабораторная работа № 2 |
| №4 | Итоговый тест по теме «Углеводороды» | 1 | | 1 | Итоговый тест |
Лекция № 1.
Этиленовые углеводороды (алкены).
Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°. Длина двойной связи равна 0,134 нм. Простейшим алкеном является этен (C2H4). Строение его молекула можно выразить такими формулами:
H H H H
| | : :
C==C C::C
| | : :
H H H H
Модели молекулы этилена приведены на рис. 1.
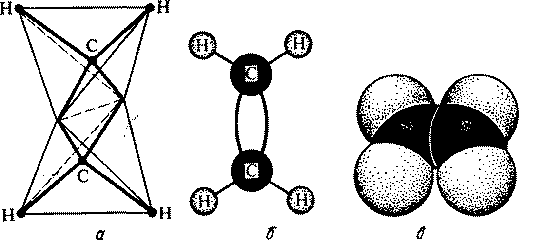
Рис.1. Модели пространственного строения молекулы этилена:
a тетраэдрическая; б - шаростержневая; в - по Бриглебу
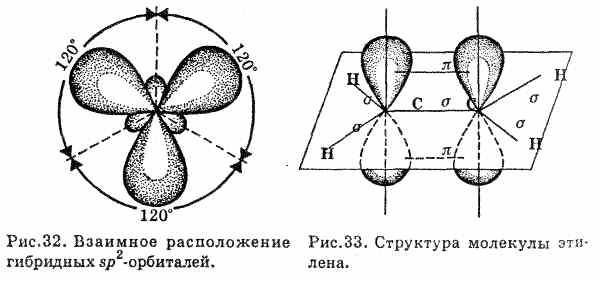
В молекуле этилена оба атома углерода находятся в состоянии sp2-гибридизации: одна s- и две р-орбитали смешиваются по форме, давая три гибридные орбитали, которые образуют Ϭ-связи. Третья р-орбиталь каждого из этих двух атомов используется для образования π-связи между ними и поэтому в гибридизации не участвует.
Все атомы молекулы этилена (и все Ϭ-связи) лежат в одной плоскости, угол между Ϭ-связями равен 120°.
р-орбитали обоих атомов углерода ориентированы перпендикулярно этой плоскости, при их «боковом» перекрывании образуется π -связь.
Номенклатура и изомерия
Номенклатура. Алкены простого строения часто называют, заменяя суффикс -ан в алканах на -илен: этан — этилен, пропан — пропилен и т.д.
По систематической номенклатуре названия этиленовых углеводородов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан — алкен, этан — этен, пропан — пропен и т.д.).
Выбор главной цепи и порядок названия тот же, что и для алканов. Однако в состав цепи должна обязательно входить двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь. Например:
СH3
|
H3C—CH2—C—CH==CH2 H3C—C==CH—CH—CH2—CH3
| | |
CH3 CH3 CH3
3,3-диметилпентен-1 2,4-диметилгексен-2
Иногда используют и рациональные названия. В этом случае все алкеновые углеводороды рассматривают как замещенные этилена:
Н3С—СН==СН—CH2—СН3
метилэтилэтилен
Непредельные (алкеновые) радикалы называют тривиальными названиями или по систематической номенклатуре:
Н2С==СН— - винил (этенил)
Н2С==CН—СН2 - аллил (пропенил-2)
Изомерия. Для алкенов характерны два вида структурной изомерии. Кроме изомерии, связанной со строением углеродного скелета (как у алканов), появляется изомерия, зависящая от положения двойной связи в цепи. Это приводит к увеличению числа изомеров в ряду алкенов.
Первые два члена гомологического ряда алкенов - этилен и пропилен - изомеров не имеют и их строение можно выразить так:
H2C==CH2 H2C==CH—CH3
этилен пропилен
(этен) (пропен)
Для углеводорода С4H8 возможны три изомера:
H2C==CH—CH2—CH3 H3C—CH==CH—CH3
бутен-1 бутен-2
СН3
! |
H2C==C—CH3
2-метилпропен-1
Первые два отличаются между собой положением двойной связи углеродной цепи, а третий — характером цепи (изостроение).
Однако в ряду этиленовых углеводородов помимо структурной изомерии возможен еще один вид изомерии — цис-, транс-изомерия (геометрическая изомерия). Такая изомерия характерна для соединений с двойной связью. Если простая s-связь допускает свободное вращение отдельных звеньев углеродной цепи вокруг своей оси, то вокруг двойной связи такого вращения не происходит. Это и является причиной появления геометрических (цис-, транс-) изомеров.
Геометрическая изомерия — один из видов пространственной изомерии.
Изомеры, у которых одинаковые заместители (при разных углеродных атомах) расположены по одну сторону от двойной связи, называют цис-изомерами, а по разную — транс-изомерами:
H H H CH3
| | | |
C==C C==C
| | | |
H3C CH3 H3C H
цис-бутен-2 транс-бутен-2
Цис- и транс-изомеры отличаются не только пространственным строением, но и многими физическими и химическими свойствами. Транс-изомеры более устойчивы, чем цис-изомеры.
Физические свойства
Физические свойства алкенов похожи на свойства алканов, хотя все они имеют несколько более низкие температуры плавления и кипения, чем соответствующие алканы. Например, пентан имеет температуру кипения 36 °С, а пентен-1 — 30 °С. При обычных условиях алкены С2 - С4 — газы. С5 – С15 — жидкости, начиная с C16 — твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях.
Таблица. Физические свойства некоторых алкенов.
| Название | Формула | t°пл., °С | t°кип., °С |
| Этилен | CH2=CH2 | -169,2 | -103,8 |
| Пропилен | CH2=CH–CH3 | -187,6 | -47,7 |
| Бутен-1 | CH2=CH–CH2–CH3 | -185,3 | -6,3 |
| цис-Бутен-2 | H3C CH3 I I C=C I I H H | -138,9 | 3,5 |
| транс-Бутен-2 | H CH3 I I C=C I I H3C H | -105,9 | 0,9 |
| Изобутилен | CH2=C–CH3 I CH3 | -140,8 | -6,9 |
| Пентен-1 | CH2=CH–CH2–CH2–CH3 | -165,2 | 30,1 |
| цис-Пентен-2 | CH3 C2H5 I I C=C I I H H | -151,4 | 37,0 |
| транс-Пентен-2 | CH3 H I I C=C I I H C2H5 | -140,2 | 36,4 |
Способы получения
В природе алкены встречаются редко. Поскольку алкены являются ценным сырьем для промышленного органического синтеза, разработаны многие способы их получения.
1. Основным промышленным источником алкенов служит крекинг алканов, входящих в состав нефти:
t
С8Н18 → С4Н10 + С4Н8
Крекинг протекает по свободнорадикальному механизму при высоких температурах (400-700 °С).
2. Другой промышленный способ получения алкенов - дегидрирование алканов:
t, Cr2O3
СН3-СН2-СН3 → СН3-СН=СН2 + Н2
3. В лабораторных условиях алкены получают по реакциям отщепления (элиминирования), при которых от соседних атомов углерода отщепляются два атома или две группы атомов, и образуется дополнительная p-связь. К таким реакциям относятся следующие.
1) Дегидратация спиртов происходит при их нагревании с водоотнимающими средствами, например с серной кислотой при температуре выше 150 °С: H2SO4
СН3-СН2-ОН → СН2=СН2 + Н2О
2) Отщепление галогеноводородов проводят при действии спиртовых растворов щелочей на моноалкилгалогениды:
С2Н5ОН
СН3-СН2-СНВr-СН3 + КОН → СН3-СН=СН-СН3 + КВr + Н2О
При отщеплении Н2O от спиртов, НВr и HCl от алкилгалогенидов атом водорода преимущественно отщепляется от того из соседних атомов углерода, который связан с наименьшим числом атомов водорода (от наименее гидрогенизированного атома углерода). Эта закономерность носит название правила Зайцева.
3) Дегалогенирование происходит при нагревании дигалогенидов, имеющих атомы галогена у соседних атомов углерода, с активными металлами:
CH2Br-CHBr-CH3 + Mg → СН2=СН-СН3 + MgВr2.
Химические свойства
Все специфические химические свойства алкенов определяются наличием в их молекуле π -электронного облака (то есть собственно двойной связью). Электроны π -облака находятся вне плоскости молекулы и легко доступны для атаки электрофильными частицами. Поэтому практически все реакции алкенов имеют электрофильный механизм (обычно это электрофильное присоединение, которое обозначается кратко как АЕ).
Рассмотрим конкретные примеры реакций присоединения.
1) Гидрогалогенирование. При взаимодействии алкенов с галогеноводородами (HCl, НВr) образуются алкилгалогениды:
СН3-СН=СН2 + НВr ® СН3-СНВr-СН3.
Продукты реакции определяются правилом Марковникова.
Следует, однако, подчеркнуть, что в присутствии какого-либо органического пероксида полярные молекулы НХ реагируют с алкенами не по правилу Марковникова:
R-O-O-R
СН3-СН=СН2 + НВr → СН3-СН2-СН2Вr
Это связано с тем, что присутствие перекиси обусловливает радикальный, а не ионный механизм реакции.
2) Гидратация. При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов. Присоединение воды также идет по правилу Марковникова:
СН3-СН=СН2 + НОН ® СН3-СН(ОН)-СН3.
3) Галогенирование. Алкены обесцвечивают бромную воду:
СН2=СН2 + Вr2 ® ВrСН2-СН2Вr.
Эта реакция является качественной на двойную связь.
4) Гидрирование. Присоединение водорода происходит под действием металлических катализаторов:
t, Ni
СН3-СН=СН2 + Н2 → СН3-СН2-СН3
5) Полимеризация алкенов и их производных в присутствии кислот протекает по механизму АE:
Н+
nCH2=CHR → (-CH2-CHR-)n
где R = Н, СН3, Cl, С6Н5 и т.д. Молекула CH2=CHR называется мономером, полученное соединение — полимером , число n-степень полимеризации.
Полимеризация различных производных алкенов дает ценные промышленные продукты: полиэтилен, полипропилен, поливинилхлорид и другие.
Кроме присоединения, для алкенов характерны также реакции окисления. При мягком окислении алкенов водным раствором перманганата калия (реакция Вагнера) образуются двухатомные спирты:
3СН2=СН2 + 2КМnО4 + 4Н2О ® 3НОСН2-СН2ОН + 2MnO2↓ + 2KOH.
В результате протекания этой реакции фиолетовый раствор перманганата калия быстро обесцвечивается и выпадает коричневый осадок оксида марганца (IV). Эта реакция, как и реакция обесцвечивания бромной воды, является качественной на двойную связь. При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв двойной связи с образованием кетонов, карбоновых кислот или СО2, например:
[О]
СН3-СН=СН-СН3 → 2СН3-СООН
По продуктам окисления можно установить положение двойной связи в исходном алкене.
Как и все другие углеводороды, алкены горят, и при обильном доступе воздуха образуют диоксид углерода и воду:
СnН2n + Зn/2О2 ® nСО2↑ + nН2О.
При ограниченном доступе воздуха горение алкенов может приводить к образованию монооксида углерода и воды:
СnН2n + nО2 ® nCO↑ + nH2O.
Если смешать алкен с кислородом и пропустить эту смесь над нагретым до 200°С серебряным катализатором, то образуется оксид алкена (эпоксиалкан), например:
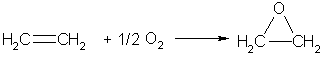
При любых температурах алкены окисляются озоном (озон более сильный окислитель, чем кислород). Если газообразный озон пропускают через раствор какого-либо алкена в тетрахлор-метане при температурах ниже комнатной, то происходит реакция присоединения, и образуются соответствующие озониды (циклические перекиси). Озониды очень неустойчивы и могут легко взрываться. Поэтому обычно их не выделяют, а сразу после получения разлагают водой — при этом образуются карбонильные соединения (альдегиды или кетоны), строение которых указывает на строение подвергавшегося озонированию алкена.
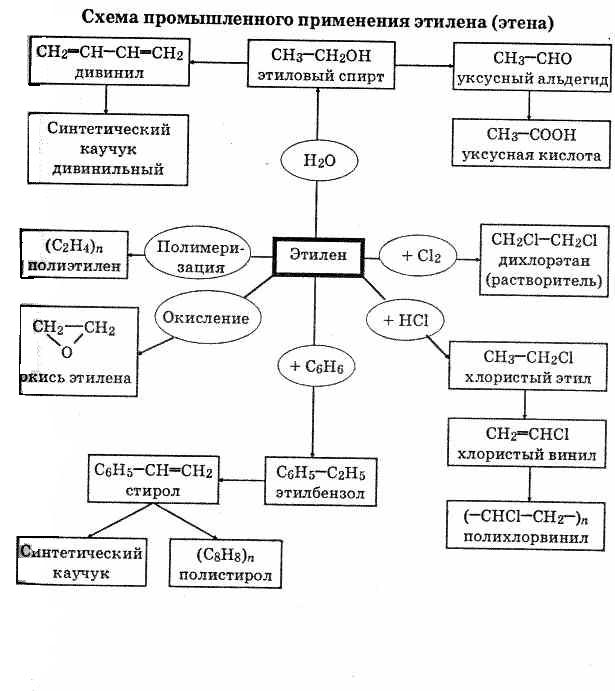
Применение алкенов
Алкены — одни из наиболее важных органических соединений. Объясняется это их высокой реакционной способностью, доступностью и низкой стоимостью. Ниже приведена схема применения этена (этилена).
Тест № 1.
1)Алкены - это ________? углеводороды, содержащие в молекуле, помимо одинарных связей, одну двойную связь.
А) ароматичные. Б) циклические. В) ациклические. Г) предельные;
2) Какой общей формуле соответствуют Алкены?
А) СnH2n-6 Б) CnH2n+2 В) CnH2n-2 Г) CnH2n;
3) В какой гибридизации находятся атомы алкенов?
А) sp2. Б) sp3. В) sp. Г) sp4;
4) Сколько негибридизованных p- орбиталей находится в молекулах алкенов?
А) 1. Б) 2. В) 3. Г) 4;
5) В какие реакции способны вступать Алкены?
А) замещения. Б) присоединения. В) соединения. Г) обмена;
6) Алкены растворимы в воде?
А) да. Б) нет В) малорастворимые;
7) Как называется этот алкен, СН3-СН2-СН=СН2?
А) бутен-2. Б) пропен-1. В) бутан-1. Г) бутен-1;
8) Является ли, СН4 - алкеном?
А) нет, это алкан. Б) да. В) нет, это арен. Г) нет, это алкин;
9) Какая это изомерия - С=С-С-С и С-С=С-С?
А) межклассовая. Б) по положению двойной связи. В) геометрическая. Г) структурная;
10) В каком агрегатном состоянии находятся высшие Алкены?
А) жидкости. Б) газы. В) твердые вещества;
11) Какой тип химических реакций в алкенах?
А) нуклеофильные. Б) радикальные. В) электрофильные;
12) Какой катализатор присутствует в гидрировании алкенов?
А) железо. Б) хлор. В) бром. Г) палладий;
13) По какому правилу происходит гидрогалогенирование алкенов?
А) Вюрца. Б) Марковникова. В) Лебедева. Г) Вагнера;
14) Как называется это соединение – (…-СН2 –СН2-…)?
А) полиэтилен. Б) этан. В) этанол. Г) этин;
15) В молекуле этена валентный угол равен:
А) 120°. Б)109°28. В)180°. Г)90°;
16) Какое строение имеет молекула этена?
А) линейное. Б) плоское. В) пирамидальное. Г) тетраэдрическое;
17) Бутен можно получить крекингом:
а) пропана. Б) октана. В) гептана. Г) октена;
18) Для получение алкенов не применяют крекинг:
А) термический. Б) восстановительный. В) каталитический;
19) Реакция присоединения водорода называется?
А) гидрирование. Б) галогенированием. В) дегидрированием. Г) гидрогалогенированием;
20) Сумма коэффициентов в реакции горения бутена равна:
А) 21. Б) 15. В) 22. Г) 23
Лабораторная работа № 1 по теме "Алкены"
Решение необходимо представить в развернутом виде.
Составьте структурную формулу:
а) 6-метил-4-этилгептена-2
б) 3,5-диметилгексена-1
2. Для алкена имеющего молекулярную формулу С7Н14 запишите четыре разных изомера. Все вещества назовите по международной номенклатуре.
3. Определите класс соединений, дайте названия веществам:
а


 ) СН3-СН-С=СН2 в) СН3
) СН3-СН-С=СН2 в) СН3


 СН3 СН3 б) СН2 СН3-С-СН-СН2-СН3
СН3 СН3 б) СН2 СН3-С-СН-СН2-СН3 3НС С2Н5
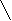
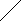 СН2 СН2
СН2 СН2
 СН2 СН2
СН2 СН2г

 ) СН2=С-СН=СН2 д) СН3
) СН2=С-СН=СН2 д) СН3 СН3 СН3-СН2-С-СН3
СН3 СН3-СН2-С-СН3е) СН3
С

 Н3-С=СН-СН-СН2-СН3
Н3-С=СН-СН-СН2-СН3СН3 С2Н5
4. Запишите уравнения следующих реакций:
а) горение пропена
б) гидробромирование бутена-1
в) гидратация этена
г) хлорирование пропена
5. Решите цепочку превращений, укажите типы реакций:
а)
С
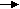
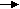
 Н4 СH3Cl C2H6 C2H4 C2H5OH
Н4 СH3Cl C2H6 C2H4 C2H5OHб)
C
 2H5OН C2H4 НОСН2-СН2ОН
2H5OН C2H4 НОСН2-СН2ОН 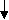
-(CH2-CH2)n-
6. Задачи
а) Определите молекулярную формулу углеводорода, содержащего 84% углерода, если плотность его паров по воздуху равна 2,48.
б) По термохимическому уравнению реакции горения этилена
C2H4 + 3 O2 = 2CO2 + 2H2O + 1400 кДж
рассчитайте, сколько теплоты выделится, если в реакцию вступило 40 л этилена (н.у.).
Лекция № 2.
Диеновые углеводороды (алкадиены).
Диеновые углеводороды или алкадиены – это непредельные углеводороды, содержащие две двойные углерод - углеродные связи. Общая формула алкадиенов CnH2n-2.
В зависимости от взаимного расположения двойных связей диены подразделяются на три типа:
углеводороды с кумулированными двойными связями, т.е. примыкающими к одному атому углерода. Например, пропадиен или аллен CH2=C=CH2;
- углеводороды с изолированными двойными связями, т.е разделенными двумя и более простыми связями. Например, пентадиен -1,4
CH2=CH–CH2–CH=CH2;
- углеводороды с сопряженными двойными связями, т.е. разделенными одной простой связью. Например, бутадиен -1,3 или дивинил
CH2=CH–CH=CH2, 2-метилбутадиен -1,3 или изопрен
| CH2=С–CH=CH2. I CH3 |
Наибольший интерес представляют углеводороды с сопряженными двойными связями.
Получение
Углеводороды с сопряженными двойными связями получают:
дегидрированием алканов, содержащихся в природном газе и газах нефтепереработки, при пропускании их над нагретым катализатором
CH3–CH2–CH2–CH3 ––600°С;Cr2O3,Al2O3® CH2=CH–CH=CH2 + 2H2
| CH3– | CH–CH2–CH3 ––600°С;Cr2O3,Al2O3® CH2= I CH3 | C–CH=CH2 + 2H2 I CH3 |
- дегидрированием и дегидратацией этилового спирта при пропускании паров спирта над нагретыми катализаторами (метод акад. С.В.Лебедева)
2CH3CH2OH ––450°С;ZnO,Al2O3® CH2=CH–CH=CH2 + 2H2O + H2
Физические свойства
Бутадиен -1,3 – легко сжижающийся газ с неприятным запахом, t°пл.= -108,9°C, t°кип.= -4,5°C; растворяется в эфире, бензоле, не растворяется в воде.
2- Метилбутадиен -1,3 – летучая жидкость, t°пл.= -146°C, t°кип.= 34,1°C; растворяется в большинстве углеводородных растворителях, эфире, спирте, не растворяется в воде.
Химические свойства
Атомы углерода в молекуле бутадиена-1,3 находятся в sp2 - гибридном состоянии, что означает расположение этих атомов в одной плоскости и наличие у каждого из них одной p- орбитали, занятой одним электроном и расположенной перпендикулярно к упомянутой плоскости.
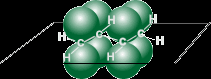 a) | 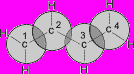 b) |
| Схематическое изображение строения молекул дидивинила (а) и вид модели сверху (b). Перекрывание электронных облаков между С1–С2 и С3–С4 больше, чем между С2–С3. | |
p- Орбитали всех атомов углерода перекрываются друг с другом, т.е. не только между первым и вторым, третьим и четвертым атомами, но и также между вторым и третьим. Отсюда видно, что связь между вторым и третьим атомами углерода не является простой s- связью, а обладает некоторой плотностью p- электронов, т.е. слабым характером двойной связи. Это означает, что s- электроны не принадлежат строго определенным парам атомов углерода. В молекуле отсутствуют в классическом понимании одинарные и двойные связи, а наблюдается делокализация - электронов, т.е. равномерное распределение - электронной плотности по всей молекуле с образованием единого - электронного облака.
Взаимодействие двух или нескольких соседних - связей с образованием единого - электронного облака, в результате чего происходит передача взаимовлияния атомов в этой системе, называется эффектом сопряжения.
Таким образом, молекула бутадиена -1,3 характеризуется системой сопряженных двойных связей.
Такая особенность в строении диеновых углеводородов делает их способными присоединять различные реагенты не только к соседним углеродным атомам (1,2- присоединение), но и к двум концам сопряженной системы (1,4- присоединение) с образованием двойной связи между вторым и третьим углеродными атомами. Отметим, что очень часто продукт 1,4- присоединения является основным.
Рассмотрим реакции галогенирования и гидрогалогенирования сопряженных диенов.
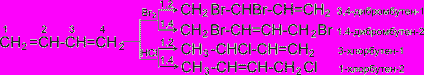
Как видно, реакции бромирования и гидрохлорирования приводят к продуктам 1,2- и 1,4- присоединения, причем количество последних зависит, в частности, от природы реагента и условий проведения реакции.
Важной особенностью сопряженных диеновых углеводородов является, кроме того, их способность вступать в реакцию полимеризации. Полимеризация, как и у олефинов, осуществляется под влиянием катализаторов или инициаторов.
Она может протекать по схемам 1,2- и 1,4- присоединения.
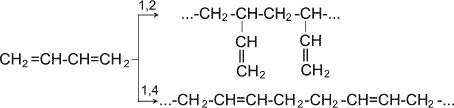
Полимеризация диеновых соединений
В упрощенном виде реакцию полимеризации бутадиена -1,3 по схеме 1,4 присоединения можно представить следующим образом:
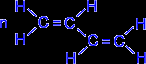 | ––––® | 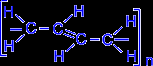 . . |
В полимеризации участвуют обе двойные связи диена. В процессе реакции они разрываются, пары электронов, образующие - связи разобщаются, после чего каждый неспаренный электрон участвует в образовании новых связей: электроны второго и третьего углеродных атомов в результате обобщения дают двойную связь, а электроны крайних в цепи углеродных атомов при обобщении с электронами соответствующих атомов другой молекулы мономера связывают мономеры в полимерную цепочку.
Элементная ячейка полибутадиена представляется следующим образом :
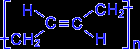 .
.Как видно, образующийся полимер характеризуется транс- конфигурацией элементной ячейки полимера. Однако наиболее ценные в практическом отношении продукты получаются при стереорегулярной (иными словами, пространственно упорядоченной) полимеризации диеновых углеводородов по схеме 1,4- присоединения с образованием цис- конфигурации полимерной цепи. Например, цис- полибутадиен
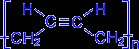 .
.Натуральный и синтетический каучуки
Натуральный каучук получают из млечного сока (латекса) каучуконосного дерева гевеи, растущего в тропических лесах Бразилии.
При нагревании без доступа воздуха каучук распадается с образованием диенового углеводорода – 2- метилбутадиена-1,3 или изопрена. Каучук – это стереорегулярный полимер, в котором молекулы изопрена соединены друг с другом по схеме 1,4- присоединения с цис- конфигурацией полимерной цепи :
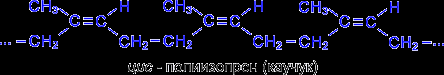
Молекулярная масса натурального каучука колеблется в пределах от 7.104 до 2,5.106.
транс- Полимер изопрена также встречается в природе в виде гуттаперчи.
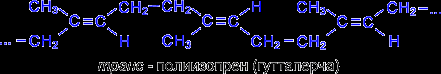
Натуральный каучук обладает уникальным комплексом свойств: высокой текучестью, устойчивостью к износу, клейкостью, водо- и газонепроницаемостью. Для придания каучуку необходимых физико-механических свойств: прочности, эластичности, стойкости к действию растворителей и агрессивных химических сред – каучук подвергают вулканизации нагреванием до 130-140°С с серой. В упрощенном виде процесс вулканизации каучука можно представить следующим образом :
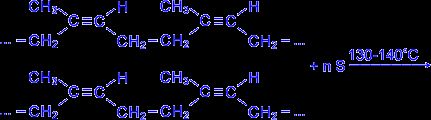
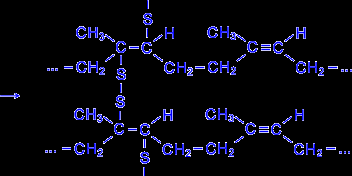
Атомы серы присоединяются по месту разрыва некоторых двойных связей и линейные молекулы каучука "сшиваются" в более крупные трехмерные молекулы – получается резина, которая по прочности значительно превосходит невулканизированный каучук. Наполненные активной сажей каучуки в виде резин используют для изготовления автомобильных шин и других резиновых изделий.
В 1932 году С.В.Лебедев разработал способ синтеза синтетического каучука на основе бутадиена, получаемого из спирта. И лишь в пятидесятые годы отечественные ученые осуществили каталитическую тереополимеризацию диеновых углеводородов и получили стереорегулярный каучук, близкий по свойствам к натуральному каучуку. В настоящее время в промышленности выпускают каучук, в котором содержание звеньев изопрена, соединенных в положении 1,4, достигает 99%, тогда как в натуральном каучуке они составляют 98%. Кроме того, в промышленности получают синтетические каучуки на основе других мономеров – например, изобутилена, хлоропрена, и натуральный каучук утратил свое монопольное положение.
Тест № 2.
по теме "Алкадиены"
1. Название углеводорода с формулой СН2=СН-С=СН-СН-СН3
│ │
С2Н5 СН3
а) 5-метил-3этилгексадиен-1,3 б)2-этил-4-метилгексадиен-3,5
в)3,5-диметилгептадиен-4,6 г)3,5-диметилгептадиен-1,3.
2.Изомерия углеродного скелета у алкадиенов начинается с:
а)пропадиена б)бутадиена в)пентадиена г)гексадиена
3. Диеновые углеводороды являются межклассовыми изомерами:
а)алканов б)алкенов в)алкинов) д)циклоалканов
4.При дегидробромировании 1,3-дибромпентана образуется:
а)пентадиен-1,2 б)пентадиен 1,3 в)пентадиен 1,4 г)бутадиен-1,3
5.Получение бутадиен-1,3 из этилового спирта называется реакцией:
а)Лебедева б)Зелинского в)Вюрца г)Кучерова
6.Какая масса пентадиена -1,3 занимает при одинаковых условиях тот же объём, что и 2.8г этилена?
а)5.6г б)6.2г в)6.4г г)6.8г
7.Число изомерных алкадиенов с общей формулой С5Н8 равно:
а)3 б)4 в)5 г)6
8. Сумма коэффициентов в уравнении реакции получения бутадиена по методу Лебедева равна:
а)4 б)5 в)6 г)7
9.Алкадиены способны присоединять:
а)водород б)галогеноводороды в)галогены г)все ответы верны
10.Резину получают в результате процесса:
а)полимеризации изопрена б)вулканизации каучука
в)деполимеризации каучука г) сополимеризации бутадиенат и стирола
11. Какая масса бутадиена-1,3 занимает при одинаковых условиях тот же объем, что и 2.6г ацетилена?
а)3.8г б)4.2г в)5.6г г) верного ответа нет
Лекция № 3.
Ацетиленовые углеводороды (алкины)
Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу CnH2n-2. Родоначальником гомологического ряда этих углеводородов является ацетилен HCєCH.
Изомерия
Алкинам свойственна изомерия углеродного скелета (начиная с C5H8), изомерия положения тройной связи (начиная с C4H6) и межклассовая изомерия с алкадиенами.
Получение
В промышленном масштабе для технических целей ацетилен получают высокотемпературным пиролизом метана.
2CH4 ––1500°C® HCєCH + 3H2
- Алкины можно получить из дигалогенопроизводных парафинов отщеплением галогеноводорода при действии спиртового раствора щелочи. Атомы галогена при этом могут быть расположены как у соседних атомов углерода, так и у одного углеродного атома.
| СH3–CH–CH2 + 2 KOH ––этанол® CH3–CєCH + 2KBr + 2H2O I I Br Br |
| Br I CH3–C–CH2–CH3 + 2KOH ––этанол® CH3–CєC–CH3 + 2KBr + 2H2O I (бутин-2) Br |
- Ацетилен получают также из ацетиленида (карбида) кальция при разложении его водой.
CaC2 + 2H2O ® Ca(OH)2 + HCєCH
Физические свойства
По физическим свойствам алкины напоминают алкены и алканы. Температуры их плавления и кипения увеличиваются с ростом молекулярной массы. В обычных условиях алкины С2–С3 – газы, С4–С16 – жидкости, высшие алкины – твердые вещества. Наличие тройной связи в цепи приводит к повышению температуры кипения, плотности и растворимости их в воде по сравнению с олефинами и парафинами. Физические свойства некоторых алкинов сведены в таблице.
Таблица. Физические свойства некоторых алкинов
| Название | Формула | t°пл., °C | t°кип., °C |
| Ацетилен | HCєCH | -80,8 | -83,6 |
| Метилацетилен | CH3–CєCH | -102,7 | -23,3 |
| Бутин-1 | C2H5–CєCH | -122,5 | 8,5 |
| Бутин-2 | CH3–CєC–CH3 | -32,3 | 27,0 |
| Пентин-1 | CH3–CH2–CH2–CєCH | -98,0 | 39,7 |
| Пентин-2 | CH3–CH2–CєC–CH3 | -101,0 | 56,1 |
| 3-Метилбутин-1 | CH3–CH–CєCH I CH3 | – | 28,0 |
Химические свойства
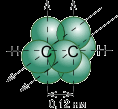
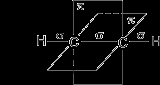
Углеродные атомы в молекуле ацетилена находятся в состоянии sp-гибридизации. Это означает, что каждый атом углерода обладает двумя гибридными sp- орбиталями, оси которых расположены на одной линии под углом 180° друг к другу, а две p- орбитали остаются негибридными.

sp- Гибридные орбитали двух атомов углерода в состоянии,
предшествующем образованию тройной связи и связей C–H
По одной из двух гибридных орбиталей каждого атома углерода взаимно перекрываются, приводя к образованию s- связи между атомами углерода. Каждая оставшаяся гибридная орбиталь перекрывается с s- орбиталью атома водорода, образуя - связь С–Н.
Схематическое изображение строения молекулы ацетилена (ядра атомов углерода и водорода на одной прямой,
две π- связи между атомами углерода находятся в двух взаимно перпендикулярных плоскостях)
Две негибридные p- орбитали каждого атома углерода, расположенные перпендикулярно друг другу и перпендикулярно направлению Ϭ- связей, взаимно перекрываются и образуют две π- связи. Таким образом, тройная связь характеризуется сочетанием одной Ϭ- и двух π- связей.
Для алкинов характерны все реакции присоединения, свойственные алкенам, однако у них после присоединения первой молекулы реагента остается еще одна π - связь (алкин превращается в алкен), которая вновь может вступать в реакцию присоединения со второй молекулой реагента. Кроме того, "незамещенные" алкины проявляют кислотные свойства, связанные с отщеплением протона от атома углерода, составляющего тройную связь (єС–Н).
Реакции присоединения
Гидрирование. Гидрирование алкинов осуществляется при нагревании с теми же металлическими катализаторами (Ni, Pd или Pt), что и в случае алкенов, но с меньшей скоростью.
CH3–CєCH(пропин) ––t°,Pd;H2•® CH3–CH=CH2(пропен) ––t°,Pd;H2®
CH3–CH2–CH3(пропан)
- Галогенирование. Алкины обесцвечивают бромную воду (качественная реакция на тройную связь). Реакция галогенирования алкинов протекает медленнее, чем алкенов.
HCєCH ––Br2® CHBr=CHBr(1,2- дибромэтен) ––Br2®
CHBr2–CHBr2(1,1,2,2- тетрабромэтан)
- Гидрогалогенирование. Образующиеся продукты определяются правилом Марковникова.
CH3–CєCH ––HBr® CH3–CBr=CH2(2- бромпропен -1) ––HBr®
CH3–CBr2–CH3(2,2- дибромпропан)
- Гидратация (реакция Кучерова). Присоединение воды осуществляется в присутствии сульфата ртути. Эту реакцию открыл и исследовал в 1881 году М.Г.Кучеров.
Присоединение воды идет по правилу Марковникова, образующийся при этом неустойчивый спирт с гидроксильной группой при двойной связи (так называемый, енол) изомеризуется в более стабильное карбонильное соединение - кетон.
| C2H5–CєCH + H2O ––HgSO4® [C2H5– | C=CH2](енол) ® C2H5– I ø OH | C–CH3(метилэтилкетон) II O |
В случае гидратации собственно ацетилена конечным продуктом является альдегид.
| | | O II |
| HCєCH + H2O ––HgSO4® [CH2=  | CH](енол) ® CH3– I | C(уксусный альдегид) I |
H | O | H |
- Полимеризация. Ацетиленовые углеводороды ввиду наличия тройной связи склонны к реакциям полимеризации, которые могут протекать в нескольких направлениях:
- Под воздействием комплексных солей меди происходит димеризация и линейная тримеризация ацетилена.
HCєCH ––kat.HCєCH® CH2=CH–CєCH ––kat.HCєCH® CH2=CH–CєC–CH=CH2
- При нагревании ацетилена в присутствии активированного угля (реакция Зелинского) осуществляется циклическая тримеризация с образованием бензола.
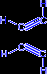 | + | 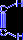 | ––600°C,C® | 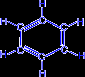 |
Кислотные свойства
Водородные атомы ацетилена способны замещаться металлами с образованием ацетиленидов. Так, при действии на ацетилен металлического натрия или амида натрия образуется ацетиленид натрия.
HCєCH ––NaNH2® HCєCNa + NH3
Ацетилениды серебра и меди получают взаимодействием с аммиачными растворами соответственно оксида серебра и хлорида меди.
HCєCH + 2[Ag(NH3)2]OH ®AgCєCAg + 4NH3 + 2H2O
Ацетилениды серебра, меди обладают исключительной взрывчатостью. Они легко разлагаются при действии соляной кислоты.
AgCєCAg + 2HCl ® HCєCH+ 2AgClЇ
Данным свойством ацетиленидов пользуются при выделении ацетиленовых углеводородов из смесей с другими газами.
Применение
При горении ацетилена в кислороде температура пламени достигает 3150°C, поэтому ацетилен используют для резки и сварки металлов. Кроме того, ацетилен широко используется в органическом синтезе разнообразных веществ - например, уксусной кислоты, 1,1,2,2- тетрахлорэтана и др. Он является одним из исходных веществ при производстве синтетических каучуков, поливинилхлорида и других полимеров.
Тест № 3.
по теме "Алкины"
Выпишите номера правильных высказываний.
1. Общая формула алкинов СnН2n
2. В молекулах алкинов одна двойная связь.
3. Этилен - важнейший представитель алкинов.
4. Для алкинов наиболее характерны реакции замещения.
5. Один из алкинов применяется при сварке и резке металлов.
6. В молекулах алкинов одна тройная связь.
7. Алкины можно получить реакцией Лебедева.
8. Названия алкинов образуют с помощью суффикса -ан.
9. Для алкинов наиболее характерны реакции присоединения.
10. Формула ацетилена C3H4.
11. Алкины применяют для получения резины.
12. Один из алкинов получают карбидным способом.
13. Из алкина реакцией Кучерова можно получить альдегид.
14. Один из алкинов - ацетилен - летучая жидкость.
15. Формула ацетилена C2H2.
16. Гидратация гомологов ацетилена идет по правилу Марковникова.
17. Как и все углеводороды, алкины горят с образованием углекислого газа и воды.
18. При определенных условиях из алкинов можно получить алканы.
19. Ацетилен можно получить дегидратацией этилового спирта.
20. Общая формула алкинов СnH2n-2.
Лабораторная работа № 2.
Вещество, соответствующее формуле CnH2n-2
пропан
- бутин-1
- циклогексан
- циклогексин
- Количество структурных изомеров с тройной химической связью для вещества C5H8
4
- 3
- 2
- 1
- C аммиачным раствором оксида серебра взаимодействует
бутин-1
- бутин-2
- бутен-1
- бутен-2
- При взаимодействии бутина-1 с водой образуется
бутанол-1
- бутанолы
- бутанон-2
- бутанол-2
- Ацетилен взаимодействует с перечисленными веществами
аммиачный раствор оксида серебра
- раствор перманганата калия
- бромная вода
- гидроксид натрия
- фенол
- натрий
- ацетон
В ответе запишите буквы в соответствующем алфавитном порядке.
- Количество σ-связей в молекуле 2-метилбутин-1
10
- 11
- 12
- 13
- Количество атомов водорода в молекуле вещества х2
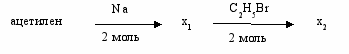
5
- 6
- 10
- 11
- Напишите уравнения реакций по схеме
C3H6 → C3H6Cl2 → x → C3H6O → C3H8O
Вещество х называется
пропан
- пропен
- пропандиол 1, 2
- пропин
- Объем воздуха, необходимый для сжигания 6 л ацетилена (объемная доля кислорода в воздухе 20%)
75 л
- 3 л
- 15 л
- 150 л
- Карбид кальция массой 200 г, содержащий 20% примесей, обработали водой. Образовавшийся ацетилен подвергли гидратации (реакция Кучерова). Рассчитайте, какая масса ацетальдегида образовалась, если массовая доля выхода ацетилена составила 75% от теоретического (82,5г).
Итоговый тест по теме «Углеводороды»
В каком из вариантов ответа углеводороды расположены в порядке уменьшения длины углерод - углеродной связи?
1) ацетилен, этан, этилен, 2) этан, этин, этен
3) этан, этилен, ацетилен 4) этан, алкадиен, этилен,
2. Молярную массу алкина с числом углеродных атомов, равным n , можно рассчитать по формуле:
1) 12n-2 2) 14n + 2 3) 14n -2 4) 12n+ 2
3. Какое из следующих утверждений не верно?
1) Любой предельный углеводород содержит первичный атом углерода
2) Любой предельный углеводород содержит атом углерода в состоянии sp3-гибридизации
3) для алкенов характерно большее число типов изомерии по сравнению с алканами и алкинами
4) молекулы циклоалканов содержат только σ-связи.
4. Найдите верное утверждение:
1) Два гомолога могут являться изомерами
2) два изомера могут являться гомологами
4) два вещества, состав молекул которых отличается на одну или несколько групп –СН2-, являются гомологами.
5. Изомерами являются все три вещества в группе:
1) бутен-1, транс-бутен-2, 2-метилбутен-2 2) бензол, гексатриен-1,3,5, гексадиин-2,4
3) 2-метилпетадиен-1,3, циклогексен, 3,3-диметилбутин-1 4) бутин-2, бутадиен-1,3, метилциклопропан
6. При взаимодействии карбида кальция с соляной кислотой наряду с ацетиленом образуется:
1) гидроксид кальция 2) оксид кальция 3) хлорид кальция 4) кальций
7. Какой из углеводородов нельзя получить реакцией дегидрирования?
1) 2,3-диметилпентан 2) бутен-2 3) 2-метилбутадиен-1,3 4) бензол
8. Тип гибридизации атомов углерода в молекуле пентен-1-ина-3 слева направо таков:
1) sp2, sp2, sp, sp, sp3 2) sp2, sp, sp3 sp3 sp 3) sp, sp, sp2 sp2 sp3 4) sp2, sp2, sp3 sp3 sp
9. Какой из углеводородов, формулы которых приведены ниже, способен существовать в виде геометрических изомеров?
1) СН3-С≡С-СН3 2) СН=СН2 4) СН3-С=СН-СН3
3
 ) СН2=СН-СН=СН-СН3 | |
) СН2=СН-СН=СН-СН3 | | СН3 СН3
|
10. Основным продуктом дегидратации спирта, имеющего формулу СН2-С-СН2-СН2-СН3 является:
1) 2,3-диметилпентен-2 3) 2-этил-3-метилбутен-1 | |
2) 3-метилгексен-2 4) 2,3-диметипентен-1 СН3 ОН
11. Реакции присоединения наиболее характерны для всех углеводородов группы:
1) алканы, алкены, алкины 2) алкены, алканы, алкадиены
3) алкены, алкадиены, алкины 4) циклоалканы, алкены,
12. Структурным звеном полипропилена является фрагмент, представленный формулой:
1) –СН2-СН2-СН2- 2) –СН- 3) СН3 4) –СН2-СН-
| | |
СН2-СН3 -С- СН3
|
СН3
13. Число изомерных гептенов, содержащих в молекуле один третичный атом углерода, равно:
1) один 2) три 3) два 4) четыре
14. В каком из углеводородов величина валентного угла между углеродными атомами максимальна?
1) пропан 2) пропен 3) циклопропан 4) пропин
15. Какой тип изомерии отсутствует у алкинов?
1) углеродного скелета 2) геометрическая 3) положения кратной связи 4) межклассовая
16. Укажите формулу углеводорода, для которого реакции присоединения могут протекать только в одну стадию:
СН-СН
1) СН2 – СН2 2) СН≡С-СН3 3) СН2=СН-СН=СН2 4) // \\
\ / СН СН
СН2 \ /
СН2
17. К какому классу углеводородов может относиться вещество, в молекуле которого число атомов водорода меньше, чем атомов углерода?
1) алкин 2) алкадиен 3) алкадиин 4) циклоалкан
18. Алкадиены с изолированными двойными связями наиболее сходны по своим химиечским свойствам:
1) с алканами 2) с алкенасм 3) с алкинами 4) с аренами
19. Укажите структурное звено полимерной цепи натурального каучука:
1) -СН2 Н 2) –СН2 СН2- 3) –СН2 СН2- 4) –СН2 Н
\ / \ / \ / \ /
С=С С=С С=С С=С
/ \ / \ / \ / \
Н СН2- СН3 Н СН3 СН3 СН3 СН2-
