С. И. Михалевич д м. н., профессор, заведующая кафедрой акушерства, гинекологии и репродуктивного здоровья Белмапо
| Вид материала | Документы |
- Кафедра акушерства и гинекологии, 373.09kb.
- А. Хальфина, Научным центром акушерства, гинекологии и перинатологии Российской академии, 5747.86kb.
- Пояснительная записка Акушерство и гинекология, 273.61kb.
- Пояснительная записка Акушерство и гинекология, 328.95kb.
- Пояснительная записка Акушерство и гинекология, 193.86kb.
- Номинация 8 «За верность профессии» Быстрицкая Тамара Сергеевна, 251kb.
- Тематический план лекций по акушерству для студентов IV курса педиатрического факультета, 34.21kb.
- Календарно-тематический план лекций по репродуктологии кафедра акушерства, гинекологии, 83.5kb.
- Программа и учебно-тематические планы дополнительного профессионального образования, 3331.61kb.
- Заведующий кафедрой акушерства и гинекологии, д м. н., профессор Н. А. Жаркин, 1276.27kb.
МЕТОДЫ ОЦЕНКИ И ИССЛЕДОВАНИЯ БОЛИ
Оценка боли – важный элемент эффективности послеоперационного обезболивания.
В настоящее время в различных областях медицины широко используется понятие «качество жизни». Качество жизни – это интегральная характеристика физического, эмоционального и социального функционирования больного, основанная на его субъективном восприятии. Качество жизни является одним из ключевых понятий в современной медицине, которое позволяет дать глубокий многоплановый анализ проблем больного человека. Оно является одним из основных критериев при оценке успешности лечения выраженных болевых синдромов. При определении качества жизни больных с болевыми синдромами оцениваются разные стороны их жизнедеятельности, как связанные, так и не связанные с болевым синдромом; это позволяет дифференцированно определять, как адекватная аналгезия влияет на состояние пациента. Всегда следует учитывать, что качество жизни изменяется в зависимости от состояния больного, в том числе обусловленного лечением выраженного болевого синдрома. Данные о качестве жизни позволяют осуществлять постоянный мониторинг состояния больного и в случае необходимость проводить коррекцию лечения. Для определения качество жизни необходимо участие пациента в оценке своего состояния. Пациенты, проводящие мониторинг собственной боли, испытывают чувство защищенности, ощущение усиленного контроля своего состояния. Напротив, больные, пренебрегающие регистрацией болей, либо пациенты со стабильно удерживающимися болями, не поддающимися лечению, чувствуют себя заброшенными. Это увеличивает возбуждение пациента, что способствует усилить перцепцию боли. [5, 7, 8, 9, 11, 23]
Принципы адекватной оценки боли:
- Исследование интенсивности боли обязательно осуществляется как в покое, так и при движениях пациента (подъем головы, кашель), что позволяет оценить его функциональный статус (табл. 3).
- Эффективность обезболивания определяется оценкой интенсивности боли до и после назначения каждого анальгетика или метода анальгезии.
- В хирургических ОРИТ и прочих подразделениях, где находятся пациенты с болью высокой интенсивности, оценка на начальном этапе лечения осуществляется каждые 15-30 минут, а затем, по мере снижения интенсивности, каждые 2 часа.
- В хирургических отделениях периодичность оценки интенсивности боли составляет 4-8 часов, что зависит как от выраженности боли, так и от эффективности обезболивания.
- При решении вопроса о необходимости обезболивания необходимо ориентироваться на критерии максимально допустимой интенсивности боли (пороги вмешательства). В частности, по 10-балльной визуально-рейтинговой шкале максимально допустима интенсивность боли 3 балла в покое и 4 балла при движениях (кашле).
- Внезапное усиление интенсивности боли, особенно связанное с появлением гипотензии, тахикардии, лихорадки, требует немедленной комплексной оценки состояния пациента, поскольку может быть связано с развитием хирургических осложнений, тромбоза глубоких вен и другой экстренной патологией.
- Интенсивность боли до и после лечения, неблагоприятные эффекты при проведении обезболивания должны быть четко зарегистрированы в доступных формах (дневник наблюдения и лист интенсивной терапии).
- Пациенты, с которыми затруднен вербальный контакт, требуют внимания при оценке боли. В эту категорию могут быть включены пациенты с нарушениями когнитивных функций, эмоционально лабильные пациенты, а также пациенты, чей уровень образования и степень культурного развития намного ниже среднего.
- Немедленное обезболивание проводиться пациентам при очевидной боли (без оценки боли), в том случае, когда больные из-за выраженного болевого синдрома не могут быть достаточно сосредоточены, чтобы оценить выраженность боли.
- В некоторых случаях родственники пациентов могут участвовать в оценке боли, при условии адекватного реагирования и сотрудничества.
Выбирая способ оценки боли необходимо убедиться в том, что:
- Он соответствует образовательному уровню пациента, его физическому, психическому и эмоциональному статусу
- Он отвечает как интересам пациента, так и потребностям специалистов, занимающихся обезболиванием
Для определения интенсивности боли используют специальные шкалы оценки боли. Использование какой-то одной шкалы в пределах одной клиники позволяет всему персоналу, занимающемуся обезболиванием, «говорить на одном языке». Самооценка боли пациентом является наиболее ценным инструментом. Во всех случаях необходимо в первую очередь прислушиваться к мнению пациента и доверять его ощущениям. Для определения интенсивности болевого синдрома используются как правило описательные характеристики боли, даваемые самим пациентом, так и различные шкалы: визуальная аналоговая, словесная рейтинговая и другие. [2, 3, 5, 7, 9, 10, 11, 14, 15, 16, 19, 23]
Различные варианты визуальной аналоговой шкалы (ВАШ) применяются в клинической практике с 80-х годов прошлого века. ВАШ представляет собой горизонтальную линию 10 см, концы которой соответствуют крайним степеням интенсивности боли – от «нет боли» до «нестерпимая боль». Пациент делает отметку на этом отрезке в точке, которая отражает интенсивность его боли.
Метод описательных определений заключается в том, что больному предлагаются определения боли: «лёгкая», «умеренная», «терпимая», «сильная», - до «нестерпимой». Пациент выбирает определение и подчёркивает его.
На рисунке 1 представлены различные варианты шкал самооценки боли. [5, 7, 9, 10, 11, 13, 14, 16, 23]
Рисунок 1
Выбор способа оценки боли
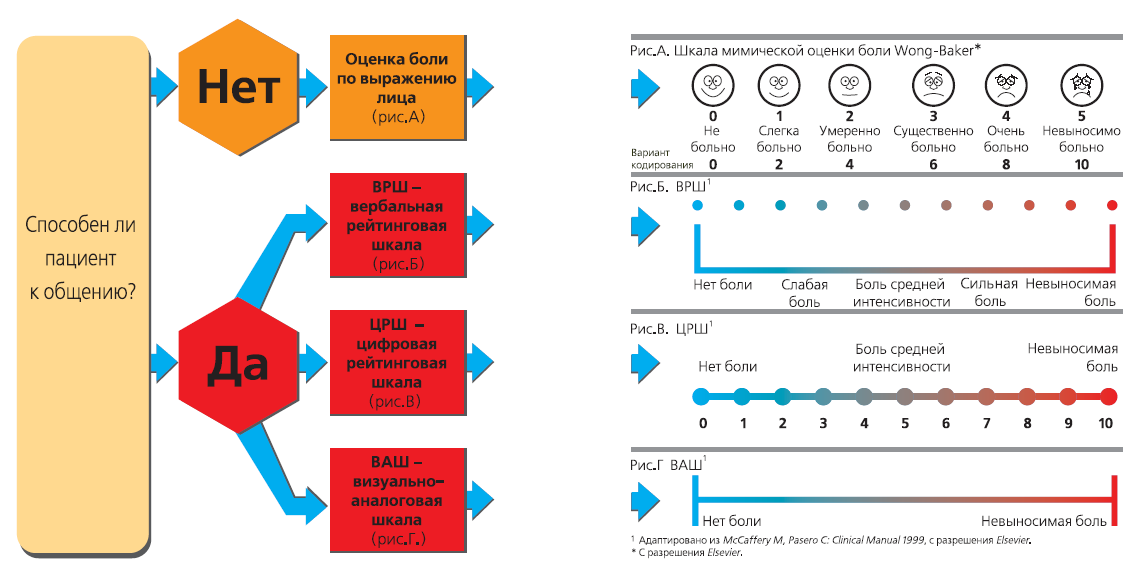
Рис.А. Оценка боли по выражению лица: пиктограмма шести лиц с различной мимикой, отражающей спектр ощущений от улыбки и хорошего настроения до страдания. Эта шкала может быть использована у пациентов, общение с которыми затруднено.
Рис.Б. Вербальная рейтинговая шкала (ВРШ): пациента просят оценить боль по одному из 5 критериев: «отсутствие боли, слабая, средняя, сильная, невыносимая боль».
Рис.В. Цифровая рейтинговая шкала (ЦРШ): представляет собой отрезок прямой с цифрами от 0 до 5 (или от 0 до 10), где 0 соответствует полному отсутствию боли, а 5 (или 10) – максимально возможной, невыносимой боли. Пациента просят оценить интенсивность боли соответствующей цифрой.
Рис.Г. Визуально-аналоговая шкала (ВАШ): представляет собой отрезок прямой длиной 100 мм, без делений и цифр, начало которого имеет обозначение «боли нет», а окончание – «невыносимая боль». Пациент делает отметку на этом отрезке в точке, которая отражает интенсивность его боли.
В рутинной клинической практике чаще используются шкалы ВРШ и ЦРШ, а ВАШ преимущественно применяется в исследовательских целях.
Для описательной характеристики боли, оценки ее силы и влияния на организм используют различные анкеты и опросники. Опросник МакГилла оценивает сенсорные, аффективные и моторно-мотивационные компоненты боли. Слова-дескрипторы отражают характер ощущений, интенсивность и продолжительность боли. В литературе сообщается о высокой информативности опросника, позволяющий уловить минимальные колебания уровня болевых реакций, что очень важно при подборе метода ведения и дозы анальгетика. К таким же опросникам можно отнести Дартмутскую болевую анкету.
По данным анкеты измеряется индекс интенсивности боли, число выбранных слов и общая интенсивность по шкале боли. Для удобства часто используют сокращенный вариант анкеты МакГилла (Melzack R., 1987;).
Словесная рейтинговая шкала позволяет адекватно оценить состояние больного, хорошо корреспондируется с результатами других измерений интенсивности боли, но слабо отражает персональные факторы, влияющие на формирование болевого синдрома. Часто сенсорные, аффективные и оценочные описания боли зависят от эмоционального состояния больного. Пациенты с хроническими болевыми синдромами для определения интенсивности боли. Пользуются несколькими словами. В таких случаях предлагается перекрестно-модальный подход в оценке боли, предусматривающий составление подробного ряда обозначений выраженности боли самим больным (Evans С J. et al., 2004;).
Для регистрации боли в течение ограниченного времени, например при клинических испытаниях нового лекарства или в послеоперационный период, полезной может быть специализированная компьютерная программа Pain Track. Пациент при помощи калибратора выбирает уровень, соответствующий его болевым ощущениям. Повторные оценки боли в течение нескольких дней дают диаграмму флюктуаций интенсивности боли, оцениваемую компьютером (Sto-ne А.А. et al., 2003; Cook AJ. et al., 2004; Aaron L.A. et al., 2004).
ВЕДЕНИЕ ДОКУМЕНТАЦИИ
Необходимо регулярно регистрировать интенсивность боли, изменения схемы обезболивания, эффективность анальгезии, побочные эффекты используемых препаратов и методов обезболивания. Вышеуказанные данные вносятся в отдельный раздел листа послеоперационного наблюдения или в специальную карту послеоперационного обезболивания.
- Медсестра, ответственная за пациента, регистрирует интенсивность боли и проводит обезболивание в соответствии с принятыми национальными рекомендациями.
- Врач, ответственный за пациента, при необходимости (недостаточная эффективность анальгезии) изменяет схему обезболивания.
- В дальнейшем стратегия лечения боли определяется совместно врачом, ответственным за обезболивание, и палатными медсестрами.
- Как врачи, так и медсестры уделяют особое внимание эффективности обезболивания, а также выявлению побочных эффектов используемых препаратов.
Таблица 6
Ориентировочный протокол оценки интенсивности
послеоперационной боли
| Время | 10 | 13 | 16 | 19 | 22 | 01 | 05 |
| (Покой/активизация) | П | А | А | П | П | А | С |
| ВАШ | 2 | 6↓2 | 2 | 2 | 8↓3 | 3 | |
Примечание. П - боль в покое; А - боль при активизации (кашель); ↓ - введение анальгетика; 6↓2 - интенсивность боли до и после введения анальгетика; С - пациент спит.
ИНФОРМИРОВАНИЕ ПАЦИЕНТОВ
Успех обезболивания во многом зависит от степени информированности пациентов и их веры в компетентность врача. В связи с этим целесообразно предоставить пациентам детальную информацию о послеоперационной боли и способах борьбы с ней. Подобная информация обычно включает:
- Сведения о важности лечения послеоперационной боли.
- Доступные методы послеоперационного обезболивания.
- Общепринятая практика оценки боли.
- Оптимальная оценка боли и адекватное обезболивание.
- Степень участия пациента в процессе обезболивания.
Информирование пациента и активное их участие в обезболивании является важной составляющей, которая не всегда выполняется в полном объеме. Для решения этой проблемы используются частные беседы, наглядная информация в виде брошюр, плакатов, ссылок на популярные интернет-сайты по обезболиванию.
До оперативного вмешательства в беседе с пациентами и его родственниками целесообразно обсудить следующие вопросы:
- выбор метода анестезии и послеоперационного обезболивания;
- выбор метода исследования боли и объяснение пациентам вариантов их использования;
- план оценки интенсивности боли;
- определение уровня боли по бальной оценке, выше которого будут рассматриваться варианты анальгезии;
- важность сообщения об интенсивности боли, избегая преувеличения.
ЗАДАЧИ ПОСЛЕОПЕРАЦИОННОГО ОБЕЗБОЛИВАНИЯ
- Повышение качества жизни пациентов в послеоперационном периоде.
- Ускорение послеоперационной функциональной реабилитации.
- Снижение частоты послеоперационных осложнений.
- Ускорение выписки пациентов из клиники.
Нужно отметить, что в настоящее время в большинстве развитых стран неадекватное послеоперационное обезболивание рассматривается как нарушение прав человека.
СОВРЕМЕННЫЕ ВОЗМОЖНОСТИ
ЛЕЧЕНИЯ ПОСЛЕОПЕРАЦИОННОЙ БОЛИ
Предупреждение и лечение послеоперационной боли является одной из ключевых задач современной медицины. В большинстве развитых стран послеоперационное обезболивание осуществляется в соответствии с принятыми национальными и международными стандартами. Тем не менее в определенной степени можно руководствоваться международными рекомендациями, в частности "Acute Pain Management: Scientific Evidence" (2005), суммировавшими данные доказательной медицины об эффективности различных средств и методов послеоперационной анальгезии, а также руководством "Postoperative Pain Management - Good Clinical Practice" (2005), переведенным на русский язык.
В настоящее время во многих клиниках внедрена формулярная система использования лечебных препаратов тех или иных групп, целесообразность применения которых подтверждена данными доказательной медицины, а также обусловлена потребностями и особенностями конкретного лечебного учреждения. Многие авторы полагают, что все хирургические подразделения, а также отделения анестезиологии, реанимации и интенсивной терапии должны иметь в своем арсенале только те анальгетики и анестетики, эффективность и безопасность назначения которых подтверждена доказательствами I (систематизированные обзоры и метаанализы) и II (рандомизированные контролируемые исследования с определенными результатами) уровня (табл. 2).
Таблица 2.
Препараты, применение которых для послеоперационного обезболивания обосновано данными доказательной медицины
(Acute Pain Management: Scientific Evidence, 2-nd edition, 2005)
| Группа | Препараты | Дозы, путь введения |
| Неопиоидные анальгетики, НПВП | Диклофенак Кетопрофен (Кетонал ®) Кеторолак (Кеторол ®) | 75 мг (150 мг суточная), в/м 50 мг (200 мг), в/м 30 мг (90 мг), в/м |
| Неопиоидные анальгетики, прочие | Парацетамол (Перфалган®) | 1 г (4 г), в/в инфузия в течение 15 минут |
| Опиоидные анальгетики, сильные | Морфин Промедол | 5-10 мг (50 мг), в/в, в/м 20 мг (160 мг), в/в, в/м |
| Опиоидные анальгетики, слабые | Трамадол (Трамал®) | 100 мг (400 мг), в/в, в/м |
| Адъювантные препараты | Кетамин | 0,15-0,25 мг/кг в/в |
| Местные анестетики | Лидокаин 2% Бупивакаин (Маркаин®) 0,25%, 0,5% Ропивакаин (Наропин®0,2%,0,75%, 1% | (800 мг суточная)* (400 мг суточная)* (670 мг суточная)* |
*инфильтрация краев раны, интраплевральное введение, продленная блокада периферических нервов и сплетений, продленная эпидуральная анальгезия.
Мировой опыт послеоперационного обезболивания позволяет выделить следующие основные современные тенденции в его проведении:
1. Все более широкое применение неопиоидных анальгетиков – нестероидных противовоспалительных препаратов (НПВП) и парацетамола. В различных европейских клиниках частота назначения данных препаратов в качестве базиса послеоперационного обезболивания составляет от 45 до 99%.
- Ограничение традиционного внутримышечного назначения опиоидных анальгетиков, что обусловлено низкой эффективностью и значительным количеством побочных эффектов данной методики.
- Широкое применение высокотехнологичных методов обезболивания - продленной эпидуральной анальгезии посредством инфузии местных анестетиков, а также контролируемой пациентом внутривенной или эпидуральной анальгезии.
- Мультимодальный характер послеоперационного обезболивания, т.е. одновременное назначение нескольких препаратов или методов обезболивания, способных воздействовать на различные механизмы формирования болевого синдрома. [2, 5, 7, 9, 11, 13, 14, 16, 19, 23, 25]
В настоящее время не существует идеального анальгетика или метода лечения острой послеоперационной боли. Максимально приближенное к решению проблемы адекватное обезболивание - это лечение послеоперационной боли, включающее множество факторов: хороший сестринский уход, сочетание нефармакологических и фармакологических методов, сбалансированная (мультимодальная) анальгезия с индивидуальным подбором безопасных средств разных уровней. Концепция мультимодальности предусматривает одновременное назначение двух и более анальгетиков и/или методов обезболивания, обладающих различными механизмами действия и позволяющих достичь адекватной анальгезии при минимальных побочных эффектах. [2, 5, 7, 9, 11, 13, 14, 16, 19, 23, 25]
Используемые в настоящее время методы послеоперационного обезболивания представлены в таблице 3.
Таблица 3
Методы послеоперационного обезболивания
| 1. Традиционное введение опиоидов: внутримышечные инъекции по требованию. 2. Опиоидные препараты агонисты/антагонисты: а) парентеральное введение опиоидов: внутривенно болюсно, длительная внутривенная инфузия, контролируемая пациентом анальгезия. б) непарентеральное введение опиоидов: щечное/подъязычное, пероральное, трансдермальное, назальное, ингаляционное, внутрисуставное 3. Методы регионарной анестезии: а) эпидуральное введение опиоидов; б) нестероидные противовоспалительные препараты; в) введение а2 -адренергических агонистов:
4. Нефармакологические методы:
5. Сочетанное использование представленных методов. |
Однако, говоря о методах лечения послеоперационной боли, нужно всегда помнить, что предотвращение ноцицептивной стимуляции, приводящей к развитию болевого синдрома гораздо проще и требует меньших медикаментозных затрат, нежели борьба с уже развившейся сильной болью. Так, ещё в 1996 году в Ванкувере метод предупреждающей анальгезии был признан перспективным направлением в патогенетической терапии болевых синдромов и широко используется прогрессивными клиниками в настоящее время. Для этих целей целесообразно использовать НПВП.
Опиоидная анальгезия и способы ее оптимизации
Традиционно системное введение опиоидных анальгетиков рассматривалось в качестве основы послеоперационного обезболивания как в отечественных, так и в зарубежных стационарах. В то же время данные препараты не являются "золотым стандартом" лечения острой боли. По оценкам зарубежных специалистов, эффективность обезболивания при традиционном назначении опиоидов в качестве монотерапии не превышает 25-30%.[2, 5, 13, 18, 23, 25]
Проблема заключается в том, что эффективная анальгетическая доза зачастую близка к той, которая вызывает депрессию дыхания.
Помимо депрессии дыхания увеличение дозы лимитировано увеличением частоты других побочных эффектов, таких как угнетение сознания, кожный зуд, тошнота и рвота, нарушение моторики ЖКТ, затруднение самостоятельного мочеиспускания в послеоперационном периоде.
Различия в свойствах разных опиоидов обусловлены их различными взаимоотношениями с рецепторами:
а) сродством к определенному типу рецепторов,
б) степенью связывания с рецептором (сила и продолжительность эффекта),
в) конкурентной способностью (антагонизмом) к определенному типу рецепторов.
В соответствии с этим, опиоиды могут быть агонистами или антагонистами тех или иных рецепторов, что и определяет присущий каждому опиоиду спектр свойств.
Группа опиатных анальгетиков насчитывает более 20 препаратов. Наиболее часто используемые препараты:
Морфин применяется обычно в дозе 10 мг в/м, действие его продолжается 3-5 часов. Максимальная доза для взрослых: разовая - 0,02г, суточная - 0,05г. Наиболее важные побочные эффекты это: угнетение дыхания, тошнота и рвота. Хотя морфин имеет ряд нежелательных побочных эффектов, он является отличным анальгетиком и принят в качестве «эталонного» препарата группы наркотических анальгетиков, в сравнении с которым оценивается действие всех остальных опиоидов.
Промедол применяется обычно в дозе 20 мг в/м, что вызывает 3-4-х часовую анальгезию. По анальгетической активности он в 3-5 раз слабее морфина, но значительно менее токсичен, в меньшей степени угнетает дыхательный центр, реже вызывает рвоту. В клинических дозировках не оказывает негативного воздействия на организм матери и плода.
Омнопон представляет собой смесь гидрохлоридов алкалоидов опия, где на долю морфина приходится около 50%, применяется в дозе 20 мг. Максимальная доза для взрослых: разовая - 0,03 г суточная - 0,1 г. Обладает меньшей анальгетической активностью, чем морфин и промедол, что обусловливает его меньшую популярность.
Трамадола гидрохлорид - анальгетик, опосредующий обезболивающий эффект как через m-опиоидные рецепторы, так и путем ингибирования норадренергического и серотонинергического механизма передачи болевой импульсации. Трамадол характеризуется сравнительно высокой биодоступностью - 60-70 % при разных способах введения, быстрым и длительным болеутоляющим эффектом. Существенное преимущество трамадола по сравнению с другими опиоидными анальгетиками крайне низкая степень привыкания и минимальный наркогенный потенциал этого препарата. В отличие от других опиоидов, в эквианальгетических дозах трамадол не вызывает запора, не угнетает кровообращения и дыхания. Из возможных побочных эффектов следует отметить развитие тошноты, головокружения, в редких случаях рвоты. Помимо применения трамадола в качестве анальгетика, с 1989 г. он используется для купирования мышечного тремора в раннем послеоперационном периоде.
Наиболее эффективные попытки улучшения качества послеоперационной опиоидной аналгезии основаны на оптимизации способов введения препаратов.
