Кинетика растворения триоксида урана в 30 ном тбф в углеводороном разбавителе, насыщенном азотной кислотой
| Вид материала | Документы |
СодержаниеЕ) определяли по тангенсу угла наклона прямой в координатах ln k Список литературы |
- Восстановление гексафторида урана до тетрафторида урана метанолом в плазменных потоках, 75.13kb.
- Экономика утилизации отходов обогащения урана Содержание, 372.53kb.
- Термохимия растворения ccl 4, бензола и его производных в индивидуальных и смешанных, 298.7kb.
- Правила безопасности при работе с хлорной кислотой и перхлоратами в учреждениях, организациях, 239.36kb.
- Радиационно-термодинамический метод контроля обогащения изотопа урана-235 в гфу. Опыт, 97.44kb.
- Международная торговля отходами ядерной индустрии на примере отвального гексафторида, 194.2kb.
- Ном «язык и межкультурная коммуникация» Разработчик – к п. н., доцент Н. В. Татаринова, 23.66kb.
- Аннотация ном «проектированиие баз данных», 57.69kb.
- Нептун, 95.58kb.
- Открытие Нептуна, 23.15kb.
Кинетика растворения триоксида урана в 30 %-ном ТБФ в
углеводороном разбавителе, насыщенном азотной
кислотой
Балахонов В.Г., Дорда Ф.А., Лазарчук В.В., Матюха В.А., Сироткина М.В., Тинин В.В.
ОАО «Сибирский химический комбинат», г. Северск
О
 дним из конверсионных направлений деятельности РХЗ ОАО «Сибирский химический комбинат» является переработка оксидов регенерированного урана с целью его очистки от b-, a- и g-излучающих продуктов деления, в основном от технеция-99, тория-228 и продуктов его радиоактивного распада.
дним из конверсионных направлений деятельности РХЗ ОАО «Сибирский химический комбинат» является переработка оксидов регенерированного урана с целью его очистки от b-, a- и g-излучающих продуктов деления, в основном от технеция-99, тория-228 и продуктов его радиоактивного распада. Существующая на РХЗ схема экстракционной переработки регенерированного урана включает операции растворения оксидов урана в азотной кислоте, восстановительной обработки растворов урана с применением в качестве восстановителя урана (IV), экстракции урана 30 % ТБФ в углеводородном разбавителе С-13, вытеснительно-восстановительной промывки экстракта урана азотнокислым раствором урана (VI) и урана (IV), реэкстракции урана разбавленным раствором азотной кислоты, упаривания реэкстракта урана, регенерации экстрагента карбонатным и слабокислым растворами.
Схема обеспечивает необходимую очистку урана от технеция-99, тория-228 и продуктов его радиоактивного распада. В то же время недостатком данной схемы переработки оксидов регенерированного урана является значительное количество жидких радиоактивных отходов, попадающих под категорию САО.
Надо отметить, что к настоящему времени при промышленной переработке оксидов регенерированного урана на РХЗ в этом плане опробованы некоторые технические решения, позволяющие уменьшить объем жидких радиоактивных отходов в 1,5…2 раза. Это проведение периодической регенерации экстрагента карбонатными и слабокислыми растворами, уменьшение потока вытеснительно-восстановительного раствора вплоть до полного прекращения его подачи в колонну промывки экстракта урана.
Дальнейшее снижение объема жидких радиоактивных отходов (в 10 и более раз) возможно на принципиально новых технических решениях. В [1-5] описаны способы растворения оксидов (в основном диоксида урана) в ТБФ, насыщенном азотной кислотой. Показано, что раствор ТБФ, насыщенный азотной кислотой, является эффективным растворителем диоксида урана. При этом процесс растворения оксидов урана совмещается с процессом экстракции урана ТБФ и очисткой урана от радионуклидов.
В [6] описаны способы выщелачивания урана из руд органическими растворителями. Так, для выщелачивания карнотитовых руд плато Колорадо использовался подкисленный серной кислотой раствор смеси моно- и диизооктилового эфира фосфорной кислоты в изопропиловом эфире. Данный способ растворения позволил уменьшить расход азотной кислоты на 1 т руды в 2…3 раза и увеличить скорость выщелачивания урана за счет перехода урана непосредственно в органический раствор.
Совмещение операций растворения оксидов урана, экстракции урана экстрагентом и промывки экстракта урана в одном аппарате должно привести к упрощению аппаратурно-технологической схемы, увеличению производительности переработки оксидов регенерированного урана, уменьшению объема жидких радиоактивных отходов.
В экспериментах использовали порошки триоксида урана фирмы БНФЛ с содержанием урана 82,7 % мас. В качестве растворителя применяли 30 % ТБФ в углеводородном разбавителе С-13 с содержанием азотной кислоты 0,91 моль/дм3. Насыщение экстрагента азотной кислотой осуществляли путем контакта с 5,0 моль/дм3 раствором азотной кислоты (2…3 контакта) при О:В=1:1 и температуре 22…25 °С.
Исследование влияния температуры и времени на скорость растворения триоксида урана проводили в термостатированной стеклянной колбе, в которую заливали экстрагент объемом 100 мл, насыщенный азотной кислотой, и 2 мл раствора с содержанием азотной кислоты 3 моль/дм3. Температуру раствора в реакторе поддерживали с помощью термостата с точностью ± 2 °С. При достижении заданной температуры при интенсивном перемешивании жидкости (перемешивание магнитной мешалкой) вносили порошок триоксида урана массой 14,2 г (11,7 г по U).
Степень растворения оксидов в органических растворах определяли по содержанию урана в пробах, отобранных через заданные промежутки времени с помощью микропипетки. Содержание урана в пробах определяли комплексонометрическим методом с относительной погрешностью определения ± 3 %.
Как показали эксперименты, полное растворение триоксида урана в органических растворах в интервале температур 18…40 °С достигается за 5…20 мин. С увеличением температуры скорость реакции растворения триоксида урана увеличивается (рисунок 1).
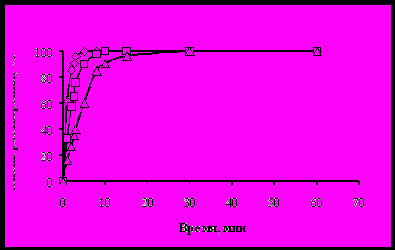
à - 40 °С; ð - 32 °С; D - 18 °С
Рисунок 1 – Кинетика растворения порошков триоксида урана в 30 % ТБФ
в разбавителе С-13
Триоксид урана растворяется в азотной кислоте по реакции
UO3 + 2HNO3 = UO2(NO3)2 + H2O (1)
без выделения газообразных продуктов реакции и изменения валентного состояния урана.
Теоретически для растворения 1 т триоксида урана (0,83 т урана) по реакции (1) необходимо 0,46 т азотной кислоты. В экспериментах расход азотной кислоты на растворение триоксида урана составил 0,41 т на 1 т триоксида урана.
Математическую обработку экспериментальных данных осуществляли по уравнению сокращающейся сферы, применяемому для описания кинетики гетерогенных реакций, скорость которых зависит как от диффузии реагентов к поверхности реагирования, так и от скорости реакции на поверхности раздела фаз
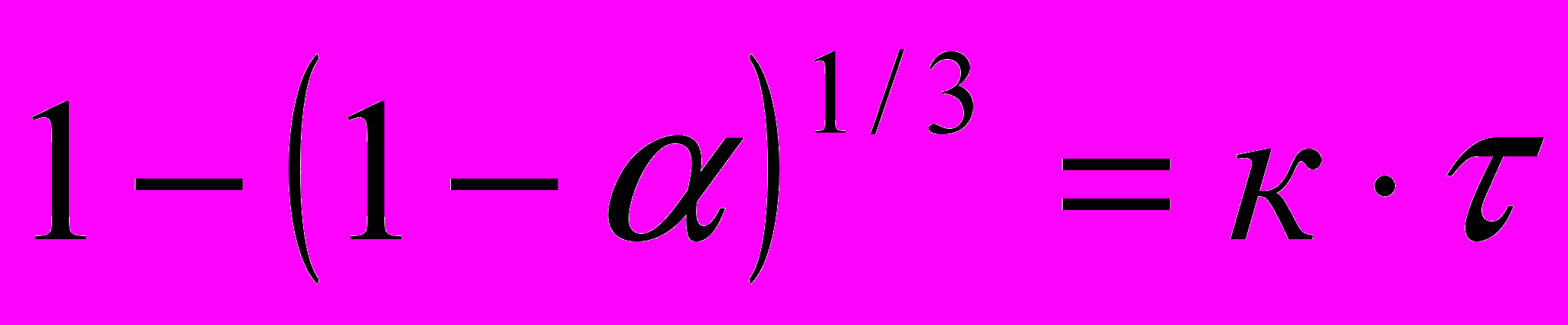 , (2)
, (2)где
 – степень растворения, доля; k – кажущаяся скорость реакции растворении, с-1;
– степень растворения, доля; k – кажущаяся скорость реакции растворении, с-1;t – время растворения, мин.
При обработке экспериментальных данных строили зависимость степени растворения 1 – (1 – a)1/3 от времени растворения (t) и по тангенсу угла наклона прямых определяли константы скорости реакции. Адекватность применения выбранного уравнения оценивали по коэффициенту корреляции.
Энергию активации ( Е) определяли по тангенсу угла наклона прямой в координатах ln k – (1/T), а по точке пересечения прямой с ординатой определяли предэкспоненциальный множитель kо.
Анализ представленных данных показывает, что уравнение сокращающейся сферы с достаточной достоверностью (коэффициенты корреляции 0,98…0,99) описывает процесс растворения триоксида урана в органических растворах, содержащих азотную кислоту.
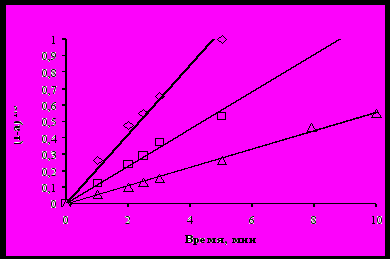
à – 40 °С; ð – 32 °С; D – 18 °С
Рисунок 2 – Обработка экспериментальных данных по уравнению
сокращающейся сферы
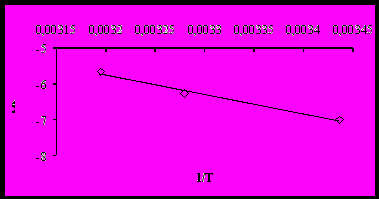
Рисунок 3 – Зависимость ln k от 1/Т
Математическая обработка данных позволила определить кажущуюся энергию активации (E = 45,1 кДж/моль), предэкспоненциальный множитель (kо = 1,12×105 с-1) и вывести зависимость степени реагирования от температуры и времени процесса растворения
 . (3)
. (3)Результаты расчетов по уравнению (2) удовлетворительно согласуются с экспериментальными данными в интервале температур 18…40 °С (таблица 1).
Таблица 1 – Расчетные значения констант скорости реакций растворения триоксида урана, кажущейся энергии активации и предэкспоненциального множителя
| t, °C | T, K | k, c-1 | E, кДж/моль | kо, с-1 |
| Органический раствор | ||||
| 18 | 291 | 0,00093 | 45,1 | 1,12×105 |
| 32 | 305 | 0,0019 | ||
| 40 | 313 | 0,0035 | ||
Таблица 2 – Сравнение расчетных и экспериментальных данных процесса растворения триоксида урана в 30 % ТБФ в С-13, насыщенном азотной кислотой
| t, мин | Степень растворения триоксида урана (  ), ), | |||||
| 18 °С | 32 °С | 40 °С | ||||
| Эксп. | Расч. | Эксп. | Расч. | Эксп. | Расч | |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 1 | 0,17 | 0,15 | 0,33 | 0,33 | 0,61 | 0,48 |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 2 | 0,27 | 0,29 | 0,57 | 0,60 | 0,86 | 0,78 |
| 2,5 | 0,35 | 0,35 | 0,65 | 0,68 | 0,91 | 0,87 |
| 3,0 | 0,40 | 0,41 | 0,76 | 0,76 | 0,96 | 0,93 |
| 5,0 | 0,61 | 0,61 | 0,90 | 0,95 | 1,0 | 1,0 |
| 8 | 0,85 | 0,80 | 0,98 | 1,0 | - | - |
| 10 | 0,91 | 0,90 | - | - | - | - |
| 15 | 0,97 | 0,99 | - | - | - | - |
Кажущаяся энергия активации, равная Е = 45,1 кДж/моль, свидетельствует о том, что процесс протекает в кинетической области реагирования. Способом ускорения процесса является повышение температуры.
Список литературы
1 Филиппов А.П., Стрелков Л.А. Исследование процессов окисления и растворения соединений урана в неводных средах. Растворение окислов урана в растворах экстрагентов, насыщенных минеральными кислотами // Радиохимия, 1971. – Т. 13. – № 1. – С. 52-57.
2 Филиппов А.П., Стрелков Л.А. Исследование процессов окисления и растворения соединений урана в неводных средах. Влияние формы нахождения азотной кислоты в системе ТБФ – HNO3 на процесс окисления и растворения диоксида урана // Радиохимия, 1971. – Т. 13. – № 1. – С. 58-62.
3 Филиппов А.П., Стрелков Л.А. Кинетика растворения диоксида урана в сольватах азотной кислоты // Радиохимия, 1973. – Т. 15. – № 2. – С. 186-194.
4 Мясоедов Б.Ф., Куляко Ю.М., Трофимов Т.И., Самсонов М.Д. Растворение оксидов U, Np, Pu, Am и их смесей трибутилфосфатом, насыщенным HNO3 // Радиохимия, 2003. – Т. 45. – № 5. – С. 453-455.
5 Мясоедов Б.Ф., Куляко Ю.М., Трофимов Т.И., Самсонов М.Д. Экстрагирование актинидов из их диоксидов органическими реагентами, насыщенными азотной кислотой // Радиохимия, 2007. – Т. 49. – № 3. – С. 211-215.
6 Шевченко В.Б., Судариков Б.Н. Технология урана. - М.: Государственное изд-во литературы в области атомной науки и техники, 1961. – 330 с.
