На правах рукописи
| Вид материала | Автореферат диссертации |
- Печатная или на правах рукописи, 21.09kb.
- Удк 796/799: 378 , 770.24kb.
- На правах рукописи, 399.58kb.
- На правах рукописи, 726.26kb.
- На правах рукописи, 1025.8kb.
- На правах рукописи, 321.8kb.
- На правах рукописи, 552.92kb.
- На правах рукописи, 514.74kb.
- На правах рукописи, 670.06kb.
- На правах рукописи, 637.26kb.
На правах рукописи
МОТУЩУК
Анна Евгеньевна
МУТАЦИИ И ПОЛИМОРФИЗМЫ
В ГЕНАХ МИОЦИЛИНА, ЦИТОХРОМА Р450 1В1 И WDR36 У БОЛЬНЫХ
С ПЕРВИЧНОЙ ВРОЖДЕННОЙ, ПЕРВИЧНОЙ ЮВЕНИЛЬНОЙ И ПЕРВИЧНОЙ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМАМИ ИЗ ЧИСЛА ЖИТЕЛЕЙ САНКТ-ПЕТЕРБУРГА.
14.01.07. – Глазные болезни
03.01.04 – Биохимия
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Санкт-Петербург
2010
Работа выполнена на кафедре офтальмологии ГОУ ВПО «Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Федерального агентства по здравоохранению и социальному развитию РФ и в Отделе молекулярной генетики НИИ экспериментальной медицины СЗО РАМН.
Научные руководители: доктор медицинских наук, профессор
Астахов Юрий Сергеевич
доктор биологических наук, доцент
Мандельштам Михаил Юрьевич
Официальные оппоненты: доктор медицинских наук, профессор
Бржеский Владимир Всеволодович
доктор медицинских наук, профессор
Денисенко Александр Дорофеевич
Ведущая организация:
Российский государственный медицинский университет, г. Москва
Защита диссертации состоится «25» февраля 2010г. в ___ часов на заседании Диссертационного совета при ГОУ ВПО “Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова” Федерального агентства по здравоохранению и социальному развитию РФ по адресу: 197089, Санкт-Петербург, ул. Л. Толстого, д. 6/8.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО "Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова".
Автореферат разослан «___» января 2010 г.
Ученый секретарь диссертационного совета
доктор медицинских наук,
профессор Дискаленко Виталий Васильевич
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ.
Актуальность темы. В мире от глаукомы страдает более 90 млн. человек (Goldberg I., 2000), а к 2030 году ожидается увеличение числа таких больных в 2 раза (Rochtchina E. et al., 2000). По данным А.В. Хватовой (2005), в настоящее время больных с врожденной глаукомой насчитывается около 300 000, из них 75% слепые. Доля глаукомы среди причин первичной инвалидности за последнее десятилетие выросла с 12 до 20% (Либман Е.С. с соавт., 2000), а в Санкт-Петербурге – до 30% и занимает первое место как причина инвалидности по зрению (Разумовский М.И. с соавт., 2004).
Первичная открытоугольная глаукома (ПОУГ) – одна из главных причин слабовидения и слепоты среди лиц трудоспособного возраста в развитых странах (Quigley H.A. et Broman A.T., 2006; Нестеров А.П., 2008), и, несмотря на достигнутые успехи в её лечении, более половины больных продолжают терять зрительные функции. Первичная врожденная глаукома – очень редкая патология в нашей стране (встречаемость составляет 1 случай на 10 000 новорожденных) (Алексеев И.Б., 2008) и выступает как причина слепоты в 2,5 – 7% случаев (Сомов Е.Е., 2005).
Особенность ПВГ, ПЮГ и ПОУГ заключается в их бессимптомном течении на начальных этапах. Вместе с тем, подавляющее большинство применяемых диагностических тестов рассчитано на выявление уже имеющихся у пациента изменений, связанных с глаукомой, когда часть времени на лечение упущена. Кроме того, особенностью ПВГ и ПЮГ является то, что в большинстве случаев при работе с детьми возникают трудности в сборе жалоб, анамнеза, а также не всегда возможно применение общепринятых и высокотехнологичных методик обследования.
В связи с этим особое значение приобретают диагностические тесты, с помощью которых можно выявить глаукому на самой ранней стадии или установить склонность к ее развитию еще в преморбидном периоде. Из известных на сегодняшний день методик далеко не все отвечают таким требованиям, как достаточная информативность, простота и, следовательно, поиски в этом направлении необходимо продолжать.
Благодаря достижениям молекулярной генетики последних десятилетий стал возможен прогресс в доклинической диагностике и понимании точных механизмов развития сотен моногенных заболеваний. Определенные успехи достигнуты и в изучении патогенеза мультифакториальных заболеваний (Горбунова В.Н., Баранов В.С., 1997; Баранов В.С. с соавт., 2000), в этиологию которых наряду с факторами внешней среды значительный вклад вносят генетические составляющие.
ПВГ, обусловленная мутациями в гене CYP1B1 (2p21), чаще всего наследуется по аутосомно-рецессивному типу с вариабельной пенетрантностью (Bejjani B.A. et al., 2000). Мутации в гене CYP1B1 ответственны за развитие 10-15% спорадических и 20-100% семейных случаев ПВГ (Plasilova М. et al., 1999; Mashima Y. et al., 2001; Stoilov I. et Sarfarazi M., 2002; Curry S.M. et al., 2004).
ПЮГ обусловлена мутациями в генах MYOC (1q24.3-q25.2) и CYP1B1 (2p21). Мутации в гене MYOC чаще всего наследуются по аутосомно-доминантному типу со степенью пенетрантности 80-96% и ответственны за 5-20% спорадических и 20-36% семейных случаев данного заболевания (Booth A. et al., 1997; Fingert J.H. et al., 1999; Shimizu S. et al., 2000; Faucher M. et al., 2002; Wiggs J.L. et al., 2007; Lin Y. et al., 2008; Mengkegale M.G. et al., 2008). В ряде случаев ПЮГ является мультигенным заболеванием, зависящим от сочетания генотипов генов MYOC и CYP1B1 (Vincent A.L. et al., 2002; Bayat B. et al., 2008).
ПОУГ обусловлена мутациями в гене MYOC (1q24.3-q25.2) и наследуется по аутосомно-доминантному типу с неполной пенетрантностью. Мутации в этом гене ответственны за развитие от 2% до 5% случаев данного заболевания (Fingert J.H. et al., 1999; Kumar A. et al., 2007; Wiggs J.L. et al., 2007; Sud A. et al., 2008), а их носители имеют риск развития ПОУГ в течение жизни, варьирующий от 60 до 100%. Мутации в гене WDR36 (5q22.1) ответственны за развитие 5-17% случаев ПОУГ (Monemi S. et al., 2005; Suriyapperuma S.P. et al., 2007; Lin Y. et al., 2008).
Мутации в гене MYOC имеют две основные патогенетические точки приложения в глазу – в области трабекулярной сети и в области решетчатой пластинки. Повышенная экспрессия миоцилина в клетках трабекулярной сети приводит к уменьшению числа актиновых волокон в них и к нарушению функционирования актомиозинового сократительного комплекса, кроме того, он блокирует функции ряда белков, которые принимают участие в оттоке водянистой влаги (ВВ). Все это ведет к нарушению оттока ВВ в области трабекулы. Кроме того, ген миоцилина экспрессируется в ганглиозных клетках сетчатки и астроцитах в области решетчатой пластинки. Мутации в гене MYOC приводят к неправильному укладыванию белка миоцилина и его внутриклеточному накоплению в эндоплазматической сети и в аппарате Гольджи, что в конечном итоге приводит к запуску процесса апоптоза и, как следствие, к снижению механической устойчивости решетчатой пластинки.
Цитохром P450 1B1 (белок, кодируемый геном CYP1B1) относится к ферментам, которые ответственны за первую фазу метаболизма разнообразных ксенобиотиков (компонентов пищи, лекарственных препаратов, ядов), а также и эндогенных субстратов (таких как стероиды, жирные кислоты, простагландины). Существует гипотеза, что данный белок может вовлекаться в элиминацию метаболитов, которые оказывают токсическое воздействие на развитие структур глаза, а также может участвовать в выработке регуляторной молекулы, которая контролирует экспрессию генов, влияющих на развитие радужно-роговичного угла (РРУ) глаза, что возможно приводит к развитию ПВГ.
Ген WDR36 кодирует белок активации Т-клеток, имеющий, по меньшей мере, 8 WD40-повторов. Известно, что данный ген вовлечен в активацию Т-клеток и регулируется в значительной степени координированно с IL-2. Однако его функции и роль в патогенезе глаукомы в настоящее время неизвестны. Данные, полученные при исследовании мутаций в данном гене (а точнее его изменений нуклеотидной последовательности N355S, A449T, R529Q и D658G) в разных популяциях мира, очень противоречивы и говорят как в пользу вовлеченности гена WDR36 в патогенез глаукомы, так и против этого.
Спектр описанных мутаций в этих генах является этнически и популяционно специфичным (Gong G. et al., 2004; Ishikawa K. et al., 2004), что делает невозможным в России в целях диагностики опираться на данные, полученные в других странах. В нашей стране исследования мутаций генов MYOC, CYP1B1 и WDR36 у пациентов с разными формами глаукомы не проводились. В связи с этим данное исследование, направленное на определение спектра мутаций в перечисленных генах у больных Санкт-Петербурга, представляется актуальным.
Цель работы: Определить спектр и частоту встречаемости мутаций в генах миоцилина, цитохрома Р450 1B1 и WDR36 и их диагностическое значение у пациентов с различными формами первичной глаукомы в Санкт-Петербурге.
В соответствии с поставленной целью, были сформулированы следующие задачи:
Определить спектр и частоту встречаемости мутаций в генах миоцилина, цитохрома Р450 1В1 и WDR36 у больных ПВГ, ПЮГ и ПОУГ.
- Определить связь полиморфизма L432V в гене цитохрома Р450 1В1 с развитием различных форм первичной глаукомы.
- Оценить диагностическую значимость обнаруженных полиморфизмов в генах миоцилина и цитохрома Р450 1В1.
- Разработать методы быстрого тестирования обнаруженных мутаций.
- Определить частоту встречаемости и вклад в развитие различных форм первичной глаукомы изменений нуклеотидной последовательности (N355S, A449T, R529Q и D658G) в гене WDR36.
Научная новизна работы. Впервые в России на клиническом материале изучен спектр мутаций в генах MYOC, CYP1B1 у пациентов с первичной врожденной и первичной ювенильной глаукомами. Определен вклад обнаруженных мутаций и полиморфизмов в заболеваемость ПВГ и ПЮГ в Санкт-Петербурге. Показано отсутствие связи между широко распространенными изменениями нуклеотидной последовательности гена WDR36 и возникновением ПВГ, ПЮГ и ПОУГ.
Практическая значимость работы. Внедрена в клиническую практику методика генетического тестирования родственников пробандов больных первичной ювенильной глаукомой, позволяющая выделить группу риска развития данного заболевания, диспансерное наблюдение за которой является непременным условием профилактики слепоты, обусловленной глаукомой. Полученные данные позволяют проводить генетическое консультирование носителей мутаций в гене миоцилина.
Разработан метод быстрой детекции мутации G367R в гене миоцилина, полиморфизма N453S в гене цитохрома Р450 1В1 с помощью специфических эндонуклеаз рестрикции и мутации P369ins в гене цитохрома Р450 1В1 с помощью гетеродуплексного анализа.
Основные положения диссертации, которые выносятся на защиту.
- Мутация G367R в гене миоцилина встречается у пациентов с первичной ювенильной глаукомой Санкт-Петербурга с частотой, сопоставимой с таковой в других популяциях.
- Впервые в мире охарактеризована новая мутация P369ins в гене цитохрома Р450 1В1 у пациента с первичной врожденной глаукомой, которая является частью компаунд-генотипа и может быть предрасполагающим фактором развития ПВГ.
- Носительство аллеля G полиморфизма L432V в гене цитохрома Р450 1В1 не является генетическим фактором риска развития ни одной из форм первичной глаукомы у больных Санкт-Петербурга.
- Среди всех обнаруженных полиморфизмов в генах MYOC и CYP1B1, лишь носительство аллеля G полиморфизма N453S в гене цитохрома Р450 1В1 может являться генетическим фактором риска развития ПВГ.
- Экспресс-диагностика мутации G367R в гене миоцилина и полиморфизма N453S в гене цитохрома Р450 1В1 может быть осуществлена с помощью ПДРФ-анализа.
- Диагностику мутации P369ins в гене цитохрома Р450 1В1 удобно проводить с помощью гетеродуплексного анализа.
- Пациентов с ПЮГ, их детей и кровных родственников до 35 лет целесообразно тестировать на наличие мутаций в гене миоцилина.
Внедрение результатов работы в практику.
Методика молекулярно-генетического исследования у больных с первичной ювенильной глаукомой внедрена в работу клиники офтальмологии Санкт-Петербургского государственного медицинского университета имени акад. И.П. Павлова.
Апробация работы.
Основные материалы диссертации доложены и обсуждены на:
II международном молодежном конгрессе «Санкт-Петербургские научные чтения – 2007», Санкт-Петербург, 5-7 декабря 2007 года; Всероссийском Форуме «Наука и инновации в технических университетах», Санкт-Петербург, 28-31 октября 2008 года; Всероссийской межвузовской конференции студентов и аспирантов «XXXVII неделя науки СПбГПУ», Санкт-Петербург, 24-29 ноября 2008 года; Съезде генетиков и селекционеров, посвященый 200-летию со дня рождения Чарльза Дарвина и V съезде Вавиловского общества генетиков и селекционеров, Москва, 21-28 июня 2009 года; совместном заседании научной проблемной комиссии по молекулярной медицине и кафедры офтальмологии Санкт-Петербургского государственного медицинского университета имени акад. И.П. Павлова, ноябрь 2009 года.
Публикации результатов работы.
По теме диссертации опубликовано 11 работ. 22.06.2009 принят к оформлению патент на изобретение «Способ обнаружения мутации P369ins в гене CYP1B1, предрасполагающей к развитию первичной врожденной глаукомы» (входящий номер 032948, регистрационный номер 2009123806).
Структура и объем диссертации.
Диссертационная работа изложена на 161 страницах машинописного текста и состоит из введения, трех глав, заключения, выводов, практических рекомендаций, указателя литературы. Содержит 23 таблицы, 41 рисунок и 2 приложения. Список литературы включает 251 источник (17 отечественных и 234 зарубежных).
ОБЩАЯ ХАРАКТЕРИСТИКА БОЛЬНЫХ И МЕТОДЫ ИХ ОБСЛЕДОВАНИЯ.
В качестве материала настоящей работы использованы результаты обследования 315 человек. Все обследуемые были разделены на 4 группы: I-я группа – больные ПВГ (31 человек); II-я группа – больные ПЮГ (14 человек); III-я группа – больные ПОУГ (170 человек); IV-я (контрольная) группа – лица без патологии зрительно-нервного аппарата (100 человек). Пациенты I-II групп длительно наблюдались на офтальмологических отделениях СПбГПМА, ДГБ №19 им. К.А. Раухфуса, ГМПБ № 2, а также в детском отделении ГДЦ № 7. Пациенты III группы длительно наблюдались в клинике офтальмологии СПбГМУ им. акад. И.П. Павлова и окулистами по месту жительства. Средний возраст обследуемых I-IV групп составил (M±m): 18,7±1,8, 34,9±4,0, 66,1±1,0, 68,0±1,0 года соответственно.
В контрольную группу отбирались пациенты по следующим критериям: острота зрения не ниже 0,4; отсутствие отягощенного наследственного анамнеза по глаукоме; отсутствие заболеваний сетчатки и зрительного нерва, травм и ожогов глаз в анамнезе и на момент обследования.
Клинические методы обследования.
После подписания информированного согласия всем больным, а также их родственникам проводилось полное офтальмологическое обследование по следующей схеме: сбор жалоб и выяснение анамнеза; клинико-генетический анализ родословных с использованием генеалогического метода; авторефрактометрия (RK-F1 «Canon», Япония); визометрия (без коррекции и с оптимальной коррекцией) по таблицам Головина – Сивцева; статическая компьютерная периметрия по программам «Тотальная периметрия» и «Глаукома» на периметре «Периком» («ВНИИМП-ОПТИМЕД», Россия); биомикроскопия на щелевой лампе AT-16 («Shin-nippon», Япония); тонометрия (тонометр Маклакова); гониоскопия с помощью трехзеркальной линзы Гольдмана (фирма «ОЛИС», Россия); офтальмоскопия с широким зрачком (электроофтальмоскоп BXα «Neitz», Япония); биомикроскопия сетчатки и зрительного нерва с помощью асферических линз (60-75 D фирмы «ОЛИС», Россия); пахиметрия роговицы AL-3000 «Tomey», США; А-сканирование UD-6000 «Tomey», США; ретинальная томография ДЗН с помощью гейдельбергского ретинального томографа HRT-III «Heidelberg engineering», США.
Молекулярно-генетические методы исследования. Экспериментальная часть работы проводилась на базе Отдела молекулярной генетики НИИ экспериментальной медицины РАМН.
ДНК выделяли из лейкоцитов периферической венозной крови пациентов по методу Кюнкеля с соавт. (Kunkel L.M. et al., 1977; Bell G.I. et al., 1981). Для поиска мутаций были выбраны: 3 экзона гена миоцилина; 2 и 3 экзон гена цитохрома Р450 1В1, в пределах которых локализованы наиболее часто встречающиеся в мире мутации, вызывающие ПВГ и ПЮГ(Vasiliou V. et Gonzalez F.J., 2008); 17 экзон гена WDR36, поскольку он кодирует функционально важный домен белка − WD40 повтор. Кроме того, исследовали 8, 11, 13 и 17 экзоны гена WDR36 на известные в мире изменения нуклеотидной последовательности (N355S, A449T, R529Q и D658G). Исследуемые участки генов MYOC, CYP1B1 и WDR36 амплифицировали методом полимеразной цепной реакции (ПЦР) с использованием олигонуклеотидных праймеров.
Для поиска изменений нуклеотидной последовательности в генах миоцилина, цитохрома Р450 1В1 и 17 экзона WDR36 использовали анализ конформационного полиморфизма однонитевых фрагментов ДНК (SSCP-анализ), гетеродуплексный анализ. В нашей работе SSCP-анализ проводили по модифицированной методике, предложенной A. Markoff с соавт.(1997), в 6 и 12% полиакриламидном геле с окрашиванием однонитевых конформеров серебром и на секвенаторе ALFexpress II («Amersham Biosciences», UK) с использованием Cy5-меченных праймеров («Синтол», Москва). Обработку и последующий анализ полученных пиков осуществляли с использованием прилагаемого программного обеспечения ALFwin Fragment Analyser.
Клонирование и секвенирование по нашему заказу выполняли в компании “Евроген” (Москва).
Все обнаруженные варианты последовательности, приводящие к изменению рестрикционной карты, а также наличие известных в мире изменений нуклеотидной последовательности гена WDR36 подтверждали ПДРФ-анализом. Гидролиз амплификатов проводили в соответствии с условиями, рекомендованными фирмой-производителем («СибЭнзим», Новосибирск).
Статистическая обработка полученных результатов выполнена с использованием программного пакета (SPSS, 11.0.1.). Проверку равновесия Харди-Вайнберга для генотипов по изучаемым полиморфизмам проводили с помощь критерия c2–Пирсона (Айала Ф. с соавт., 1988).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ.
В результате проведенной работы идентифицирована 1 мутация и 1 полиморфизм в гене миоцилина, 1 мутация и 7 полиморфизмов в гене цитохрома Р450 1В1, а также 3 полиморфизма в гене WDR36.
Поиск мутаций в гене миоцилина.
Мутация G367R (с.1099 G>A).
Мутация была выявлена в гетерозиготном состоянии в последовательности 3 экзона гена MYOC при SSCP-анализе продуктов амплификации данного фрагмента у одного пробанда с ПЮГ (рис. 1).

Рисунок 1. Электрофореграмма ручного SSCP-анализа продуктов амплификации 3 экзона гена MYOC (стрелками обозначены зоны, соответствующие дополнительным конформерам, образуемые мутантным аллелем).
1,2,3 – образцы ДНК пациентов без мутации; 4 – образец ДНК пациента с мутацией G367R.
Р
А. СAC GGA CAG
Б. His Arg/Gly Gln
СAC A/GGA CAG
езультаты секвенирования фрагмента ДНК, содержащего мутацию G367R, представлены на рисунке 2.
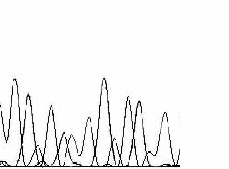
Рисунок 2. Идентификация мутации G367R (с.1099 G>A) в 3 экзоне гена миоцилина методом автоматического секвенирования ДНК.
А. – фрагмент канонической последовательности 3 экзона гена миоциллина;
Б. – фрагмент последовательности, содержащий мутацию G367R.
Мутация G367R (с.1099 G>A) приводит к замене кодона GGA, кодирующего аминокислоту глицин (Gly), на кодон AGA, кодирующего аминокислоту аргинин (Arg).
Наличие мутации G367R у пациентки в исследовании было также подтверждено ферментативным гидролизом продуктов амплификации фрагмента 3С гена MYOC эндонуклеазой рестрикции BstDS I (рис. 3Б). При гидролизе фрагмента с канонической последовательностью протяженностью 190 п.н., образуются два фрагмента длиной 147 и 43 п.н. Появление нуклеотида А в 1099 положении по кДНК приводит к исчезновению сайта для данной эндонуклеазы рестрикции и исходный фрагмент не гидролизуется.
Данная мутация была обнаружена нами у матери пробанда И. (62 года), у которой в 30 лет была диагностирована ювенильная глаукома. Из анамнеза известно, что диагноз глаукомы был также поставлен бабушке с материнской стороны, но она была недоступна для исследования. У отца клинические признаки глаукомы на момент обследования отсутствовали и мутация не была обнаружена. Проведя клинико–генетический анализ родословной пробанда, можно говорить об аутосомно-доминантном типе передачи мутации G367R (Рис. 3А).
В нашем исследовании эта мутация встретилась у одной пациентки с ПЮГ, что позволяет считать, что ее частота в этой группе не выше 7%, среди пациентов со всеми формами первичной глаукомы – 0,5%. Эти результаты согласуются с наблюдаемой частотой мутации G367R у больных глаукомой в других странах мира (Suzuki Y. et al., 1997; Fingert J.H. et al., 1999; Kubota R. et al., 2000; Mabuchi F. et al., 2001; Michels-Rautenstrauss K. et al., 2002; Melki R. et al., 2003).
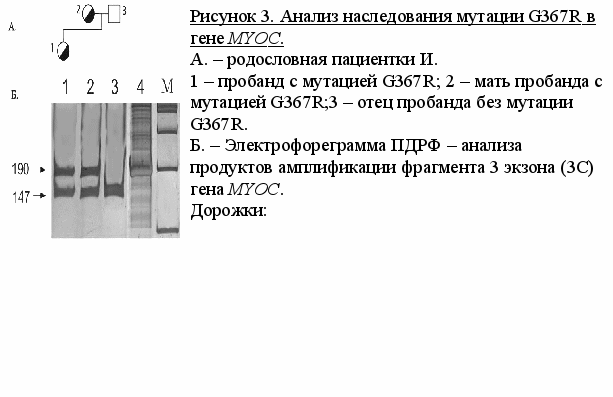
1 – образец ДНК пробанда с мутацией G367R в гетерозиготном состоянии после ферментативного гидролиза; 2 – образец ДНК матери пробанда с мутацией G367R в гетерозиготном состоянии после ферментативного гидролиза; 3 – образец ДНК отца пробанда без мутации G367R после ферментативного гидролиза; 4 – образец амплифицированной ДНК, не обрабатывавшейся эндонуклеазой рестрикции; М – маркер молекулярного веса с шагом 100 п.н.
Мутация G367R находится в 3 экзоне гена MYOC, где, по данным мировой литературы, находится 97% всех случаев мутаций, которые обуславливают развитие заболевания (Hogewind B.F.T. et al., 2007). В 1997 году Y. Suzuki с соавт., рассматривая мутацию G367R, подчеркивал, что наиболее часто встречающиеся мутации в гене MYOC располагаются в 364, 367, 368, 370 и 437 кодонах. Такое концентрирование описанных мутаций вокруг 367 положения свидетельствует о том, что замены около этой позиции играют очень важную роль в патогенезе глаукомы. В 2007 году B.F.T. Hogewind с соавт. подтвердил, что более 30% мутаций гена MYOC локализуются в области кодонов 361-380 и 420-440 нуклеотидов, которые располагаются в ольфактомединподобном домене белка.
В результате замены, которая происходит при мутации G367R, по-видимому, существенно изменяется пространственная укладка белка (так как глицин относится к группе аминокислот, которые не имеют бокового радикала, а аргинин – к группе аминокислот, которые имеют объемную положительно заряженную боковую цепь, меняющую заряд белка). В клетках накапливается неправильно уложенный протеин, приводя клетки к апоптозу. Таким образом, предположительно белок с заменой G367R может напрямую приводить к гибели посредством апоптоза ганглиозных клеток сетчатки, астроцитов и ряда структур в области решетчатой пластинки (именно в них экспрессируется миоцилин (Karali A. et al., 2000; Swiderski R.E. et al., 2000; Clark A.F. et al., 2001), и, как следствие, вызывать снижение механической устойчивости решетчатой пластинки.
Идентификация полиморфизмов в гене миоцилина.
Полиморфизм Y347Y (с.1041 Т>С). Полиморфизм был выявлен в гетерозиготном состоянии в последовательности 3 экзона гена миоцилина при SSCP-анализе у 2 пробандов с ПВГ (6,5%), у 21 пробанда с ПОУГ (12,4%) и у 7 человек (7%) из группы контроля. Данный полиморфизм не приводит к изменению аминокислотной последовательности миоцилина из-за вырожденности генетического кода.
Поиск мутаций в гене цитохрома Р450 1В1.
Мутация P369ins (c.1508insCTC). Мутация была выявлена в гетерозиготном состоянии в последовательности 3-его экзона гена CYP1B1 при SSCP-анализе у одного пациента с ПВГ (рис. 4).
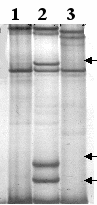
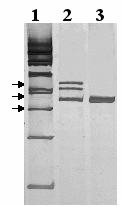
Рисунок 4 Электрофореграмма ручного SSCP – анализа продуктов амплификации 3-его экзона гена CYP1B1(стрелками обозначены зоны, соответствующие дополнительным конформерам и гетеродуплексам, образуемые мутантным аллелем).
1, 3 – образцы ДНК пациентов без мутации; 2– образец ДНК пациента с мутацией P369ins.
После SSCP-анализа образец с аномальной электрофоретической подвижностью был клонирован в векторе pAL-TA и секвенирован в фирме «Евроген» (Москва). Для отбора клонов с мутацией использовали гетеродуплексный анализ: отжиг амплифицированной ДНК изучаемых клонов с амплифицированной ДНК без мутации, что приводило к образованию гетеродуплексов при наличии в клоне трехнуклеотидной делеции. В дальнейшем мы использовали гетеродуплексный анализ для детекции мутации P369ins. О присутствии мутации в гетерозиготном состоянии судили по образованию дополнительных полос в геле, имеющих электрофоретическую подвижность такую же, как у фрагментов ДНК длиной 420 и 450 п.н., которые отсутствуют в ДНК пациентов без мутации (рис. 5) (оформляется патент на изобретение «Способ обнаружения мутации P369ins в гене CYP1B1, предрасполагающей к развитию первичной врожденной глаукомы»).
Рисунок 5 − Детекция мутации P369ins (c.1508ins3) в гетерозиготном состоянии в гене CYP1B1 с помощью гетеродуплексного анализа (стрелками обозначены зоны, соответствующие гетеродуплексам и гомодуплексам).
Дорожки: 1 – маркер молекулярного веса с шагом 100 п.н.; 2 – образец ДНК пациента, гетерозиготного по мутации P369ins; 3 – образец ДНК пациента без мутации P369ins.
Описанная нами мутация не индексирована в Human Genome Mutation Database и в доступной нам литературе не описана (Vasiliou V. et Gonzalez F.J., 2008).
В нашем исследовании мутация P369ins встретилась у пациента с ПВГ и ее частота составила 3%, среди пациентов со всеми формами первичной глаукомы – 0,5%.
Секвенирование мутантного аллеля выявило инсерцию трех нуклеотидов CTC и появление дополнительного остатка пролина в 369-ом положении белка цитохрома Р450 1В1 (рис. 6).
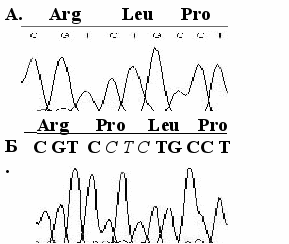
Рисунок 6. Идентификация мутации P369ins (c.1508ins3) в третьем экзоне гена цитохрома Р450 1В1 методом автоматического секвенирования ДНК.
А. – фрагмент канонической последовательности 2 экзона гена CYP1B1;
Б. – фрагмент клонированной последовательности, содержащий мутацию P369ins.
Лейциновый остаток в 369-ом положении входит в состав последовательности RLP – аргинин-лейцин-пролин (аминокислотные остатки 368 – 370, нумерация по последовательности белка человека NP_000095.1) идентичной как в белке человека, так и его гомологов у шимпанзе, собаки, быка, мыши, крысы, курицы, и рыбы Danio rerio, что свидетельствует о высокой консервативности данной области и ее важном значении для структуры и функции белка. Этот факт позволяет нам предположить, что любые изменения, локализующиеся в этой зоне, окажут существенное влияние на структуру и функцию белка. В результате мутации P369ins в белке цитохрома Р450 1В1 гена CYP1B1 возникает последовательность RPLP – аргинин-пролин-лейцин-пролин с двумя близко расположенными остатками пролина. Остатки пролина образуют другой валентный угол в полипептидной цепи, чем остатки других аминокислот, и вставка дополнительного пролина должна существенно изменить пространственную укладку белка, что, возможно, скажется на его функции.
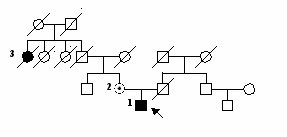 На рисунке 7 представлена родословная данного пациента
На рисунке 7 представлена родословная данного пациента1 – пробанд с мутацией P369ins (обозначен стрелкой); 2 – мать пробанда, носитель мутации P369ins; 3 – сестра дедушки пробанда с материнской стороны, которая страдала ПОУГ.
Данная мутация была обнаружена нами у матери пробанда И. (53 года). На момент обследования клинические признаки заболевания у нее отсутствовали. Другие родственники были недоступны для исследования.
Пациент с ПВГ унаследовал мутацию P369ins от матери, которая на настоящий момент не имеет патологии органа зрения. Он является генетическим компаундом. Вторую, не идентифицированную нами мутацию, необходимую для развития ПВГ, пациент, предположительно, унаследовал от отца, который, к сожалению, не был доступен для исследования. Проведя тщательное обследование кодирующей части белка цитохрома Р450 1В1, мы не обнаружили вторую мутацию и это, возможно, связано с тем, что она локализуется: (а) в промоторе гена CYP1B1; (б) в другом гене, располагающемся в локусе, связанном с развитием ПВГ, таком как GLC3B или GLC3C; (в) в другом гене, являющемся кандидантным для данного заболевания, например MYOC или FOXC1, и мы имеем дело с дигенным наследованием; или (г) в других генах, вызывающих глаукому и пока неизвестных науке.
Идентификация полиморфизмов в гене цитохрома Р4501В1.
В гене цитохрома Р450 1В1 у пациентов с различными формами глаукомы при SSCP-анализе были идентифицированы 7 полиморфизмов.
Полиморфизм IVS1-12T>C (g.3793 T>C) был выявлен в области первого интрона, прилежащей ко второму экзону при SSCP-анализе у 8 пробандов с ПВГ (26%), у 6 пробандов с ПЮГ (43%) в гетерозиготном состоянии и у 30 человек (30%) из группы контроля. Гомозиготами по неканоническому аллелю С полиморфизма было 20 пробандов с ПВГ (64%), 7 - с ПЮГ (50%) и 57 из группы контроля (57%).
Полиморфизм R48G (g.3947 C>G) был выявлен в последовательности 2 экзона у 10 пробандов с ПВГ (32%), у 8 пробандов с ПЮГ (57%), а также у 43 человек (43%) из группы контроля в гетерозиготном состоянии. Гомозиготами по редкому аллелю G полиморфизма было 3 пробанда с ПВГ (10%), 1 - с ПЮГ (7%) и 13 из группы контроля (13%).
Полиморфизм A119S (g.4160 G>T) был выявлен в последовательности 2 экзона у 14 пробандов с ПВГ (45%), у 9 пробандов с ПЮГ (64%) и у 45 человек (45%) из группы контроля в гетерозиготном состоянии. Гомозиготами по редкому аллелю Т полиморфизма было 3 пробанда с ПВГ (10%), 1 - с ПЮГ (7%) и 14 из группы контроля (14%).
Полиморфизм G188G (g.4369 C>A) был выявлен в последовательности 2 экзона у одного родственника в гомозиготном состоянии по редкому аллелю А.
Полиморфизм L432V (g.8131 C>G) был выявлен в 3 экзоне гена у 13 пробандов с ПВГ (42%), у 8 пробандов с ПЮГ (64%), у 83 пробандов с ПОУГ (47%) и у 50 человек (50%) из группы контроля в гетерозиготном состоянии. Гомозиготами по редкому аллелю G полиморфизма было 7 пробандов с ПВГ (23%), 2 - с ПЮГ (14%), 32 (18%) – с ПОУГ и 22 из группы контроля (22%). Рассматривая полиморфизм L432V необходимо отметить, что отношение к нему двоякое. Большинство авторов считают его нейтральным, но в 2008 году вышла работа индийских ученых, которые исследовали молекулярную природу ПОУГ и установили, что аллель G встречается достоверно чаще у пациентов с ПОУГ, чем среди здоровых доноров (р=0.0001; OR=6,027; 95% CI:3,863 – 9,401). Кроме того, при трансфекции культуры клеток пигментного эпителия сетчатки кДНК CYP1B1 с заменой L432V, было отмечено повышенное образование активных форм кислорода (ROS) по сравнению с наблюдаемым при экспрессии аллеля дикого типа (Bhattacharjee A. et al, 2008). Активные формы кислорода оказывают цитотоксическое действие на сетчатку и зрительный нерв, а также приводят к деструктивным изменениям в дренажном аппарате глаза. На основании вышеизложенных данных авторы сделали заключение, что аллель G полиморфизма L432V является предрасполагающим фактором к развитию ПОУГ, но в нашем исследовании это не было подтверждено.
Полиморфизм D449D (g.8184 C>T) был выявлен в последовательности 3 экзона у 14 пробандов с ПВГ (45%), у 8 пробандов с ПЮГ (57%) и у 53 человек (53%) из группы контроля в гетерозиготном состоянии. Гомозиготами по редкому аллелю Т полиморфизма было 6 пробандов с ПВГ (19%), 2 - с ПЮГ (14%) и 15 из группы контроля (15%).
Полиморфизм N453S (g.8195 A>G) был выявлен в последовательности 3 экзона у 11 пробандов с ПВГ (35%), у 2 пробандов с ПЮГ (14%) и у 18 человек (18%) из группы контроля в гетерозиготном состоянии. Гомозиготой по редкому аллелю G полиморфизма был только 1 пробанд с ПВГ (3%).
При данном полиморфизме происходит замена аминокислоты аспарагин (Asn) в положении 8195 по геномной последовательности на аминокислоту серин (Ser). В доступной нам литературе этот вариант нуклеотидной последовательности рассматривается как нейтральный полиморфизм (Sitorus R. et al., 2003; Reddy A.B.M. et al., 2004; Acharya M. et al., 2006). Тем не менее, при изучении частоты встречаемости аллелей данного полиморфизма было обнаружено, что аллель G в группе пациентов с ПВГ встречалась достоверно чаще, чем в группе контроля (c2=6,498, р=0,011). Этот факт позволил нам рассматривать аллель G полиморфизма N453S как генетический фактор риска развития данного заболевания. Был разработан метод быстрого тестирования данного полиморфизма методом ПДРФ-анализа. При обработке продукта амплификации фрагмента 3 экзона с канонической последовательностью длиной 344 п.н. эндонуклеазой рестрикции Mwo I ферментативного гидролиза не происходит. Замена нуклеотида A на G в положении 8195 приводит к появлению сайта для Mwo I и образованию двух фрагментов 41 п.н. и 303 п.н.
Полиморфизмы в гене WDR36.
В нашем исследовании мы изучили встречаемость четырех изменений нуклеотидной последовательности гена WDR36, а именно N355S, A449T, R529Q и D658G. Эти варианты в оригинальной работе Monemi S. с соавт. (2005) названы мутациями и в той же работе высказано предположение об их связи с ПОУГ. По результатам исследований других авторов эти варианты встречаются как среди больных ПОУГ, так и у здоровых доноров, и поэтому мы в дальнейшем будем называть эти изменения нуклеотидной последовательности полиморфизмами. Детекция полиморфизмов происходила с помощью ПДРФ – анализа.
Полиморфизм N355S (с.1064 A>G) локализован в последовательности 8 экзона гена WDR36. Это изменение нуклеотидной последовательности в нашем исследовании не было выявлено ни у пациентов с разными формами глаукомы, ни в группе контроля.
Полиморфизм A449T(с.1345 G>A) локализован в последовательности 11 экзона гена WDR36 и был найден у 1 пациента с ПОУГ (0,6%) в гетерозиготном состоянии.
Полиморфизм R529Q (с. 1586 G>A) локализован в последовательности 13 экзона гена WDR36 и был найден у 1 родственника пациента с ПВГ в гетерозиготном состоянии, у которого на настоящий момент нет признаков заболевания глаукомой.
Полиморфизм D658G (с.1973A>G) был выявлен в последовательности 17 экзона гена WDR36 при SSCP-анализе у 1 пробанда с ПВГ (3%), у 2 пробандов с ПОУГ (1%), у 1 родственника пробанда с ПВГ, у которого в настоящий момент нет признаков заболевания глаукомой и у 1 человека (1%) из группы контроля в гетерозиготном состоянии.
Частоты встречаемости полиморфизмов, обнаруженных в исследуемых экзонах генов миоцилина, цитохрома Р450 1В1 и WDR36.
Для всех идентифицированных нами полиморфизмов было проведено сравнение частот встречаемости отдельных аллелей во всех трех исследуемых группах больных и группе контроля и оценена достоверность этих различий на основании критерия c2 или точного критерия Фишера. Результаты расчета достоверности различий встречаемости отдельных аллелей полиморфизмов представлены в таблицах 1 и 2.
Таблица 1. Частоты встречаемости аллелей полиморфизма Y347Y (g. 1041 Т>С) в гене миоцилина, полиморфизма L432V (g.8131C>G) в гене цитохрома Р450 1В1 и полиморфизмов A449T (g.1345 G>A) и D658G (g. 1973A>G) в гене WDR36: сравнение с группой контроля.
| Название полиморфизма | Аллель | ПВГ (n=62) | ПЮГ (n=28) | ПОУГ (n=340) | Группа контроля (n = 200) |
| Y347Y (g. 1041 Т>С) | Т | 0,97 | 1,0 | 0,94 | 0,97 |
| C | 0,03 | 0 | 0,06 | 0,03 | |
| Значение р | | **р=1,0 | | c2=1,33 *р=0,24 | |
| L432V (g.8131C>G) | С | 0,56 | 0,57 | 0,58 | 0,53 |
| G | 0,44 | 0,43 | 0,42 | 0,47 | |
| Значение р | | c2=0,227 *р=0,63 | c2=1,423 *р=0,23 | c2=1,42 *р=0,23 | |
| A449T (g.1345 G>A) | G | 1,0 | 1,0 | 0,997 | 1,0 |
| A | 0 | 0 | 0,003 | 0 | |
| Значение р | | | | *р=1,0 | |
| D658G (g. 1973A>G) | A | 0,984 | 1,0 | 0,994 | 0,995 |
| G | 0,016 | 0 | 0,006 | 0,005 | |
| Значение р | | *р=0,418 | | *р=1,0 | |
* - значение р для χ2 – Пирсона (при сравнении частоты встречаемости аллелей в группе больных и контрольной группе);
** - значение р для точного критерия Фишера (при сравнении частоты встречаемости аллелей в группе больных и контрольной группе); n – число изученных хромосом.
Таблица 2. Частоты встречаемости аллелей обнаруженных полиморфизмов в гене цитохрома Р450 1В1: сравнение с группой контроля.
| Название полиморфизма | Аллель | ПВГ (n=62) | ПЮГ (n=28) | Группа контроля (n = 200) |
| IVS1-12T>C (g.3793 T>C) | Т | 0,23 | 0,29 | 0,28 |
| С | 0,77 | 0,71 | 0,72 | |
| Значение р | | c2=0,7*р=0,4 | c2=0,04*р=0,95 | |
| R48G (g.3947 C>G) | С | 0,74 | 0,64 | 0,66 |
| G | 0,26 | 0,36 | 0,34 | |
| Значение р | | c2=1,63*р=0,2 | c2=0,016*р=0,899 | |
| A119S (g.4160 G>T) | G | 0,68 | 0,61 | 0,635 |
| T | 0,32 | 0,39 | 0,265 | |
| Значение р | | c2=0,372 *р=0,542 | c2=0,082*р=0,775 | |
| D449D (g.8184 C>T) | С | 0,58 | 0,57 | 0,585 |
| Т | 0,42 | 0,43 | 0,415 | |
| Значение р | | c2=0,004 *р=0,952 | c2=0,019*р=0,891 | |
| N453S (g.8195 A>G) | A | 0,79 | 0,93 | 0,91 |
| G | 0,21 | 0,07 | 0,09 | |
| Значение р | | c2=6,498*р=0,011 | **р=1,0 | |
Равновесие Харди-Вайнберга выполнялось во всех исследуемых группах для всех полиморфизмов. Наличие равновесия свидетельствует об отсутствии давления эволюционного отбора на какой-либо из вариантов обнаруженных полиморфизмов.
Из таблицы 2 видно, что частота встречаемости аллеля G полиморфизма N453S (g.8195 A>G) была достоверно выше среди больных ПВГ, чем в контрольной группе (c2=6,498*р=0,011). Это позволяет рассматривать аллель G полиморфизма N453S как генетический фактор риска развития данного заболевания.
Для других полиморфизмов в генах миоцилина, цитохрома Р450 и WDR36 статистически достоверной разницы в частотах встречаемости аллелей между изученными группами получено не было.
ВЫВОДЫ.
- Впервые в России у пациентки с ПЮГ идентифицирована мутация G367R в гене миоцилина (частота встречаемости среди больных ПЮГ составила 7%, а среди всех больных с разными формами первичной глаукомы – 0,5%, что сопоставимо с частотой ее встречаемости в других популяциях мира).
- Впервые в мире у больного с ПВГ выявлена мутация P369ins в гене цитохрома Р450 1В1 (частота встречаемости среди пациентов с ПВГ составила 3%, а среди пациентов со всеми формами первичной глаукомы-0,5%).
- Полиморфизм L432V в 3 экзоне гена цитохрома Р450 1В1 для больных Санкт-Петербурга с ПВГ, ПЮГ и ПОУГ является нейтральным вариантом последовательности, не ассоциированным ни с одной из форм заболевания.
- Аллель G полиморфизма N453S (g.8195 A>G) в гене CYP1B1 статистически достоверно чаще встречается в группе больных с ПВГ, чем в группе контроля, и может рассматриваться как генетический фактор риска развития этого заболевания. Для остальных полиморфизмов в генах миоциллина (Y347Y) и цитохрома Р450 (IVS1-12T>C, R48G, A119S, G188G, D449D) ассоциации с развитием ПВГ и ПЮГ не выявлено.
- Разработан метод быстрого обнаружения мутации G367R в гене миоцилина и полиморфизма N453S в гене цитохрома Р450 1В1 с помощью ПДРФ-анализа, а также мутации P369ins в гене цитохрома Р450 1В1 с помощью гетеродуплексного анализа.
- Изменения нуклеотидной последовательности в гене WDR36 A449T, R529Q и D658G являются нейтральными полиморфизмами и не ассоциированы с развитием заболевания разными формами первичной глаукомы в Санкт-Петербурге. Полиморфизм N355S не характерен для больных разными формами первичной глаукомы в Санкт-Петербурге.
- Пациенты с ПЮГ, их дети и кровные родственники до 35 лет нуждаются в генетическом обследовании на наличие мутаций в гене миоцилина.
Практические рекомендации.
- Комплекс молекулярно-генетических методов поиска мутаций в гене миоцилина может быть рекомендован для использования в доклинической диагностике ПЮГ;
- Генетическое тестирование на наличие мутации G367R в гене миоцилина и полиморфизма N453S в гене цитохрома Р450 1В1 показано пациентам с ПВГ и ПЮГ и их родственникам;
- Разработанный экспресс-метод обнаружения мутации G367R в гене миоцилина и полиморфизма N453S в гене цитохрома Р450 1В1 с помощью ПДРФ-анализа может быть рекомендован для внедрения в клиническую практику, как наиболее экономичный по сравнению с другими молекулярно-генетическими методами.
Список работ, опубликованных по теме диссертации.
- Кохреидзе Л.Г., Мотущук А.Е., Рахманов В.В., Грудинина Н.А. Поиск мутаций в генах MYOC и WDR36 у больных первичной открытоугольной глаукомой в Санкт-Петербурге // II молодежный медицинский конгресс «Санкт-Петербургские чтения-2007» (Санкт-Петербург, 5-7 декабря 2007), Тезисы докладов. – СПб, 2007. – Стр. 115-116.
- Грудинина Н.А., Мотущук А.Е., Комарова Т.Ю., Тихомирова О.С., Кохреидзе Л.Г., Рахманов В.В., Мандельштам М.Ю., Астахов Ю.С., Васильев В.Б. Исследование гена WDR36 у больных первичной открытоугольной глаукомой из Санкт – Петербурга // Молекулярно-биологические технологии в медицинской практике. – Выпуск 12. – Новосибирск, 2008. – Стр.78-85.
- Комарова Т.Ю., Мотущук А.Е., Грудинина Н.А., Мандельштам М.Ю. Изучение роли гена WDR36 у больных с разными видами глаукомы // XXXVII неделя науки СПбГПУ (Санкт-Петербург, 24-29 ноября 2008), Материалы Всероссийской межвузовской научной конференции студентов и аспирантов, Часть XVIII. – СПб, 2008. – Стр. 36-38.
- Комарова Т.Ю., Мотущук А.Е., Грудинина Н.А., Мандельштам М.Ю. Полиморфизм L432V в гене CYP1B1 не ассоциирован с первичной врожденной глаукомой и первичной открытоугольной глаукомой у жителей Санкт-Петербурга // XXXVII неделя науки СПбГПУ (Санкт-Петербург, 24-29 ноября 2008), Материалы лучших докладов. – СПб, 2008. – Стр. 39-41.5.
- Комарова Т.Ю., Мотущук А.Е Поиск широко распространенных мутаций в гене WDR36 у пациентов с первичной открытоугольной глаукомой из Санкт-Петербурга // Наука и инновации в технических университетах (Санкт-Петербург, 28-31 октября 2008), Материалы всероссийского форума студентов, аспирантов и молодых ученых. – СПб, 2008. – Стр. 174-175.
- Мотущук А.Е., Рахманов В.В., Комарова Т.Ю., Грудинина Н.А. Поиск мутаций в генах MYOC, WDR36 и CYP1B1 у больных первичной открытоугольной глаукомой в Санкт-Петербурге // Ученые записки СПбГМУ им. акад. И.П. Павлова. – 2008. – Том XV, №4. – Стр. 79.
- Мотущук А.Е., Грудинина Н.А., Рахманов В.В., Мандельштам М.Ю., Астахов Ю.С., Васильев Новая мутация P369ins в гене CYP1B1 у пациента с первичной врожденной глаукомой из Санкт-Петербурга // Ученые записки СПбГМУ им. акад. И.П. Павлова. – 2009. – Том XVI, №2. – Стр. 88-89.
- Мотущук А.Е., Рахманов В.В., Грудинина Н.А. Исследование гена CYP1B1 у больных первичной врожденной глаукомой из Санкт-Петербурга // Актуальные вопросы клинической и экспериментальной медицины – 2009, Сборник тезисов научно-практической конференции молодых ученых. – СПб, 2009. – Стр. 198-200.
- Мотущук А.Е., Грудинина Н.А., Комарова Т.Ю., Рахманов В.В., Мандельштам М.Ю., Астахов Ю.С., Васильев В.Б. Полиморфные маркеры гена CYP1B1 не ассоциированы с первичной врожденной глаукомой у жителей Санкт-Петербурга // Молекулярно-биологические технологии в медицинской практике. – Выпуск 13. – Новосибирск, 2009. – Стр.83-86.
- Мандельштам М.Ю., Мотущук А.Е., Комарова Т.Ю., Грудинина Н.А., Рахманов В.В., Астахов Ю.С., Васильев В.Б. Молекулярно-генетические маркеры в диагностике глаукомы // Съезд генетиков и селекционеров, посвященный 200-летию со дня рождения Чарльза Дарвина и V съезд Вавиловского общества генетиков и селекционеров (Москва, 21-28 июня 2009). – Сборник тезисов. Часть I. – Москва. – стр. 457.
- Мотущук А.Е., Комарова Т.Ю., Грудинина Н.А., Рахманов В.В., Мандельштам М.Ю., Астахов Ю.С., Васильев В.Б. Генетические варианты CYP1B1 и WDR36 у больных первичной врожденной и первичной открытоугольной глаукомой из Санкт-Петербурга // Генетика. – 2009. – Т. 45, №12. – С. 1676-1684.
СПИСОК ПРИНЯТЫХ СОКРАЩЕНИЙ:
а.о. – аминокислотный остаток
ВГД – внутриглазное давление
ВВ – водянистая влага
ДЗН – диск зрительного нерва
кДНК – комплементарная ДНК
ПААГ – полиакриламидный гель
ПВГ – первичная врожденная глаукома
ПДРФ-анализ – анализ полиморфизма длин рестрикционных фрагментов
п.н. – пары нуклеотидов
ПОУГ – первичная открытоугольная глаукома
ПЦР – полимеразная цепная реакция
ПЮГ – первичная ювенильная глаукома
РРУ – радужно-роговичный угол
т.п.н. – тысячи пар нуклеотидов
Э/Д – отношение диаметра экскавации к диаметру диску зрительного нерва
SSCP-анализ – анализ конформационного полиморфизма однонитевых фрагментов ДНК
