На правах рукописи
| Вид материала | Автореферат |
- Печатная или на правах рукописи, 21.09kb.
- Удк 796/799: 378 , 770.24kb.
- На правах рукописи, 399.58kb.
- На правах рукописи, 726.26kb.
- На правах рукописи, 1025.8kb.
- На правах рукописи, 321.8kb.
- На правах рукописи, 552.92kb.
- На правах рукописи, 514.74kb.
- На правах рукописи, 670.06kb.
- На правах рукописи, 637.26kb.
На правах рукописи
ТЕРЕХОВ
Дмитрий Валентинович
ЭФФЕКТИВНОСТЬ НЕСПЕЦИФИЧЕСКОЙ ИНГАЛЯЦИОННОЙ ИММУНОТЕРАПИИ РУЗАМОМ ПРИ АТОПИЧЕСКОЙ БРОНХИАЛЬНОЙ АСТМЕ
14.03.09 - клиническая иммунология, аллергология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва-2012
Работа выполнена в ГБОУ ДПО «Российская медицинская академия последипломного образования» Минзравсоцразвития России
Научный руководитель:
доктор медицинских наук,
профессор НЕНАШЕВА Наталья Михайловна
Официальные оппоненты:
доктор медицинских наук, профессор ГАРИБ Фируз Юсупович
доктор медицинских наук ОСИПОВА Галина Леонидовна
Ведущая организация: ГБОУ ВПО «Саратовский государственный медицинский университет» Минзравсоцразвития России
Защита состоится «15» февраля 2012 г. в 10:00 на заседании диссертационного совета Д.208.071.04 при ГБОУ ДПО «Российская медицинская академия последипломного образования» Минзравсоцразвития России по адресу: 123995, г. Москва, ул. Баррикадная, д. 2/1.
С диссертацией можно ознакомиться в библиотеке ГБОУ ДПО РМАПО Минзравсоцразвития России (125445, г. Москва, ул. Беломорская, д.19/38).
Автореферат разослан «12 » января 2012 г.
Ученый секретарь
диссертационного совета
д. м. н., профессор ЛУГОВСКАЯ С. А.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Бронхиальная астма (БА) – глобальная проблема мирового здравоохранения: в мире насчитывается около 300 млн. лиц, страдающих данной патологией [GINA, updated 2009]. Частота встречаемости БА в разных странах мира составляет от 1 до 18% населения. За последние два десятилетия произошло много научных открытий, которые расширили наши представления о патогенезе и механизмах развития БА, а также факторах, усугубляющих течение заболевания. В 90-е годы на основании многочисленных исследований в рамках проекта «Геном человека» была доказана генетическая обусловленность атопии [Armandola Е.А., 2003], повышения синтеза иммуноглобулина Е (IgE) [Meyers D.A., 1999], феномен бронхиальной гиперреактивности (БГР) [Чучалин А.Г., 2001]. Выявлена хромосомная локализация (в 5-й хромосоме) генов, отвечающих за выработку важнейших интерлейкинов (ИЛ) -3, 4, 5, 9, 13, являющихся маркерами аллергического воспаления [Meyers D.A., 1999], обнаружено 9 мутаций гена β2-адренорецептора [Чучалин А.Г., 1999; Meyers D.A., 1999], мутации гена 5-липооксигеназы [Lamdercht D.N. et al., 1998], лежащих в основе фармакогенетики и фармакотерапии астмы.
Современная терапия БА основывается на данных генетики, иммунологии, теории хронического аллергического воспаления и включает профилактическое и патогенетическое направления. Не умаляя достижения мировой фармакологической науки в процессе контроля аллергического воспаления, на первый план выходят проблемы профилактики аллергии, связанные с поиском биологических маркеров, отражающих ранние стадии воспалительного аллергического процесса и возможности их коррекции. Эти исследования тесно связаны с определением протеомной карты человека. Наука «протеомика», изучающая структуру, функции и взаимодействие внутриклеточных белков, занимает ведущее место в постгеномной фармакологии. Пептиды рассматриваются, с одной стороны, как биомаркеры патогенеза, с другой, как возможные терапевтические молекулы. Иммунотерапия с использованием регуляторных эндогенных и экзогенных пептидов – новое, быстро развивающееся направление в терапии БА [Holgate S., 2000; Kay А.В., 2003; Larche М., 2003]. К препаратам группы экзогенных пептидов относится российский противоаллергический препарат Рузам, экстрагированный из термофильного активного штамма Staphylococcus aureus С2, прошедший термическую стадию обработки и оказывающий противоаллергическое и противовоспалительное действие на некоторые клеточные (эозинофилы, нейтрофилы, тучные клетки) и гуморальные (Ig E, ингибирование реакции пассивной кожной анафилаксии) мишени аллергического воспаления [Колганова Н.А., 2002; Чучалин А.Г., Ковалева В.Л., Колганова Н.А.,2003].
До недавнего времени Рузам вводился только подкожно и интраназально, что имело определенные недостатки. Введение препарата подкожно требовало постоянного контроля врача и временных затрат, а применение Рузама интраназально показано для лечения больных аллергическим ринитом. В связи с этим представляется актуальным изучение нового пути введения препарата Рузам, который был бы безопасен, эффективен, не требовал много времени на курс лечения и по возможности сокращал количество визитов пациента к врачу. Таким методом лечения может быть ингаляционная терапия Рузамом. В связи с этим актуальным является проведение открытого рандомизированного, плацебо-контролируемого проспективного исследования противоаллергической и противовоспалительной активности ингаляционной формы препарата Рузам в терапии БА.
Цель исследования. Оценить эффективность и безопасность противоаллергического и противовоспалительного действия ингаляционной формы препарата Рузам в терапии больных бронхиальной астмой, используя комплексную оценку с включением клинико-функциональных показателей и маркеров воспаления.
Задачи исследования:
1. Оценить клинико-функциональную эффективность лечения Рузамом (ингаляционной формы) в комбинации с ингаляционными глюкокортикостероидами (ИГКС) по сравнению с плацебо+ИГКС больных неконтролируемой атопической БА легкого и среднетяжелого течения.
2. Определить влияние неспецифической иммунотерапии Рузамом в комбинации с ИГКС по сравнению с плацебо+ИГКС на аллергическое воспаление в нижних дыхательных путях, используя неинвазивные методы оценки воспаления: уровень неспецифической БГР и оксида азота в выдыхаемом воздухе (NOex), и инвазивные методы: определение IgE в сыворотке крови и маркеров воспаления (интерферона-гамма (ИФН-γ), эозинофильного катионного протеина (ECP), нейтрофильной эластазы (НЭ), ИЛ-4, клеточного состава) в сыворотке крови и индуцированной мокроте.
3. Изучить влияние ингаляционной формы препарата Рузам на частоту ОРВИ и уровень ИФН-γ в сыворотке крови и индуцированной мокроте.
4.Определить длительность эффекта неспецифической иммунотерапии Рузамом (ингаляционной формы) в комбинации с ИГКС путем изучения частоты обострений БА, объема базисной терапии, динамики клинико-функциональных и лабораторных показателей через 6 месяцев после окончания терапии
5. Изучить безопасность иммунорегуляторного препарата Рузам для ингаляционного применения с помощью регистрации нежелательных побочных эффектов.
Научная новизна. Впервые в отечественной практике на достаточном клиническом материале проведено открытое рандомизированное, плацебо-контролируемое проспективное исследование и показано противоаллергическое и противовоспалительное действие ингаляционной формы препарата Рузам в комплексе с ИГКС у больных неконтролируемой атопической БА.
Впервые показана эффективность и безопасность новой формы доставки отечественного препарата Рузам для ингаляционного применения по сравнению с плацебо у больных неконтролируемой атопической БА.
Показано влияние неспецифической иммунотерапии Рузамом в комбинации с ИГКС на аллергическое воспаление в нижних дыхательных путях, характеризующееся снижением уровня неспецифической БГР, NOex, эозинофилов и ЕСР в сыворотке крови и индуцированной мокроте.
Впервые показано влияние терапии Рузамом на продукцию ИФН-γ, уровень которого в индуцированной мокроте больных увеличился с 48(28,5÷84,5) пг/мл до 268(127,8÷385,3) пг/мл, р=0,011, что сопровождалось уменьшением частоты ОРВИ у пролеченных пациентов в 2,5 раза (р=0,0034) и связанных с ними обострений БА в 3 раза (р=0,000027).
Проведение исследования клинико-функциональных и лабораторных показателей через 6 месяцев после лечения Рузамом+ИГКС выявило сохранение достигнутого клинико-функционального контроля, дальнейшее снижение ЕСР в сыворотке крови и индуцированной мокроте.
Практическая значимость работы. Выявленная в результате исследования эффективность и безопасность комбинированной терапии Рузамом (раствор для ингаляций)+ИГКС у больных неконтролируемой атопической БА легкого и среднетяжелого течения, позволяет рекомендовать этот метод лечения в реальную клиническую практику.
Комбинированная терапия Рузам (раствор для ингаляций)+ИГКС позволяет лучше контролировать симптомы аллергического воспаления, снижает количество обострений БА, уменьшает объем симптоматической терапии, снижает частоту ОРВИ.
Внедрение в практику более удобной для врача и пациента новой лекарственной формы препарата Рузам позволит повысить эффективность лечения больных персистирующей бронхиальной астмой и сократить временные затраты на лечение, что приведет к экономии ресурсов здравоохранения.
Доказана целесообразность исследования уровня NOex у больных атопической БА для определения эффективности проводимой противоастматической терапии.
Показана высокая информативность АСТ-теста и ACQ-вопросника, коррелирующих между собой и с клинической оценкой, функциональными показателями, маркерами воспаления.
Комплексное обследование, а также оценка состояния в динамике на фоне комбинированной терапии (ИГКС+Рузам – раствор для ингаляций) у пациентов с легкой персистирующей и среднетяжелой атопической БА должны дополняться оценкой воспаления, что обеспечит индивидуальный и более объективный подход к пациенту и оптимизирует достижение контроля БА.
Основные положения, выносимые на защиту
1. Препарат Рузам (раствор для ингаляций) в комбинации с ИГКС эффективен при лечении неконтролируемой атопической БА легкого персистирующего и среднетяжелого течения, что подтверждает положительная динамика клинико-функциональных показателей и маркеров воспаления в сыворотке крови и индуцированной мокроте.
2. Комбинированная терапия Рузамом (раствор для ингаляций)+ИГКС приводит к значимому снижению обострений БА за счет достижения более стабильного контроля БА, повышения содержания ИФН-γ в индуцированной мокроте и уменьшения частоты ОРВИ у пролеченных пациентов.
3. Анализ эффективности комбинированной терапии Рузам+ИГКС атопической БА легкого персистирующего и среднетяжелого течения должен быть комплексным и включать клинико-функциональные параметры и маркеры аллергического воспаления, что позволяет проводить более объективную оценку состояния БА и эффективности противоастматической терапии.
4. Рузам в дозе 2,5 мл 1 раз в день в течение двух недель хорошо переносится и безопасен в терапии пациентов с атопической БА.
Внедрение в практику: Результаты исследований внедрены в практику работы аллергологического отделения ГКБ №52 и поликлинического консультативного аллергологического центра на базе ГКБ №52 г. Москвы, а также включены в материалы лекций, практических и семинарских занятий на кафедре клинической аллергологии РМАПО.
Апробация диссертации. Основные результаты диссертации доложены на конференции молодых ученых РМАПО (Москва, 27 апреля 2011 г.), XI Международном конгрессе: «Современные проблемы иммунологии, аллергологии и иммунофармакологии» (Москва, 7 июля 2011 г.).
Апробация диссертационной работы проведена на совместной научной конференции кафедры клинической аллергологии ГБОУ ДПО РМАПО и сотрудников Городской клинической больницы №52 г. Москвы (21.09.2011).
Публикации результатов исследования. По теме диссертации опубликовано 8 печатных работ, из них 2 работы в изданиях, рекомендуемых ВАК РФ; 1 работа в журнале Allergy Европейского общества аллергологов и иммунологов.
Структура и объем работы. Диссертационная работа изложена на 168 страницах машинописного текста, содержит 22 таблицы, иллюстрирована 19 рисунками и состоит из введения, обзора литературы, материалов и методов исследования, результатов собственных исследований, обсуждения результатов, выводов, практических рекомендаций, списка литературы и приложения. Библиографический указатель содержит 241 источник литературы, из которых 68 – в Российской и 173 – в зарубежной печати.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Клиническая характеристика больных. В настоящем открытом рандомизированном, плацебо-контролируемом проспективном исследовании проведена оценка эффективности и безопасности ингаляционной формы препарата Рузам у больных персистирующей атопической (БА) легкого и среднетяжелого неконтролируемого течения. Дизайн исследования представлен на рис.1.

Рис. 1. Дизайн исследования.
Критерии включения в исследование:
Возраст 18 - 65 лет.
- Наличие установленного диагноза персистирующей атопической БА легкой и средней степени тяжести течения (GINA, 2006) в течение не менее 2 лет.
- Наличие клинических проявлений БА в период исследования с общим показателем симптомов не более 8 баллов за сутки.
- Наличие информированного согласия пациента и разрешения этического комитета.
- Женщины, обладающие детородной способностью, должны иметь отрицательный результат анализа мочи на беременность.
Критерии исключения:
1. Терапия системными кортикостероидами в течение 6 месяцев до включения в исследование.
2. ОРВИ и клинически значимые обострения хронических
воспалительных заболеваний дыхательных путей в течение
3 недель до включения в исследование.
3. Декомпенсированные соматические заболевания.
4. Постоянное использование антигистаминных препаратов
5. Стаж курения более 10 пачек-лет.
6. Обострение хронических заболеваний.
Обследовано 102 пациента с верифицированным диагнозом бронхиальной астмы. Критериям включения/исключения соответствовали 63 пациента с атопической БА легкого персистирующего (n=30) и среднетяжелого (n=33) неконтролируемого течения.
Группы больных, включенных в исследование, были сопоставимы по основным характеристикам. Все пациенты, включенные в исследование, имели атопическую форму БА, у абсолютного большинства больных выявлялась полисенсибилизация к неинфекционным аэроаллергенам. Наследственный анамнез по БА и атопии был отягощен у 31 (49%) и 9 (14%) больных соответственно.
План исследования предусматривал период включения в исследование (1 неделя), рандомизационный визит, промежуточный визит 2 (через 1 неделю лечения), контрольный визит 3 (через две недели лечения), во время которого проводилась оценка эффективности и безопасности проведенного лечения, и заключительный визит (через 6 месяцев) для оценки отдаленных результатов.
После завершения недельного вводного периода пациенты были рандомизированы в две группы методом случайной выборки: первая группа получала лечебный курс препарата Рузам, вторая группа пациентов (группа контроля) получала, в качестве плацебо, 0,9% раствор NaCl. Лечебный период составил 2 недели, в течение которого проводились ингаляции раствора Рузама или NaCl через небулайзер по 2,5 мл один раз в день. Выбор схемы терапии основывался на рекомендациях фирмы-производителя ООО «Рузам-М». Все больные получали базисную терапию ИГКС в виде моно- или комбинированной терапии (ИГКС и длительно действующий β2-агонист (ДДБА), в соответствии с рекомендациями GINA 2006. Фармакотерапия оставалась постоянной во время вводного и лечебного периодов исследования. Для купирования симптомов астмы использовался короткодействующий β2-агонист (Cальбутамол). Группы больных не отличались по тяжести БА и объему терапии (табл. 1).
Таблица 1. Общая характеристика больных.
| Показатель | Больные, получающие Рузам+ИГКС | Больные, получающие плацебо+ИГКС |
| Пол (мужчины/женщины | 17/14 | 22/10 |
| Возраст | 36,3±13,3 | 33,3±14,9 |
| Легкая персистирующая БА | 17 | 13 |
| Среднетяжелая БА | 14 | 19 |
| Длительность БА (лет) | 14,03±11,41 | 13,4 ±10,04 |
| Возраст дебюта БА | 21,03±12,5 | 19,0±11,8 |
Характеристика препарата. Препарат Рузам был разработан на базе НИИ пульмонологии и представляет собой фильтрат культуры термофильного штамма Staphylococcus aureus, получаемый по оригинальной технологии (патент № 2641293 а/с 873684 и 43320 38/28-14 1978 и 1987 гг.). Методом ионообменной хроматографии установлено, что по химической структуре Рузам является липопротеином (пик в зоне пептидов с молекулярной массой от 6000 до 13000 Дальтон). Препарат Рузам представляет собой прозрачную бесцветную жидкость, с содержанием белка 0,02-0,04 мг/мл, рН от 6,5 до 7,5, стерилен и нетоксичен. Разрешение Фармакологического Комитета на проведение клинического исследования ингаляционной формы Рузама № 020706 получено 10.07.2009. Исследование проведено по протоколу, утвержденному на заседании локального комитета по этике ГОУ ДПО РМАПО от 02.06.2009.
Методы исследования
1. Общеклиническое обследование включало изучение жалоб, анамнеза, методы объективного и инструментального исследования (общий анализ крови, мочи, биохимический анализ крови, ЭКГ).
2. Специфическое аллергологическое обследование включало: аллергологический анамнез; кожные аллергические пробы с неинфекционными аллергенами.
3. Оценка клинических симптомов. На протяжении вводного и лечебного периода исследования, а также в течение одной недели через 6 месяцев после лечения все пациенты вели дневник самоконтроля, где отмечали выраженность симптомов БА (приступы удушья, пробуждения, вызванные симптомами БА; потребность в β2-агонистах; фиксировались значения утренних и вечерних измерений пиковой скорости выдоха (ПСВ). Степень выраженности симптомов оценивали по четырехбалльной шкале, учитывая отдельно ночные и дневные симптомы.
4.Функциональные методы обследования. Для изучения функции внешнего дыхания (ФВД) использовали спирометрию. Исследование проводили на приборе «MASTER SCREEN BODY» фирмы «JAGER» с определением дыхательных объемов и расчетом скоростных показателей по кривой «поток-объем». При динамическом исследовании основным показателем был выбран объем форсированного выдоха за первую секунду (ОФВ1 (% от должного)) как наиболее легко воспроизводимый и высокочувствительный при БА.
Оценку ПСВ и ее мониторирование проводили с помощью пикфлоуметра фирмы «Clement Clarke International».
Для определения порога неспецифической БГР проводился тест с метахолином (Acetyl-β-methycholine chloride, SIGMA). Применяли дозовый метод с помощью компрессорного небулайзера фирмы «Пари». Тест выполнялся в соответствии с рекомендациями Европейского респираторного общества (ERS). Тест считался положительным при снижении ОФВ1на 20% от базового значения, и концентрация раствора метахолина, приведшая к такому снижению, считалась пороговой концентрацией (ПК20).
5. Определение NOex. Измерения NOex производили с помощью портативного прибора NIOXMINO; AerocrineAB, производства Швеции. Прибор рекомендован к применению Европейским респираторным и Американским торакальным обществами. Прибор функционирует на основании электрохимического анализа выдыхаемого воздуха. В качестве контрольной группы было обследовано 7 здоровых лиц (4 мужчин и 3 женщины). Уровень NOex у них составил Ме=10 (5÷17) pрb.
6. Исследование индуцированной мокроты. Индуцированную мокроту получали с помощью 3-4-5% раствора NaCl по методу Попова. Для индукции мокроты нами использовался ультразвуковой небулайзер фирмы Omron Micro AIR c мощностью распыления от 0,25 мл/мин, средним размером распыляемых частиц менее 5 мкм. Образцы мокроты собирались в стерильные контейнеры. Исследование мокроты проводилось не позднее чем через два часа после ее получения. Затем готовились мазки для изучения клеточного состава мокроты. Полученный материал подвергали гомогенизации с использованием раствора дитиотреитола (DTT) 0,1%. Полученную смесь взбалтывали в течение 15 минут на водяной бане при комнатной температуре для отделения слизи. Далее добавляли 4 объема фосфатно-солевого буфера, встряхивание было продолжено в течение 5 мин. Смесь фильтровали через нейлоновую марлю и центрифугировали в течение 10 минут при 1 000 оборотах в минуту. Полученный супернатант сохраняли при температуре -70°С для последующего определения ЕСР, ИФН-γ.
7. Лабораторные методы. Уровень IgE в сыворотке крови определяли иммуноферментным методом с помощью диагностических наборов «IgE общий-ИФА-БЕСТ» производства компании Вектор-Бест в соответствии с инструкцией производителя. Нормальные показатели IgE в сыворотке крови у взрослых, по данным лаборатории, составляют от 15 до 140 МЕ/мл.
Определение уровня ИФН-γ в супернатанте индуцированной мокроты проводилось методом твердофазного иммуноферментного анализа с использованием наборов моноклональных антител («Вектор Бест», Новосибирск). Анализ был проведен в парных образцах. Все процедуры по определению и выделению образцов были проведены согласно рекомендациям и ограничениям производителя. В качестве контрольной группы уровень ИФН-γ в индуцированной мокроте определялся у 5 здоровых лиц (2 мужчин и 3 женщины) и составил Ме=37(17÷63) пг\мл.
Определение содержания ECP в сыворотке крови и супернатанте индуцированной мокроты пациентов проводили иммунохемилюминесцентным методом на приборе «UniCAP 100» («Phadia», Швеция) с применением реагентов для определения ECP, согласно инструкции производителя. Содержание ЕСР в сыворотке крови здоровых лиц составляет до 15 мкг/л, а в индуцированной мокроте до 12 мкг/л (по данным лаборатории Фидес Лаб).
В совместном исследовании с доцентом кафедры биохимии РМАПО Е.А. Нешковой проводилось определение активности НЭ в сыворотке крови спектрофотометрическим методом с использованием синтетического субстрата BOC-Ala-ONp (N-тетр-бутокси-карбонил-аланин-нитрофениловый. Нормальный уровень активности НЭ у здоровых доноров составляет 200±34 мЕ/мл.
Определение активности Альфа-1-антитрипсина (α1-АТ) в сыворотке крови выполнялось по унифицированному методу В.Ф. Нартиковой и Т.С. Пасхиной с помощью спектрофотометра любого типа. Активность α1-АТ в норме для сыворотки крови взрослого человека равна 29.9 ±1.2 ИЕ/ мл.
8. Оценка контроля бронхиальной астмы. Вопросник «АСТ» (Asthma Control Test) – тест по контролю БА. Тест состоит из 5 вопросов, ответы на которые представлены в виде пятибалльной оценочной шкалы. Результатом теста является сумма ответов в баллах. Вопросник по контролю астмы (ACQ – Asthma Control Questionnaire), включает 5 пунктов. Оценка выраженности симптомов происходит по визуально-аналоговой балльной шкале от 0 баллов (симптом отсутствует) до 6 баллов – максимально выраженный симптом. Вопросники заполнялись больными самостоятельно до начала лечения, сразу после лечения и через 6 месяцев после курса лечения Рузамом.
9. Оценка безопасности терапии. Безопасность терапии определялась путем выявления нежелательных побочных явлений с помощью опроса пациентов на плановых визитах с оценкой контроля жизненно важных функций, проведения клинического и биохимического анализов крови до и после лечения, исследования общего анализа мочи и ЭКГ до и после лечения.
10.Методы статистической обработки. Cтатистическая обработка данных производилась с помощью пакета «Statistica» версии 6.0. компании «StatSoft Inc». Качественные переменные описывались отношением шансов. В случае ненормального распределения признаков использовали непараметрические методы (описательная статистика проводилась с помощью Ме[Q1; Q3]. Для сравнения показателей в независимых группах использовался тест Манна-Уитни, для сравнения показателей внутри группы – тест Вилкоксона). Различия в группах считались значимыми при р< 0,05. Анализ связей между группами проводили с помощью ранговой корреляции по Спирмену. В случае нормального распределения использовались параметрические методы (описательная статистика проводилась с помощью M±s).
Результаты собственных исследований
Оценка эффективности и безопасности проводимого лечения основывалась на динамике следующих параметров: клинических симптомов БА, данных функциональных и лабораторных показателей. Критерием эффективности терапии являлась также оценка уровня контроля БА.
Через 2 недели лечения у больных, получавших ингаляционную терапию Рузам+ИГКС, отмечена значимая положительная динамика дневных (исходно Ме=1,3(0,5÷2,0), сразу после лечения Ме=0,6(0÷1,5), р=0,0018) и ночных (исходно Ме=1,1(0,5÷2,0), сразу после лечения Ме=0,86(0÷1,7), р=0,022) симптомов. В группе плацебо+ИГКС также отмечалась значимая положительная динамика дневных (исходно Ме=1,35(0,5÷2,0), сразу после лечения Ме=0,4(0,2÷1,0), р=0,006) и ночных (исходно Ме=1,18(0,55÷1,95), сразу после лечения Ме=0,6(0,2÷1,2), р=0,003) симптомов. Уменьшение выраженности симптомов в группе плацебо+ИГКС объясняется, по-видимому, эффектом «плацебо». Подтверждением данного факта является то, что в этой группе снизились только субъективные показатели, объективные же показатели (ПСВ, ОФВ1, БГР и др.) остались без динамики (табл. 3), в отличие от больных, получавших Рузам+ИГКС.
Через 6 месяцев после окончания курса лечения Рузам+ИГКС, несмотря на сохранение снижения дневных (р=0,65) и ночных (р=0,95) симптомов, данные утеряли статистическую значимость по сравнению с показателями, полученными сразу после лечения. В группе плацебо+ИГКС отмечалось статистически незначимое повышение суммарной балльной оценки дневных (р=0,22) и ночных (р=0,5) симптомов, по сравнению с показателями, полученными сразу после лечения.
Снижение балльной оценки дневных и ночных симптомов сопровождалось значимым (р=001) снижением потребности в симптоматической бронхолитической терапии, по сравнению с исходными данными в группе Рузам+ИГКС. На фоне терапии плацебо+ИГКС не произошло статистически значимого (р=0,37) снижения потребности в ингаляциях Сальбутамола. Через 6 месяцев после окончания курса лечения Рузам+ИГКС отмечалось незначимое (р=0,47) увеличение потребности в быстро действующих β2-агонистах. В группе плацебо+ИГКС у больных произошло значимое (р=0,036) увеличение потребности в препаратах для купирования приступов БА (рис. 2).
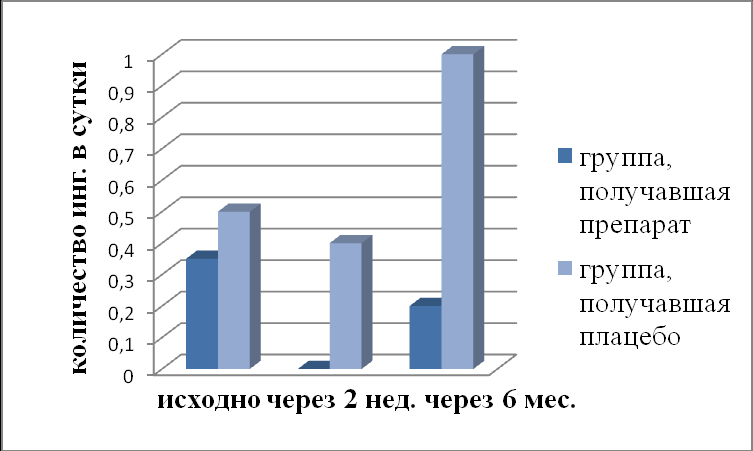















Рис. 2. Динамика потребности в β2- агонистах.
При оценке показателей пикфлоуметрии, сразу после окончания курса терапии Рузам+ИГКС отмечалось значимое увеличение утренних значений ПСВ (исходно Ме=406(317÷500), сразу после лечения – Ме=425(345÷493), р=0,042) и тенденция (р=0,072) к увеличению вечерних значений ПСВ. В группе плацебо+ИГКС не отмечалось повышения ПСВ как в утренние, так и вечерние часы. Через 6 месяцев показатели ПСВ у больных обеих групп остались без существенных изменений.
При проведении спирометрии выявлено значимое увеличение ОФВ1 в группе больных, лечившихся Рузамом+ИГКС, исходно Ме=91(81÷101), сразу после лечения – Ме=94(88÷105), р=0,015. В группе плацебо+ИГКС увеличения ОФВ1 не произошло. Спустя 6 месяцев после лечения показатель ОФВ1 существенно не изменился в обеих группах и составлял более 80% от должного значения.
Для оценки эффективности достижения контроля БА применялись два стандартизированных международных вопросника по оценке контроля БА (АСТ и АСQ) с целью определения их взаимной валидности и корреляции. Оценка АСТ-теста – 25 баллов, а ACQ-вопросника – 0 баллов соответствует полному контролю БА. После лечения общий балл АСТ-теста статистически значимо вырос в обеих группах: в группе пациентов, получавших Рузам+ИГКС, до лечения Ме=17(14÷20), после лечения Ме=21(20÷23), р=0,00011, в группе пациентов, получавших плацебо+ИГКС, до лечения Ме=17(13÷20), после лечения Ме=20(16÷22,5), р=0,00037. Через 6 месяцев сохранялась тенденция (р=0,1) к повышению суммарного балла АСТ-теста в группе пациентов, получавших Рузам+ИГКС. В группе плацебо+ИГКС количество баллов АСТ-теста осталось без динамики (р=0,32).
Сразу после лечения общий балл АСQ-вопросника статистически значимо снизился как в группе Рузам+ИГКС (до лечения Ме=8(8÷10), после лечения Ме=4(2÷7), р=0,000026), так и в группе плацебо+ИГКС (до лечения Ме=7(5÷12), после лечения Ме=6(3÷8), р=0,0035 ). Через 6 месяцев сохранялась тенденция (р=0,41) к снижению суммарного балла АСQ-теста в группе пациентов, получавших Рузам+ИГКС. В группе плацебо+ИГКС отмечалась тенденция к повышению количества баллов по АСQ-вопроснику (р=0,57; рис. 3).
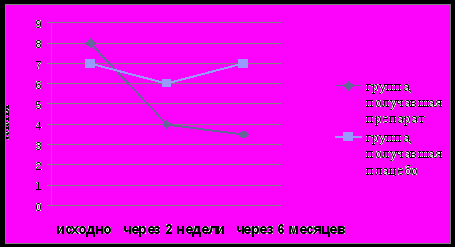
Рис. 3. Изменение уровня контроля БА по вопроснику АСQ.
Повышение уровня контроля заболевания по АСТ-тесту сопровождалось снижением суммарного балла АСQ-вопросника на фоне терапии Рузам+ИГКС, что подтверждается наличием тесной обратной корреляционной зависимости между общим баллом вопросника AСQ и результатами ACT-теста. Данная связь прослеживается на всех этапах наблюдения, что свидетельствует о равнозначности применяемых вопросников и высокой степени их взаимной корреляции (исходно r=-0,69, р=0,003, через 2 недели лечения r=-0,66, р=0,005, через 6 месяцев r=-0,68, р=0,007).
В качестве критерия эффективности проведенной терапии Рузам+ИГКС был проанализирован объем базисной терапии ИГКС в обеих группах через 6 месяцев после активной терапии. В группе больных, получивших ингаляционную терапию Рузам+ИГКС, произошло значимое снижение общей дозы ИГКС с 661(290,4) до 465(413,4) мкг/сут (р=0,001) в пересчете на Бекламетазон дипропионат (БДП), что свидетельствует о достигнутом стабильном контроле БА у этих пациентов. У 11 больных этой группы, в результате достижения стойкого контроля БА, ИГКС были вообще отменены (согласно рекомендациям GINA 2009). У больных группы плацебо+ИГКС, напротив, объем общей суточной дозы ИГКС был значимо увеличен с 756(474,3) до 863(502,1) мкг/сут (р=0,028) в пересчете на БДП, что говорит о нестабильном течении БА у пациентов этой группы.
Для изучения влияния препарата Рузам на частоту ОРВИ была проведена оценка этого показателя за год до лечения и в течение года после лечения. Как видно из рис. 4, у пациентов, получавших Рузам+ИГКС, значимо снизилась частота ОРВИ (до лечения М=3,9(1,8) на одного пациента в год, в течение 1 года после лечения М=1,96(0,94), р=0,00034). У этих же пациентов отмечается значимое повышение содержания ИФН-γ в индуцированной мокроте (до лечения – 55(28,5÷84,5)пг/мл, после лечения – 268(128÷385)пг/мл, р=0,011; табл. 2). В группе плацебо+ИГКС частота заболеваний ОРВИ не изменилась (до лечения М=2,3(1,7) в год, в течение 1 года после лечения М=2,15(1,19), р=0,44; рис. 4). Содержание ИФН-γ оставалось без значимого изменения (табл. 2). Через 6 месяцев после лечения в индуцированной мокроте пациентов, получавших Рузам+ИГКС произошло значимое снижение содержания ИФН-γ. В группе плацебо+ИГКС – без динамики.
Таблица 2. Динамика изменений показателей ИФН-γ в индуцированной мокроте больных БА, получавших терапию Рузам+ИГКС vs плацебо+ИГКС.
| Показатель Ме[25%-75%] | Пациенты, получавшие Рузам+ИГКС | Пациенты, получавшие плацебо+ИГКС | |
| Показатели ИФН-γ в индуцированномокроте (пг/мл) | Исходно | 55(28,5÷84,5) | 64(29,0÷88,4) |
| Через 2 недели | 268(128÷385) | 160(117÷268) | |
| Через 6 месяцев | 88(30÷107) | 80(43÷106) | |
| Р1-2; Р2-3 | Р=0,01; р=0,012 | р=0,09; р=0,2 | |
Р1-2 – по сравнению с исходными данными через 2 недели лечения
Р2-3– по сравнению с данными сразу после лечения и через 6 месяцев
Р<0,05 – статистически значимо
Результаты многочисленных исследований (Nicholson et al, 1994; Johnnston et al, 1995; Busse, 1994) свидетельствуют, что ОРВИ являются наиболее частой причиной обострений БА. В частности, у взрослых до 65% обострений БА вызываются ОРВИ. Поэтому снижение частоты ОРВИ является важным компонентом достижения стабильного контроля БА и предотвращения обострений.
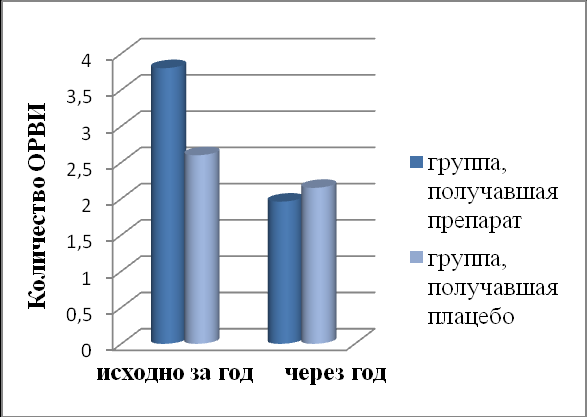
























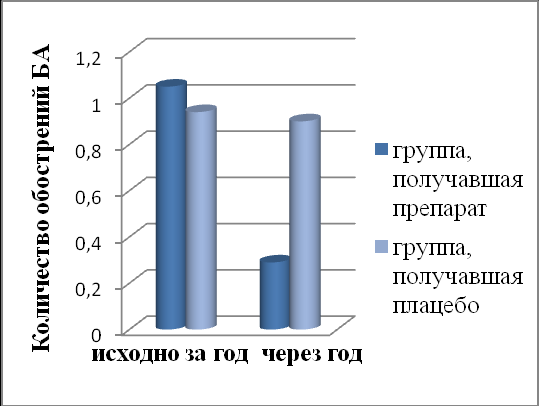
Рис. 4. Изменения частоты ОРВИ и обострений БА в результате терапии Рузам+ИГКС vs плацебо+ИГКС.
У пациентов, получавших Рузам+ИГКС, до лечения среднее количество обострений БА на пациента в год составляло 1,05(0,35), через 1 год после лечения – 0,29(0,46), р=0,000027: у 8 пациентов – среднетяжелые обострения, у одного пациента отмечено тяжелое обострение, которое требовало стационарного лечения. В группе плацебо+ИГКС частота обострений БА не изменилась – до лечения среднее количество обострений на пациента составляло 0,94(0,48) в год, через 1 год – 0,9(0,46), р=0,79: у 26 пациентов – среднетяжелые обострения, у троих пациентов отмечены тяжелые обострения, которые требовали стационарного лечения (Рис. 4). Было установлено, что у пациентов, получавших терапию Рузам+ИГКС сокращается риск развития обострения БА в 23 раза (ОШ=23 (ДИ=9,4-35,6)) (в подгруппе пациентов с легкой персистирующей БА в 105 раз (ОШ=105 (ДИ=32-226), в подгруппе пациентов со среднетяжелой БА – в 4,1 раза (ОШ=4,1 (ДИ=2,3-14,7).
Для оценки противовоспалительного эффекта препарата Рузам проводилось изучение БГР в качестве неинвазивного маркера воспаления у всех пациентов (n=63). После лечения отмечалось значимое повышение порога БГР (р=0,01) у пациентов, получавших Рузам+ИГКС, что свидетельствует о влиянии препарата Рузам на степень метахолин-индуцированной БГР. В группе пациентов, получавших плацебо+ИГКС, повышение порога БГР отмечено не было (р=0,86). Было установлено, что у пациентов, получивших Рузам+ИГКС, повышается вероятность снижения БГР в 2,1 раза по сравнению с группой плацебо+ИГКС (ОШ=2,1 (ДИ=1,2-12,3).
Через 6 месяцев у больных обеих групп отмечено значимое повышение порога БГР, по сравнению с показателями, полученными сразу после лечения (табл. 3). Повышение порога БГР у больных в группе плацебо+ИГКС вероятно объясняется тем, что за 6 месяцев наблюдения отмечалось увеличение общего объема базисной терапии ИГКС, тогда как в группе пациентов, получивших Рузам+ИГКС данная положительная динамика была отмечена на фоне снижения общего объема базисной терапии ИГКС.
Таблица 3. Изменения результатов провокационного бронхоконстрикторного теста с раствором метахолина на фоне терапии Рузам+ИГКС vs плацебо+ИГКС.
| Показатель Ме[25%-75%] | Пациенты, получавшие Рузам+ИГКС | Пациенты, получавшие плацебо+ИГКС | |
| Показатели БГР (мг/мл) | Исходно | 1,0(0,25÷4,0) | 2,0(0,18÷4,0) |
| Через 2 недели | 1,0(0,5÷2,0) | 2,0(0,5÷4,0) | |
| Через 6 месяцев | 2,0(1,0÷8,0) | 4,0(2,0÷8,0) | |
| Р1-2; Р2-3 | р=0,01; р=0,045 | р=0,86; р=0,005 | |
Р1-2 – по сравнению с исходными данными через 2 недели лечения
Р2-3– по сравнению с данными сразу после лечения и через 6 месяцев
Р<0,05 – статистически значимо
Еще одним неинвазивным маркером воспаления, который оценивался в исследовании, был NОex, который также определялся у всех пациентов. На момент включения в исследование уровень NОex у больных обеих групп был выше значения NOex у здоровых лиц (NOex у здоровых взрослых не превышает 25 ррb), что является показателем неконтролируемого течения воспаления у исследуемой группы больных. После лечения Рузам+ИГКС уровень NОex у больных значимо снизился (исходно Ме=25(19÷61), сразу после лечения Ме=24(15÷58), р=0,03). В группе пациентов, получавших плацебо+ИГКС, отмечалась лишь тенденция к снижению уровня NОex (р=0,48). Через 6 месяцев после лечения уровень NОex у пациентов обеих групп не изменился и остался выше нормальных значений.
При корреляционном анализе выявлена статистически значимая обратная корреляция между показателями NОex и степенью БГР (r=-0,32, р=0,0094), что свидетельствует о тесной взаимосвязи данных маркеров воспаления, которые должны учитываться для определения уровня контроля атопической БА.
Для оценки противовоспалительного эффекта препарата Рузам применялись инвазивные методы определения маркеров воспаления. Уровень эозинофилов в периферической крови у пациентов, получавших Рузам+ИГКС, несколько (р=0,02) снизился: до лечения он составил 5(4÷6)%, после лечения – 4,5(3÷6)%. В группе плацебо+ИГКС – без выраженной динамики: до лечения – 4(3÷5)%, после лечения – 4(3÷5)%, (р=0,17).
Уровень эозинофилов в индуцированной мокроте у пациентов, получавших Рузам+ИГКС, значимо (р=0,007) снизился: до лечения он составил 9(8÷9)% после лечения – 7(6÷7)%. В группе больных, получавших плацебо+ИГКС, уровень эозинофилов оставался без существенных изменений (р=0,54). Через 6 месяцев после лечения уровень эозинофилов в мокроте больных обеих групп без существенных изменений.
ЕСР, являющийся признанным маркером аллергического воспаления, значимо снизился после лечения Рузам+ИГКС. Как видно из рис. 5, сразу после лечения в сыворотке крови произошло снижение ЕСР с 19(2,25÷33,3)мкг/л до 9(6÷12,7)мкг/л, р=0,04, в индуцированной мокроте – с 598(394÷1261)мкг/л до 352(255÷708)мкг/л, р=0,02. В группе больных, получавших плацебо+ИГКС, показатели ЕСР оставались без существенных изменений. Определение этого маркера через 6 месяцев выявило его дальнейшее значимое снижение только в группе больных, получивших лечение Рузам+ИГКС (в сыворотке крови Ме=1,9(1,3÷5,8)мкг/л, р=0,037, в индуцированной мокроте Ме=216(168÷394)мкг/л, р=0,014). В группе плацебо+ИГКС снижение данного показателя оказалось незначимым как в сыворотке крови, так и в индуцированной мокроте (рис.5).
С



 нижение ЕСР в сыворотке крови и индуцированной мокроте через 6 месяцев после активного лечения свидетельствует о пролонгированном противовоспалительном эффекте препарата Рузам в комбинации с ИГКС.
нижение ЕСР в сыворотке крови и индуцированной мокроте через 6 месяцев после активного лечения свидетельствует о пролонгированном противовоспалительном эффекте препарата Рузам в комбинации с ИГКС.




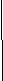



























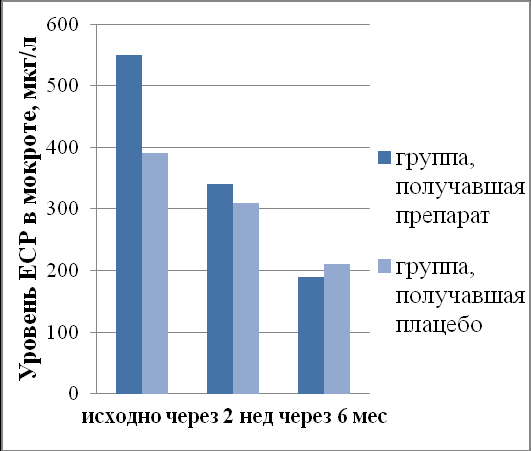
Рис. 5. Динамика ЕСР в сыворотке крови и индуцированной мокроте больных на фоне терапии Рузам+ИГКС vs плацебо+ИГКС.
При корреляционном анализе была выявлена значимая корреляционная связь между показателями ЕСР в крови и ЕСР в индуцированной мокроте (r=0,9; р=0,03).
Многими исследованиями наряду с эозинофильным воспалением было показано наличие нейтрофильного компонента в случае более тяжелого течения БА. Влияние терапии Рузам+ИГКС/плацебо+ИГКС на активность НЭ изучалось у 15 пациентов, распределенных в терапевтические группы, получавшие ингаляционную форму препарата Рузам+ИГКС (n=10) или плацебо+ИГКС (n=5). Пациенты для исследования были отобраны методом случайной выборки. Из 10 пациентов, получавших Рузам+ИГКС, у 6 БА имела среднетяжелое течение, у 4 – легкое течение. В группе плацебо+ИГКС у всех 5 пациентов БА имела среднетяжелое течение.
У всех пациентов исходно, сразу после лечения и через 6 месяцев после лечения определяли уровень активности НЭ и α1-AT в сыворотке крови. Исходный уровень НЭ у пациентов, получавших Рузам+ИГКС, составил 435(348÷491,2)мЕ/мл, у получавших плацебо – 485(478÷568)мЕ/мл и значимо (р<0.05) превышал границы нормальных значений данного показателя у здоровых доноров (200±34 мE/мл). Это может косвенно свидетельствовать о том, что при атопической БА наряду с эозинофильным воспалением выявляется нейтрофильный компонент, характеризующийся повышением активности НЭ в сыворотке крови больных с легким персистирующим (4 пациента) и среднетяжелым течением заболевания (11 пациентов). Нами ранее определялся уровень активности НЭ у пациентов легкой неконтролируемой БА, которые не получали ИГКС, а использовали только симптоматическую терапию в режиме по «требованию». Исходный уровень НЭ также превышал границы нормальных значений и составлял 575,3±260 мЕ/мл (Ненашева Н.М., Терехов Д.В. 2010). Проведенный на фоне терапии анализ уровня НЭ в сыворотке крови показал, что у пациентов обеих групп не наблюдалось снижения НЭ (р=0,7 и р=0,68 соответственно). Определение этого маркера через 6 месяцев выявило его незначимое снижение в обеих группах, что может свидетельствовать об отсутствии влияния препарата Рузам, равно как и фармакотерапии низкими и средними дозами ИГКС на активность НЭ в сыворотке крови.
У всех включенных в исследование пациентов не было выявлено недостаточности α1-АТ, и средний уровень активности составил 38,9 (43,7÷51,4)мЕ/мл. Данный показатель не отличался ни в одной из выделенных групп пациентов. Лечение Рузам+ИГКС/плацебо+ИГКС не привело к значимым изменениям α1-АТ. Через 6 месяцев также не было выявлено значимых изменений данного показателя в обеих группах.
В предыдущих исследованиях по изучению эффективности инъекционной и интраназальной форм препарата Рузам в работах Е.С. Пыжевой, Н.А. (1997), Колгановой (2001), Г.Л. Осиповой, (2002), Е.В. Шуваловой (2004), Т.Н. Антоновой (2009) было выявлено снижение IgE в сыворотке крови на фоне лечения Рузамом. Мы также изучили влияние ингаляционной формы Рузама на уровень IgE. Показатели IgE в сыворотке крови у больных, включенных в исследование, были значительно выше нормального уровня. В группе пациентов, получавших Рузам+ИГКС, исходно уровень IgE был 510(158÷783) МЕ, в группе пациентов, получавших плацебо – 405(121÷780) МЕ. Сразу после лечения анализ уровня IgE в сыворотке крови показал, что у пациентов обеих групп, наблюдалось незначимое снижение IgЕ (в группе Рузам+ИГКС Ме=482(260÷676), р=0,15, в группе плацебо+ИГКС Ме=382(96÷784), р=0,4). Через 6 месяцев после активной терапии нами не было выявлено каких-либо значимых изменений этого показателя у больных обеих групп.
С целью определения длительности эффекта ингаляционной терапии Рузам+ИГКС у пациентов с неконтролируемым течением БА были оценены клинико-функциональные показатели и маркеры воспаления у больных через 6 месяцев после лечения. Результаты, приведенные выше, позволяют заключить о наличии пролонгированного эффекта ингаляционной формы препарата Рузам, проявляющегося в сохранении достигнутого клинико-функционального контроля, значимого снижения объема базисной терапии ИГКС, а также снижения частоты обострений БА и ОРВИ. Анализ лабораторных показателей выявил дальнейшее снижение ЕСР в сыворотке крови и индуцированной мокроте больных.
Все пациенты, получавшие ингаляционную терапию Рузам+ИГКС, отметили хорошую его переносимость, однако у двоих пациентов (6%) отмечался сухой кашель на фоне ингаляций Рузама, который проходил самостоятельно через 20-30 минут и не требовал отмены препарата. В группе плацебо+ИГКС нежелательных явлений отмечено не было. В клинических и биохимических анализах крови, общем анализе мочи, данных ЭКГ изменений не наблюдалось, что свидетельствует о безопасности использования данного препарата по предложенной схеме и его хорошей переносимости.
ВЫВОДЫ:
1. Препарат Рузам в форме ингаляций в комбинации с ИГКС по сравнению с плацебо+ИГКС является эффективным видом терапии неконтролируемой атопической БА персистирующего легкого и среднетяжелого течения, что проявилось в значимом снижении потребности в симптоматической терапии бронходилататорами (р=0,01), повышении функциональных показателей легких: утренней ПСВ (р=0,042) и ОФВ1 (р=0,015), а также достижении более высокого и стабильного уровня контроля БА (р=0,00011).
2. Комбинированная терапия Рузамом и ИГКС по сравнению с плацебо+ИГКС обладает влиянием на эозинофильное воспаление, проявляющимся значимым снижением числа эозинофилов (р=0,02) и ЕСР (р=0,04) в сыворотке крови.
3. Ингаляционная терапия Рузамом в комбинации с ИГКС по сравнению с плацебо+ИГКС оказывает топический противовоспалительный эффект, проявляющийся значимым снижением числа эозинофилов (р=0,007), ЕСР (р=0,02), повышением ИФН-γ (р=0,013) в индуцированной мокроте, а также значимым снижением неинвазивных маркеров воспаления в дыхательных путях: NОex (р=0,03), БГР (р=0,01).
4. Комбинированная терапия Рузамом (ингаляционная форма) и ИГКС обладает пролонгированным эффектом на протяжении 6 месяцев, проявившимся уменьшением частоты ОРВИ у пролеченных пациентов в 2,5 раза и связанных с ними обострений БА в 3 раза, что обусловлено противовоспалительным эффектом Рузама.
5. Вопросники по оценке контроля БА: АСТ-тест и AСQ являются равнозначными, вследствие их высокой взаимной корреляции ( r=-0,69, p=0,003) и оба могут успешно применяться в клинической практике для оценки контроля БА, так как достоверно коррелируют с клинико-функциональными параметрами контроля БА и маркерами воспаления.
6. Отсутствие серьезных побочных эффектов при лечении ингаляционной формой Рузама в комбинации с ИГКС продемонстрировало безопасность применения препарата, назначаемого в дозе 2,5 мл 1 раз в день в течение 14 дней, у больных неконтролируемой атопической БА легкого и среднетяжелого персистирующего течения.
Список работ, опубликованных по теме диссертации.
Ненашева Н.М., Терехов Д.В. Возможность достижения контроля атопической бронхиальной астмы с помощью антилейкотриенового препарата монтелукаст// Сборник трудов национальной конференции «Аллергология и клиническая иммунология – практическому здравоохранению» Москва. - 2011 – С. 129-130.
- Terekhov D., Nenasheva N. The control of atopic bronchial asthma by using montelukast // Allergy. – Volume 65 (Suppl.92) XXIX Congress of the European Academy of Allergy Clinical Immunology Abstract Book. – London. – 2010 – 5-9 June. –p.150. – abstr.364
- Терехов Д.В. Эффективность неспецифической ингаляционной иммунотерапии Рузамом при бронхиальной астме// Труды межрегионального форума «Актуальные вопросы аллергологии и иммунологии – междисциплинарные проблемы» Санкт-Петербург – 27-30 сентября – С. 289-290.
- Терехов Д.В. Эффективность неспецифической ингаляционной иммунотерапии Рузамом при бронхиальной астме//Сборник материалов конференции молодых ученых, посвященных 80-летию РМАПО: Москва. – 2010г. – С. 128-130
- Терехов Д.В. Эффективность неспецифической ингаляционной иммунотерапии Рузамом при бронхиальной астме// Сборник материалов конференции молодых ученых РМАПО: Москва. – 2011г. – С. 44-46 (доклад).
- ТереховД.В., Ненашева Н.М. Эффективность неспецифической ингаляционной иммунотерапии Рузамом при атопической бронхиальной астме // Российский Аллергологический журнал. – 2011. –№ 4. – С. 49-54.
- Терехов Д.В., Ненашева Н.М. Отсроченные результаты неспецифической ингаляционной иммунотерапии Рузамом при атопической бронхиальной астме // Российский Медицинский журнал. – 2011. –№ 6. – С. 16-20.
- Терехов Д.В., Ненашева Н.М. Эффективность неспецифической ингаляционной иммунотерапии Рузамом при бронхиальной астме// Сборник материалов XI Международного конгресса: «Современные проблемы иммунологии, аллергологии и иммунофармакологии» Москва. – 2011г. – 5-8 июля. – С. 378-380.
Список сокращений
- БА – бронхиальная астма
- БГР – бронхиальная гиперреактивность
- ИГКС – ингаляционные глюкокортикостероиды
- ИФН-γ – интерферон-гамма
- ОФВ1 – объем форсированного выдоха за 1 секунду
- ПСВ – пиковая скорость выдоха
- ФВД – функция внешнего дыхания
- АСТ – тест по контролю астмы
- AСQ – опросник по контролю астмы
- ЕСР – эозинофильный катионный протеин
- NOex – оксид азота в выдыхаемом воздухе
- IgE – иммуноглобулин E
