Роль нейронов медиобазального гипоталамуса, синтезирующих дофамин, в центральной регуляции репродуктивной функции у овец и крыс 03. 00. 13 физиология человека и животных
| Вид материала | Автореферат |
- «Физиология человека и животных», 406.55kb.
- Роль β-адренорецепторов в регуляции водно-солевого обмена у белых крыс, 748.01kb.
- Рабочая программа дисциплины «физиология» (Физиология животных), 288kb.
- Задачи курса: изучение механизмов функционирования отдельных нейронов, 90.68kb.
- Морфофункциональное состояние и свободнорадикальный гомеостаз щитовидной железы и надпочечников, 340.16kb.
- Хаматова Резеда Минекасимовна типологические особенности кровообращения у детей 8-16, 1063.36kb.
- Всеместная трансформация среды, высокая этологическая пластичность и социализация, 87.64kb.
- Роль индивидуальных психофизиологических особенностей студентов в адаптации к умственной, 674.31kb.
- Реакция гемопоэза на физическое воздействие и биологическая роль интерлейкина, 143.2kb.
- Оглы биологические основы разработки биотехнических методов интенсификации репродуктивной, 577.44kb.
РОССИЙСКАЯ АКАДЕМИЯ НАУК
Институт биологии развития им. Н. К. Кольцова
На правах рукописи
ЗИЯЗЕТДИНОВА Гузель Зуфаковна
Роль нейронов медиобазального гипоталамуса, синтезирующих дофамин, в центральной регуляции репродуктивной функции
у овец и крыс
03.00.13 - физиология человека и животных
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва 2007
Работа выполнена в лаборатории гормональных регуляций
Института биологии развития им. Н. К. Кольцова РАН (г. Москва)
и в лаборатории контроля овуляции Национального института сельскохозяйственных исследований (г. Нузийи, Франция)
Научный руководитель:
академик Михаил Вениаминович Угрюмов
Официальные оппоненты:
доктор биологических наук, профессор
Борис Николаевич Манухин
доктор медицинских наук, профессор
Василий Николаевич Бабичев
Ведущая организация:
Научно-исследовательский институт фармакологии им. В. В. Закусова РАМН
Защита состоится « 7 » ноября 2007 г. В 1400 часов на заседании Диссертационного совета Д002.238.01 при Институте биологии развития
им. Н. К. Кольцова РАН
по адресу: 119334 Москва, ул. Вавилова д. 26.
Факс: (499) 135-80-12
E-mail: volina46@bk.ru
С диссертацией можно ознакомиться в библиотеке Института биологии развития им. Н.К. Кольцова РАН (119334 Москва, ул. Вавилова д.26.)
Автореферат разослан «___» октября 2007г.
Ученый секретарь
Диссертационного совета,
кандидат биологических наук Е.В. Волина
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Одной из важнейших функций организма является репродуктивная, которая находится под нервным и гуморальным контролем. Kлючевым звеном центральной регуляции репродуктивной функции у взрослых животных являются нейроны переднего мозга, продуцирующие гонадотропин-рилизинг гормон (ГРГ). Эти нейроны проецируют свои окончания в срединное возвышение и выделяют ГРГ в гипофизарную портальную систему циркуляции, стимулируя секрецию лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов гипофиза (Labrie, 1990; Hoffman et al., 1992). В свою очередь эти гормоны действуют на половые железы, контролируя овуляцию, спермообразование и стимулируя продукцию половых гормонов (рис. 1).
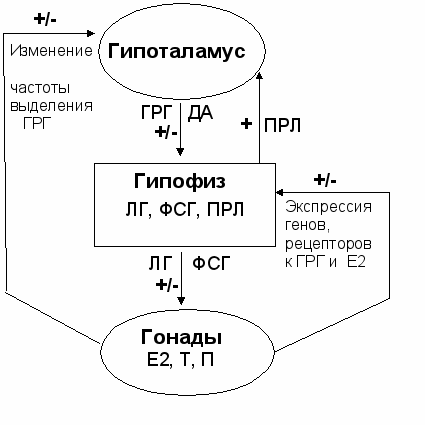
Рис.1. Схема нейроэндокринной регуляции репродуктивной функции (Shupnik, 1996).
Е2 – эстрадиол, П – прогестерон, Т – тестостерон, ГРГ-гонадотропин-рилизинг гормон, ЛГ- лютеинизирующий гормон, ФСГ- фолликулостимулирующий гормон, ПРЛ- пролактин. (+) – стимулирующий эффект; (-) – ингибирующий эффект.
Регуляция по принципу отрицательной обратной связи осуществляется тремя видами половых гормонов: эстрогенами, прогестероном и андрогенами, а положительной обратной связи – только эстрадиолом (Е2), который вызывает массированный выброс гонадотропинов у самок (Бабичев 1984; Karsch, 1984; Gharib et al., 1990). Механизм действия Е2 на ГРГ нейроны у млекопитающих остается до конца не выясненным.
Увеличение концентрации Е2 в конце фолликулярной фазы вызывает у овцы преовуляторный пик ГРГ и ЛГ, но это действие Е2 не прямое, а по всей вероятности опосредованно через нейроны медиобазального гипоталамуса. Введение имплантанта с Е2 в вентромедиальный гипоталамус увеличивает секрецию ГРГ (Сaraty et al., 1998), в то время, как большинство нейронов ГРГ локализовано в преоптической области гипоталамуса (Сaldani et al., 1988). Исходя из этого было высказано предположение, что половые стероиды могут действовать на ГРГ-нейроны опосредованно через вставочные нейроны, расположенные в аркуатном ядре и в стволе мозга у млекопитающих, в частности у крыс и овец (Нeritage et al., 1980; Merchenthaler et al., 1991; Howard et al., 1997; Сaraty et al., 1998; Goubillon et al., 1999; Pompolo et al., 2001).
Внутримышечные инъекции Е2 овариэктомированным овцам приводили к повышению концентрации дофамина (ДА) (Fabre-Nys et al., 1994) и 3,4-дигидроксифенилуксусной кислоты (ДОФУК) в дорсомедиальной части гипоталамуса, что совпадало с появлением пика ЛГ (Anderson et al., 2001). Предполагается, что это влияние Е2 на ГРГ-нейроны осуществляется через ДА-продуцирующие нейроны, что предстояло проверить в данной работе.
ДА-продуцирующая система медиобазального гипоталамуса вовлечена в нейроэндокринную регуляцию репродуктивной функции, влияя не только на выделение ГРГ в срединном возвышении, но и на секрецию пролактина в передней доле гипофиза (Everitt et al., 1992). Гибель ДА-ергических нейронов при патологии приводит к серьезным нарушениям функций мозга и организма в целом. В частности, дегенерация ДА-ергических нейронов гипоталамуса приводит к развитию гиперпролактинемии (Wuttke, 1977), которая по данным единственного исследования со временем компенсируется (Fenske et al., 1976), однако механизмы этого явления остаются не выясненными. Изучение механизмов адаптации при функциональной недостаточности ДА-ергической системы является одним из важнейших вопросов, связанных с изучением патогенеза, профилактики и прогнозирования развития заболеваний. Поэтому в данной работе предстояло выяснить, возможна ли компенсация дефицита ДА в аркуатном ядре при дегенерации ДА-ергических нейронов и каковы механизмы этого явления.
Цель и задачи исследования.
Целью настоящей работы явилось изучение роли нейронов аркуатного ядра, синтезирующих ДА, в центральной регуляции репродуктивной функции у овец и крыс.
Для достижения данной цели были поставлены следующие задачи:
1. Оценка влияния эстрогенов на нейроны аркуатного ядра, содержащие ферменты синтеза ДА и вовлеченные в регуляцию репродуктивной функции у овец.
2. Оценка экспрессии рецепторов к Е2 в ДА-продуцирующих нейронах аркуатного ядра, вовлеченных в регуляцию репродуктивной функции у овец.
3. Экспериментальное моделирование функциональной недостаточности ДА-ергической системы медиобазального гипоталамуса, ответственной за регуляцию секреции пролактина у крыс.
4. Оценка секреции пролактина в условиях дегенерации ДА-ергических нейронов аркуатного ядра у крыс.
5. Анализ компенсаторных механизмов, включающихся при функциональной недостаточности ДА-ергических нейронов аркуатного ядра у крыс.
Научная новизна работы.
- Впервые показано, что регуляторное влияние Е2 на ГРГ нейроны у овец опосредованно вставочными нейронами аркуатного ядра содержащими тирозингидроксилазу.
- Впервые показано, что дегенерация ДА-ергических нейронов аркуатного ядра и возникающий при этом дефицит ДА со временем сопровождается усилением синтеза ДА и нормализацией секреции пролактина.
Научная и практическая значимость работы.
Полученные данные способствуют углублению существующих представлений о роли гипоталамо-гипофизарного звена в нейроэндокринной регуляции репродуктивной функции. В данной работе впервые приведены доказательства компенсаторного синтеза ДА в условиях функциональной недостаточности ДА-ергических нейронов аркуатного ядра. Результаты выполненной работы могут найти практическое применение в экспериментальной нейроэндокринологии и медицине. Они позволяют по-новому оценить патогенез ряда нейроэндокринных заболеваний, связанных с недостаточностью моноаминергической системы аркуатного ядра, в основе которых лежит дегенерация ДА-ергических нейронов, (синдром гиперпролактинемии), что влечет за собой аменорею, галакторею, импотенцию и гинекомастию (Марри и др. 1993). Компенсаторное усиление синтеза ДА скорее всего происходит сохранившими биферментными нейронами аркуатного ядра, содержащими оба фермента синтеза ДА – тирозингидроксилазу (ТГ) и декарбоксилазу ароматических L-аминокислот (ДАА), либо моноферментными нейронами аркуатного ядра, содержащими один из ферментов синтеза ДА – ТГ или ДАА.
Изучение механизмов регуляции репродуктивной функции у овец, кроме теоретической значимости имеет большое практическое значение для повышения воспроизводства сельскохозяйственных животных.
Полученные данные используются для преподавания нейроэндокринологии и нейробиологии на старших курсах естественнонаучных и медицинских факультетов парижского Университета им. П. и М. Кюри, Университета г. Тур, а также Московской медицинской академии им. И. М. Сеченова и ряда других российских и зарубежных ВУЗов.
Работа выполнена по плану научно-исследовательских работ лаборатории гормональных регуляций Института биологии развития им. Н. К. Кольцова РАН и в рамках программ проектов: Российского фонда фундаментальных исследований (грант № 05-04-48829), Российского гуманитарного научного фонда (грант № 06-06-00010А), Программа президента по поддержке молодых российских ученых и ведущих научных школ (НШ-6352.2006.4), Программа фундаментальных исследований президиума РАН "Фундаментальные науки - медицине".
Апробация работы: Результаты диссертационной работы были представлены и обсуждены на международных симпозиумах: «32e Colloque de la SNE » La Grande Motte (France) 2004; «Sixth International Congress of Neuroendocrinology», Pittsburg, Pennsylvania U.S.A. 2006. ХХ съезд физиологического общества им. И. П. Павлова, Москва, 2007; на совместных коллоквиумах и семинарах: лаборатории гормональных регуляций ИБР им. Н. К. Кольцова РАН и лаборатории нейрогистологии им Б. И. Лаврентьева Института нормальной физиологии им. П. К. Анохина РАМН.
Публикации. По теме диссертации опубликовано 11 работ, из них 2 статьи в рецензируемых журналах и 9 публикаций в сборниках тезисов.
Структура и объем диссертации. Диссертация состоит из введения, обзора литературы, описания материалов и методов исследования, результатов, обсуждения, выводов и списка литературы, включающего ____ источника. Работа изложена на ____ страницах машинописного текста, содержит ____ рисунков, ____ таблиц.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Животные Эксперименты проводили на овцах породы "Иль-де-франс" в возрасте 2 лет в период репродуктивной активности (осень - зима) и на самцах крыс линии Вистар весом 250-300 г.
Экспериметальные модели
1. Овцы после введения эстрадиола. Животных синхронизировали по фазе полового цикла, вводя интравагинально тампоны с прогестероном (CIDRE®; InterAg, Hamilton, Новая Зеландия), а затем производили овариэктомию. После операции, животным вводили подкожно имплантанты с Е2 (по 1cм) в дозе 1.5 пг/мл, затем интравагинально тампоны с прогестероном, что искусственно имитировало лютеиновую фазу полового цикла (рис. 2). Через 10 дней у животных удаляли тампоны с прогестероном и вводили Е2 двумя способами. В первой экспериментальной группе овцам вводили подкожно имплантанты с Е2 - 3 имплантанта по 4 см (20 пг/мл), во второй группе проводили внутримышечную инъекцию Е2 в дозе 50 мкг, а в контрольной вводили 3 имплантанта по 4 см без Е2 (рис. 3). Животных декапитировали через 12 часов после введения Е2.
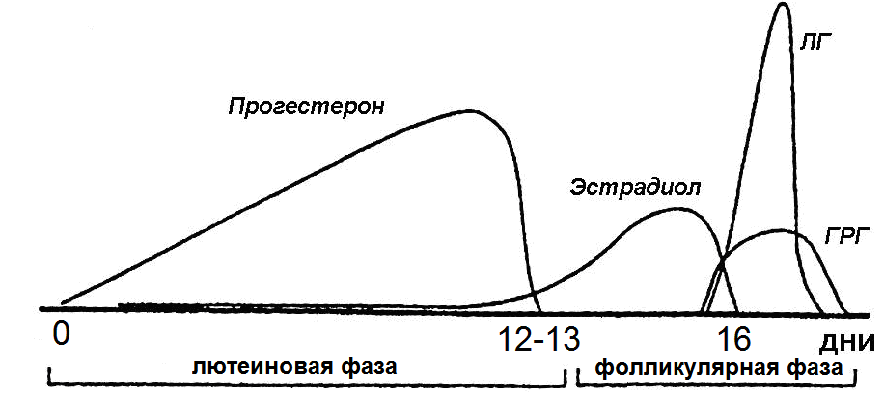
Рис.2. Схематическое изображение секреции половых гормонов у овец с нормальным половым циклом.

через 12 часов
после введения Е2
Рис. 3. Схема эксперимента на овцах после синхронизации и овариэктомии. Обозначения: +П - внутривлагалищное введение тампона с прогестероном; -П - удаление внутривлагалищного тампона с прогестероном; Е2 - эстрадиол.
2. Крысы после введение 6-гидроксидофамина. Все манипуляции с крысами проводили под нембуталовым наркозом (40 мкг/кг). Дегенерацию ДА-ергических нейронов аркуатного ядра вызывали с помощью 6-гидроксидофамина (6-ГДА), специфического нейротоксина. С этой целью животных фиксировали в стереотаксическом аппарате и по стереотаксическим координатам (Paxinos, Watson, 1986) в латеральный желудочек мозга вводили 250 мкг 6-ГДА (Sigma, США), растворенного в 20 мкл 0.9% NaCl и 0.1% аскорбиновой кислоты (стабилизатор-антиоксидант). В контроле 45 животным вводили по 20 мкл 0.9% NaCl и 0.1% аскорбиновой кислоты. Растворы вводили с помощью стеклянной микроканюли со скоростью 5 мкл/мин (Jonsson, 1983). После введения животных содержали 14 и 45 дней в обычных лабораторных условиях при свободном доступе к пище и воде.
Фиксация ткани и приготовление срезов медиобазального гипоталамуса овцы. После декапитации каждую голову овцы перфузировали через сонные артерии 1% NaNО3 на 0.1 М фосфатно-солевом буфере (ФСБ) (рН 7.4) до вымывания крови из сосудов, а затем 4% параформальдегидом на 0.1 М ФСБ (рН 7.4) в течение 15 мин при 4°C. Затем у животных выделяли головной мозг и дофиксировали его в течение 24 часов в 4% параформальдегиде при 4°C. После этого инкубировали в криопротекторе - 15% сахарозе на 0.1 М ФСБ (рН 7.4) с 0.1% азидом натрия при 4°C. Блок нервной ткани, содержащий промежуточный мозг, помещали на столик микротома (Leica, Германия) и делали серийные фронтальные срезы мозга толщиной 40 мкм; затем срезы инкубировали в растворе 0.01 М ФСБ, содержащем 0.3% тритон Х-100 (Sigma, США) и 0.1% азид натрия при 4°C.
Иммуноцитохимическое выявление с-Fos и ТГ в медиобазальном гипоталамусе у овец проводили иммунопероксидазным методом, используя несколько комбинаций первых и вторых антител. Двойное мечение проводили на серийных плавающих срезах, брали каждый 10-й срез гипоталамуса, содержащих аркуатное ядро. Для выявления двух антигенов срезы последовательно инкубировали в антителах к c-Fos (1:30000) и ТГ (1:10000) при помешивании в течение 4 дней при 4°C. Проявляли первый антиген раствором 3,3’-диаминобензидин тетрагидрохлорида (ДАБ, Sigma, США) с никель сульфат аммония [Ni(NH3)SO4], что дает черную окраску, а второй - только раствором ДАБ, что дает коричневую окраску. Наблюдения за пероксидазной реакцией проводили в световом микроскопе (Leica, Германия). Для подсчета нейронов на срезе использовали программный пакет Mercator® (Explora Nova®), который позволяет проводить картографию меченых нейронов для каждого среза автоматическим и полуавтоматическим способом.
Иммунофлюоресцентное выявление αЕ2-рецепторов в ТГ- и ДАА -содержащих нейронах медиобазального гипоталамуса у овец. Срезы инкубировали в 0.01 М растворе ФСБ, содержащем антитела к αЕ2 - рецепторам (1:15) и ТГ (1:10000), ДАА (1:5000) при помешивании в течение 4 дней при 4°C. Затем, инкубировали со вторыми антителами, мечеными, соответственно, Alexafluor 488 и Alexafluor 546. Иммунофлюоресцентную реакцию наблюдали во флюоресцентном микроскопе (Optiphot 2, Nikon, Япония).
Взятие крови и гипофиза у крыс. Для определения пролактина в крови у крыс на 14-ый день после введения 6-ГДА, для контроля эффективности модели, кровь собирали двумя способами:
1) из хвостовой вены в гепаринизированную пробирку (в дальнейшем кровь у этих животных собирали на 45-ый день); 2) из левого желудочка сердца автоматической пипеткой с гепаринизированным наконечником (непосредственно перед декапитацией животных). Таким же способом кровь собирали на 45-ый день после введения 6-ГДА. Сыворотку крови отделяли от сгустка центрифугированием при 3000 об/мин в течение 30 мин при 4 оС. Супернатант хранили при -20 оС до определения ПРЛ.
Гипофизы быстро выделяли из области турецкого седла на холоду, осторожно выделяли переднюю долю гипофиза, взвешивали, замораживали в жидком азоте и хранили до радиоиммунологического или иммуноферментного определения ПРЛ.
Выделение медиобазального гипоталамуса крыс. Крыс декапитировали и выделяли мозг. Мозг располагали вентральной поверхностью вверх и делали два фронтальных разреза: каудальный - сразу за ножкой гипофиза, ростральный – на расстоянии двух третей протяженности от хиазмы до ножки гипофиза. Иссеченную область поворачивали на 90 и вырезали аркуатное ядро, ориентируясь на инфундибулярную бухту третьего желудочка. Для определения концентрации ДА (ex vivo) свежевыделенную ткань гомогенизировали при помощи ультразвукового гомогенизатора (Branson apparatus, 60 W) в 500 мкл 0.1 н HClO4, содержащей 1 нг 3,4-дигидроксибензиламина (ДГБА) - внутренний стандарт - и центрифугировали 20 минут при 15000 об/мин. Супернатант собирали и хранили при температуре -20C до измерения ДА.
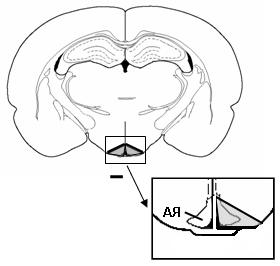
Приготовление срезов аркуатного ядра и их перфузия in vitro. Срезы мозга толщиной 300 мкм получали с помощью вибратома (Lancer Vibratome Series 1000, США) в растворе Кребса-Рингера следующего состава (мМ): NaCl 120, KCl 4.8, CaCl2 2.0, MgSO4 1.2, NaHCO3 25, D-глюкоза 10.1, HEPES 20 (pH 7.4) при температуре 4оС. Далее под контролем бинокулярной лупы вырезали аркуатное ядро (рис. 4 А). Брали по 4 среза аркуатного ядра, начиная с уровня – 2.3 мм от брегмы (Paxinos and Watson, 1982). Левые половины этих срезов брали для определения содержания ДА в ткани до перфузии, а правые половины срезов помещали в термостатируемые (37C) камеры и перфузировали раствором Кребса-Рингера (рис. 4 Б).
А
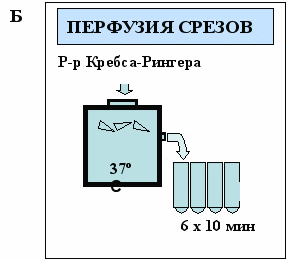
Рис. 4. (А) Схематическое изображение выделяемой области аркуатного ядра – расстояние от брегмы – 3,3 мм. Выделяемые области окрашены серым цветом. АЯ – аркуатное ядро. Масштаб – 1 мм. (Б) Схематическое изображение эксперимента с перфузией срезов аркуатного ядра в термостатируемых камерах при 37°C в растворе Кребса-Рингера.
Постоянную скорость протока раствора через камеры (100 мкл/мин) обеспечивали с помощью перистальтического насоса (Rabbit Raining, Франция). В период стабилизации системы в течение первых 40 минут пробы не собирали, после чего последовательно собирали 6 десятиминутных фракций оттекающего раствора. В каждую фракцию добавляли одну десятую объема 1 н HClO4 до конечной концентрации 0.1 н, а также 1 нг ДГБА в 10 мкл 0.1 н HClO4 и хранили при температуре -20C до измерения ДА. Материал для определения содержания ДА в срезах после перфузии обрабатывали и хранили так же, как интактную ткань.
Высокоэффективная жидкостная хроматография с электрохимической детекцией (ВЭЖХ-ЭД). ДА в ткани и в инкубационной среде определяли с помощью метода ВЭЖХ-ЭД (Amperometric detector LC-4B, Bioanalytical Systems, США) при потенциале +850 мВ. ДА экстрагировали на оксиде алюминия и элюировали 0.2 н HClO4. После 10-минутного центрифугирования при 1000 об/мин ДА определяли в супернатанте, который вводили в инжектор (Raininn, США) с петлей объемом 20 мкл. Разделение производили на 15-сантиметровой колонке с внутренним диаметром 3 мм и наполнителем Нуклеосил С-18.5 мкм (Элсико, Россия). Подвижной фазой служил 0.1 М цитратно-фосфатный буфер, содержащий 0.3 мМ октансульфоната натрия (Sigma), 0.1 мМ ЭДТА (Sigma) и 8 % ацетонитрила (Sigma) (pH 3.1). Скорость потока 800 мкл/мин обеспечивалась насосом Gilson 10SC (Франция).
Определение пролактина у крыс.
Учитывая вариабельность уровня пролактина в плазме крови, а также технические и методические возможности использовали два метода измерения пролактина – радиоиммунологический (РИА) и иммуноферментный анализ (ИФА). В начале исследований мы использовали РИА, но учитывая преимущества ИФА, который относится к поколению современных методов и не требует использования радиоактивной метки, часть экспериментов проводили с использованием ИФА.
Радиоиммунологическое определение пролактина в крови и в ткани гипофиза проводили методом двойных антител в модификации Мартина и др. (Martinat et al., 1979). В качестве стандарта для построения калибровочной кривой в диапазоне 80 пг - 80 нг и гормона для иодирования изотопом йода (125I) (Greenwood, Hunter and Glover, 1963) использовали крысиный пролактин. Специфические антитела к пролактину разводили 1:100000 (19601 P8). Антиген и антитела получали в INRA-Nouzilly (Франция). Чувствительность теста составила 80 пг на пробу.
Иммуноферментное определение пролактина в крови и ткани гипофиза проводили с помощью коммерческого набора «Rat prolactin A05101 SpiBio». Считывание результатов проводили на люминометре-фотометре LM 01A (Immunotech, Чехия) при длине волны 405 нм (диапозон волны от 405 – 414 нм). Чувствительность теста – 0.5 нг/мл. Диапазон определяемых концентраций 0.5 - 50 нг/мл.
Статистический анализ полученных результатов проводили с помощью критерия Стьюдента и непараметрического критерия Maнна – Уитни.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние эстрадиола на ТГ - содержащие нейроны аркуатного ядра у овец. Число TГ-нейронов (группа ДА-содержащих нейронов A12) в аркуатном ядре не менялось через 12 часов после введения Е2 по сравнению с контролем (рис. 5). Возможно, в них меняется синтез, т. к. имеются данные о повышении мРНК ТГ в аркуатном ядре под влиянием Е2 у овариэктомированных крыс (Morrell et al., 1989; Arbogast and Voogt, 1993; Arbogast et al., 1999), у обезьян (Kohama and Bethea, 1995), а также у овец в период эструса (вне зависимости от длины дня) (Вeccavin et al., 1998). Кроме того, известно, что у овец экспрессия ТГ может регулироваться разными факторами: уровень мРНК ТГ в аркуатном ядре контролируется Е2, а ферментативная активность ТГ в срединном возвышении меняется в зависимости от фотопериода (Viguie et al., 1996; Вeccavin et al., 1998). Ранее было показано, что внутримышечные инъекции Е2 овариэктомированным овцам приводили к повышению концентрации ДА (Fabre-Nys et al., 1994) и ДОФУК в дорсомедиальной части гипоталамуса, что совпадало с появлением пика ЛГ (Anderson et al., 2001).

Рис. 5. Количество ТГ–иммунопозитивных нейронов на срез аркуатного ядра. Брали каждый 20-й срез в ростро-каудальном направлении, у овец через 12 часов после внутримышечной инъекции эстрадиола (+Е2), а также подкожного введения имплантанта с эстрадиолом (+Е2) и без эстрадиола (-Е2). Количество животных в каждой группе n=5. M±SEM.
На следующем этапе нашей работы мы решили посмотреть, происходит ли активация ТГ нейронов в ответ на введение Е2. В качестве нейроанатомического маркера активации нейронов аркуатного ядра в ответ на введение Е2 мы использовали с-Fos (рис. 6). с-Fos - это проонкоген, участвующий в регуляции транскрипции. Его роль заключается в том, что он является звеном в системе передачи межклеточных сигналов, к «транскрипционной машине», в результате чего в ответ на такой сигнал происходят изменения в экспрессии специфических генов-мишеней (Сurran and Morgan, 1987; Curran et al., 1988).
Мы обнаружили увеличение числа c-fos-содержащих нейронов у животных через 12 часов после внутримышечной инъекции Е2 по сравнению с животными (рис. 6), которым вводили имплантант с Е2 и без Е2, что согласуется с ранее полученными результатами на овцах (Moenter et al., 1993; Clarke et al., 2001), на крысах (Hoffman et al., 1990; Lee et al., 1990), на хомяках (Berriman et al., 1992). Кроме того, число нейронов, содержащих оба маркера - c-Fos/TГ в аркуатном ядре (рис. 7) также было выше после инъекции Е2 по сравнению с контрольной группой и группой получившей имплантант с Е2.
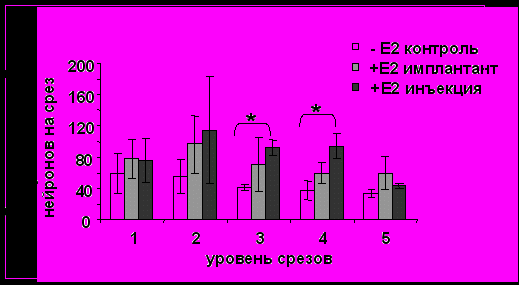
Рис. 6. Количество с-Fos–иммунопозитивных нейронов на срез аркуатного ядра. Брали каждый 20-й срез в ростро-каудальном направлении, у овец через 12 часов после внутримышечной инъекции эстрадиола (+Е2), а также подкожного введения имплантанта с эстрадиолом (+Е2) и без эстрадиола (-Е2). Количество животных в каждой группе n=5. M±SEM. * - между опытной и контрольной группами (р < 0.05).
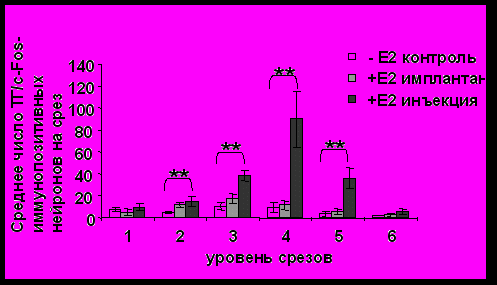
Рис. 7. Количество с-Fos/ТГ–иммунопозитивных нейронов на сериийных срезах аркуатного ядра. Брали каждый 20-й срез в ростро-каудальном направлении, у овец через 12 часов после внутримышечной инъекции эстрадиола (+Е2), а также подкожного введения имплантанта с эстрадиолом (+Е2) и без эстрадиола (-Е2). Количество животных в каждой группе n=5. M±SEM. ** - между опытными и контрольной группами (р < 0.05).
Интересно отметить, что уже через 1 час после инъекции Е2 число c-fos/ТГ–иммунореактивных нейронов увеличивалось на 4% (Clarke et al., 2001), что, по-видимому, свидетельствует о начале активации ДА-продуцирующих нейронов этой области. Нами продемонстрировано, что внутримышечная инъекция Е2 овариэктомированным овцам сопровождается активацией экспрессии генов раннего действия (c-Fos) в ТГ-содержащих нейронах аркуатного ядра.
Таким образом, наши результаты в совокупности с ранее полученными другими авторами свидетельствует об участии ДА-ергических нейронов в качестве посредников в регуляции Е2 репродуктивной функции.
Экспрессия αЕ2 рецепторов на нейронах, содержащих ферменты синтеза ДА. В нашей работе мы не обнаружили αЕ2 рецепторов в ДАА-содержащих нейронах аркуатного ядра через 12 часов после введения Е2, тогда как в TГ-иммунопозитивных нейронах обнаружены рецепторы к αЕ2. В предыдущих работах, проведенных на крысах и овцах показано менее 10 % ТГ-иммунореактивных нейронов, содержащих рецептор αЕ2 в аркуатном ядре (Kuljiis and Advis, 1989; Jansen et al., 1996 Batailler et al., 1992; Lehman and Karsch, 1993; Skinner and Herbison, 1997).
Недавние работы показали, что клетки, содержащие рецепторы к αЕ2 в аркуатном ядре, проецируются в область расположения ГРГ нейронов, хотя существование синаптических контактов между этими клетками и ГРГ нейронами не было обнаружено (Goubillon et al., 1999; Pompolo et al., 2001). Этими нейронами могут быть различные типы клеток аркуатного ядра, содержащие рецепторы к αЕ2 (рис. 8) (Thind and Goldsmith, 1986; Kuljis and Advis, 1989), а именно, нейропептид Y и β-эндорфин (Skinner and Herbison, 1997; Lehman and Karsch, 1993), галанин (Тourlet et al., 2005), энкефалин (Henry et al., 2000), нейрокинин B (Goubillon et al., 2000) и киспептид (Franceschini et al., 2006), соматостатин (Herbison 1995; Scanlan et al., 2003). Показано, что нейроны содержащие нейропептид Y (Gray and Morley, 1986; Tillet et al., 1989), нейрокинин B (Goubillon et al., 2000), галанин (Duforny and Skinner, 2005), соматостатин (Pillon et al., 2004), кисcпептид (Messager et al., 2005, Pompolo et al., 2006) проецируют свои окончания к ГРГ нейронам.
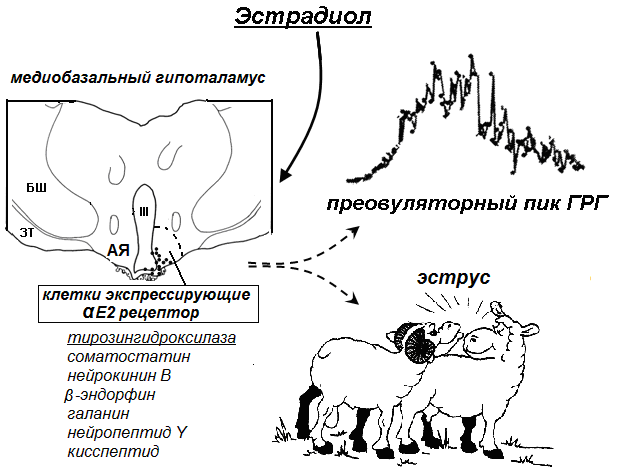
Рис. 8. Схема индукции преовуляторного пика ГРГ и эструса эстрадиолом у овец. АЯ- аркуатное ядро, БШ – бледный шар; ЗТ - зрительный тракт; III - третий желудочек.
Возможно, что ТГ-иммунореактивные клетки, которые мы обнаружили в аркуатном ядре, являются пептидергическими нейронами. Учитывая, что мы обнаружили рецепторы к Е2 на ТГ-содержащих нейронах аркуатного ядра и не обнаружили их на ДАА-содержащих нейронах, можно полагать, что ТГ-содержащие моноферментные нейроны аркуатного ядра, в которых под действием Е2 экспрессируется с-fos, опосредуют действие Е2 на ГРГ нейроны в конце фолликулярной фазы полового цикла, запуская преовуляторный пик ГРГ.
Экспериментальное моделирование функциональной недостаточности ДА-ергических нейронов аркуатного ядра, ответственных за регуляцию секреции пролактина у крыс.
Нам удалось смоделировать функциональную недостаточность ДА-ергических нейронов аркуатного ядра путем введения нейротоксина – 6-ГДА в латеральные желудочки мозга.
Секреция пролактина гипофизом после введения 6-ГДА у крыс.
На 14-ый день после введения 6-ГДА обнаружено двукратное повышение уровня пролактина в крови у крыс (рис. 9), что согласуется с данными других авторов (Fenske et al., 1976; Domanski et al., 1980; Wolinska-Witort et al., 1986) и свидетельствует о функциональной недостаточности ДА-ергической системы.
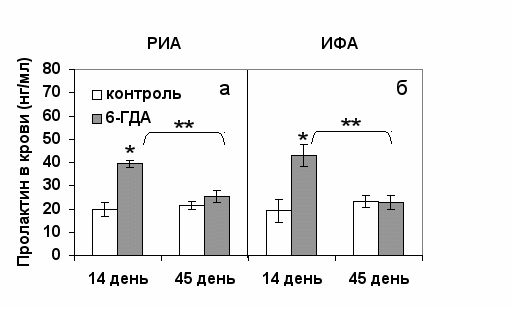
Рис. 9. Концентрация пролактина (нг/мл) в плазме крови крыс на 14-ый и 45-ый дни после введения 6-гидроксидофамина (6-ГДА). а) результат радиоиммунологического анализа (РИА); б) результаты иммуноферментного анализа (ИФА). * - достоверные различия между контрольной и опытной группой (р < 0.05). **- между опытными группами на 14-ый и 45-ый дни (р < 0.05).
В то же время уровень пролактина в гипофизе не меняется (рис. 10). Cинтез пролактина можно оценить по его суммарному содержанию в гипофизе и в крови. Поскольку его концентрация в гипофизе не изменяется, а на периферии увеличивается, то можно считать, что в целом синтез пролактина увеличивается после снятия тормозного влияния ДА. Это согласуется с данными, полученными при хроническом введении антагониста Д2 рецепторов - галоперидола, когда не происходило изменения концентрации пролактина в гипофизе, но наблюдалось повышение пролактина в крови (Mochankumar et al., 1997).
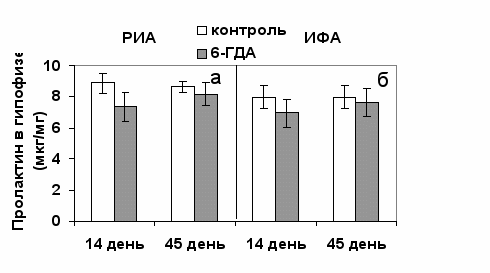
Рис. 10. Концентрация пролактина (мкг/мг) в ткани передней доли гипофиза на 14-ый и 45-ый дни после введения 6-гидроксидофамина (6-ГДА). а) результат радиоиммунологического анализа (РИА). б) результат иммуноферментного анализа (ИФА).
На 45-ый день после введения 6-ГДА концентрация пролактина в плазме крови снижалась до нормы (рис. 9), что согласуется с данными других авторов (Fenske et al., 1976), а уровень пролактина в гипофизе не отличался от контрольного (рис. 10), что говорит о снижении уровня секреции пролактина до нормы, что является показателем включения компенсаторных механизмов. Возможно, что механизм компенсации секреции пролактина связан с гиперэкспрессией Д2 рецепторов на лактотрофах в передней доле гипофиза. Ранние работы показали, что введение галоперидола – антагониста ДА, воздействующего на Д2 рецепторы лактотрофов, приводило к увеличению мРНК Д2 рецепторов в гипофизе (Arnaud et al., 1991), что является показателем компенсаторного увеличения чувствительности лактотрофов в условиях хронического дефицита ДА. Однако, в литературе отсутствуют данные об изменении числа рецепторов на лактотрофах при дегенерации ДА-ергических нейронов аркуатного ядра.
Анализ изменения уровня ДА в аркуатном ядре после введения 6-ГДА.
Фаза декомпенсации. На 14-ый день, по полученным нами данным, прямым доказательством недостаточности ДА-ергической системы является значительное снижение концентрации ДА - в 2 раза (рис. 11) в ткани аркуатного ядра, что связано с дегенерацией нейронов под действием нейротоксина, продемонстрированное другими авторами в целом гипоталамусе (Uretsky and Iversen, 1970; Reader and Gauthier, 1984). Более того, в нашей лаборатории показано, что при таком воздействии происходит дегенерация 50% ДА-ергических нейронов в аркуатном ядре (Ershov et al., 2005).
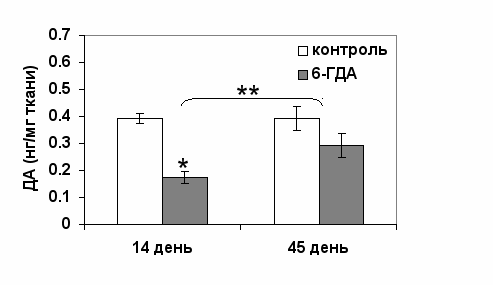
Рис. 11. Концентрация дофамина (ДА) в аркуатном ядре (нг/мг) на 14-ый и 45-ый дни после введения 6-гидроксидофамина (6-ГДА).
В экспериментах in vivo невозможно в полной мере оценить, происходит ли снижение ДА в аркуатном ядре после введения 6-ГДА вследствие изменения синтеза ДА или его выделения, поскольку часть ДА из срединного возвышения высвобождается в портальную систему циркуляции (McCann et al., 1984). Поэтому в дополнение к исследованиям in vivo были проведены эксперименты in vitro (рис. 12) для оценки скорости синтеза ДА в толстых срезах аркуатного ядра. Мы определяли суммарное содержание ДА в ткани после перфузии (рис. 12) и в инкубационной среде (рис. 13), что рассматривалось как показатель уровня синтеза ДА. Содержание ДА в ткани и в инкубационной среде уменьшалось, что свидетельствует о снижении его синтеза (рис. 14).
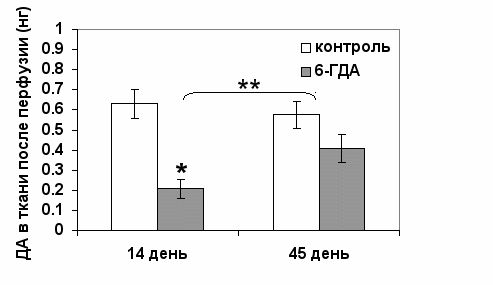
Рис. 12. Содержание дофамина (ДА) в срезах аркуатного ядра после перфузии на 14-ый и 45-ый после введения 6-гидроксидофамина (6-ГДА).* достоверные различия межу контрольной и опытной группой (р < 0.05). ** - между опытными группами на 14-ый и 45-ый дни (р < 0.05).
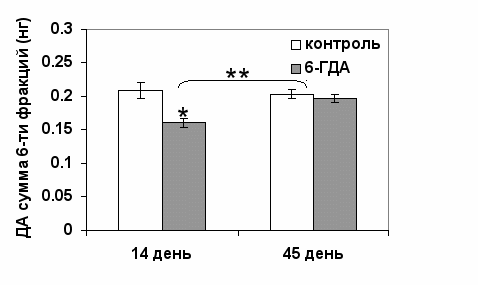
Рис. 13. Суммарное содержание дофамина (ДА) в шести 10-минутных фракциях на 14-ый и 45-ый дни после введения 6-гидроксидофамина (6-ГДА). * достоверные различия межу контрольной и опытной группой (р < 0.05). ** - между опытными группами на 14-ый и 45-ый дни (р < 0.05).

Рис. 14. Суммарное содержание дофамина (ДА) в ткани и в инкубационной среде на 14-ый и 45-ый дни после введения 6-гидроксидофамина (6-ГДА). * - различия межу контрольной и опытной группой (р < 0.05).** - между опытными группами на 14-ый и 45-ый дни (р < 0.05).
Снижение уровня ДА в ткани аркуатного ядра in vivo и in vitro свидетельствует о функциональной недостаточности ДА-ергических нейронов.
Фаза компенсации. На 45-ый день концентрация ДА в ткани аркуатного ядра не отличалось от контроля (рис. 11). Содержание ДА в ткани после перфузии (рис. 12) и в инкубационной среде (рис. 13) восстанавливалось, а также их суммарное содержание (рис. 14), что свидетельствует о восстановлении его синтеза.
Таким образом, суммарное содержание ДА в ткани и в среде на 45-ый день после введения 6-ГДА возвращается к контрольному уровню, что свидетельствует об усилении синтеза ДА. К такому результату теоретически могут привести:
а) усиление синтеза ДА в сохранившихся ДА-ергических нейронах;
б) включение или усиление кооперативного синтеза ДА моноферментными нейронами аркуатного ядра, экспрессирующими только один из ферментов синтеза ДА – ТГ или ДАА (Ershov et al., 2002).
Что касается первого механизма компенсации, то возможно происходит усиление синтеза ДА в сохранившихся 50% ДА-ергических нейронах аркуатного ядра (Jonsson 1983; Ershov et al., 2005). Известно, что в ответ на повышение уровня пролактина при гиперпролактинемии активируются нейроны медиобазального гипоталамуса (Moore et al., 1987; Arbogast and Voogt 1991), оказывая непосредственное влияние на гипоталамический контроль собственной продукции (короткая петля положительной обратной связи). Увеличение уровня пролактина сопровождается возрастанием синтеза ДА и его концентрации в гипоталамо-гипофизарной портальной системе циркуляции (Moore 1987; Ben-Jonathan et al., 1989; Ben-Jonathan 1994). Скорость синтеза ДА снижается после гипофизэктомии, либо после блокады продукции пролактина бромкриптином. Нейроэндокринные ДА-ергические нейроны содержат рецепторы к пролактину, что подводит анатомический базис для существования подобного пути обратной связи (Arbogast and Voogt 1997).
Второй механизм компенсации дефицита ДА может быть связан с увеличением числа «моноферментных» нейронов аркуатного ядра (Ershov et al., 2005), которые по числу и распространенности в пределах мозга превосходят ДА-ергические нейроны (Björklund and Lindvall 1984; Van den Pol et al., 1984). Ранее на аналогичной модели с дегенерацией нейронов аркуатного ядра в нашей лаборатории было показано увеличение числа моноферментных нейронов в вентролатеральной части аркуатного ядра (Ershov et al., 2005), которое, вероятно, является компенсаторной реакцией в ответ на дефицит ДА. Учитывая, что активность ДАА намного превышает активность ТГ и триптофангидроксилазы (Moore et al., 1985), поступление L-ДОФА в катехоламинергические нейроны из внеклеточной среды должно приводить к повышению синтеза катехоламинов в этих нейронах, а поступление в серотонинергические нейроны должно сопровождаться запуском синтеза ДА (Kannari et al., 2006). Оба пути синтеза моноаминов, особенно ДА, могут рассматриваться как компенсаторные механизмы, приобретающие особое значение при функциональной недостаточности катехоламинергической системы, особенно ДА-ергической (Ugrumov et al., 2002a). Этот механизм усиления синтеза катехоламинов может быть особенно эффективным в тех отделах мозга, где с одной стороны - в тесных топографических отношениях находятся тела и/или волокна моноферментных ТГ-содержащих нейронов, а с другой - тела и/или волокна катехоламинергических нейронов (стриатум, аркуатное ядро, срединное возвышение, задняя доля гипофиза и др.) и серотонинергических нейронов (стриатум, срединное возвышение и др.) (Lopez et al., 2001).
Таким образом, на разработанной нами фармакологической модели функциональной недостаточности ДА-ергической системы в мозге у крыс, получены доказательства компенсации дефицита ДА за счет усиления его синтеза в аркуатном ядре.
ЗАКЛЮЧЕНИЕ
Нейроны аркуатного ядра, экспрессирующие один или оба фермента синтеза ДА, у различных млекопитающих (овцы и крысы) участвуют в центральной регуляции репродуктивной функции. Участие этих нейронов опосредует действие эстрадиола на ГРГ нейроны, а в условиях функциональной недостаточности ДА-ергической системы медиобазального гипоталамуса могут оказывать компенсаторное влияние за счет усиления синтеза ДА.
ВЫВОДЫ
1. Введение эстрадиола овцам приводит к увеличению числа c-fos/ТГ нейронов в аркуатном ядре, что свидетельствует о его активирующем влиянии на ТГ-содержащие нейроны аркуатного ядра.
2. Рецепторы к эстрадиолу обнаружены только в ТГ-содержащих нейронах и отсутствуют в ДАА-содержащих нейронах аркуатного ядра. Следовательно, регуляторное влияние эстрадиола на репродуктивную функцию опосредовано через ТГ- содержащие нейроны аркуатного ядра у овец.
3. Введение нейротоксина (6-ГДА) в латеральный желудочек мозга крыс приводит к двукратному снижению уровня ДА в аркуатном ядре, т. е. к развитию функциональной недостаточности ДА-ергической системы медиобазального гипоталамуса.
4. К 14-му дню функциональная недостаточность ДА-ергических нейронов аркуатного ядра, вызванная нейротоксином, приводит к двукратному увеличению уровня секреции пролактина клетками гипофиза.
5. К 45-му дню у животных с функциональной недостаточностью ДА-ергических нейронов аркуатного ядра включаются компенсаторные механизмы, усиливается синтез ДА нейронами, что приводит к снижению уровня секреции пролактина гипофизом.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ.
Статьи.
1. Tourlet S., Ziyazetdinova G., Caraty A, Tramu G, Delsol G, Tillet Y. Oestradiol effect on galanin-immunoreactive neurones in the diencephalon of the ewe. J. Neuroendocrinolоlogy 2005. V. 17. № 3. P. 145-151.
2. Зиязетдинова Г. З., Сапронова А.Я., Киясова В.А., Нанаев А.К., Кудрин В.С., Мартина Н. , Тийе И., Угрюмов М.В. «Компенсаторная реакция при дегенерации дофаминергических нейронов аркуатного ядра у крыс». Журнал эволюционной биохимии и физиологии. 2008. Т. 44. №1 (в печати).
Тезисы докладов:
1. Ziyazetdinova G., Caraty A., Ugrumov M., Tillet Y. Effet de l`oestradiol sur les neurons à tyrosine hydroxylase (TH) de l`hypothalamus médiobasal lors du pic préovulatoire chez la brebis. 32e Colloque de la SNE (Réunion Franco-Québécoise) La Grande Motte (Hérault, France). 16 -18 septembre 2004, p. 82
2. Зиязетдинова Г. З., Угрюмов М. В. Влияние эстрадиола на дофаминергические нейроны гипоталамуса овец в преовуляторной фазе цикла. Нейрохимия: фундаментальные и прикладные аспекты. Москва. 14-16 марта 2005, стр. 55.
3. Зиязетдинова Г. З. Являются ли дофаминергические нейроны гипоталамуса мишенью для эстрадиола в преовуляторной фазе полового цикла у овец. Всероссийская конференция молодых исследователей «Физиология и медицина», Санкт-Петербург. 14-16 апреля 2005, стр. 44.
4. Зиязетдинова Г. З. Метаболизм дофамина после дегенерации дофаминергических нейронов в аркуатном ядре у взрослых крыс. Конференция молодых ученых ИБР им. Н.К. Кольцова РАН, Москва. 21 декабря 2005, стр. 4.
5. Ziyazetdinova G. Z., Sapronova A. Y., Nanaev A. K., Tillet Y. Dopamine synthesis by non dopaminergic neurons in the arcuate nucleus is a compensatory reaction under the failure of dopaminergic neurons. Sixth International Congress of Neuroendocrinology, Pittsburg, Pennsylvania U.S.A. 19-22 June 2006, р. 29.
6. Зиязетдинова Г. З., Киясова В. А., Сапронова А.Я., Воронова С. Н. Синтез дофамина недофаминергическими нейронами в аркуатном ядре взрослых крыс - компенсаторный механизм при гиперпролактинемии. Структурно-функциональные и нейрохимические закономерности асимметрии и пластичности мозга – 2006 (материалы Всероссийской конференции с международным участием), Москва, Россия, 2006, стр. 113-116.
7. Зиязетдинова Г. З., Ершов П. В., Сапронова A. Я., Нанаев А. К. Синтез дофамина в аркуатном ядре взрослых крыс после фармакологического разрушения дофаминергических нейронов. Конференция «Нейроспецифические метаболиты и энзимологические основы деятельности ЦНС». Пенза. 25-27 сентября, 2006 стр. 121.
8. Угрюмов М. В., Сапронова А. Я., Зиязетдинова Г. З., Нанаев А. К. Синтез дофамина недофаминергическими нейронами – новый компенсаторный механизм при гиперпролактинемии. VI Всероссийский конгресс эндокринологов. Москва. 30 октября – 2 ноября, 2006, стр. 421.
9. Зиязетдинова Г. З., Ершов П. В., Сапронова A.Я., Нанаев А.К. Угрюмов М.В. Кооперативный синтез дофамина недофаминергическими нейронами – механизм адаптации при гиперпролактинемии. ХХ съезд физиологического общества им. И.П. Павлова. Москва. 4-8 июня, 2007, стр. 239.
СПИСОК СОКРАЩЕНИЙ
6-ГДА - 6-гидроксидофамин
ГРГ – гонадотропин-рилизинг гормон
ДА - дофамин
ДАА- декарбоксилаза ароматических L-аминокислот
Е2 – эстрадиол
ИФА – иммуноферментный анализ
ЛГ – лютеинизирующий гормон
РИА – радиоиммунологический анализ
ТГ - тирозингидроксилаза

