В различных клеточных популяциях
| Вид материала | Документы |
- Аннотация рабочей программы дисциплины основы клеточных технологий цель дисциплины, 48.85kb.
- Сухачев александр Николаевич динамика клеточных популяций гемоцитов асцидии, 331.84kb.
- Социального развития российской федерации иммунореабилитация при инфекционно-воспалительных, 1443.13kb.
- Молекулярно-генетические и клинико-генотипические особенности муковисцидоза в российских, 924.89kb.
- Мутации и мутационный процесс в природных популяциях, 723.69kb.
- Курсовые работы на конкурс (21 мая 2009, ауд. 1-42), 85.51kb.
- М. В. Ломоносова биологический факультет кафедра антропологии Реферат, 448.61kb.
- Программа по «Экологии и природопользованию», 197.56kb.
- Физиология клеточных процесов, 79.34kb.
- «временное», 130.85kb.
| Примечание: * р< 0,05 Результаты наших исследований о вовлеченности гистамина в процессы адаптации СОЖ к повреждающему действию НПВП, сопоставленные с данными литературы, могут служить в пользу представления об участии гистамина в профилактике и заживлении язв и эрозий в этих условиях. Следует отметить, что эти предположения требуют дальнейшего экспериментального исследования. В желудках грызунов гистамин депонируется в тучных и ECL (энтерохромафинподобных) клетках. Гистамин через Н1 и Н3 рецепторы может оказывать выраженные морфогенетические эффекты. В частности, гипергастринемия, которая стимулирует пролиферативные процессы в СОЖ, реализует эти эффекты через гистамин ECL клеток (ссылка скрыта. et al., 2004). Согласно представлениям ссылка скрыта. (1985), Hernández-Angeles A. et al. (2001), Deyama Y. et al. (2002), гистамин является локальным митогеном. Процессы адаптации СОЖ к повторным воздействиям иммобилизационного стресса сопровождаются увеличением содержания гистамина в тканях желудка (Тимошин С. С. и соавт., 1991). Влияние дерморфина на ранние периоды развития рыб осетровых пород Одним из облигатных условий апробации потенциальных фармакологических препаратов является подтверждение их эффектов и отсутствие токсических проявлений на нескольких видах животных объектов. Опиоидные пептиды присутствуют у рыб на эмбриональных, «донервных» стадиях развития (Яковлева Т.В. и соавт., 1986), а также в тканях развивающихся и взрослых особей (Папин А.А., Карелин А.А., 1984; Singh R., Rai U., 2009; Macho Sanchez-Simon F., Rodriguez R.E., 2009). Исследования проводились на икре и молоди осетра амурского (Acipenser schrenckii) на протяжении четырех рыборазводных сезонов. Инкубация оплодотворенной икры осетра амурского с раствором седатина (0,001-0,2 мг/л) в течение 1 часа приводила к увеличению процента выклева. Эффект зависел от использованной концентрации пептида (табл. 8). Таблица 8 Влияние обработки оплодотворенной икры различными дозами седатинана динамику выклева личинок осетра амурского
Примечание: * р<0,05 Максимальный эффект был зарегистрирован при использовании дозы пептида 0,01 и 0,1 мг/л. Увеличение концентрации седатина до 0,2 мг/л привело к уменьшению выраженности эффекта, что, возможно, является отражением «колоколообразной» зависимости «доза-эффект», характерной для РП. Наряду с общими показателями количества сформировавшихся личинок, важным параметром является скорость выклева. Обеспечение «дружного» выклева является важной проблемой рыбоводства. Воздействие седатина значительно увеличивало скорость выклева, особенно, в первые 24 часа (рис. 3). 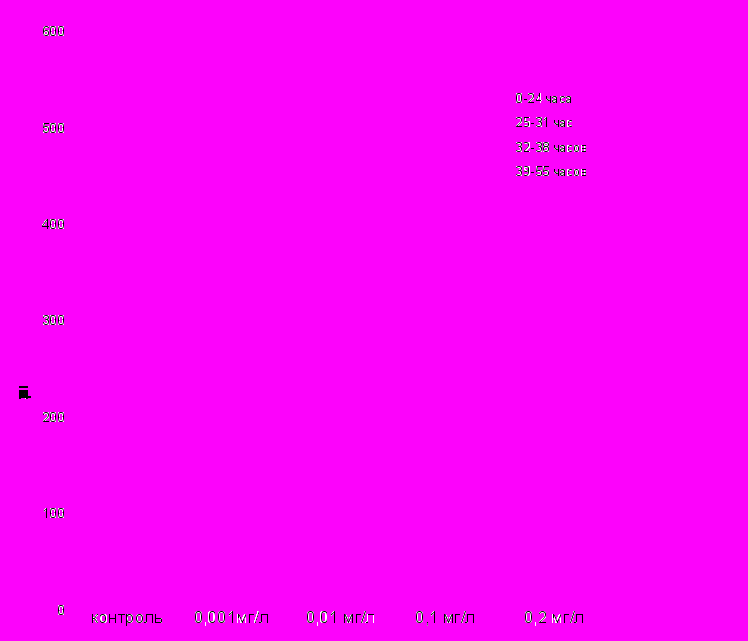 Рис. 3. Влияние обработки оплодотворенной икры различными концентрациями седатина на скорость выклева предличинок осетра амурского. Максимальная выживаемость мальков через 60 дней после обработки седатином имела место при воздействии пептидом 0,1 мг/л. Это позволило нам остановиться в последущих исследованиях на дозе 0,1 мг/л. Наблюдение за общим состоянием, поведенческими реакциями, а также анализ соматометрических показателей мальков экспериментальных групп осуществляли в течение 2 месяцев (60 дней) с момента выклева до периода помещения особей в естественную среду обитания. Однократное воздействие седатином в дозе 0,1 мг/л на оплодотворенную икру осетра амурского индуцировало увеличение массо-ростовых показателей подопытных особей по сравнению с контрольными параметрами (рис. 4). 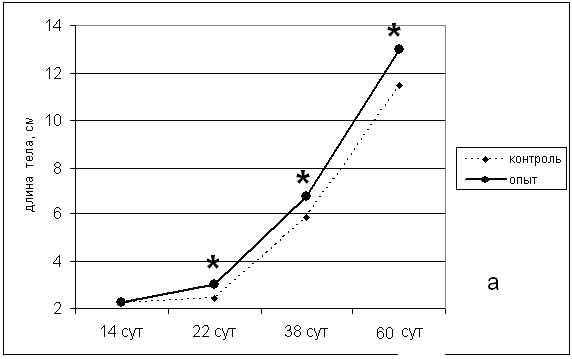 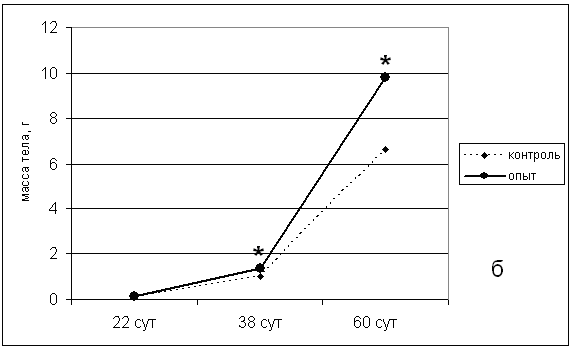 Рис. 4. Влияние однократной обработки оплодотворенной икры осетра амурского раствором седатина на динамику соматометрических показателей мальков в постнатальном периоде (а – длина тела; б – масса тела; * р<0,05). Результаты исследования сравнения эффектов безаргининового аналога седатина и седатина свидетельствуют в пользу ускоренного развития мальков, подвергнутых воздействию аргининсодержащего аналога дерморфина (табл. 9). Таблица 9 Влияние обработки оплодотворенной икры синтетическими аналогами дерморфина (седатин и седатин без аргинина) в дозе 100 мкг/л на соматометрические показатели 60-суточных мальков осетра амурского
Примечание: * р<0,05 Таким образом, обработка икры осетровых раствором седатина не вызывает негативных отклонений в последующие 2 месяца развития рыб. Более того, по данным соматометрии, имеют место признаки ускоренного развития подопытных мальков. Полученные результаты, судя по стабильности индекса упитанности по Фултону, свидетельствуют в пользу гармоничности процесса роста и развития мальков. Изменение структуры молекулы пептида удаление аминокислотного остатка аргинина (эксперимент с безаргининовым аналогом седатина), приводит к нивелированию эффекта седатина в отношении соматометрических показателей. Активность процессов свободнорадикального окисления определяли в образцах оплодотворенной икры через 18 часов после проведения инкубации с пептидами. Установлено, что при воздействии седатина на инкубируемую икру осетра амурского активируются системы антиоксидантной антирадикальной защиты: в сравнении с контролем величина S2инд статистически значимо снизилась в 1,6 раза. Наблюдается увеличение перекисной резистентности (Н2 снизилась в 2,1 раза) и замедление процесса генерации перекисных радикалов (S1инд снизилась в 1,5 раза). Анализ показателей хемилюминесценции (табл. 10) гомогенатов сердца и печени 60-суточных мальков, подвергнутых в антенатальном периоде развития однократной обработке седатином, продемонстрировал, что воздействие пептида увеличило буферную емкость антиоксидантной и антирадикальной системы защиты, а также перекисную резистентность в исследуемых тканях. Об этом свидетельствуют статистически значимое снижение амплитуды H2 (в 1,26 и 1,36 раза) и величины S2инд (в 1,31 и в 1,43 раза), соответственно. Выявленные изменения активности защитных систем не влияли на редокс-потенциал исследуемых тканей: величины S sp не имели достоверных отличий от контрольных уровней. Таблица 10 Влияние однократной обработки оплодотворенной икры осетра амурского седатином на показатели хемилюминесценции (в отн. ед.) гомогенатов сердца и печени 60-суточных мальков
Примечание: * p<0.05 Представляет интерес тот факт, что изменения свободнорадикального статуса (повышение уровня антиоксидантной защиты), сохранились в тканях сердца и печени у 60-суточных мальков (таблица 10). Таким образом, действие седатина носит долгосрочный характер. Одним их возможных объяснений этому может быть эффект эмбрионального импринтинга, опосредуемого свободнорадикальными механизмами. Подобные изменения могут быть оценены как позитивные, поскольку способствуют повышению адаптируемости особей к негативным воздействиям внешней среды. Анализ состояния ЯО осуществляли в ткани печени и миокарда сорокапятисуточных особей. Выбранный возраст определялся тем, что к этому времени у мальков полностью сформированы органы. С показателями контрольной группы сопоставляли показатели группы мальков, подвергнутых в зародышевом периоде воздействию седатина и его безаргининового аналога в концентрациях 0,1 мг/л. В наших исследованиях получены результаты, свидетельствующие о достоверном увеличении количества ЯО у подопытных особей группы «седатин», по сравнению с контрольными. Среднее число ядрышек в ядрах гепатоцитов в контрольной группе мальков составило 3,22 ± 0,15, в подопытной – 5,43 ± 0,30. У мальков, подвергнутых на ранних этапах развития воздействию «безаргининового» аналога седатина, изменения носили недостоверный характер. При анализе гистологических препаратов сердца подопытных особей молоди осетра амурского среднее число ядрышек в ядрах клеток миокарда в контрольной группе мальков составило 3,14±0,14. В подопытной группе количество ядрышек на ядро в среднем составило 5,03±0,29 (р<0,05). Прямым доказательством воздействия седатина на белоксинтетическую активность были исследования по определению суммарного белка в поперечно-полосатых мышцах 60-суточных мальков. У рыб контрольной группы диаметр мышечных волокон составлял 22,28±0,71 мкм, а у подопытных он возрастал до 24,57±0,68 мкм, причем это увеличение было статистически значимым (р<0,05). Морфометрические измерения показали, что в мышцах контрольных рыб площадь ядер равнялась 57,38 ±1,48 мкм2 . В мышцах подопытных рыб этот показатель возрастал до 60,50 ±2,33 мкм2 , но это увеличение было статистически недостоверным. Средние величины числа ядрышек и ядрышко-ядерного отношения также статистически не отличались между собой, а вот суммарная площадь ядрышек, при обработке седатином, возрастала до 8,03±0,14 мкм2 (табл. 11). Таблица 11 Изменения морфометрических параметров мышечных волокон и ядерно-ядрышкового аппарата осетровых рыб под влиянием седатина (M ± m)
Примечание: * р<0,05 Компьютерная морфометрия показала, что у контрольных рыб оптическая плотность мышечных волокон при окраске амидо-черным 10В составляла 0,403±0,012. У подопытных рыб она возрастала до 0,514±0,012, Причем, это возрастание было статистически достоверным (p<0,05). Таким образом, результаты проведенного исследования свидетельствуют, что под влиянием седатина у подопытных рыб, наряду с увеличением диаметра мышечных волокон и возрастанием ядрышковой активности, отмечается также увеличение концентрации суммарного белка в саркоплазме. Вопрос о механизмах активации ЯО в различных клеточных популяциях у мальков, подвергнутых воздействию седатина, требует своего экспериментального решения. Тот факт, что эффект отсутствовал при обработке безаргининовым аналогом, свидетельствует в пользу рабочей гипотезы о нитроксидергическом механизме или компоненте в реализации эффектов седатина. Подтверждением справедливости этого предположения служат данные литературы об активации оксидом азота факторов транскрипции. Как и в других исследовательских ситуациях, эффект NO на факторы транскрипции, зависит от дозы и ряда условий. Оксид азота может оказывать стимулирующий эффект на взаимодействие AP-I и молекулы ДНК – этот эффект опосредуется через активацию Jun-terminal Kinise (Van der Zwan L.P., et al. Kim H. et al., 2010). Кроме того, продемонстрирована возможность активации, посредством NO и его метаболитов, другого важного транскрипционного фактора – NF-κB. Полученные нами свидетельства вовлеченности нитроксидергических механизмов в реализацию адаптивных свойств седатина, находят подтверждение в опытах (ссылка скрыта. et al., 2009). Отсутствие в наших исследованиях положительного эффекта у безаргининового аналога седатина еще раз подтверждает обоснованность предположения о вовлеченности нитроксидергического компонента в оптимизацию процессов развития рыб. В связи с этим представляют интерес данные ссылка скрыта. et al. (2007) о важной роли оксида азота в становлении и функционировании кардиоваскулярной системы на разных этапах онтогенеза. Применительно к личинкам и молоди рыб этот вопрос обсуждается в работах ссылка скрыта. Eddy, (2005). При этом также как в исследованиях ссылка скрыта. et al. (2009), оценивается роль NO, как стрессмодулятора молоди рыб. Важно отметить, установленное в наших исследованиях повышение активности антиоксидантной антирадикальной защиты. Эта перестройка является необходимым фактором адекватного функционирования оксида азота. Способность седатина активировать антиоксидантную и антирадикальную защиту во многом объясняет ускорение выклева предличинок под влиянием пептидов. Сохранение в ткани сердца и печени 60-дневных мальков позитивных сдвигов в обмене активных кислородных метаболитов находит частичное объяснение в данных ссылка скрыта. еt al. (2009) о способности агонистов мю-рецепторов модулировать экспрессию генов цитокинов. Перестройка активности экспрессии генов на ранних этапах онтогенеза может быть еще одним фактором, обеспечивающим долгосрочные эффекты опиоидов. Особо следует выделить такой эффект воздействия седатина, как увеличение массы мальков на ранних стадиях развития. Увеличение соматометрических показателей под влиянием седатина является важным критерием более высоких адаптационных способностей. Рыбы одного возраста, но меньшего размера (массы), выживают в меньшем количестве (Бойко Н.Е., 2008). Выживаемость молоди зависит от ее массы и это лежит в основе весовых стандартов при выпуске мальков. Начальное отставание в массе сохраняется в последующие периоды, независимо от условий выращивания (Бойко Н.Е., 2008). Результаты исследования влияния седатина на выклев, рост и развитие молоди осетровых рыб, а также на ряд морфометрических показателей сердца, печени и мышц, легли в основу нового способа оптимизации развития рыб осетровых пород (Флейшман М.Ю., Тимошин С.С. и соавт., патент РФ № 2298921 от 20.05.2007). Этот метод используется на ряде рыборазводных предприятий Дальнего Востока. При анализе возможных внутриклеточных путей реализации митогенных эффектов опиоидов мы рассматривали: во-первых, активацию экспрессии рецепторов эпидермального фактора роста; и, во-вторых, Gβγ PI3K-Akt каскада. Кроме того, активно изучается третий путь, связанный с модуляцией активности NO (Tegeder I., Geisslinger G., 2004). Ряд лигандов субпопуляций опиоидных рецепторов, через мю-3 рецепторы, могут индуцировать образование NO посредством активации системы Gβγ -PI3K- Akt. Akt способна стимулировать эндотелиальную NOS (Dimmeler S. et al., 1999; Fulton D. et al., 1999). В иммуноцитах морфин может индуцировать образование NO также посредством взаимодействия и активации мю-3 рецепторов (Fimiani C. et al., 1999, b). Процессы активации ангиогенеза и вазодилятации, индуцируемые морфином, связывают с активацией мю-3 рецепторов (Bilfinger T.V. et al., 1998; Gupta K. et al., 2002). Мю-3 рецепторы представялют из себя сплайсинговый вариант, продуцируемый геном мю-опиатных рецепторов (Cadet P. et al., 2003). Экспрессия мю-3 рецепторов продемонстрирована в легочной ткани, при этом их активация приводит к освобождению NO (Fimiani C. et al., 1999). Способность морфина индуцировать образование NO в лейкоцитах, отменяемое L-NAME, показана в исследованиях (ссылка скрыта. et al., 2008). Важную роль играют мю-3 опиатные рецепторы, регулирующие образование NO, что имеет место в процессах эмбриогенеза (ссылка скрыта. et al., 2007). Согласно данным этих авторов, мю-3 рецептор экспрессируется на ранних стадиях развития раньше, чем, традиционные мю-1, дельта- и каппа- рецепторы. Это может служить одним из объяснений столь эффективному воздействию седатина на развитие молоди рыб при обработке им оплодотворенной икры. Однако следует иметь ввиду, что мю-3 рецепторы взаимодействуют с непептидными лигандами. При этом возможность взаимодействия седатина с мю-3 рецепторами в настоящее время обсуждается. В задачи нашего исследования не входило решение вопроса о том, с какой субпопуляцией опиатных рецепторов взаимодействует седатин. Эта характеристика пептида определяется другими методическими подходами и требует экспериментального решения. У нас нет прямых доказательств опосредованности этого эффекта через мю-3 рецепторы. При этом следует иметь в виду, что система NOS-NO может запускаться различными механизмами, а не только аргинином или активацией мю-3 рецепторов. Так, было установлено, что активация NOS-NO в СОЖ может осуществляться посредством глипролина (Pro-Gly-Pro), являющегося составной частью опиоидного пептида бета-казоморфина (Samonina G.E. et al., 2008; Мартынова К.В. и соавт., 2009). Следует еще раз подчеркнуть, что в опытах с мальками, как и при заживлении деффектов СОЖ при НПВП-гастропатиях, активация нитроксидергической компоненты происходит на фоне усиления антиоксидантной и антирадикальной систем защиты. Это имеет принципиальное значение, так как образование NO при оксидативном стрессе приводит к появлению пероксинитрита ONOO-, обладающего высокой токсичностью (ссылка скрыта. et al., 2010), и являющиегося индуктором апоптоза (ссылка скрыта. et al., 1996). NO является важным компонентом запуска системы регенерации, вовлекая в него стволовые клетки (Madhusoodanan K. S. and Murad F., 2007). Внутриклеточное содержание оксида азота является суммой NO, синтезируемого самой клеткой, плюс NO, синтезируемый клетками ближайшего окружения. Изучению влияния NO на процессы регенерации в норме и при патологических процессах посвящены многочисленные исследования (Тищенко О.В. и соавт., 2002; Коновко О.О. и соавт., 2004; Kalinichenko S.G. et al., 2005; Matveeva N.Y. et al., 2007). При оценке роли системы NOS-NO в регуляции процессов пролиферации, следует иметь в виду, что участие оксида азота в этом процессе лишь частично иллюстрирует его физиологическую активность. Данному направлению посвящены многочисленные сведения литературы. В качестве иллюстрации приведем лишь некоторые данные литературы последних лет. Обсуждается участие NOS-NO в процессах канцерогенеза и хронического воспаления (Kanwar J.R. et al., 2009). Имеются сведения участия NOS-NO в функционировании эндокринной системы (Cadenas J.L. et al., 2010), в процессах метаболизма (Fioramonti X. et al., 2010; Marsollier N. et al., 2009), в частности, метаболизма костной ткани (Sabanai K. et al., 2009); в процессах терморегуляции (Robertson R.M. and Sillar K.T., 2009; Lang J.A. et al., 2009), сперматогенеза (Lee N.P. and Cheng C.Y., 2008; Mauro A. et al., 2009); в процессах возбуждения – торможения в нервной системе (Le Roux N. et al., 2009) и в поведенческих реакциях (Rodrigues Pereira N. et al., 2010). Система NOS-NO, также, как и система циклических нуклеотидов, может служить примером универсальных функциональных блоков А.М. Уголева (1990). Согласно этой концепции, управление физиологическими процессами и реализация того или иного эффекта происходит не за счет специализированных регуляторных сигналов, а за счет универсальных функциональных блоков, образующих цепи, приспособленные для этих задач. В качестве другого возможного функционального блока можно привести PI3k/Erk, или PI3k/Аkt каскад. Обсуждая неспецифичность активации PI3k/Erk, или PI3k/Аkt каскадов посредством Gβγ Schwindinger W.F. and Robishaw J.D., (2001) и Cheng K. et al., (2003) считают ростстимулирующий путь общей опцией G-протеинсвязанных рецепторов. Это имеет место с такими лигандами G-связанных рецепторов, как допамин (Narkar V.A. et al., 2001), серотонин (Adayev T. et al., 2003), каннабиоиды (Esposito G. et al., 2002), а также АТ-II и ЭТ-I (Lüscher T.F., Barton M., 2000; Dzimiri N., 2002). Будет ли при этом усиливаться процесс пролиферации, зависит от целого ряда условий. Такими условиями могут быть различные композиции из Gβ, Gγ и участие Gα и, конечно, от типа клеток. Подчеркивается зависимость конечного эффекта от дозы лиганда (Singhal P.C. et al., 1998; Gupta et al., 2002). Боль – стимул секреции опиоидов (ссылка скрыта., 2008; ссылка скрыта. et al., 2010). Это, как правило, повреждение, а оно диктует включение восстановительных процессов. И если стресс – это время «получать раны», то постстрессорная активация опиоидной системы это время «зализывать раны». Участие опиоидов в постстрессорной репарации включает в себя изменение целого ряда функций. Эта перестройка эндокринного фона, приводящая к уменьшению секреции кортикостерона и катехоламинов, угнетающих клеточное деление (Лишманов Ю.Б. и соавт., Радивоз М.И., 1998; Дейгин В.И. и соавт., патент РФ № 2155064 от 16.04.99). Эта активация функционирования NOS-NO, обсуждавшаяся нами ранее. Наряду со свойствами опиоидов оптимизировать процессы микроциркуляции, следует отдельно выделить их способность повышать сократительную активность лимфатических микрососудов (Хугаева В.К., 1992; Хугаева В.К., Ардасенов А.В., 1995). Особо следует отметить тесное взаимодействие опиоидов, в частности, аргининсодержащего аналога дерморфина DALDA, с системой цитокинов при восстановлении тканевого гомеостаза в условиях воспаления. Приводятся сведения о вовлеченности в этот процесс интерлейкина 4, TNFα и INFγ (Philippe D. et al., 2006). При этом DALDA угнетает продукцию TNFα при воспалительных заболеваниях толстого кишечника. Особо следует отметить способность седатина нормализовать или ликвидировать проявления оксидативного стресса. Основным фактором, инициирующим возникновение оксидативного стресса, являются активные кислородные метаболиты АКМ. АКМ – это высокореактивные, преимущественно радикальные, кислородные соединения, образующиеся в живых организмах в результате неполного восстановления молекулярного кислорода (Зенков Н.К. и соавт., 2001). В период формирования концепции универсальных функциональных блоков, активные кислородные метаболиты не рассматривались в таком широком аспекте, как это происходит в настоящее время. Отнесение АКМ к универсальным функциональным блокам не бесспорно, но, у А.М. Уголева (1990), есть представление о блоках комбинированных, энергезирующих и сигнальных. АКМ, продуцируемые клеточными источниками, традиционно считались побочным продуктом метаболизма, потенциально способными вызывать повреждения липидов, белков и ДНК. С филогенетической точки зрения, первоначальное, основное свойство АКМ заключалось в их способности защищать клетку от бактериальной агрессии. В процессе эволюции они обрели статус эффективного коммуникатора внутри и межклеточной коммуникации (Турпаев К.Т., 2002). Развернутые представления об участии АКМ в различных физиологических функциях представлены в работе В.Л. Воейкова (2001). Значение АКМ, как фактора регуляции процессов клеточного деления у простейших представлены у T. Finkel (1998) и ссылка скрыта. ссылка скрыта et al. (2009). При оценке роли различных факторов в регуляции пролиферации высказывается предположение, что редокс-статус и регулирующие его АКМ являются филогенетически более древними, чем факторы роста (Меньщикова Е.Б. и соавт., 2008). При этом трудно не согласиться с авторами, что «Сегодня нет единого мнения о биологической роли окислительных процессов с участием АКМ. Мы не можем однозначно сказать, насколько токсичны АКМ или насколько они необходимы при развитии типовых патологических процессов» (цит. по Меньщикова Е.Б. и соавт., 2008). Концепция, что АКМ являются сигнальными молекулами для процессов пролиферации, основывается на следующих положениях: 1. Факторы роста и цитокины способны генерировать АКМ в клетках различного типа. 2. Ингибиторы АКМ-генерирующих ферментных систем блокируют специфические рост-факторные эффекты. 3. Экзогенные оксиданты активируют рост-фактор опосредованные сигнальные пути (Thannickal V.J, Fanburg B.L., 2000). Кроме того, что АКМ могут выступать в качестве инициатора клеточного деления, они могут запускать процессы апоптоза – конечный результат зависит от соотношения регуляторного континуума, в частности, от соотношения прооксидантов и антиоксидантов (ссылка скрыта М. Б. и др., 2005; ссылка скрыта Б. Н. и др., 2006). Коррекция оксидативного стресса даларгином сопровождается нормализацией процессов пролиферации и заживлением язв при язвенной болезни желудка и 12-перстной кишки и при атрофическом гастрите и НПВП-гастропатиях (Наумова Л.А., 2001; Болоняева Н.А. и соавт., 2005). В наших исследованиях, выполненных совместно с Е.В. Ожеговым, показано, что даларгин нормализовал общие и локальные проявления оксидативного стресса при болезни Крона. При этом имела место нормализация процессов клеточного деления (Ожегов Е.В. и соавт. 2009; Ожегов Е.В., 2010). Программа регенерации, «организуемая» лигандами опиатных рецепторов, включает в себя целый ряд универсальных функциональных блоков. Суммируя данные литературы и результаты собственных исследований, представим их. Это создание оптимального (для регенерации) эндокринного фона под воздействием опиатов, и седатина, в частности. Это формирование оптимального для регенерации цитокинового профиля (Philippe D., et al., 2006). Это включение нироксидергического компонента (Флейшман М.Ю. и соавт., 2009), имеющее место под воздействием других аргининсодержащих опиатов (Животова Е.Ю., Флейшман М.Ю. и соавт., 2009). Следствием этого является оптимизация процессов микроциркуляции (Сиротин Б.З. и соавт., 2002). Это поддержание оптимального уровня локального митогена гистамина, имеющее место под влиянием седатина и даларгина (Александрович А.Г. и соавт., 1989; Флейшман М.Ю. и соавт., 2004). Отдельно следует подчеркнуть способность седатина стимулировать процесс синтеза ДНК, ключевой момент процессов регенерации. У седатина это свойство проявляется в широком диапазоне доз, в том числе, сверхнизких (Флейшман М.Ю. и соавт., 2004). Митогенный эффект, по-видимому, осуществляется за счет активации PI3K-Erk каскада, экспрессии рецепторов эпидермального фактора роста, а также, за счет модуляции активности NO. Стимуляция процессов роста и регенерации, присущая седатину, может сохраняться в течение длительного времени при воздействии опиоидов на ранние этапы онтогенеза. Это проиллюстрировано нами в опытах с рыбами осетровых пород. Способность седатина оптимизировать фон свободнорадикального окисления и индуцировать образование NO также является важной частью, или существенным функциональным блоком реализации программы регенерации (Флейшман М.Ю. и соавт., 2004; 2007). Это свойство опиатов усилено у седатина благодаря присутствию молекулы аргинина. В настоящее время, соединение в препарате его основных свойств с нитроксидергичской составляющей, используется при создании новых классов лекарств. Это относится к статинам (ссылка скрыта. et al., 2004), НПВП препаратам (Gao G. et al., 2005; ссылка скрыта) и к другим препаратам (Ашмарин И.П. и соавт., 2003; Schiller P.W., 2010). Целенаправленный синтез пептидов является одним из подходов современной молекулярной биологии и медицины. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
