Сухачев александр Николаевич динамика клеточных популяций гемоцитов асцидии
| Вид материала | Автореферат |
- Абакумов-горбунов александр николаевич, 3249.1kb.
- Александр Николаевич Островский родился в Москве в культурной, чиновничьей семье, 106.07kb.
- Андреев Леонид Николаевич. Иуда Искариот Андреев Леонид Николаевич. Кусака. Блок Александр, 263.64kb.
- Ткачев Александр Николаевич Глава Администрации (губернатор) Краснодарского края Приветственное, 33.09kb.
- Ткачев Александр Николаевич Глава Администрации (губернатор) Краснодарского края Приветственное, 33.18kb.
- Динамика популяций и сообществ мелких млекопитающих как показатель состояния лесных, 575.93kb.
- Структура населения и динамика популяций воробьиных птиц центральной сибири 03. 00., 392.5kb.
- Программа дисциплины "Математические модели и методы теории решений" для направления, 146.63kb.
- Аннотация рабочей программы дисциплины основы клеточных технологий цель дисциплины, 48.85kb.
- Островский Александр Николаевич, 67.27kb.
На правах рукописи
СУХАЧЕВ
Александр Николаевич
ДИНАМИКА КЛЕТОЧНЫХ ПОПУЛЯЦИЙ ГЕМОЦИТОВ АСЦИДИИ HALOCYNTHIA PURPUREA В ОТВЕТ НА ТКАНЕВОЕ ПОВРЕЖДЕНИЕ
03.03.04 – Клеточная биология, цитология, гистология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Санкт-Петербург
2011
Работа выполнена в Отделе иммунологии Учреждения Российской академии медицинских наук Научно-исследовательский институт экспериментальной медицины Северо-западного отделения РАМН
Научный руководитель:
доктор биологических наук, профессор Полевщиков Александр Витальевич
Официальные оппоненты:
доктор биологических наук, профессор Атаев Геннадий Леонидович
доктор биологических наук Мазинг Юрий Андреевич
Ведущая организация: Институт эволюционной физиологии и биохимии им. И.М.Сеченова РАН
Защита диссертации состоится "____" _______ 2011 г. в ___ часов на заседании Диссертационного совета Д001.022.02 при Учреждении Российской академии медицинских наук Научно-исследовательский институт экспериментальной медицины Северо-западного отделения РАМН (197376, Санкт-Петербург, ул. Акад. Павлова, 12).
С диссертацией можно ознакомиться в научной библиотеке Учреждения Российской академии медицинских наук Научно-исследовательский институт экспериментальной медицины Северо-западного отделения РАМН (197376, Санкт-Петербург, ул. Акад. Павлова, 12).
Автореферат разослан " ___ " ____________ 2011 года.
Учёный секретарь Диссертационного Совета
доктор медицинских наук Дыбан П.А.
ВВЕДЕНИЕ
Актуальность работы. Проблема регенерации уже длительное время является одной из наиболее актуальных проблем клеточной биологии, иммунологии и фундаментальной медицины. Во всем мире идет интенсивное изучение процессов восстановления, что можно объяснить чрезвычайной важностью процессов регенерации для решения многих вопросов теоретической биологии и репаративной медицины (Lopatina T., 2011; Yun Y.R., 2010; Karalaki M., 2009; Бабаева А.Г., 1985; Горышина Е.Н., 1990). При этом способность к регенерации является универсальным свойством всех живых организмов. Однако степень выраженности этой способности у разных групп очень отличается по механизмам, формам и продолжительности. Несмотря на большую актуальность данной проблемы и масштаб исследований, на сегодняшний день нет единого общепринятого подхода к процессу регенерации, и, что не менее важно, к его регуляции. Тем не менее, благодаря использованию современных методов клеточной и молекулярной биологии, биологии развития, иммуногистохимии, клеточные основы репаративного процесса млекопитающих исследуется довольно быстрыми темпами (Karalaki M., 2009; Lopatina T., 2011). В гораздо меньшей степени это пока относится к регуляции репаративных процессов на уровне организма, пока только в общих чертах описано значение нервной и иммунной систем для инициации репаративного процесса (Бабаева А.Г., 1985), а также роль тканеспецифических факторов в ходе репарации. При этом основные исследования направлены на изучение процесса репарации у млекопитающих, обладающих очень сложной системой тканей и многофакторными регуляторными процессами. При этом млекопитающие составляют довольно молодой в филогенетическом плане класс, поэтому его изучение не может в полной мере раскрыть процесс становления механизмов регуляции регенерационных процессов и указать их древние, ключевые, а потому наиболее чувствительные к воздействию точки.
По этой причине представляется актуальным рассмотрение взаимосвязей защитных и репаративных реакций на разных эволюционных уровнях, начиная с самых древних форм, с целью проследить этапы становления комплексной защитно-репаративной реакции, формирование процесса взаимодействия иммунной и репаративной систем в разных таксонах и тем самым взглянуть на проблему в целом. Модель древнейших из ныне живущих низших хордовых животных (асцидии) очень удобна с той точки зрения, что они обладают всеми четырьмя классическими типами тканей, обладают циркуляторной системой, выполняющей как транспортные, так и защитно-репаративные функции, и при этом по общей степени сложности и интегративности тканевых систем существенно уступают млекопитающим. При этом асцидии, как все многоклеточные животные, обладают реакциями врожденного иммунитета и активно защищаются от проникновения патогенов во внутреннюю среду. Одновременно эти организмы обладают и системами репарации и регенерации (Rinkevich Y., 2010; Auger H., 2010; Kawamura K., 2010). При этом вопрос о наличии у асцидий механизмов приобретенного иммунитета остается открытым, однако есть основания предполагать наличие некоторых элементов системы приобретенного иммунитета, первые этапы её формирования (Tomaso A., 2008). Механизмы защитных реакций асцидий имеют много общих черт с реакциями, свойственными большинству беспозвоночных. С другой стороны, некоторые ответные реакции асцидий на введение чужеродных антигенов очень схожи с реакциями врожденного иммунитета позвоночных. Не случайно асцидии являются одним из главных модельных объектов по изучению этапов становления и механизмов аллораспознования, системы распознавания "своё" – "не своё" в целом (Fuke, 2001).
Изучение динамики клеточных популяций очень часто включает глубокий анализ системы циркулирующих форменных элементов. На сегодняшний день разные исследователи выделяют от 3 до 9 различных популяций циркулирующих клеток у асцидий, выделенных как правило с помощью классических гистологических и гистохимических методов исследования (Rowley, 1981; Smith, Peddie, 1992; Shirae, Saito 2000; Parrinello et al., 2007; Hirose еt al., 2003; Parrinello еt al., 2003). Лишь единичные работы предусматривают использование моноклональных антител против поверхностных антигенов и маркеров циркулирующих клеток человека (Cima F., 2006; Khalturin K., 2003). Тем не менее, единая общепризнанная классификация гемоцитов асцидий, основанная на гистогенетических связях, в настоящее время отсутствует. Неясным остается вопрос о способности циркулирующих клеток асцидий к пролиферации, что важно для понимания процесса становления системы стволовых клеток в высших таксонах позвоночных, механизмов их адгезии и миграции в очаг тканевого повреждения.
Цель работы: изучение динамики клеточных популяций асцидии Halocynthia purpurea в ответ на тканевое повреждение.
Задачи работы:
1. На основании морфологического анализа описать основные популяции гемоцитов H.purpurea, предложить их классификацию и изучить функциональные характеристики;
2. Оценить возможность использования и информативность применения метода проточной цитометрии для типирования неокрашенных циркулирующих клеток асцидий;
3. Исследовать способность циркулирующих гемоцитов к пролиферации в ответ на тканевое повреждение;
4. Изучить динамику клеточных популяций и экспрессии ими поверхностных маркеров в ответ на тканевое повреждение.
Научная новизна. Впервые проведено исследование различных популяций гемоцитов асцидии H.purpurea с применением методов проточной цитометрии и конфокальной микроскопии. Выявлена способность морулярных клеток к автофлуоресценции, что может служить основным критерием оценки относительного содержания клеток данной популяции в гемолимфе. С использованием двух методов оценки впервые показан факт пролиферации циркулирующих клеток асцидий в норме и в ответ на тканевое повреждение. Для исследования циркулирующих клеток беспозвоночных впервые были использованы трехпараметрические гистограммы, что позволило оценить клеточный состав гемолимфы и её отдельных фракций. Впервые была проведена оценка возможности использования моноклональных антител к адгезионным молекулам для типирования гемоцитов в норме и в ответ на тканевое повреждение.
Теоретическая и практическая значимость результатов работы. Основным научным значением работы является важный теоретический результат, описывающий динамику и кинетику клеточных популяций асцидий в ответ на тканевое повржедение. Полученные результаты свидетельствуют о наличии у низших хордовых циркулирующих клеток-предшественников, способных к пролиферации и дифференцировке в различные морфотипы гемоцитов асцидий. Полученные новые данные о морфологии гемоцитов асцидий и экспрессии их поверхностных маркеров, обладающих антигенным перекрестом с ключевыми адгезионными молекулами стволовых клеток млекопитающих. Существенным теоретическим и практическим результатом является адаптация метода проточной цитометрии для изучения циркулирующих клеток беспозвоночных без использования моноклональных антител.
Полученные результаты найдут применение в фундаментальных сравнительно-гистологических и сравнительно-иммунологических исследованиях, в биологии стволовых клеток, в лекционных курсах по общей и сравнительной иммунологии, сравнительной гистологии и другим дисциплинам. Методические разработки могут быть использованы для изучения защитных реакций различных таксонов беспозвоночных и позвоночных животных.
Положения, выносимые на защиту.
1. Определены основные популяции циркулирующих клеток асцидии H.purpurea.
2. Циркулирующие гемоциты асцидии способны к пролиферации и отвечают повышением её уровня на тканевое повреждение.
3. Функциональная активность циркулирующих клеток асцидий (способность к эндоцитозу, продукции активных форм кислорода, синтезу цитокино-подобных факторов) меняется в ответ на тканевое повреждение.
4. Моноклональные антитела к адгезионным молекулам человека связываются с перекрестно-реагирующими детерминантами гемоцитов асцидий; уровень связывания меняется в ответ на травму.
Реализация работы. Результаты работы легли в основу 3 статей и 7 тезисов докладов.
Личный вклад в проведенное исследование. Личный вклад автора в выполненную работу включал самостоятельное проведение большинства исследований, разработку и адаптацию ряда методов исследования, а также интерпретацию полученных результатов. Вклад соавторов ограничивался помощью в постановке и освоению новых методов исследования, технической поддержке при работе с аппаратурой и предоставлением в распоряжение автора ряда реактивов.
Апробация работы. Основные положения работы доложены и обсуждены на Объединенном иммунологическом форуме (Санкт-Петербург, 2008), Всероссийской конференции с международным участием «Водные и наземные экосистемы: проблемы и перспективы исследований» (Вологда, 2008), Всероссийской симпозиуме по биологии клетки в культуре на тему "Культивируемые клетки как основа клеточных технологий" (Санкт-Петербург, 2009), Международной научной конференции "Молодь – медицинi майбутнього" (Одесса, 2010), совместном заседании отделов иммунологии и общей и частной морфологии НИИЭМ СЗО РАМН (Санкт-Петербург, 2011).
Структура и объем диссертации. Диссертация изложена на 149 страницах текста и состоит из обзора литературы, описания материалов и методов исследования, изложения собственных результатов, их обсуждения и выводов. Работы проиллюстрированы 47 рисунками и фотографиями и 10 таблицами. Библиографический указатель содержит 154 работы, в том числе 20 работ на русском языке и 134 – на иностранных языках.
СОДЕРЖАНИЕ РАБОТЫ
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объект исследования. Исследования проведены на асцидии Halocynthia purpurea (Urochordata; Ascidiacea; Stolidobranchia; Pyuridae; Halocynthia). Сбор экспериментальных животных производили на базе морской биологической станции «Восток» Института биологии моря им.А.В.Жирмунского ДВО РАН. Животных содержали в аэрируемых аквариумах при естественной температуре и освещенности.
Фракционирование гемоцитов асцидии проводили при помощи ступенчатого (30, 25, 20 и 10%) градиента диатризоата натрия (ДН). Для получения фракций гемоцитов клеточную суспензию в объеме 1 мл наносили на охлаждённые до 0С фазы ДН и центрифугировали 10 мин при 200 g. Клетки полученных фракций отмывали охлажденным раствором Дальбекко без Ca2+ и Mg2+ с содержанием NaCl равным 34 г/л в течение 5 мин при 100g и использовали в дальнейшей работе.
Оценка кислородного метаболизма гемоцитов асцидии. Продукцию супероксиданиона О2 оценивали с помощью автоматизированной модификации НСТ теста в спонтанной и индуцированной модификациях (Полевщиков А.В., Киселева Е.П., 1994). В качестве стимуляторов использовали 0,2% суспензию зимозана в фильтрованной морской воде (ФМВ), 0,2% суспензию латексовых микробус в ФМВ или раствор ЛПС S.typhimurium (50 мкг/мл) на ФМВ. Результат выражали в единицах ОП на 2105 гемоцитов.
Оценка влияния лектинов на способность гемоцитов к поглощению нейтрального красного. Разработка и адаптация к новому объекту метода автоматизированного учета поглощения нейтрального красного была произведена на основе работ (Borenfreund E., Puerner J.A., 1984) и (Hauton C., Smith V.J., 2004). Результат выражали в единицах ОП на 2105 гемоцитов.
Определение гемагглютинирующей активности гемолимфы. Титры гемагглютининов оценивали в реакции гемагглютинации по общепринятой методике (Фримель Г. 1987). Реакцию оценивали визуально. Результат реакции выражали в виде титра, равного –log2Х, где Х – последнее разведение целомической жидкости, обеспечивавшее формирование типичного агглютината. Для эксперимента использовались следующие лектины: WGA, SBA, PSA, SNA, STA, SRA, LCA, LAL, RPA.
Исследование динамики клеточных популяций в ходе репаративных процессов. Моделью тканевого повреждения было нанесение стандартизированного надреза туники и подлежащих тканей, включая стенку синуса. Длина надреза составляла 1 см при глубине 0,5 см. Во время первого повреждения туники одновременно производили забор гемолимфы (точка 0 ч, контроль) от каждой асцидии. Для изучения динамики популяций циркулирующих клеток через 24 ч повторно надрезали асцидию и осуществляли забор гемолимфы. Посчитанные клетки (5 млн) фиксировали охлажденным до 4С формалином и хранили до использования. Исследование образцов проводили на базе Дальневосточного Государственного Университета (г. Владивосток) на проточном цитометре FACSCalibur (Becton Dickinson, США), используя лицензированное программное обеспечение CellQuest Pro. При анализе популяций гемоцитов использовали следующие цитометрические параметры: FS – прямое светорассеивание, отражающее размеры клеток, SS – боковое светорассеивание, отражающее структуру клеток и неоднородность цитоплазмы и канал PMT2 показывающий уровень автофлуоресценции. Каждый образец оценивали по 40000 событиям (клеткам). В ходе процедуры анализа устанавливали соответствующие пороговые значения для исключения из анализа меньших по размеру частиц дебриса и отдельных гранул.
Оценка пролиферативной активности гемоцитов с помощью метода проточной цитометрии. Гемолимфу с клетками получали на сроках 0, 24 и 48 ч после первого повреждения. Для оценки пролиферативной активности использовали следующие красители: йодистый пропидий (PI) и антитела к белку Ki-67 (Сибиряк С.В, 2008). При анализе на проточном цитометре FACSCaliburTM результаты обобщали по 10000 клеток, отобранных по размерам и гранулярности. Обработку полученных данных проводили, используя программное обеспечение ModFit LT 3.0TM.
В случае окраски антителами к Ki-67 к пермеабилизированным клеткам добавляли 5 мкл антител и инкубировали в течение 1 ч. Результаты флуоресценции обобщали по 10000 клеток, отобранных по размерам и гранулярности, используя проточный цитометр FACSCaliburTM. Обработку полученных данных проводили, используя программное обеспечение CellQuest Pro.
Оценка связывания моноклональных антител к адгезионным молекулам человека с гемоцитами асцидий. Уровень связывания антител определяли на точках 0 и 24 ч с момента тканевого повреждения. Для оценки использовали мышиные моноклональные антитела к CD166, CD117, CD29, CD34, CD15, CD54, CD62L, CD62P, CD90, CD94 человека, меченые аллофикоцианином. Изотипическим контролем служил иммуноглобулин MOPC-21 мыши (все реагенты BD Biosciences, США).
Конфокальная микроскопия. Метод конфокальной микроскопии использовали для детекции поверхностных адгезионных молекул. Использовали антитела к CD166, CD117, CD29, CD34, CD15, CD54, CD62L, CD62P, CD90, CD94, меченые аллофикоцианином. Отмытую клеточную суспензию наносили на стекла Culture Slides BD FalconTM (Becton Dickinson, США) и осаждали в течение 2 ч с последующей фиксацией и окрашиванием антителами. Непосредственно перед анализом образцов на конфокальном микроскопе препараты дополнительно контрастировали DAPI и заключали в мовиол. Анализ проводили на конфокальном микроскопе Zeiss LSM 510 Meta в программе LSM 5 Image Browser. Для подтверждения поверхностной локализации антигена использовали программу Z-stacks с шагом 0,1-0,5 мкм, которая позволяет получить объёмное изображение клетки.
Количественное определение цитокинов методом иммуноферментного анализа. Оценку уровней цитокинов (TNF-α, IL-10, IFN, IL-4, IL-8 и C3) в надосадочной жидкости культур стимулированных ФГА, КонА или нестимулированных 1 млн гемоцитов после 12-часовой инкубации поводили с использованием диагностических наборов производства ООО «Цитокин» (Санкт-Петербург) по рекомендациям изготовителя. Результат выражали в пг/мл.
Исследование морфологии гемоцитов. Клетки получали по стандартной методике. По 0,5 мл суспензии гемоцитов наносили на стекла Culture Slides BD FalconTM и инкубировали во влажной камере 1,5 ч при 4ºС. Затем удаляли неприкрепившиеся клетки и осевшие клетки фиксировали в 4% формалине, отмывали в дистиллированной воде и высушивали. Для изучения препаратов использовали окраски по Маю-Грюнвальду, Гейденгайну, Маллори и толуидиновым синим. Окрашивание препаратов проводили по стандартным методикам с небольшими модификациями (Лилли Р., 1969; Пирс Э., 1962).
Статистические методы. В работе применяли следующие статистические методы: вычисление средних, квадратичного отклонения, доверительных интервалов. Сравнение выборок производили с помощью параметрического t критерия Стьюдента и непараметрического W-критерия Уайта. Обработку данных вели по лицензионным программам Excel7.0 и Origin50. Во всех экспериментах различие между контролем и опытом считалось статистически достоверным только для p<0,05 и менее.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Морфологическая характеристика гемоцитов асцидии H.purpurea. Морфология гемоцитов H.purpurea в целом соответствует описанию клеток других видов асцидий (Fuke M., 2001; Hirose E. et al., 2003; Parrinello N. Et al., 2007; Shirae M., Saito Y., 2000). Наименее дифференцированные гемобласты, диаметр которых не превышает 5 мкм, представляют собой клетки сферической формы с большим расположенным в центре пузырьковидным ядром, содержащим конденсированный хроматин, и небольшим количеством резко базофильной цитоплазмы. Гемобласты не окрашиваются витальными красителями и чаще всего не проявляют амебоидной активности. Лишь изредка можно наблюдать клетки с узкими псевдоподиями, которыми они прикрепляются к субстрату (рис.1).
К гранулоцитам (рис.2) отнесены сравнительно мелкие клетки диаметром около 8 мкм со светлой цитоплазмой, содержащей круглые или овальные гранулы размером около 0,5 мкм. Материал гранул резко азурофилен и окрашивается по Маю-Грюнвальду в темно малиновый цвет. В клетках с небольшим числом гранул, вероятно, представляющих более молодые формы, ядра более крупные, в более зрелых клетках ядра мелкие с конденсированным хроматином.
Морулярные клетки (рис.4) являются самой многочисленной популяцией гемоцитов H.purpurea. Они имеют округлую форму и содержат несколько больших вакуолей. Из-за большого размера и плотности вакуолей морулярные клетки практически не способны к распластыванию. Однако часть морулярных клеток частично дегранулирует в ходе выделения и приобретают небольшую способность к распластыванию (рис. 4А и Б). Ядро морулярных клеток окрашивается базофильно и чаще всего лежит ацентрично. Содержимое вакуолей окрашено резко оксифильно, при этом на рис. 4А видно, что часть вакуолей при выделении и сопутствующей активации теряет свое содержимое и становится бесцветной. При окраске по Гейденгайну (рис. 4 В и Г) также выявляются как частично распластанные клетки с прозрачными вакуолями, так и совсем нераспластанные морулярные клетки с плотным содержимым вакуолей. На рис. 4 Д, Е и Ж представлены морулярные клетки после окраски толуидиновым синим. Приведенная на рис. 4Е морулярная клетка с единственной вакуолью нередко описывается другими исследователями как перстневидная клетка, однако в данной работе на основании результатов морфологического исследования и результатов проточной цитометрии они рассматриваются как разновидность морулярных клеток.
Гиалиновые амебоциты и макрофагоподобные клетки часто объединяют в одну группу фагоцитов. Эти клетки достаточно большого размера (8-27 мкм) и непостоянной формы. Гиалиновые амебоциты обладают компактным ядром и значительным объемом цитоплазмы (рис. 3). В циркуляции они имеют шаровидную форму, однако после выделения, оседая на стекло, они быстро активируются и выпускают длинные тонкие псевдоподии, принимают веретеновидную или отросчатую форму и переходят к амебоидному движению (рис.3Б). Цитоплазма этих клеток окрашивается базофильно при использовании метода Мая-Грюнвальда. При окраске по методу Маллори цитоплазма окрашивается голубым цветом, что позволяет предполагать наличие в ней заряженных кислых мукополисахаридов, а в цитоплазме выделяются небольшие фиолетовые гранулы (рис.3В). Сходные более многочисленные гранулы найдены и у более крупных макрофагоподобных клеток, отличающихся фестончатым краем и высокой фагоцитарной активностью (рис. 5). Наличие переходных форм, сходство гранулярных включений и высокая амебоидная активность этих клеток, возможно, являются основанием для объединения этих клеток в один дифферон.
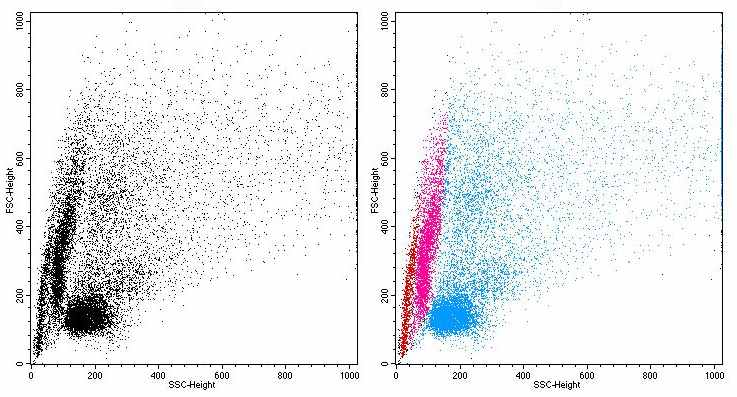
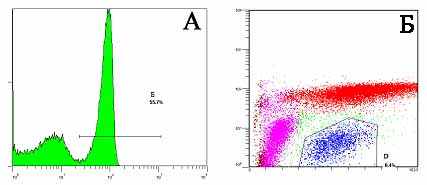
Использование метода проточной цитометрии для типирования циркулирующих клеток асцидии H.purpurea. Метод проточной цитометрии был впервые применен для изучения гемоцитов асцидии H.purpurea. Результаты проточной цитометрии (рис. 6) хорошо согласуется с данными световой микроскопии (рис. 1-5). Благодаря этому методу со стандартными параметрами FS/SS можно выделить 3 популяции клеток, которые условно были обозначены как А, В и С. Соотнесение выделенных проточной цитометрией популяций с результами гистологического исследования было проведено с помощью градиентного центрифугирования. При этом популяция А соответствует гиалиновым амебоцитам и гемобластам (до 16% циркулирующих клеток). В популяции В содержатся в основном макрофагоподобные клетки (до 18% гемоцитов). Популяция С содержит в основном морулярные клетки, ее доля в гемолимфе достигает 72%, как и у других асцидий (Fuke M., 2001; Parrinello N. et al., 1996).
С использованием метода проточной цитометрии впервые показана способность морулярных клеток к автофлуоресценции, по которой эту популяцию легко отличить от других гемоцитов (рис. 7). Узкий пик указывает на почти одинаковую способность всех морулярных клеток к автофлуоресценции (рис. 7А). По способности к автофлуоресценции легко отличить морулярные клетки от гранулоцитов, также входящие в состав популяции С, доля которых по результатам проведенного исследования составляет 8,4%.
Функциональная характеристика гемоцитов асцидии H.purpurea. В результате использования автоматизированного НСТ-теста показана способность гемоцитов асцидий к усилению кислородного метаболизма под влиянием корпускулярных (зимозан, латекс), но не растворимых (ЛПС) стимуляторов. Уровень синтеза активных форм кислорода (АФК) был наиболее высок при стимуляции гемоцитов микробусами латекса. При инкубации гемоцитов асцидии с суспензией зимозана уровень продукции АФК был несколько ниже, однако он все равно превышал контрольные значения (рис. 9).
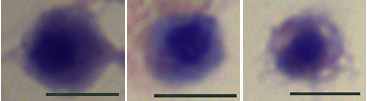 | Рис. 1. Гемобласты асцидии H.purpurea. Окраска по Маю-Грюнвальду. Объектив 100. |
 | Рис. 2. Гранулоциты асцидии H.purpurea. Окраска по Маю-Грюнвальду. Объектив 100. |
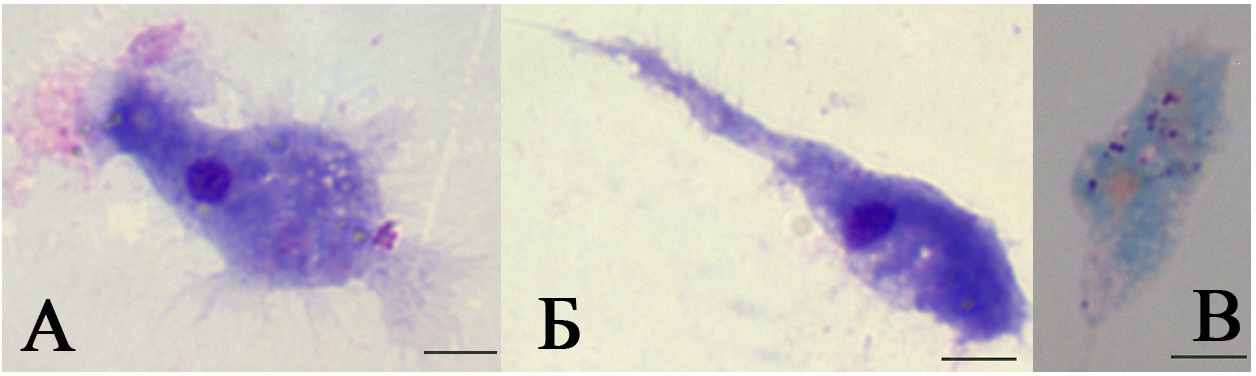 | Рис. 3. Гиалиновые амебоциты асцидии H.purpurea. А,Б - окраска по Маю-Грюнвальду; В – окраска по Маллори. Объектив 100. |
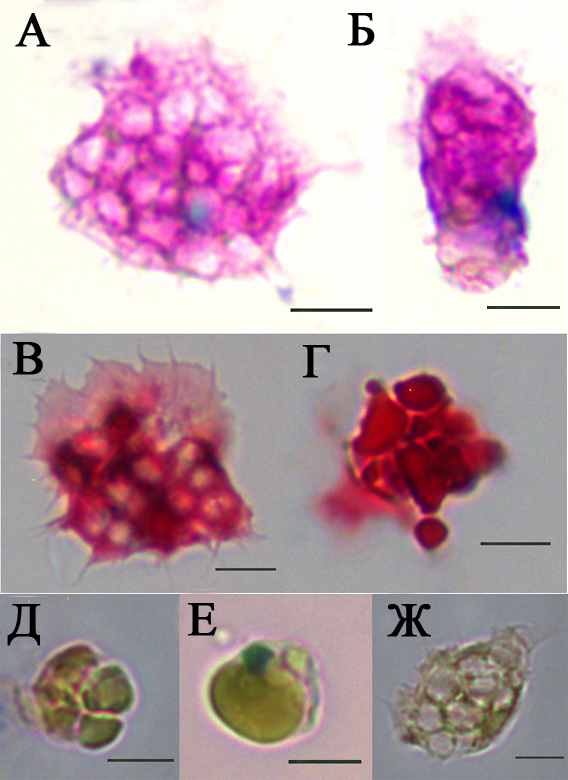 | Рис. 4. Морулярные клетки асцидии H.purpurea. Объектив 100. А,Б – окраска по Маю-Грюнвальду; В,Г – окраска по Гейденгайну; Д,Е,Ж – толуидиновый синий. |
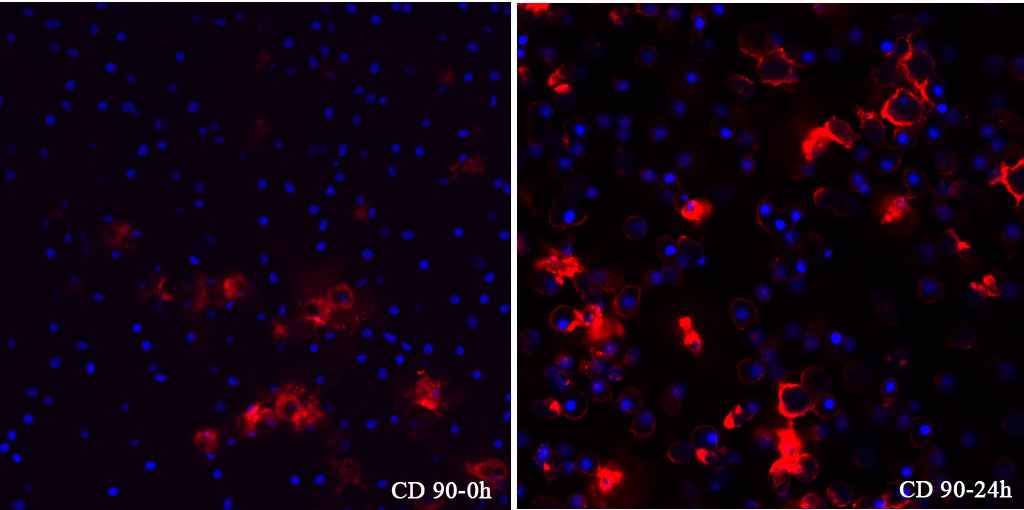
 | Рис. 5. Макрофагоподобные клетки асцидии H.purpurea. А –окраска по Маю-Грюнвальду; Б –окраска по Маллори; В – процесс фагоцитоза, окраска по Маю-Грюнвальду. Объектив 100. Рис. 6. Распределение гемоцитов асцидии при прямом и боковом светорассеивании. Красный цвет- популяция А, фиолетовый –популяция В и голубой – популяция С. По оси абсцисс: SS – боковое светорассеивание, по оси ординат: FS – прямое светорассеивание Рис. 7. Уровень автофлуоресценции гемоцитов асцидии H.purpurea. А - по оси абсцисс: PMT2Log – уровень автофлуоресценции, по оси ординат: условная численность клеток Б - по оси абсцисс: SS – боковое светорассеивание, по оси ординат: PMT2Log – уровень автофлуоресценции Рис. 8. Связывание антител к CD90 с циркулирующими гемоцитами асцидий по результатам конфокальной микроскопии. Слева – точка 0 ч; справа – 24 ч. Использование суммации двух каналов: 650-704 нм для АРС (красный цвет) и 435-485 нм для DAPI (синий цвет). | ||
 | |||
 | |||
 | |||
 | Рис. 9. Продукция АФК гемоцитами асцидии H.purpurea. По оси абсцисс: стимуляторы; по оси ординат: продукция АФК, ед.ОП/2×105 гемоцитов, X±s, n≥8 по каждой точке. Примечание: здесь и далее *, **, *** - различия с контролем достоверны при p<0,05, p<0,01 и p<0,001, соответственно, по критерию t Стьюдента. | | |
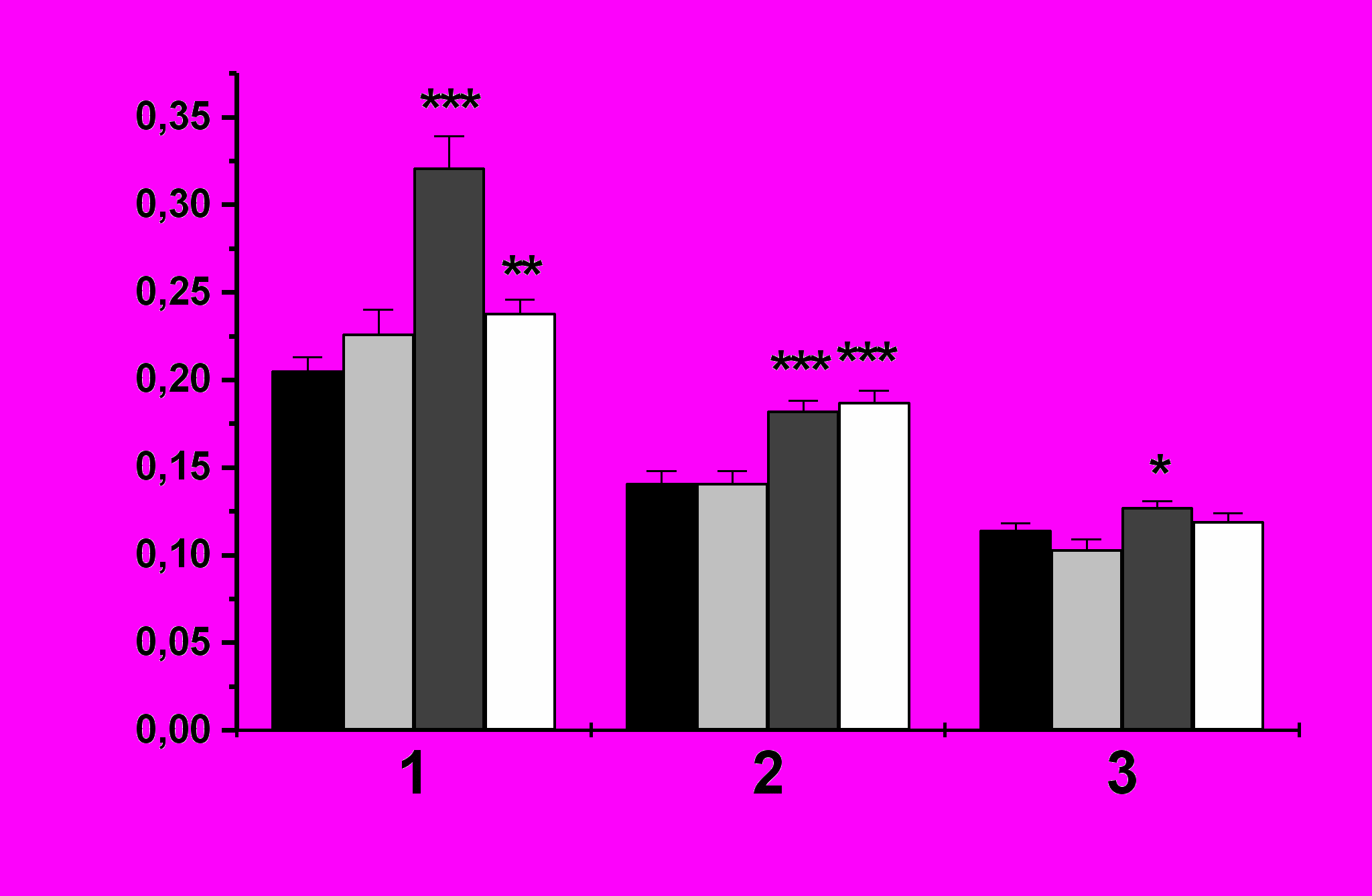 | Рис. 10. Продукция АФК различными фракциями гемоцитов асцидии H.purpurea. По оси абсцисс: фракции 1 – преимущественно гиалиновые амебоциты, 2 – макрофагоподобные клетки, 3 – морулярные клетки; по оси ординат: продукция АФК, ед.ОП/2×105 гемоцитов. Черные столбики – контроль (ФМВ), светло-серые – ЛПС, темно-серые – зимозан, белые – микробусы латекса, X±s, n≥8 по каждой точке. | | |
Сходные в целом результаты были получены при исследовании продукции АФК по фракциям гемоцитов (рис. 10). Уровень синтеза кислородных радикалов во фракциях клеток был значительно ниже такового для нефракционированных клеток, что косвенно указывает на необходимость межклеточной кооперации для усиления кислородного взрыва. Наибольшая продукция АФК была связана с гиалиновыми амебоцитами, меньшая – с макрофагоподобными, наименьшая – с морулярными клетками. Можно предположить, что поглощение зимозана задействует в первую очередь клеточные рецепторы макрофагоподобных клеток, родственные TLR4, тогда как при ответе на растворимый бактериальный ЛПС не происходит формирования фагоцитарных вакуолей, что приводит к отсутствию усиления продукции АФК.
Лектины зародышей пшеницы WGA и картофеля STA достоверно повышают уровень эндоцитоза при использовании в качестве стимулятора суспензии зимозана. Вероятно, специфичные к NAcDGlc и NAcGlc3 лектины выступают в роли опсонинов, устанавливая связи между частицами зимозана и гемоцитами, повышая тем самым уровень эндоцитоза (рис. 11).
Параллельно проводили оценку углеводной специфичности гемагглютининов гемолимфы асцидии (табл. 1). В данном случае использование лектинов WGA, чечевицы LCA и гороха PSA, специфичных к NAcDGlc, a-Man и DMan соответственно, приводило к значительному увеличению опсонизирующей активности гемолимфы. Возможно, лектиновый механизм агглютинации частиц и их последующего захвата гемоцитами важен с точки зрения защитных реакций асцидий и их характера питания.
 | Рис. 11. Уровень поглощения нейтрального красного гемоцитами асцидии H.purpurea в присутствии различных лектинов, Xs, n6 по каждой точке, ед.ОП (=570 нм). 1 – ФМВ (контроль); 2 - зимозан 3 - лектин зародышей пшеницы; 4 – лектин картофеля |
Таблица 1.
Оценка влияния лектинов растительного происхождения на агглютинирующие свойства гемолимфы H.purpurea к эритроцитам человека, Xs, n≥8 по каждой точке.
| Лектины | Углеводная специфичность | Титр гемагглютининов, –log2Х |
| LAL (лектин бобовника) | LFuc | 5,17±0,21 |
| PSA (лектин гороха) | DMan | 6,13±0,32** |
| WGA (лектин завязей пшеницы) | NAcDGlc | 7,35±0,25*** |
| STA (лектин картофеля) | NAcGlc3 | 4,78±0,34 |
| SRA (лектин бузины красной) | NANA | 4,43±0,34 |
| RPA (лектин робинии) | NAcGalactosamine | 5,43±0,22 |
| SBA (лектин сои) | NAcDGal | 5,27±0,19 |
| SNA (лектин бузины черной) | NAcNANA(2→6)Gal/NAcGal | 4,83±0,26 |
| LCA (лектин чечевицы) | a-Man | 7,39±0,33*** |
| Контроль | | 4,67±0,19 |
Что касается динамики продукции активных форм кислорода гемоцитами при ответе на тканевое повреждение и в процессе репарации, то установлено, что уровень АФК через 24 ч после повреждения достоверно падает (рис. 12). Это может быть связано как с общей потерей большого числа циркулирующих клеток при повреждении покровов, так и с потерей зрелых клеток, максимально способных к синтезу АФК. Через 48 ч уровень продукции АФК падает еще ниже. Если у интактного животного суспензия зимозана достоверно повышает уровень продукции АФК, то через 24 ч после повреждения происходит достоверно понижение этого уровня. Это наблюдение позволяет предположить, что для восстановления популяции зрелых гемоцитов, активно отвечающих кислородным взрывом на суспензию зимозана, требуется гораздо больший временной интервал, чем 24-48 ч, что косвенно указывает на медленный характер созревания циркулирующих гемоцитов.
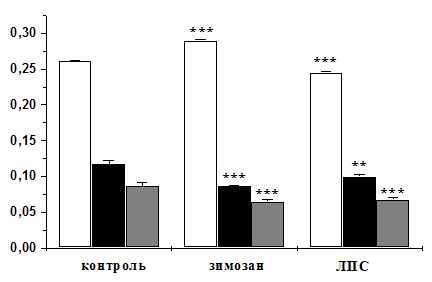 | Рис. 12. Продукция АФК гемоцитами асцидии H.purpurea в ответ на повреждение. По оси абсцисс: модельные антигены; по оси ординат: продукция АФК, ед.ОП/2×105 гемоцитов, белые столбики – точка 0 ч, черные – точка 24 ч, серые – точка 48 ч, X±s, n≥8. Достоверность различий оценивали по сравнению с соответствующей точкой контроля. |
Изучение динамики клеточных популяций гемоцитов асцидии H.purpurea с использованием метода проточной цитометрии. Результаты, полученные при исследовании динамики клеточных популяций асцидии при повреждении ее покровов, свидетельствуют о том, что морулярные клетки и фагоциты так или иначе связаны с развитием ответных реакций на повреждение покровов. Количество морулярных клеток, которые составляют основу популяции С, снижается после повреждения, так как именно морулярные клетки несут ответственность за первичную «заклейку» раны. Фагоциты, напротив, показывают увеличение своей численности после повреждения покровов, что может быть ответом как на возможное проникновение микрофлоры, так и необходимость клиренса поврежденного участка ткани. При этом, нельзя исключить ускоренного формирования гиалиновых амебоцитов и их следующей стадии развития макрофагоподобных клеток из клеток-предшественников (гемобластов) в ответ на повреждение (рис.13).
С помощью двух методов оценки клеточной пролиферации (PI и антитела к Ki-67) было зарегистрировано повышение уровня пролифирирующих клеток в циркуляции после тканевого повреждения (рис. 14, 15). Приведенные на рис. 14 результаты являются примером детекции пролиферативной активности циркулирующих клеток асцидий в ответ на тканевое повреждение с помощью метода проточной цитометрии.
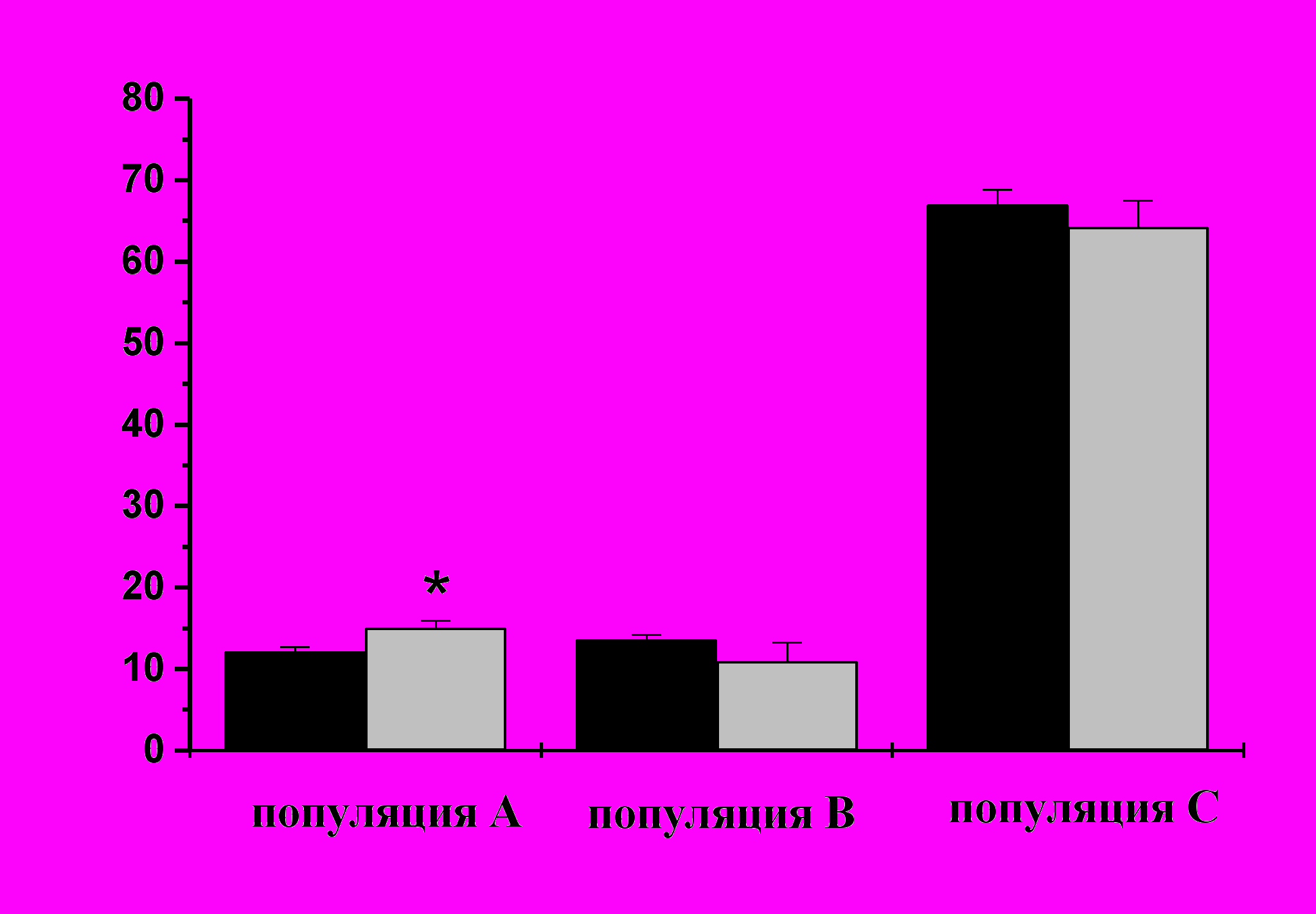 | Рис. 13. Динамика изменений клеточных популяций гемоцитов асцидии H.purpurea в ответ на повреждение покровов по результатам проточной цитометрии. По оси абсцисс - популяции клеток, по оси ординат - процентное содержание в циркуляции, n≥24 по каждой точке. Черные столбики – интактные животные, серые столбики – через 24 ч после повреждения покровов. |
При тканевом повреждение покровов и стенки синуса уровень пролиферирующих клеток повышается примерно в 3 раза от 5% у интактных животных до 15-20% уже через 24 ч (рис. 14, 15). Однако остается открытым вопрос, способны ли гемобласты дифференцироваться только в циркулирующие клетки, или они являются стволовыми клетками с более широким кругом возможных дифференцировок. Доказанный в рамках работы факт – обнаружение пролиферирующих клеток в норме и в ответ на тканевое повреждение – является приоритетным результатом, доказывающим возможность пролиферации циркулирующих клеток у низших хордовых животных. При этом нет оснований утверждать, что циркулирующие пролиферирующие клетки обязательно сами и являются стволовыми. Существует вероятность, что собственно стволовые клетки существуют оседло, а их потомки, полустволовые или дифференцирующиеся клетки, и формируют пул циркулирующих стволовых клеток. Так или иначе, но возникновение системы стволовых клеток у хордовых животных, по-видимому, связано как с формированием циркуляторной системы, так и с несомненным усложнением тканевой дифференцировки, которая имеет место при переходе от первичноротых животных к вторичноротым и далее к хордовым животным.
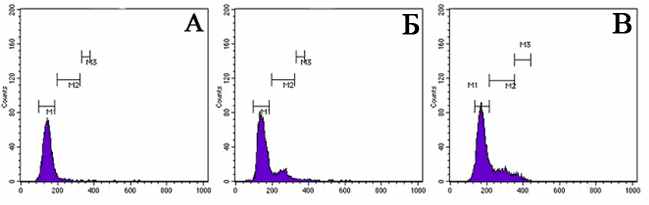
Рис. 14. Пример оценки пролиферативной активности гемоцитов асцидии H. purpurea в ответ на повреждение с использованием PI. А – 0 ч, Б – 24 ч, В – 48 ч. По оси абсцисс: количество событий (клеток); по оси ординат: флуоресценция PI. M1 – G0-G1 фазы клеточного цикла, М2 – S фаза клеточного цикла, М3 – G2-М фазы клеточного цикла и начало митоза.
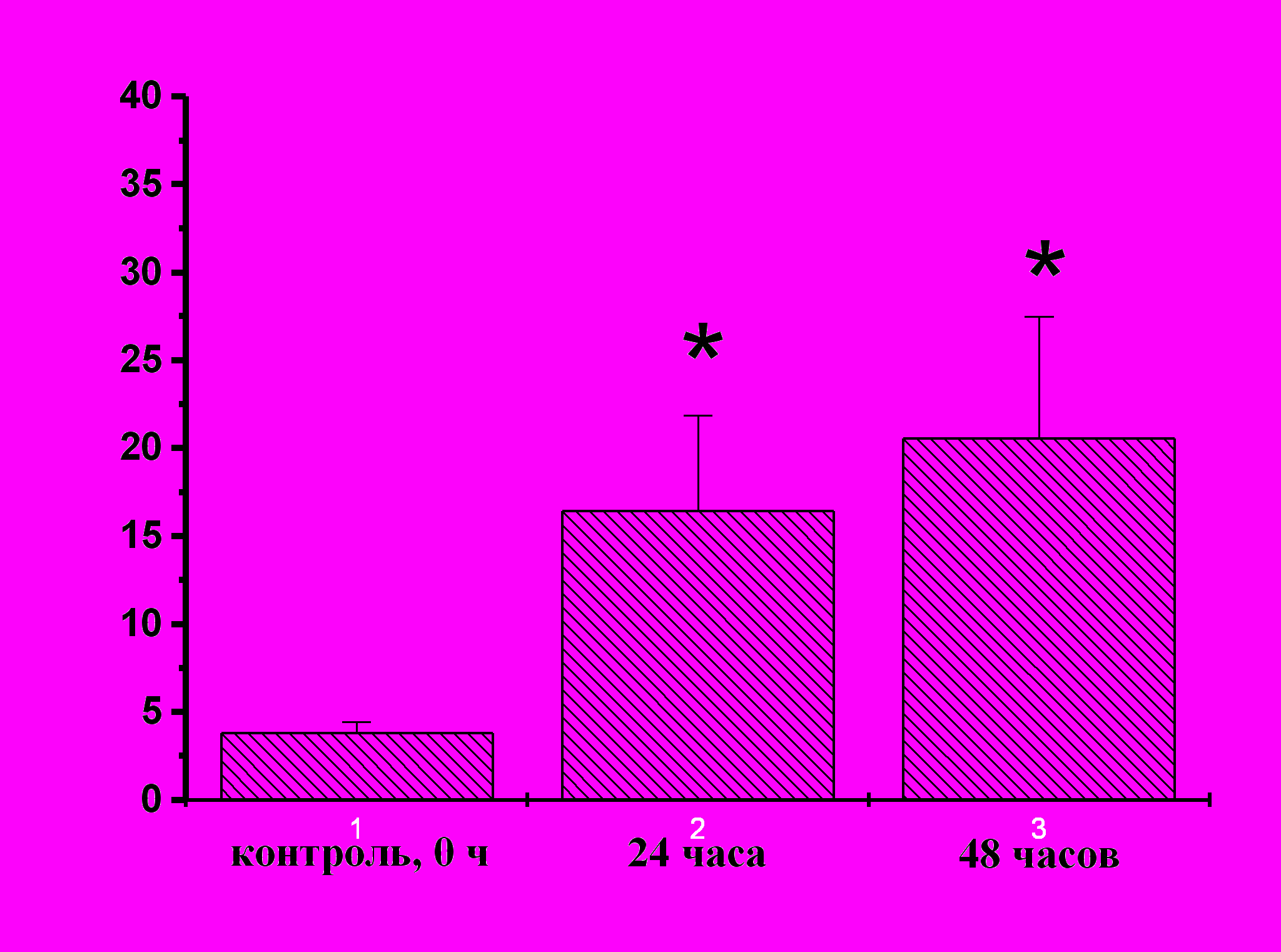 | 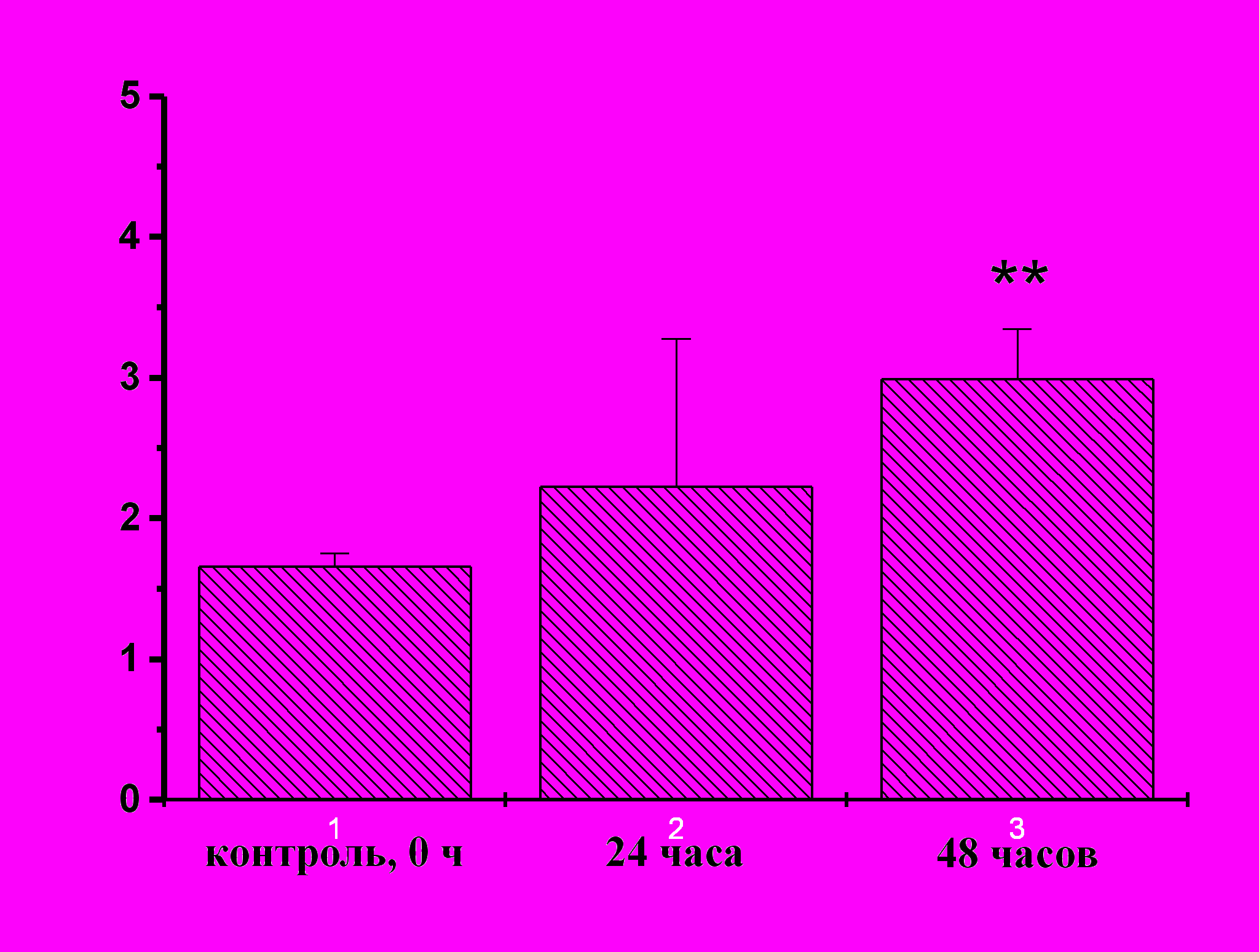 |
| Рис. 15. Оценка уровня пролиферации гемоцитов асцидии H.purpurea в ответ на повреждение с использованием PI (слева) и антител к антигену Ki-67 (справа). По оси абсцисс: сроки после повреждения; по оси ординат: процент клеток, находящихся в S-фазе клеточного цикла для PI, или процент позитивных клеток по белку Ki-67; X±s, n≥12. | |
Обобщенный анализ динамики аналогов или гомологов адгезионных молекул приведен в табл. 2. Хотя все собранные в этой таблице антитела в той или иной степени являются адгезионными молекулами, два антитела (CD90 и CD117), скорее, выявляют активационные маркеры: CD117 является молекулой c-kit, связывающимся с рецептором SCF, в то время как CD90 связывается с экстраклеточными доменами сигнальных тирозинкиназ (семейств lck и fyn) и тирозинфосфатаз (CD45) (Stuermer С. Et al., 2004).
Таблица 2.
Обобщенный анализ изменения связывания моноклональных антител к адгезионным молекулам с циркулирующими гемоцитами через 24 ч после тканевого повреждения внутри выделенных популяций.
| Антитела к | А | В | С |
| CD29 (1-цепь интегринов) | | | |
| CD34 (адгезионная молекула стволовых клеток) | | | |
| CD62P (Р-селектин) | | | |
| CD54 (ICAM-1) | | | |
| CD90 (Thy-1) | | | |
| CD117 (c-kit) | | | |
| Обозначения: | |||
| - изменения не более 1% - изменения от 1 до 5% - изменения от 5 до 10% - изменения свыше 10% | популяция А (гемобласты + гиалиновые амебоциты) популяция В (макрофагоподобные клетки) популяция С (морулярные клетки + гранулоциты) | ||
В ответ на повреждение покровов, сопряженное с массированной потерей циркулирующих клеток, происходит существенное снижение уровня экспрессии маркеров на клетках популяции С, сформированной морулярными клетками и гранулоцитами. Из этого правила есть только одно исключение – прирост уровня маркера, связывающегося с антителами к CD90 (рис. 8), хотя, принимая во внимание сигнальный характер путей, и это наблюдение может иметь логичное объяснение. Не исключено, что высокое и достоверное повышение на клетках всех популяций (А, В, С) уровня экспрессии молекулы CD90 как раз отражает усиление межклеточной кооперации в ответ на повреждение тканей. По всем остальным маркерам клетки популяции С отвечают на травму выраженным снижением плотности маркеров. Принимая во внимание, что клетки этой популяции являются самыми дифференцированными среди циркулирующих гемоцитов (Горышина Е.Н., Чага О.Ю. 1990), и, учитывая их роль в восстановлении туники в ответ на тканевое повреждение, эти клетки расходуются быстрее всего.
Не менее логичным выглядит снижение уровня экспрессии адгезионных молекул, характерных для стволовых клеток позвоночных, на клетках популяции А. Принимая во внимание их наименьшую зрелость среди всех циркулирующих клеток асцидий и наличие в этой популяции возможных стволовых клеток в виде гемобластов, снижение экспрессии рассматриваемых маркеров может объясняться как выходом незрелых клеток из циркуляции для последующей дифференцировки в тканях, так и сменой маркеров по ходу дифференцировки в циркуляции и превращения в клетки других популяций (В или С).
С этой точки зрения клетки популяции В отражают картину динамической смены поверхностных маркеров в условиях ответных клеточных реакций на тканевое повреждение (снижение уровня экспрессии CD34, CD62P), трансформацию части клеток популяции А в клетки популяции В, а также активацию клеток самой популяции В, относящихся к числу самых активных фагоцитов (Rowley A.F., 1981; Fuke M., 2001).
Изменения уровней экспрессии указанных молекул согласуются с результатами оценки уровня синтеза цитокиноподобных молекул гемоцитами H.purpurea in vitro. Методом ИФА показано, что гемоциты асцидии секретируют в надосадочную среду факторы, взаимодействующие с моноклональными антителами против TNF-, IL-10, IL-4 и IFN человека. Обращает на себя внимание, что наличие синтеза TNF для асцидий предполагалось и ранее, на основании наличия у них гена, гомологичного гену TNF человека. Находка высокого уровня синтеза молекул, обладающих антигенным перекрестом с молекулами IL-10 и IFN в двухдетерминантном ИФА, носит приоритетный характер, и хотя требует перепроверки с использованием молекулярно-биологических методов, позволяет предполагать гораздо большую древность этих важнейших цитокинов, чем считалось ранее, а также их возможное появление задолго до становления системы приобретенного иммунитета, с которой их традиционно связывают.
Обобщая полученные в ходе работы данные можно предложить возможную схему гемопоэза у асцидии H.purpurea (рис. 16). Гемобласты являются клетками-предшественниками для гиалиновых амебоцитов, гранулоцитов и морулярных клеток. При этом гиалиновые амебоциты могут быть переходной стадией от гемобластов к макрофагоподобным клеткам. У колониальных асцидий предлагается похожая схема гемопоэза, однако в ней гранулоциты являются предшественниками морулярных клеток (Ballarin L., Cima F., 2005). По нашим данным, генез морулярных клеток из гранулоцитов представляется спорным. Структура гранул морулярных клеток и гранулоцитов не имеет ничего общего (рис. 2 и 4), к тому же, мы обнаружили, что морулярные клетки при всех размерах и любом числе гранул обладают способностью к автофлуоресценции, а гранулоциты со своей стороны, занимают на dot-plot гистограмме с проточного цитометра положение, сильно отличающее их от морулярных клеток (рис. 7). Выдвинутую гипотезу косвенно подтверждают и результаты анализа уровня экспрессии адгезионных молекул стволовых клеток на гемоцитах (табл. 2).
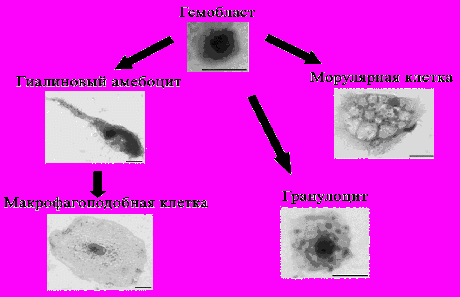
Рис. 16. Вероятная схема гемопоэза асцидии H.purpurea.
Полученные при этом приоритетные результаты по пролиферации циркулирующих клеток и схеме их поверхностных маркеров в ответ на тканевое повреждение позволяют с большим обоснованием выдвинуть гипотезу о формировании системы циркулирующих стволовых клеток уже у низших хордовых.
ВЫВОДЫ
1. Циркулирующие гемоциты асцидии Halocynthia purpurea включают 5 основных популяций клеток: лимфоцитоподобные гемобласты; гиалиновые амебоциты, содержащие минимальное число гранул при окрашивании по Маллори; крупные макрофагоподобные клетки, способные к фагоцитозу и содержащие гранулы; гранулоциты, содержащие многочисленные гранулы; морулярные клетки, содержащие крупные, заполненные плотным содержимым вакуоли.
2. Использование метода проточной цитометрии обеспечивает разделение основных популяций циркулирующих клеток асцидии Halocynthia purpurea: морулярных клеток, гранулоцитов, макрофагоподобных клеток и общей популяции гиалиновых амебоцитов и гемобластов. Установлена автофлуоресценция морулярных клеток.
3. Гемоциты асцидии Halocynthia purpurea способны к спонтанной и фагоцитоз-индуцированной продукции активных форм кислорода, поглощению красителя нейтральный красный, изменению уровня экспрессии мембранных рецепторов в ответ на тканевое повреждение и секреции молекул, обладающих антигенным перекрестом с TNF, IFN и IL-10 человека. Растворимые бактериальные липополисахариды не изменяют уровня кислородного метаболизма. Установлена необходимость кооперации клеток для повышения уровня продукции активных форм кислорода.
4. По результатам иммунохимического анализа с гемоцитами асцидии Halocynthia purpurea связываются моноклональные антитела к CD29, CD34, CD54, CD62P, CD90, CD117 человека. Не обнаружено взаимодействия с антителами к CD15, CD62L, CD94 и CD166.
5. С использованием метода проточной цитометрии показано, что у интактных животных менее 4% циркулирующих гемоцитов асцидии Halocynthia purpurea находились в синтетической фазе клеточного цикла, в то время как через 24 ч после тканевого повреждения их доля возрастала в 3 раза, а через 48 ч – в 5 раз.
6. Тканевое повреждение вызывает через 24 ч изменения состава циркулирующих гемоцитов асцидии Halocynthia purpurea, уровня экспрессии их поверхностных маркеров.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
Статьи (в т.ч. в изданиях, рекомендованных ВАК РФ):
1. Сухачев А.Н., Кудрявцев И.В., Полевщиков А.В. Разработка методов фракционирования циркулирующих гемоцитов асцидии Halocynthia purpureae // Цитология.- 2008.- Т.50, №9.- С. 824-825.
2. Сухачев А.Н., Кудрявцев И.В., Романюк Д.С., Кумейко В.В., Харазова А.Д., Полевщиков А.В. Продукция активных форм кислорода гемоцитами различных фракций асцидии Halocynthya purpurea // Вест. Санкт-Петербургского универ. серия 3: Биология.- 2008.- №3.- С. 22-29.
3. Сухачев А.Н., Кудрявцев И.В., Полевщиков А.В. Цитометрический анализ клеточных популяций асцидии Halocynthia purpurea // Росс. аллергол. журн. – 2009. - № 3, вып. 1. – С. 306-307.
Тезисы докладов:
1. Сухачев А.Н., Кудрявцев И.В. Клеточные реакции врожденного иммунитета асцидий: продукция активных форм кислорода // Бюлл. Север. госуд. мед. универ.- 2008.- Вып. ХХ, №1.- С. 41-42.
2. Сухачев А.Н., Кудрявцев И.В., Романюк Д.С., Полевщиков А.В. Оценка углеводной специфичности гемагглютининов гемолимфы асцидии Halocynthia purpurea // Росс. иммунол. журн..- 2008. - Том 2 (11), № 2-3. - С.162-163.
3. Сухачев А.Н., Кудрявцев И.В., Романюк Д.С., Полевщиков А.В. Функциональная характеристика клеточных фракций асцидии Halocynthia purpurea // Росс. иммунол. журн..- 2008. - Том 2 (11), № 2-3. - С.162.
4. Сухачев А.Н., Кудрявцев И.В., Полевщиков А.В. Оценка влияния различных модельных антигенов на пино- и фагоцитарную активности циркулирующих клеток асцидии Halocynthia purpurea // Сибир. мед. журн. - 2008.- Т.23, №3(1).- С.119.
5. Сухачев А.Н., Кудрявцев И.В., Полевщиков А.В. Разработка методов оценки функциональной активности гемоцитов в защитных реакциях асцидий // Матер. Всеросс. Конф. с межд. участ. «Водные и наземные экосистемы: проблемы и перспективы исследований» - 2008. - С. 98-101
6. Сухачев А.Н., Кудрявцев И.В., Полевщиков А.В. Исследование динамики клеточных популяций и репаративной способности асцидии Halocynthia purpurea // Цитология. – 2009. – Т.51. – С. 788.
7. Сухачев А.Н., Дьячков И.С., Романюк Д.С., Полевщиков А.В., Кудрявцев И.В. Изменения уровня цитокинов в ходе репаративного процесса у низших хордовых животных // тез. межд. науч. конф. «Молодь – медицинi майбутнього» – 2010 – С. 55-56.
