Ремоделирование миокарда и функциональные резервы сердечно-сосудистой системы при ревматических заболеваниях 14. 00. 39 ревматология
| Вид материала | Документы |
- Проблемы гипоксии при заболеваниях сердечно-сосудистой системы. Применение препарата, 483.23kb.
- Исследование сердечно-сосудистой системы, 2098.29kb.
- Рекомендации по питанию при сердечно-сосудистых заболеваниях Какие продукты питания, 110.46kb.
- Сборник статей по применению аппарата полимаг-01 Магнитотерапия при заболеваниях сердечно-сосудистой, 328.49kb.
- Лечебно-диагностическая программа при заболеваниях сердечно-сосудистой системы, 34.54kb.
- Расписание лекций по патологической физиологии на VI семестр 2011 2012 учебного года, 13.37kb.
- Базовая программа эндоэкологической реабилитации (при заболеваниях сердечно-сосудистой, 47.41kb.
- Нарушение деятельности сердечно-сосудистой системы. Контроль артериального давления., 171.88kb.
- Л. В. Мальцева Биология, 8 класс Урок, 75.75kb.
- Автореферат разослан 2011, 574.55kb.
p<0,05
Рис.14. Достоверные корреляционные связи ТКИМ и показателями СМАД у больных ССД.
При ГВ у 2 (6,7%) пациентов определялось утолщение КИМ более 0,9 мм с обеих сторон, хотя в целом по группе больных ГВ отличий от группы контроля по величине КИМ выявлено не было (справа 0,58±0,32 мм, слева 0,59±0,28 мм, р=0,615 и р=0,703 соответственно). Выявлены достоверные различия между ТКИМ у больных ГВ с АГ и без АГ (0,65±0,23 мм против 0,49±0,21 при р=0,043) (рис.15).
Рис.15. ТКИМ ОСА у больных ГВ с АГ и без АГ.
При повышении активности заболевания при ГВ наблюдалось утолщение КИМ ОСА (R = 0,54 при р=0,01). Корреляционный анализ выявил достоверные положительные взаимосвязи ТКИМ ОСА и возраста пациентов ГВ (R=0,5 при р=0,002). Отмечены достоверные положительные корреляции между индексами нагрузки давлением, средним АД и ТКИМ ОСА (таблица 12).
При НАА были выявлены наиболее выраженные как структурные, так и функциональные нарушения. Отмечено достоверное увеличение КИМ по отношению к группе контроля (р=0,0001). На ТКИМ у больных НАА влияли длительность заболевания (R=0,46; p=0,02) и активность васкулита (ИКАВ, R=0,52; p=0,04), ТМЖП и ММЛЖ (R=0,38 при р=0,03 и R=0,32 при р=0,04 соответственно). Различия между ТКИМ у больных НАА без АГ и с АГ составляют 25% (0,72±0,25 мм и 0,9±0,29 мм соответственно, р=0,031) . Достоверные корреляционные связи между ТКИМ и показателями СМАД представлены на рисунке 16.
Таблица 12
Корреляционная зависимость между ТКИМ ОСА и показателями СМАД у больных ГВ
-
Показатель
R
p
ТКИМ ОСА слева и среднее САД_днем
0,44
0,015
ТКИМ ОСА слева и среднее ДАД днем
0,48
0,02
ТКИМ ОСА слева и индекс времени САД днем
0,59
0,002
ТКИМ ОСА слева и индекс времени ДАД днем
0,58
0,003
ТКИМ ОСА слева и среднее САД ночью
0,57
0,001
ТКИМ ОСА слева и среднее ДАД ночью
0,53
0,02
ТКИМ ОСА слева и индекс времени САД ночью
0,54
0,015
ТКИМ ОСА слева и индекс времени ДАД ночью
0,52
0,03
ТКИМ ОСА справа и индекс времени САД ночью
0,62
0,003
ТКИМ ОСА справа и индекс времени_ДАД ночью
0,49
0,02
ТКИМ ОСА справа и индекс времени_САД днем
0,67
0,01
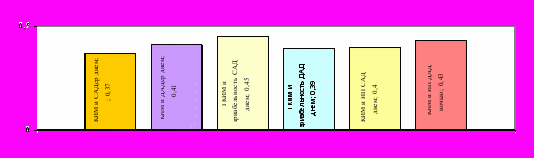
Рис. 16. Достоверные корреляционные связи ТКИМ и показателями СМАД у больных НАА.
При УП ТКИМ была достоверно взаимосвязана с ИКАВ и возрастом больных УП (R=0,47, р=0,03 и R=0,51, р=0,005). У больных УП без АГ ТКИМ составила 0,64±0,16 мм, тогда как с АГ она достигла 0,89±0,13 мм (р=0,01). Достоверные корреляционные связи между ТКИМ и показателями СМАД при УП немногочисленны и представлены на рисунке 17.
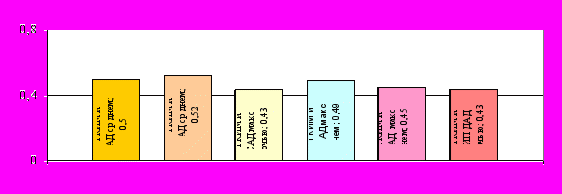
p<0,05
p<0,05
Рис. 17. Достоверные корреляционные связи между ТКИМ и показателями СМАД при УП.
При ОТ ТКИМ не отличалась от контрольных значений (р>0,05). У больных ОТ без АГ ТКИМ составила 0,49±0,09 мм и с АГ 0,64±0,15 при р=0,012.
Ремоделирование сосудистой стенки является сложным полиэтиологическим процессом, влияя на отдельные звенья которого возможно предотвращение многих осложнений основного заболевания, снижение риска развития цереброваскулярных поражений. Проанализировано влияние липидного спектра на ТКИМ (таблица 13).
Таблица 13
Липидный спектр у больных РЗ
| Группы | Липиды, ммоль/л | КА, у.е. | |||
| ОХС | ХС ЛПВП | ХС ЛПНП | ТГ | ||
| РЗ с АГ | 4,96±0,2 | 1,27±0,1 | 5,2±1,2 | 1,5±0,1 | 3,1±0,2 |
| РЗ без АГ | 4,78,1±0,2 | 1,2±0,1 | 4,58±0,69 | 1,49±0,1 | 3,2±0,3 |
| ГБ | 5,21±0,15 | 1,17±0,1 | 4,97±0,15 | 1,61±0,15 | 3,4±0,6 |
| АТ | 6,4±0,11 | 0,98±0,06 | 5,28±0,12 | 2,15±0,07 | 5,5±0,2 |
| Контроль | 4,1±0,1 | 1,34±0,31 | 3,37±0,69 | 0,96±0,29 | 2,4±0,53 |
Особенностью липидограммы у больных РЗ как с наличием АГ, так и без нее, явились более низкие показатели концентрации ХС ЛПВП и более высокие показатели КА в отличие от аналогичных параметров липидного спектра у больных ГБ и контроля.
У больных РЗ с АГ выявлена прямая корреляционная связь средней силы между ТГ, КА и СМАД (r=0,31, p=0,04 и r=0,4, p=0,01 соответственно). В группе больных РЗ как с АГ, так и без АГ параметры ОХС, ХС ЛПНП и КА зависели от активности процесса (r=0,42, p=0,01, r=0,53, p=0,001, r=0,45, p=0,001 соответственно). Установлены прямые корреляционные связи между концентрацией ОХС, КА и СРБ сыворотки крови (r=0,46, p=0,002, r=0,48, p=0,003 соответственно).
У больных РЗ без АГ установлена обратная корреляционная связь между КА, прямая – между ХС ЛПВП и длительностью заболевания (r=-0,43, p=0,02, r=0,27, p=0,03). У больных РЗ независимо от наличия АГ выявлены прямые корреляционные связи с ТКИМ ОСА и степенью активности (r=0,46, p=0,02), атерогенными фракциями липидов (r=0,39, p=0,015), маркерами воспалительного процесса (r=0,44, p=0,02).
Многочисленными исследованиями, проведенными в разных странах, показано, что вероятность возникновения атеросклероза прямо пропорциональна содержанию ХС ЛПНП и обратно пропорциональна содержанию ХС ЛПВП. Таким образом, полученные данные о состоянии липидного обмена у больных РЗ, свидетельствуют о повышении атерогенности сыворотки крови у данных больных, что является дополнительным фактором риска сосудистых поражений и гемодинамических нарушений при изучаемых заболеваниях, в частности нарушениях внутрисердечной и центральной гемодинамики.
Анализ состояния липидного обмена у больных РЗ показал, что наиболее выраженные изменения были выявлены у больных СКВ и ССД. Уровень ОХС у больных СКВ (4,83±0,37 ммоль/л) и ССД (4,69±0,42 ммоль/л) был выше, чем в контрольной группе (4,19±0,1 ммоль/л). Концентрация ЛПНП и ТГ в сыворотке крови больных СКВ (5,51±2,09 ммоль/л и 1,89±1,12 ммоль/л соответственно) и ССД (4,71±1,68 ммоль/л и 1,761±0,98 ммоль/л) также была выше по сравнению с контролем (3,37±0,69 ммоль/л и 0,82±0,29 ммоль/л). Индекс атерогенности также был выше при СКВ и ССД (3,07±1,2 и 2,7±1,3), чем в группе контроля (2,4±0,53). Содержание ЛПВП было ниже у больных СКВ и ССД (1,109±0,3 ммоль/л и 1,18±0,3 ммоль/л соответственно) по сравнению с контрольной группой (1,34±0,31 ммоль/л).
Полученные сведения о состоянии липидного обмена, в основном совпадают с литературой, которые указывают на снижение ЛПВП и повышение уровня ОХС, ЛПНП, ТГ и, следовательно, на повышение атерогенности сыворотки крови. Можно предположить, что индукция атероматоза зависит от факта хронического аутоиммунного воспаления.
В данном клиническом исследовании отмечалось: неадекватное увеличение ЧСС и АД в ответ на ФН и значительный прирост показателей КДО и КСО. В то же время отсутствовало должное снижение показателя УПСС в ответ на ФН. Указанные гемодинамические нарушения отмечались на фоне увеличения исходной концентрации адреналина и норадреналина, а также снижения исходной концентрации ГКС. Одновременно отсутствовало адекватное повышение концентрации вазоактивных аминов и ГКС в ответ на стрессовую ситуацию - физическую нагрузку.
ЧСС у больных СКВ до ФН практически не отличалась от контрольных цифр (74,4±8,9 в 1 минуту, контроль 72,3± 9,7 1 в минуту, p=0,26), после ФН увеличение ЧСС у больных было менее выражено (при СКВ на 16%, а у контроля на 67,9%). САД до ФН у больных СКВ превышало контрольные значения (125,423,48 мм.рт.ст., контроль 112,459,12 мм.рт.ст., p=0,003), а после ФН прирост САД у контрольной группы был значительно выше (на 29,7%) и на 9,3% соответственно). ДАД до ФН было также несколько выше у больных СКВ (80,78±20,55 мм.рт.ст., а у контроля 74,899,02 мм.рт. ст., р=0,116), однако увеличение ДАД после ФН выявлено у больных на 8,8%, в то время как у контроля отмечено не было. УО в покое у больных СКВ был достоверно выше по сравнению с контрольной группой (79,525,8 мл в сравнении с 63,116,2 мл, р=0,002). После ФН УО равномерно увеличился: на 40% у контрольной группы и на 36,3% у больных СКВ. В то время как показатели ФВлж до ФН у больных СКВ, оставаясь удовлетворительными, были ниже, чем у контрольной группы (69,86,3% и 70,55,3% у контроля, p=0,571) и увеличились также равномерно - на 11,2% в группе контроля и 9,3% у больных СКВ. КДОлж в покое был несколько выше в группе больных СКВ (p=0,003) и увеличился после ФН на 16,5%, в то время как в контрольной группе на 9,8 %.
У больных СКВ исходно отмечалось достоверное повышение концентрации адреналина по сравнению с контрольной группой (р=0,0001), норадреналина (р=0,0001), серотонина (р=0,0001) и снижение концентрации ГКС (р=0,0001). После пробы с ФН отсутствовал адекватный прирост уровня катехоламинов. В группе контроля концентрация адреналина возрастала на 112,4%, норадреналина на 46,4%, а при СКВ происходило снижение концентрации адреналина на 7,8%, норадреналина на 1,1%. В группе контроля после ФН отмечалось увеличение концентрации серотонина на 34,2%, а у больных СКВ концентрация не изменялась (0,89%). После ФН концентрация ГКС так и не достигла должных значений у больных СКВ (0,779±0,06 мкг/мл) (рисунок 18).
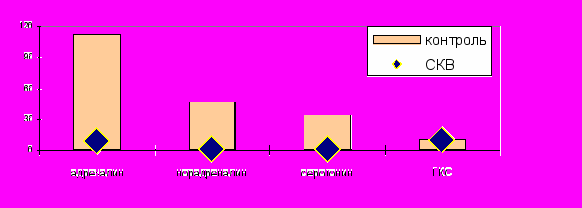
Рис. 18. Реакция вазоактивных аминов и ГКС на ФН при СКВ.
ЧСС у больных ССД до ФН практически не отличалась от контрольных цифр (69,7±6,5 в минуту, контроль 72,3±9,7 в минуту, p=0,04), в то время как после ФН увеличение ЧСС у больных было менее выражено (при ССД на 17,4 %, а у контроля на 67,9%). САД до ФН у больных ССД не превышало контрольные значения (113,413.97 мм.рт.ст., контроль 112,459,12 мм.рт.ст. (р=0,728), а после ФН прирост САД у контрольной группы был выше (ССД 22,7%, контроль 29,7%). ДАД до ФН было недостоверно ниже у больных ССД (70,811,67 мм.рт.ст., а у контроля 74,899,02 мм.рт.ст., р=0,085), однако увеличение ДАД после ФН выявлено у больных на 18,5%, в то время как у контроля отмечено не было. Показатели УО в покое были достоверно выше у больных ССД (78,623,5 и 63,116,2 соответственно, р=0,001), после ФН увеличились - на 40,0% у контрольной группы и на 14,1% у больных ССД. Показатели ФВлж выброса до ФН были несколько ниже, чем у контрольной группы (68,5±5,7% и 70,5±5,3%, р=0,1), а увеличение показателей после ФН составило 11,2% в группе контроля и всего 2,6% у больных ССД. КДОлж в покое был выше в группе больных ССД (131,4±24,3 и 103,2±19,2 соответственно, р=0,0002) и увеличился после ФН на 13,7%, в то время как в контрольной группе на 9,91%. Имея практически равные показатели КСОлж, КСРлж до ФН в обеих сравниваемых группах, отмечено увеличение КСОлж после ФН в группе больных ССД на 30%, а в контрольной группе на 1%. Сравнивая показатели УПСС, надо отметить выраженную тенденцию к снижению последнего после ФН у контрольной группы на 50,3 %, а у больных ССД лишь на 27,5% (p=0,015) при достоверно не различающихся показателях УПСС в покое (29,4±5,4 у.е. у контроля и 30,86,1 у.е. у больных ССД, p=0,273).
После пробы с ФН у больных ССД отмечалось снижение уровня адреналина на 10,7%, в группе контроля концентрация адреналина возрастала на 112,4%. Концентрация норадреналина после ФН возрастала на 10,1%, в группе контроля - на 46,4%. В группе контроля после ФН отмечалось увеличение концентрации серотонина на 34,2%, а у больных ССД на 30,9%. После ФН концентрация ГКС, хоть и увеличилась на 17,2%, но так и не достигла должных значений (рисунок 19).
ЧСС у больных СВ до нагрузки достоверно не отличалась от контрольных цифр (71,57±6,3 в минуту, контроль 72,3±9,7 в минуту, p=0,614) (таблица 52), после ФН увеличение ЧСС у больных было менее выражено (СВ на 17,2%, а у контроля на 67,9%). До нагрузки САД было достоверно выше значений в контрольной группе (р=0,015), а после ФН прирост САД у контрольной группы был выше (СВ на 15,2%, контроль на 29,7%. ДАД до нагрузки имело тенденцию к снижению у больных СВ (р=0,02), однако увеличение ДАД после ФН определялось у больных СВ на 15,2% (у больных НАА на 9,4%), в то время как у контроля отмечено не было. Показатели УО в покое между этими двумя группами достоверного различия не имели (67,3520,5 мл и 63,116,2 мл соответственно при р=0,283), а после ФН увеличились - на 40,0% у контрольной группы и на 4,8% у больных СВ. При НАА УО в покое был ниже контрольных цифр (УО=60,112,4 мл, р=0,36), а после ФН увеличился на 20,4%. Показатели ФВлж у больных СВ соответствовали контрольной группе. Сравнивая показатели УПСС, надо отметить выраженную тенденцию к снижению последнего после ФН у контрольной группы на 49,7 %, а у больных СВ на 38,4% при достоверно не различающихся показателях УПСС в покое (29,4±5,4 у.е. у контроля и 31,26,6 у.е. у больных СВ при р=0,161).
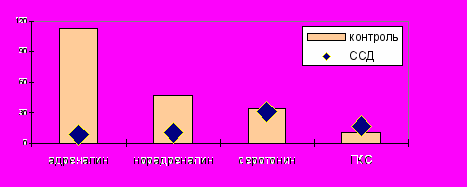
Рис. 19. Реакция вазоактивных аминов и ГКС на ФН при ССД.
При ФН отмечалось увеличение уровня медиаторов и ГКС как в группе контроля, так и при СВ. Однако темп прироста отличался. Темп прироста: уровня адреналина в контрольной группе 43,8%, при СВ - 9,3%; норадреналина – 112,4% и 12,47% соответственно; серотонина – 34,2% и 20,6 соответственно; ГКС – 10,3% и 14,4% соответственно (рисунок 20).
Таким образом, у больных РЗ отмечались: неадекватное увеличение ЧСС и АД в ответ на ФН, значительный прирост показателей КДОлж и КСОлж, в то же время, отсутствие должного снижения показателя УПСС в ответ на физическую нагрузку. Указанные гемодинамические нарушения отмечались на фоне увеличения исходной концентрации адреналина и норадреналина, а также снижения исходной концентрации ГКС.
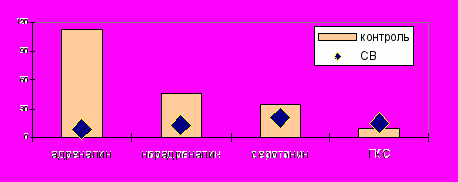
Рис. 20. Реакция вазоактивных аминов и ГКС на ФН при СВ.
После ФН ритм сердца при РЗ изменялся следующим образом. У 53,1% пациентов был значительно удлинен восстановительный период, количественные параметры SDNN, rMSSD сохранялись на предельно низких значениях, доля симпатического воздействия на синусовый ритм преобладала над парасимпатическим рефлекторным влиянием. Было нарушено также соотношение LF/HF. Если на высоте нагрузки у больных РЗ значение его составило 6,5±1,2, то на 20-й минуте данный показатель регистрировался на отметке 2,8±0,76. Возвращение LF/HF к исходному значению в течение 20 минут восстановительного периода не произошло. В группе контроля в ответ на ФН происходило уменьшение RRNN (р=0,001), снижение мощности HF-компонентов спектра (р=0,015), повышение мощности VLF, LF и соотношения LF/HF (р=0,001). После 5-минутного периода восстановления в группе контроля основные показатели ВРС возвращались к исходному уровню. У больных РЗ в течение первых 10 мин восстановления амплитуда симпатических и парасимпатических волн нарастала постепенно, замедленно за счёт снижения гуморально-метаболических волн. Лишь к 20 мин показатели ВРС вернулись к исходным значениям, соответственно на высоте нагрузки и спустя 20 мин восстановительного периода: LF/HF с 6,5±1,2 ед. до 2,37±0,9 у.е., SDNN с 162,2±24,3 мс до 135,1±24,3 мс, rMSSD с 134,5±19,8 мс до 95,2±12,2 мс. У 253 (91,3%) больных РЗ были выявлены признаки вегетативного дисбаланса. LF/HF=6,5±1,2 подтверждало доминирующее влияния симпатического отдела вегетативной нервной системы при хроническом течении патологического процесса.
Наиболее выраженная тенденция к снижению со стороны абсолютных значения LF наблюдалась у больных ГБ по сравнению с больными РЗ (21,5% по сравнению с 5,1%). В контрольной группе отмечен прирост LF на 7,8%.Наивысшая степень прироста симпатико-парасимпатического соотношения отмечена в контрольной группе – 371,8%. У больных РЗ LF/HF составил 182,6%, у больных ГБ 135%. Прирост этих параметров отражает степень усиления симпатических влияний на синусовый ритм при выполнении ФН и зависит от ремоделирования сердечно-сосудистой системы.
Приведенные выше данные свидетельствуют о снижении вагусной активности и нарушение баланса вегетативных влияний на синусовый ритм в пользу симпатического отдела вегетативной нервной системы у больных РЗ, причём ВРС снижается при нарастании тяжести заболевания. При РЗ отмечается недостаточная функциональная активность эрготропного вегетативного звена и нарушение регуляции межсистемного вегетативного тонуса с гиперсимпатикотонией в сердечно-сосудистой системе на фоне общей относительной парасимпатикотонии.
При проведении пробы с ФН наиболее рельефные изменения ВРС обнаружены у больных РЗ, где снижение ТР составило 34,1% от исходных значений. При ГБ абсолютные значения этого параметра снижались гораздо меньше (на 29,9%), а относительное убывание этого параметра достоверно не отличалось от больных РЗ (р=0,06). В контрольной группе «потери» ТР были минимальными и составили 7,9%. Снижение этого критерия при ФН у больных РЗ и ГБ является проявлением синдрома ремоделирования сердечно-сосудистой системы. Вместе с тем необходимо иметь в виду, что исходно нормальные значения ТР при РЗ свидетельствуют о превалировании функциональных расстройств регуляции сердечного ритма над органическими.Степень изменения этих показателей, отражающих парасимпатическую активность представлена на рисунке 21.
Таким образом, можно предположить, что при РЗ имеет место следующий механизм: аутоиммунное воспаление, повреждение кардиомиоцитов и/или нарушение микроциркуляции, снижение сократительной способности миокарда, снижение сердечного выброса, компенсирующееся повышением активности САС, постоянно высокий уровень катехоламинов приводит к десенситизации, снижению чувствительности рецепторного аппарата и уменьшению толерантности к ФН, тем самым вызывая порочный круг развития ХСН.
  |   |   |
Рис. 21. Распределение мощности спектра ВРС в покое и при ФН у больных РЗ и ГБ.
Выводы
- Вовлечение сердечно-сосудистой системы имело место у 187 (67,5%) больных ревматическими заболеваниями, причем спектр изменений варьировал от бессимптомной (латентной) диастолической дисфункции у 46 (16,6%) и адаптивного ремоделирования ЛЖ у 93 (33,6%) до развития дезадаптивного ремоделирования миокарда с признаками хронической сердечной недостаточности у 48 (17,3%) человек.
- Доказана роль воспалительного компонента в формировании ремоделирования миокарда, нарушений внутрисердечной гемодинамики и артериальной гипертензии. Получена прямая статистически значимая корреляционная зависимость между размерами межжелудочковой перегородки, задней стенки левого желудочка и степенью активности заболевания у пациентов СКВ по шкалам активности SLAM, SLEDAI, ECLAM (r=0,63, p=0,007 и r=0,57, p=0,002), индексом клинической активности васкулита (ИКАВ) (r>0,3, р<0,05) и степенью активности при ССД (r=0,51, р=0,007 ; r=0,54, p=0,04).
- У больных ревматическими заболеваниями обнаружено достоверное утолщение комплекса интима-медиа, которое коррелировало с возрастом и активностью воспаления (r=0,43, р=0,015 и r=0,37, р=0,02). У 46,9% больных ТКИМ превышала 0,9 мм. Взаимосвязь ТКИМ с показателями ММлж и ТМЖП (r=0,47, р=0,006 и r=0,51, р=0,01) указывает на общий механизм ремоделирования для всех уровней сердечно-сосудистой системы.
- При СКВ активность заболевания определяла выраженность гипертрофических процессов миокарда левого желудочка (r=0,57, р=0,005) и диастолическую дисфункцию (r=-0,43, р=0,023). У больных ССД высокая активность также ассоциировалась с гипертрофией миокарда левого желудочка (r=0,52, р=0,015), но диастолическая дисфункция определялась в первую очередь длительностью заболевания (r=-0,44, р=0,024). При СВ явной зависимости между выраженностью гипертрофии миокарда и клиническими показателями не обнаружено, диастолическая функция ЛЖ зависела от длительности васкулита (r=-0,46, р=0,032).
- Артериальная гипертензия выявлена у 50,9% больных ревматическими заболеваниями. При СКВ артериальная гипертензия встречалась у 57,8% пациентов, при ССД – у 52,3%, при СВ – у 43,6%. Суточный профиль артериального давления у больных РЗ характеризовался повышением средних значений и показателей нагрузки давлением и превалированием лиц с недостаточным снижением давления в ночные часы на фоне гиперактивации симпатоадреналовой системы c повышением уровня вазоактивных аминов (адреналина и норадреналина, р<0,05).
- Неблагоприятные типы суточного профиля АД (non-dipper и night-peaker) отмечены у 47,3% больных РЗ и связаны с возрастом пациентом (r=0,52, р=0,007), активностью воспаления (r=0,44, р=0,01) и наличием артериальной гипертензии (r=0,59, р=0,0001). Выраженный дисбаланс суточного профиля артериального давления в сторону ночных индексов при РЗ лежит в основе более серьезного нарушения структурно-функционального состояния миокарда по сравнению с изолированной АГ.
- Больные ревматическими заболеваниями независимо от наличия или отсутствия АГ имели диастолическую дисфункцию левого желудочка. Максимальная выраженность изменения объемных показателей присутствовала у пациентов СКВ и ССД. Достоверная корреляционная связь (r=0,64) между типом диастолической функции левого желудочка и диастолической функции правого желудочка при РЗ подтверждает фактор межжелудочкого взаимодействия. Тип диастолической функции левого желудочка у больных РЗ соответствовал типу диастолической функции правого желудочка в 64,2%, а в 6,1% диастолическая дисфункция правого желудочка была более выражена.
- У больных РЗ выявлялись геометрические типы левого желудочка, обусловленные как перегрузкой его объемом, так и давлением и отмечался как адаптивный концентрический, так и дезадаптивный эксцентрический вариант. Нормальную геометрическую модель сердца имели 59,2%, эксцентрическую гипертрофию ЛЖ 18,4%, концентрическую гипертрофию 19,5% и концентрическое ремоделирование 2,9% больных.
- Состояние вегетативной регуляции сердечно-сосудистой системы у больных РЗ характеризовалось выраженным напряжением симпатической нервной системы с достоверным повышением концентрации катехоламинов (норадреналина на 3,9%, адреналина на 43,8%, р=0,0001). Данные процессы коррелировали с индексами активности SLEDAI и SLAM, а также с ИКАВ (r>0,3, р<0,05). Гиперсимпатикотония является одним из факторов, приводящих к формированию и прогрессированию сердечной недостаточности.
- Нарушение нейрогуморальной регуляции сердечно-сосудистой системы у больных РЗ характеризовалось отсутствием увеличения концентрации катехоламинов и серотонина в ответ на физическую нагрузку (р>0,05), в то время как у контрольной группы прирост концентрации адреналина составил 112,4%, норадреналина на 46,4%%, серотонина – на 34,2%. Отсутствие прироста концентрации адреналина, норадреналина и серотонина при нагрузке и адекватного изменения гемодинамических показателей характерно для феномена десенситизации миокарда. У обследованных больных РЗ отмечено достоверное снижение исходной концентрации ГКС на 11,9 %. После пробы с физической нагрузкой концентрация ГКС, хотя и увеличилась на 13,8% при РЗ (контроль на 10,3%) , но так и не достигла должных значений.
- Надсегментарная вегетативная дисфункция у больных РЗ характеризуется широким спектром клинических проявлений, наиболее распространенными из которых были различные формы адаптационных расстройств (90,3%). У 53,8% больных РЗ возникали вегетативные кризы. Наиболее дезадаптивными среди изученных заболеваний является НАА. Нарушение адекватной надсегментарной вегетативной регуляции подтверждается данными КИГ и КОП, согласно которым у большинства обследованных больных (58,4%) на фоне патологического вегетативного обеспечения деятельности с преобладанием недостаточных вариантов (29,6%) в сердечно-сосудистой системе доминирует эрготропный тонус, а вегетативная реактивность в большинстве случаев имеет гиперсимпатикотонический характер.
- Показатели вариабельности ритма сердца были достоверно ниже у больных РЗ по сравнению с контролем. При РЗ отмечено нарушение соотношения симпатических и парасимпатических составляющих спектра за счет активации первого его компонента. Лишь у 11,6% больных ревматическими заболеваниями анализ ВРС свидетельствовал об адекватном вегетативном обеспечении.
