Ремоделирование миокарда и функциональные резервы сердечно-сосудистой системы при ревматических заболеваниях 14. 00. 39 ревматология
| Вид материала | Документы |
- Проблемы гипоксии при заболеваниях сердечно-сосудистой системы. Применение препарата, 483.23kb.
- Исследование сердечно-сосудистой системы, 2098.29kb.
- Рекомендации по питанию при сердечно-сосудистых заболеваниях Какие продукты питания, 110.46kb.
- Сборник статей по применению аппарата полимаг-01 Магнитотерапия при заболеваниях сердечно-сосудистой, 328.49kb.
- Лечебно-диагностическая программа при заболеваниях сердечно-сосудистой системы, 34.54kb.
- Расписание лекций по патологической физиологии на VI семестр 2011 2012 учебного года, 13.37kb.
- Базовая программа эндоэкологической реабилитации (при заболеваниях сердечно-сосудистой, 47.41kb.
- Нарушение деятельности сердечно-сосудистой системы. Контроль артериального давления., 171.88kb.
- Л. В. Мальцева Биология, 8 класс Урок, 75.75kb.
- Автореферат разослан 2011, 574.55kb.
Рис. 4. Достоверные корреляционные связи структурно-функциональных показателей ЛЖ с активностью и длительностью заболевания при СКВ (р<0,05).

Рис. 5. Достоверные корреляционные связи структурно-функциона-льных показателей ЛЖ с активностью и длительностью заболевания при ССД (р<0,05).
Рис. 6. Достоверные корреляционные связи структурно-функциона-льных показателей ЛЖ с активностью и длительностью заболевания при СВ (р<0,05).
Максимальное число пациентов РЗ имели нормальную модель (НМ) сердца (n=164; 59,2%), эксцентрический (ЭГЛЖ) и концентрический (КГЛЖ) тип гипертрофии ЛЖ отмечены у 51 (18,4%) человека и 54 (19,5%) больных соответственно и у 8 (2,9%) - концентрическое ремоделирование (КРЛЖ) (рис.7). Таким образом, у больных РЗ выявлялись геометрические типы ЛЖ, обусловленные как перегрузкой ЛЖ объемом, так и давлением. При этом отмечался как дезадаптивный эксцентрический вариант ремоделирования, так и адаптивный концентрический вариант ремоделирования миокарда ЛЖ.

Рис 7. Геометрические типы ЛЖ при РЗ.
В качестве показателя, отражающего взаимосвязь систолической функции ЛЖ с особенностями его геометрии, использовался интегральный систолический индекс ремоделирования (ИСИР). При РЗ, АТ и ГБ ИСИР был достоверно ниже, чем в группе контроля (ИСИР=98±17,5, ИСИР=94,1±25,2, ИСИР=117±19,8, р<0,010 (рис. 8). Низкие значения ИСИР у больных РЗ (-16,2%), АТ (-19,6%) и ГБ (-54,4) отражают наименее благоприятное соотношение сниженной сократительной способности миокарда и сферизации ЛЖ, что было максимально выражено у больных ГБ. У больных РЗ значения ИСИР свидетельствуют о сохраненной систолической функции ЛЖ при его эллипсоидной форме. ИСИР практически не различался между группами больных с НМ и КГЛЖ (86,7±15,9 и 87,4±16,3 соответственно, р=0,609). У больных с КРЛЖ этот показатель имел наибольшее значение (93,8±13,1), отражая уменьшение полости ЛЖ, сопровождающееся развитием эллипсоидной формы ЛЖ и некоторым увеличением ФВлж, что направлено на поддержание УО. Самые низкие значения ИСИР были отмечены у больных с ЭГЛЖ (48,9±18,2), которые были почти в 2 раза ниже показателей других групп. Следовательно, наиболее неблагоприятным в плане прогноза развития систолической дисфункции можно считать ЭКГЛ.
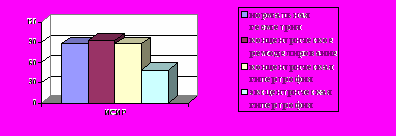
Рис 8. ИСИР при РЗ при различных профилях ремоделирования.
Индекс относительной толщины стенок ЛЖ (ИОТ) был увеличен по сравнению с контрольной группой (0,38±0,07) у больных РЗ (0,46±0,09, р=0,0001), ГБ (0,49±0,12, р=0,0001) и достоверно не отличался при АТ (0,37±0,13). Высокие значения ИОТ свидетельствовали о преобладании процессов гипертрофии миокарда над дилатацией полостей. Количественным отражением величины пост- и пред- нагрузки ЛЖ является миокардиальный стресс (МСс). При всех исследуемых нозологических формах МСс был достоверно выше, чем в контрольной группе (РЗ – 75,3±12,6 г/см² , р=0,0001; ГБ – 104,9±47,8 г/см², р=0,0001; АТ – 76,93±18,9 г/см², р=0,0001; контроль – 56,17±10,47 г/см²). Повышение МСс является предиктором развития гипертрофии миокарда ЛЖ.
При анализе зависимости от типа ремоделирования ЛЖ МСс у больных РЗ с КРЛЖ был выше, чем у больных с нормальной геометрией ЛЖ. Данный факт мог стать одним из пусковых механизмов формирования гипертрофии миокарда ЛЖ. У больных с ЭГЛЖ МСс характеризовался более высокими значениями, что может отражать дезадаптивный характер ремоделирования миокарда и неспособность нормализовать все возрастающую нагрузку (рис. 9). Изменения данного показатели в зависимости от геометрии ЛЖ были однотипными и при ГБ. В связи с этим можно считать, что в формировании типа ремоделирования миокарда основная роль принадлежит повышенному артериальному давлению.
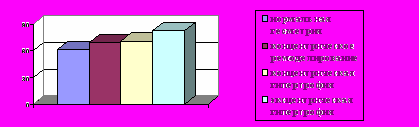
Рис 9. МСс при различных профилях ремоделирования у больных РЗ.
По имеющимся данным литературы, значения показателя ИСИР диагностически является более точным в плане оценки нарушения систолической функции левого желудочка. У пациентов РЗ с АГ ИСИР был достоверно ниже (р=0,002) в сравнении с больными без АГ. Сочетание с достоверно большими значениями МСс у больных РЗ свидетельствовало о более быстром нарастании систолической дисфункции левого желудочка и дальнейшем переходе адаптивного ремоделирования в дезадаптивное у пациентов РЗ с АГ, имеющих более выраженные изменения геометрии левых камер сердца в сравнении с больными РЗ без АГ.
При проведении корреляционного анализа была выявлена положительная корреляционная связь между показателями ИСИР и КСРлж (r=0,49), КДРлж (r=0,73), ОТСлж (r=0,73), а также отрицательная с ИСд (r=-0,87) у пациентов РЗ с АГ. Полученные данные свидетельствуют о наличии четкой взаимосвязи между нарушениями систолической функции ЛЖ у пациентов с артериальной гипертензией и структурно-геометрической перестройкой левых отделов сердца, даже при сохраненной ФВлж.
У 51 больного РЗ с КРЛЖ масса миокарда ЛЖ не изменялась, происходило увеличение ОТСлж и уменьшение полости ЛЖ. ИСд составил 0,51±0,06, ЛЖ приобретал более эллипсоидную форму. У 54 человек РЗ с КГЛЖ была увеличена масса миокарда ЛЖ, относительная толщина стенок ЛЖ и ИСд=0,57±0,08. При ЭГЛЖ у 8 больных РЗ была увеличена масса миокарда ЛЖ, диаметр полости ЛЖ и ИСд=0,62±0,09. Максимальный ИСд выявлен у больных АТ (0,72±0,18).
У больных СКВ и ССД изменения внутрисердечной гемодинамики и геометрии ЛЖ были однотипными, но менее выраженными при ССД. Исключение составляла толщина стенки левого желудочка при ССД (ТМЖП=11,9±3,7 мм, р=0,0001 и ТЗСлж=11,5±4,1 мм, р=0,025), что значительно превышало показатели больных СКВ.
Единой находкой среди обследуемых больных РЗ было нормальное состояние систолической функции, хотя ФВлж и была несколько ниже средних в группе сравнения (-4,7%, р<0,05). При этом во всех 6 группах было отмечено возрастание КСОлж, а в пяти (за исключением ОТ) – увеличение КДОлж.
Полученные результаты позволили сделать заключение, что больные с СКВ, ССД и СВ независимо от наличия или отсутствия АГ, имели диастолическую дисфункцию. Максимальная выраженность изменения объемных показателей и наиболее выраженная диастолическая дисфункция присутствовала у пациентов с СКВ и ССД.
Следует отметить, что наибольшие изменения были выявлены у больных РЗ с наличием АГ, что, вероятно, связано с имеющейся гипертрофией миокарда и его ремоделированием (таблица 4).
ТМЖП и ТЗСлж были сравнимы у здоровых лиц и у больных РЗ без АГ. Точно также не различались между собой по этим показателям группы больных АГ и РЗ с АГ. Таким образом, выраженность гипертрофических процессов в миокарде левого желудочка, несомненно, определялась АГ в обеих сравниваемых группах.
У больных с АГ имелись признаки ремоделирования сердца: величины ТЗСлж и ОТСлж были выше, а КДО/ММлж – ниже, чем в контроле, но систолическая функция ЛЖ оказалась сохраненной у больных обеих подгрупп. КДРлж и КДОлж у больных с ревматической патологией и без нее при наличии АГ возрастали. КСОлж возрастал в обеих сравниваемых группах, но в группе с АГ значительно больше, чем у пациентов РЗ с ГБ. УО у больных РЗ с АГ повышался незначительно по сравнению с больными ГБ. Размеры левого предсердия были увеличены в обеих гипертензивных группах, однако у больных ГБ этот рост был большим.
Существенные различия параметров внутрисердечной гемодинамики выявлены у больных СКВ с артериальной гипертензией и без АГ (таблица 5). КДРлж и КСРлж, размер ЛП, КДОлж и КСОлж, толщина стенок ЛЖ были достоверно выше у пациентов СКВ с АГ и СКВ без АГ (таблица 5). КДРлж при СКВ с АГ составил 47,42±5,76 мм, а при СКВ без АГ 38,80±6,56 мм при р = 0,001.
Отмечена тенденция к увеличению полости левого желудочка при повышении выраженности АГ и степени активности СКВ по шкале SLAM (r=0,38 при р=0,05 – для КДРлж). Между величиной УО, ЛП и синдромом артериальной гипертензии выявлены достоверные положительные корреляции (таблица 6).
Таблица 4
Показатели внутрисердечной гемодинамики у больных
с артериальной гипертензией и без АГ
| Показатель | РЗ без АГ n =136 m±sd | РЗ с АГ n =141 m±sd | Контроль группа n =32 m±sd | ГБ n = 70 m±sd | Достоверность р |
| ЛП | 34,28 ±4,17 | 37,80 ±6,56 | 31,6 (29; 33) | 39,8 (30; 40,4) | Ι и ΙΙ = 0,006 Ι и ΙΙΙ = 0,005 Ι и IV = 0,001 ΙΙ и III = 0,001 ΙI и IV = 0,06 ΙΙΙ и IV = 0,023 |
| КДРлж | 47,42± 3,76 | 53,23 ±3,43 | 48,28±7,5 | 55,3±3,6 | Ι и ΙΙ = 0,0001 Ι и ΙΙΙ = 0,9 Ι и IV = 0,001 ΙΙ и III = 0,005 ΙI и IV = 0,007 ΙΙΙ и IV = 0,004 |
| КДОлж | 102,33 ±16,38 | 147,30 ± 22,92 | 103,2±19,2 | 139,41±12,9 | Ι и ΙΙ = 0,001 Ι и ΙΙΙ = 0,14 Ι и IV = 0,001 ΙΙ и III = 0,01 ΙI и IV = 0,07 ΙΙΙ и IV = 0,001 |
| КСОлж | 32,76 ± 11,60 | 51,91 ± 17,37 | 36,8±10,5 | 72,4±9,3 | Ι и ΙΙ = 0,001 Ι и ΙΙΙ = 0,053 Ι и IV = 0,001 ΙΙ и III = 0,01 ΙI и IV = 0,03 ΙΙΙ и IV = 0,002 |
| УО | 64,32 ± 17,12 | 76,38 ± 15,62 | 63,1±16.2 | 94,27 ± 21,62 | Ι и ΙΙ = 0,06 Ι и ΙΙΙ = 0,07 Ι и IV = 0,03 ΙΙ и III = 0,04 ΙI и IV = 0,05 ΙΙΙ и IV = 0,003 |
| ТМЖП | 8,66 ±1,82 | 10,14 ± 2,23 | 8,6±2,2 | 11,9±1,32 | Ι и ΙΙ = 0,02 Ι и ΙΙΙ = 0,08 Ι и IV = 0,001 ΙΙ и III = 0,02 ΙI и IV = 0,06 ΙΙΙ и IV = 0,003 |
| ТЗСлж | 8,83 ± 0,98 | 10,04 ± 0,92 | 8,3±1,7 | 11,7±3,43 | Ι и ΙΙ = 0,002 Ι и ΙΙΙ = 0,054 Ι и IV = 0,015 ΙΙ и III = 0,01 ΙI и IV = 0,07 ΙΙΙ и IV = 0,02 |
Таблица 5
Показатели внутрисердечной гемодинамики у больных
СКВ с АГ и СКВ без АГ
| Показатель | СКВ без АГ n=43 m±sd | СКВ с АГ n=59 m±sd | р |
| ЛП | 34,28±6,67 | 38,80±6,56 | 0,001 |
| КДРлж | 47,42±5,76 | 54,23±4,43 | 0,001 |
| КДОлж | 97,33±26,38 | 147,30±32,92 | 0,001 |
| КСОлж | 32,76 ±11,60 | 51,91±17,37 | 0,0009 |
| УО | 64,32±17,12 | 94,27±21,62 | 0,0004 |
| ТМЖП | 8,66±0,82 | 10,14±1,23 | 0,0002 |
| ТЗСлж | 8,83±0,98 | 10,04±0,92 | 0,0001 |
Таблица 6
Достоверные корреляционные взаимосвязи показателей внутрисердечной гемодинамики в зависимости от наличия артериальной гипертензии у больных СКВ
| Показатель | r | p |
| ЛП и АГ | 0,45 | 0,02 |
| КСРлж и АГ | 0,44 | 0,02 |
| КСОлж и АГ | 0,58 | 0,002 |
| УО и АГ | 0,48 | 0,02 |
| ТМЖП и АГ | 0,38 | 0,05 |
Следует отметить четкие различия параметров ЭХОКС у пациентов ССД с АГ, в сравнении с больными ССД без АГ. Так, размеры ЛП и ТЗлж были достоверно больше при ССД с АГ ( 39±1,73 мм против 31±3,2 мм при р=0,02 и 1,3± 0,2 мм против 1,0±0,1 мм при р=0,01). Других статистически значимых различий между пациентами ССД с АГ и без АГ не обнаружено.
Статистически значимых различий между параметрами внутрисердечной гемодинамики у пациентов СВ с АГ и без АГ не выявлено.
Таким образом, для наблюдаемых больных с АГ было характерно закономерное увеличение ММлж с довольно высокими объемными показателями и сохраненной систолической функцией. У пациентов РЗ артериальная гипертензия при этой же интенсивности гипертрофических процессов сопровождалась значительной объемной перегрузкой и снижением сократительной способности миокарда левого желудочка. Последний вариант гемодинамических нарушений является более неблагоприятным.
Для пациентов РЗ было характерно нарушение суточного профиля АД в сравнении с группой контроля (таблица 7). Суточный профиль АД у больных РЗ характеризовался преобладанием неблагоприятных суточных ритмов типа night-peaker (11,9%) и non-dipper (35,4 %), в то время как у здоровых лиц он чаще ассоциировался с нормальным вариантом (dipper – 84,4%).
Таблица 7
Суточный профиль АД при РЗ и ГБ
| СНСАД | Контроль n=32 абс., % | ГБ n=70 абс., % | РЗ (абс., %) | |
| РЗ без АГ n=136 | РЗ с АГ n=141 | |||
| Dipper | 27(84,4) | 34(48,6) | 73(53,6) | 49(34,8) |
| Non-dipper | 1(3,1) | 29(41,4) | 42(30,9) | 56(39,7) |
| Over-dipper | 4(12,5) | 3(4,3) | 11(8,1) | 13(9,2) |
| Night-peaker | 0(0) | 4(5,7) | 10(7,3) | 23(16,3) |
Тип «dipper» определялся только у 38 (37,3%) больных СКВ, у 17 (28,8%) больных СКВ с АГ и у 21 (48,8%) пациентов СКВ без АГ. Тип профиля АД «night-peaker» с ночной гипертензией зарегистрирован только у больных СКВ с АГ – 11 (18,6%). В группе контроля и у больных СКВ без АГ тип “night-peaker”не зафиксирован. У 9 (15,3%) больных СКВ с АГ и у 7 (10,8%) больных СКВ без АГ имело место чрезмерное ночное падение АД – «over-dipper», среди здоровых лиц – у 4 человек (12,5%) (таблица 8).
Таблица 8
Суточные ритмы АД у больных РЗ
| СНСАД | Контроль n=32 | СКВ | СВ | ССД | |||
| СКВ с АГ n=59 | СКВ без АГ n=43 | СВ с АГ n=48 | СВ без АГ n=62 | ССД с АГ n=34 | ССД без АГ n=31 | ||
| Dipper | 27 | 17 | 21 | 17 | 29 | 15 | 23 |
| Non-dipper | 1 | 22 | 15 | 24 | 20 | 10 | 7 |
| Over-dipper | 4 | 9 | 7 | 0 | 3 | 4 | 1 |
| Night-peaker | 0 | 11 | 0 | 7 | 10 | 5 | 0 |
Вариант суточного профиля АД «dipper» встречался у 23 (74,2%) больных ССД без АГ и у 15 (44,1%) пациентов с АГ. У больных ССД с АГ тип «non-dipper» отмечен у 10 (29,4%) , а без АГ – у 7 (22,5%) человек. У 5 (14,7%) больных ССД с АГ регистрировалась ночная гипертензия - вариант «night-peaker», при ССД без АГ и у группы контроля данный тип профиля не отмечен. У 4 (11,8%) пациентов ССД на фоне АГ зафиксирован тип профиля over- dipper.
При СВ у 17 (15,4%) человек отмечалась ночная гипертензия – суточный профиль АД «night-peaker». Недостаточное снижение АД в ночные часы – тип профиля АД «non-dipper» наблюдалось у 44 (40%) пациентов СВ.
Встречаемость нормального индекса СМАД («dipper») была значительно снижена у больных с ГБ и в обеих группах больных с РЗ (с и без АГ). При этом самая низкая частота «dipper» отмечена у пациентов РЗ с АГ; она была достоверно ниже, чем при ГБ. В группу больных РЗ с АГ также достоверно чаще, чем в у здоровых лиц и людей с ГБ встречалась ночная гипертония – тип профиля АД «night-peaker» (суточный индекс отрицательный). Суточный профиль с чрезмерным ночным падением АД – «over-dipper» (суточный индекс более 20%) – одинаково часто наблюдался по всех обследованных группах. Недостаточное снижение АД в ночные часы – «non-dipper» (СИ=0-10%) было отмечено во всех группах по сравнению со здоровыми людьми. Более высокая встречаемость этого показателя зарегистрирована в гипертензивных группах (таблица 9).
Таблица 9
Суточный профиль артериального давления при РЗ и ГБ
-
СНСАД
Контроль
n=32
ГБ
n=70
РЗ
РЗ без АГ
n=136
РЗ с АГ
n=141
Dipper
27(84,4)
34(48,6)*
73(53,6)*
49(34,8)*+
non-dipper
1(3,1)
29(41,4)*
42(30,9)*+
56(39,7)*
over-dipper
4(12,5)
3(4,3)
11(8,1)
13(9,2)
night-peaker
0(0)
4(5,7)
10(7,3)*
23(16,3)*+
Примечание: * - р<0,05 по сравнению с группой контроля, + - р<0,05 достоверность различий между группами РЗ и ГБ.
Таким образом, при СКВ, ССД и СВ неблагоприятные значения показателей СМАД чаще всего были связаны с возрастом пациентов и активностью воспалительного процесса. Гипертонические изменения параметров СМАД с очень высокой степенью достоверности сопровождались нарушениями внутрисердечной гемодинамики, включая гипертрофию миокарда, расширение полостей и диастолическую дисфункцию. Выраженный дисбаланс суточного профиля АД в сторону ночных индексов при РЗ, вероятно, лежит в основе более серьезного нарушения структурно-функционального состояния миокарда по сравнению с влиянием изолированной АГ.
У больных РЗ получены многочисленные достоверные взаимосвязи между показателями внутрисердечной гемодинамики и СМАД. Степень активности патологического процесса при СКВ (шкала SLEDAI) была достоверно выше у пациентов СКВ с АГ в сравнении с больными без АГ (24 и 15 баллов при р=0,04- соответственно). С повышением активности СКВ наблюдалась тенденция к повышению среднесуточного АД, индексов нагрузки давлением и недостаточной степени ночного снижения АД. С увеличением возраста больных СКВ отмечена естественная тенденция к повышению САД и увеличение вариабельности ритма сердца.
Наиболее выраженное влияние на параметры СМАД при ССД оказывали возраст больных, длительность патологического процесса и в меньшей степени активность (r=0,57, r=0,58, r=0,19), при СВ – степень активности заболевания и возраст больных. Степень выраженности синдрома Рейно при ССД отрицательно коррелировала со значением СНСАД для САД (r=-0,57). Выявлено, что при повышении среднего АД и его вариабельности у больных ССД наблюдались признаки ДД.
Таким образом, выраженность отклонений от нормы показателей СМАД у больных РЗ находилась в прямой зависимости от длительности заболевания, активности воспалительного процесса и наличия признаков АГ.
Изучение ВРС выявило, что показатель соотношения СНС и ПСН (L/F) на 35,3% выше при РЗ (р=0,0015), что свидетельствует о преобладании симпатических влияний. Показатели влияния ПСН (PNN50 (мс) и RMSSD (мс) снижены у 66,8% и повышены у 33,2%, что свидетельствует о дисбалансе механизмов вегетативной регуляции. ЭКГ без нарушений ритма зарегистрирована у 31% больных РЗ. Нарушения ритма чаще наблюдались при РЗ с АГ - 75,2%, при РЗ без АГ - 63%. Избыточное вегетативное обеспечение достоверно коррелировало с наличием КГЛЖ и КРЛЖ (r=0,43 и r=0,47), недостаточное вегетативное обеспечение - с ЭКЛЖ (r=0,51).
Активность отдельных уровней управления ритмом сердца оценивалась по данным спектрального анализа. Так общая мощность нейрогуморальной регуляции (ТР) при РЗ была выше на 3,7% (р=0,001), при ГБ - ниже на 23% (р=0,001). При РЗ и ГБ преобладали волны самой низкой частоты, что свидетельствует об усилении нейрогуморальных влияний.
С учетом этих данных представляется актуальным изучение нейрогуморальных влияний на гемодинамические механизмы при РЗ.
В целом в группе РЗ отмечалось достоверное повышение концентрации медиаторов эрготропного ряда (норадреналина, адреналина) и их метаболитов (5-ОИУК). Наиболее выраженными сдвигами в системе эрготропных медиаторов характеризовалась СКВ и ССД.Со стороны трофотропных нейротрансмиттеров (гистамин-гистаминаза, серотонин), наблюдалась подобная, но не равнозначная тенденция: в то время как содержание гистамина во всех группах больных в 2 и более раз превышало контрольные значения (0,067±0,017 мкг/мл и 0,024±0,003 мкг/мл, р=0,0001 соответственно), концентрация серотонина (0,103±0,014 мкг/мл и 0,073±0,005 мкг/мл, р=0,0001), хотя и увеличивалась, но в меньшей степени. При всех формах РЗ отмечено достоверное увеличение активности гистаминазы, более значимое при ССД (на 95,2%), ОТ (на 85,8%), ГВ (на 77,9%). МАО имела достоверную тенденцию к повышению во всех группах, за исключением ОТ, а содержание ОИУК имело тенденцию к повышению у больных с СКВ, ССД и НАА, в целом в группе РЗ незначительно достоверно отличалось от контрольных значений (р=0,047). В то же время активность серотонинсинтетазы при РЗ не отличалась от контрольных значений (р=0,708). Коэффициент гистамин/гистаминаза возрастал в группе в целом на 84% (0,025±0,007 в контроле, 0,046±0,014, р=0,0001). Коэффициент серотонин/МАО был повышен практически у всех групп больных (0,187±0,101 в контроле и 0,211±0,013 при РЗ, р=0,002). Коэффициент серотонин/ОИУК также имел в целом тенденцию к увеличению, но достоверную только при СКВ (0,397+0,078). Изменения коэффициентов наряду с динамикой абсолютных показателей медиаторов позволяют предположить относительное снижение уровня ингибиторных систем. Данный факт можно трактовать как разбалансированность гуморальных реакций, что способствует формированию порочного круга в патогенезе РЗ.
При СКВ концентрация адреналина была значительно увеличена (0,154±0,014 мкг/мл при контроле 0,105±0,015 мкг/мл, р=0,0001) и коррелировала с тяжестью процесса (R=0,3, p=0,021), фазой обострения (R=0,34, p=0,015), активностью (R=0,57, p=0,001), трофическими расстройствами кожи (R=0,67, p=0,02), капилляритами (R=0,13, p=0,015), синдромом Рейно (R=0,12, p=0,003), полиартралгиями (R=0,18, p=0,004), миокардиодистрофией (R=0,67, p=0,02), нефритом (R=0,21, p=0,004), аКЛ IgG (R=0,29, p=0,001), а-нДНК (R=0,35, p=0,024), СРБ (R=0,27, p=0,001), показателем САД покое (R=0,41, p=0,012), концентрацией адреналина, норадреналина и глюкокортикоидов после нагрузки (R=0,28, p=0,032; R=0,26, p=0,027; R=0,27, p=0,03), концентрацией серотонина в покое (R=0,32, p=0,04).
Повышенная концентрация норадреналина у больных СКВ по сравнению с контрольной группой (0,450±0,028 мкг/мл и 0,403±0,027 мкг/мл соответственно, р=0,05) достоверно коррелировала с тяжестью (R=0,65, p=0,001), активностью процесса (R=0,28< p=0,003), индексом клинической активности SLAM (R=0,79, p=0,001), наличием аКЛ IgG (R=0,19, p=0,03), а-нДНК (R=0,34, p=0,006), повышенной СОЭ (R=0,32, p=0,023), концентрацией адреналина и норадреналина после нагрузки (R=0,43, p=0,034; R=0,68, p=0,031), клиническими проявлениями поражения сердца R=0,27, p=0,034), показателями САД, КДО, КСО, КСР, КДР до и после нагрузки (p<0,05), УО, МО, СИ и ЧСС после физической нагрузки, ДАД в покое (p<0,05), толщиной ЗСЛЖ и МЖП уровнем ГКС (p<0,05).
Концентрации серотонина при СКВ повышалась до 0,112±0,008 мкг/мл (при контроле 0,073±0,005 мкг/мл, р=0,0001) и коррелировала с тяжестью заболевания (R=0,34, p=0,006), индексом активности SLAM (R=0,31, p=0,043), наличием LE- клеток (R=052, p=0,005), вторичного антифосфолипидного синдрома в анамнезе (R=0,23, p=0,013), ливедо (R=0,18, p=0,03), аллопецией (R=0,23, p=0,04), пурпурой (R=0,31, p=0,034), трофическими язвами (R=0,29, p=0,021), “сосудистой бабочкой» (R=0,34, p=0,01), тромбофлебитами (R=0,37, p=0,015), полиартралгиями (R=0,27, p=0,026), аКЛ IgG (R=0,34, p=0,018), а-нДНК (R=0,29, p=0,033), СРБ (R=0,39, p=0,002). Обратная корреляция отмечена с концентрацией ГКС в покое (R=-0,38, p=0,041). Несмотря на значительное повышение концентрации гистамина у больных СКВ по сравнению с контрольными значениями (0,085±0,011 мкг/мл и 0,024±0,003 мкг/мл соответственно) количество достоверных корреляционных зависимостей было невелико: между концентрацией гистамина и поражением почек (R=-0,2341, р=0,002) и активностью МАО (R=-0,2844, р=0,005). Имело место достоверное снижение концентрации ГКС по сравнению с контрольной группой (0,779±0,06 мкг/мл и 1,263±0,06 мкг/мл соответственно).
При ССД концентрация адреналина была значительно увеличена (0,69±0,009 мкг/мл при контроле 0,105±0,015 мкг/мл, р=0,0001), норадреналина – 0,434±0,04 мкг/л и 0,405±0,027 мкг/л при р=0,0001. При проведении корреляционного анализа выявлено снижение уровня адреналина в крови больных ССД при увеличении их возраста и активности заболевания (R=-0,64 при р=0,037; R=-0,58 при р=0,042). Повышение содержания адреналина в плазме коррелировало с САД в покое (R=0,54, p=0,04) и после нагрузки (R=0,58, p=0,03), с ДАД после нагрузки (R=0,59, p=0,043), МО и СИ после физической нагрузки (R=0,58, p=0,037; R=0,59, p=0,023). Обратная корреляция отмечена с концентрацией ГКС в покое (R=-0,51, p=0,02). Повышение концентрации норадреналина имело сходные корреляционные связи с клинико-лабораторными признаками. Уровень адреналина при ССД снижался при увеличении стадии и длительности артериальной гипертонии (R=-0,45 при р=0,018 и R=-0,51 при р=0,02). Повышение концентрации серотонина при ССД коррелировало с клиническими проявлениями поражения сердца (R=0,58, p=0,03), концентрацией норадреналина в покое (R=0,56, p=0,03), показателями КСО и КСР до нагрузки (R=0,57, p=0,001; R=0,57, p=0,019).
При СВ изменения концентрации вазоактивных аминов было аналогичными другим группам РЗ. Характерным является факт увеличения содержания концентрации серотонина плазмы, наиболее выраженный при ОТ и УП (0,140±0,034 мкг/мл, р=0,004, 0,177±0,043 мкг/мл, р=0,001 соответственно в сравнении с контрольной группой 0,073±0,005 мкг/мл). Отмечалось значительное увеличение концентрации адреналина (НАА - 0,148±0,012 мкг/мл, р=0,0001, ОТ - 0,138±0,011 мкг/мл, р=0,0001, УП - 0,146±0,018 мкг/мл, р=0,0001, ГВ - 0,149±0,012 мкг/мл, р=0,00001) по сравнению с группой контроля (0,105±0,015 мкг/мл). Концентрация норадреналина была несколько выше в группе контроля (0,405±0,027 мкг/мл мкг/мл). Уровень гистамина был значительно повышен при СВ, превышая контрольные значения более чем в 2 раза Данное увеличение имело прямую корреляцию с суставным синдромом, концентрацией СРБ и обратную корреляцию с норадреналином (R=0,43 при р=0,008, R=0,57 при р=0,001, R=-0,67 при р=0,001 соответственно).Повышение содержания адреналина в плазме коррелировало с САД, МО и СИ после ФН (R=0,35, р=0,002; R=0,43, р=0,01; R=0,54, р=0,003). Достоверные корреляционные связи в группе больных СВ в основном выявлены при ГВ и НАА.
Повышение концентрации серотонина при ГВ находилось в прямой корреляционной связи с клинико-лабораторными показателями: наличием пурпуры (R=0,21, p=0,004), ливедо (R=0,29, p=0,001), капилляритами (R=0,15, p=0,04), тромбофлебитом глубоких вен (R=0,15, p=0,03), изолированным гематурическим синдромом (R=0,14, p=0,03), артралгиями (R=0,25, p=0,009), абдоминалгиями (R=0,21, p=0,007).
Повышение концентрации адреналина при ГВ находилось в прямой зависимости с развитием трофических язв (R=0,29, p=0,002) и увеличением концентрации норадреналина (R=0,15, p=0,001).
Концентрация ГКС при ГВ значительно снижалась (0,765±0,095 мкг/мл и 1,163±0,06 мкг/мл в контрольной группе, р=0,0001). При нарастании степени выраженности кожных проявлений при ГВ отмечалось достоверное повышение уровня адреналина (R=0,43 при р=0,035). C увеличением длительности АГ регистрировалось снижение концентрации норадреналина в крови больных ГВ (R=-0,51 при р=0,04).
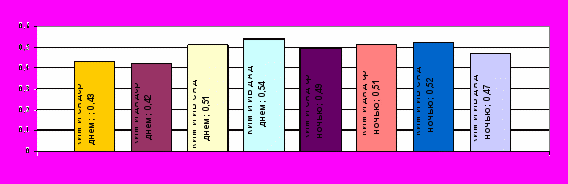
При анализе взаимосвязей показателей СМАД от уровня катехоламинов в крови пациентов ГВ наблюдались положительные корреляционные связи между показателями суточного индекса, величиной и скоростью утреннего подьема САД, дневной вариабельностью САД и концентрацией норадреналина в крови: R=0,32; 0,36; 0,41; 0,54; 0,42 соответственно при р<0,05. Значения среднего ДАД днем и ночью, индексов нагрузки давлением в ночные часы отрицательно коррелировали с уровнем адреналина в крови (R=-0,57 при р=0,002, R=-0,54 при р=0,003 соответственно, для индекса времени САД ночью R=-0,43 при р=0,03, для индекса времени ДАД ночью R=-0,51 при р=0,02.
При НАА наблюдалось повышение концентрации серотонина, которое коррелировало с фазой обострения заболевания (R=0,33, p=0,003), наличием ливедо (R=0,27, p=0,032), трофических расстройств кожи (R=0,26, p=0,03), полиартралгиями (R=0,24, p=0,02), преходящими ОНМК (R=0,19, p=0,004), головной болью/мигренями (R=0,23, p=0,009), уровнем СРБ (R=0,39, p=0,006), содержанием адреналина (R=0,21, p=0,032), ГКС (R=-0,39, р=0,02). Корреляции между содержанием адреналина и клинико-лабо-раторными показателями были подобны таковым для серотонина. Прямые корреляции отмечены с фазой обострения (R=0,34, p=0,003), ИКАВ (R=0,61, p=0,002), наличием ливедо (R=0,23, p=0,042), синдромом Рейно (R=0,18, p=0,036), повышением концентрации аКЛ IgG (R=0,23, p=0,04), СРБ (R=0,27, p=0,027), содержанием серотонина (R=0,29, p=0,003). Обратная корреляция зафиксирована с концентрацией ГКС (R=-0,19, p=0,043).
При НАА фаза обострения патологоического процесса имела прямые корреляции с выраженностью активности процесса (R=0,19, p=0,003), наличием трофических расстройств кожи (R=0,16, p=0,038), миалгиями (R=0,26, p=0,029), синдромом Рейно (R=0,15, p=0,009), полиартралгиями (R=0,41, p=0,004), повышением концентрации аКЛ IgG (R=0,26, p=0,007), СРБ (R=0,31, p=0,001), повышением уровня серотонина(R=0,34, p=0,008) и адреналина (R=0,37, p=0,003). Обратная корреляция отмечена с уровнем ГКС (R=-0,47, p=0,007) и норадреналина (R=-0,19, р=0,043). Показатель активности ИКАВ коррелировал с величиной СОЭ (R=0,34, p=0,039), концентрацией адреналина (R=0,61, p=0,008), обратная корреляция отмечена с концентрацией ГКС (R=-0,44, p=0,024).
Тяжелым осложнением НАА является нарушение мозгового кровообращения. Отмечена прямая корреляция между преходящими ОНМК и хроническим течением заболевания (R=0,33, p=0,001), артериальной гипертензией (R=0,31, p=0,003), наличием ливедо (R=0,24, p=0,007), синдрома Рейно (R=0,15, p=0,038), уровнем серотонина (R=0,045, p=0,002). Обратная корреляция имела место c концентрацией ГКС (R=-0,24, p=0,003).
Изменения коэффициентов наряду с динамикой абсолютных показателей медиаторов позволяют предположить относительное снижение уровня ингибиторных систем. Данный факт можно трактовать как разбалансированность гуморальных реакций, что способствует формированию порочного круга в патогенезе ревматических заболеваний.
У пациентов РЗ выявлено достоверное увеличение ТКИМ ОСА во всех исследуемых группах (р<0,05). ТКИМ при РЗ более 0,9 мм выявлена у 130 (46,9%) человек. ТКИМ достоверно увеличена при СКВ, ССД, НАА УП, ГБ, АТ (р<0,05); при РЗ с АГ ТКИМ больше, чем при ГБ (р=0,043). При СКВ наибольшее влияние на ТКИМ оказывали возраст (R=0,56, р=0,002), длительность заболевания (R=0,43, р=0,01)и степень активности (R=0,46, р=0,016). При СКВ толщина КИМ ОСА была положительно взаимосвязана со средним САД днем, средним ДАД ночью (R=0,46, р=0,01), и индексами нагрузки давлением (R=0,42 при р=0,042; R=0,46, р=0,01; R=0,51 при р= 0,005) (таблица 11).
Таблица 11
Достоверные корреляционные связи ТКИМ ОСА и показателей
СМАД при СКВ
| Показатель | R | р |
| Среднее САД днем и ТКИМ ОСА | 0,42 | 0,04 |
| Среднее ДАД ночью и ТКИМ ОСА | 0,46 | 0,01 |
| Индекс времени САД днем и ТКИМ ОСА | 0,51 | 0,005 |
| Индекс площади САД днем и ТКИМ ОСА | 0,44 | 0,05 |
| Индекс времени САД ночью и ТКИМ ОСА | 0,48 | 0,043 |
При ССД показатель ТКИМ ОСА достоверно (р=0,0001) отличался от группы контроля (0,89±0,15 мм, 0,55±0,1 мм соответственно). С увеличением возраста больных отмечалось увеличение ТКИМ (R=0,46 при р=0,03). Достоверных корреляционных связей между длительностью, активностью заболевания и ТКИМ не выявлено.При ССД определялись достоверные различия ТКИМ в зависимости от наличия АГ (0,79±0,14 мм и 0,94±0,26 мм при р=0,006).Выявлены достоверные корреляционные связи при ССД между ТКИМ и показателями СМАД (рисунок 14). ТКИМ ОСА увеличивалась при повышении величины и скорости утреннего подъема САД (R=0,52 при р=0,03 и R=0,44 при р=0,04).