«Технология бродильных производств и виноделие»
| Вид материала | Методические рекомендации |
- Методические рекомендации по выполнению лабораторного и научно-исследовательского практикума, 952.7kb.
- Учебное пособие по дисциплине для студентов специальности 270500 «Технология бродильных, 1164.77kb.
- Учебно-методический комплекс для студентов дневной и заочной формы обучения по специальности, 1588.96kb.
- Методические рекомендации по выполнению самостоятельной работы и изучению дисциплины, 846.76kb.
- Отчет о результатах самообследования основной образовательной программы по специальностям:, 1627.98kb.
- Рабочая программа по дисциплине опд. Ф. 12 «Микробиология» направления 260200 Производство, 368.1kb.
- Методические указания «Вопросы к зачету лабораторных работ», 128.49kb.
- Учебное пособие по дисциплине для студентов специальностей 270500 «Технология бродильных, 2133.55kb.
- Н. Г. Осенний 2012 г. Расписание, 59.13kb.
- Прикладнаямеханика лекция, доц. Воложанинов С. С. 2/150, 47.06kb.
3.2 Коллоквиум 2. Биологически активные вещества
Витамины
Какие вещества относят к витаминам?
- По какому принципу классифицируют витамины? Почему?
- Что такое антивитамины? Провитамины? Витаминоподобные вещества?
- Какие формы витамина Д существуют в природе?
- Как проявляется недостаток витамина Е? Почему его называют витамином размножения?
- В чем заключается основная биологическая роль водорастворимых витаминов?
Ферменты
Какие вещества относят к ферментам? Какова их биологическая роль?
- Какую химическую природу имеют ферменты? Что такое апофермент, холофермент, кофермент, простетическая группа?
- Какими свойствами обладают ферменты?
- Механизм действия ферментов. Активный центр, его строение.
- По какому принципу классифицируют ферменты? Назовите основные классы и приведите примеры реакций, катализируемых этими ферментами.
- Как регулируется активность ферментов? Что такое аллостерическая регуляция?
- Что такое номенклатура ферментов?
Гормоны
Какие вещества являются гормонами?
- Принципы классификации гормонов.
- Растительные гормоны.
3.3 Коллоквиум 3. Обмен веществ и энергии
Общая характеристика обмена веществ
Понятие обмена веществ. Две стороны обмена.
- Пластический и энергетический обмен.
- На какие этапы можно подразделить обмен веществ?
- Виды энергии, используемые живой клеткой.
- Какую роль играет АТФ в энергетике клетки?
- Процессы биологического окисления (тканевое дыхание).
- Назовите основные ферменты дыхательной (электрон-транспортной) цепи. Какую функцию они выполняют? Где локализованы?
- Перечислите реакции цикла Кребса. Какую роль выполняет цикл трикарбоновых кислот (ЦТК) в обмене?
- Как протекает процесс окислительного фосфорилирования в клетке?
- Что такое «индекс фосфорилирования»?
Обмен углеводов
Гликолиз, гликогенолиз и спиртовое брожение: основные этапы, сходство и различие процессов.
- Перечислите этапы аэробного окисления глюкозы до углекислого газа и воды.
- Энергетический баланс окисления глюкозы при гликолизе и при полном окислении глюкозы до СО2 и воды.
- Глюконеогенез: биологическая роль, основные этапы.
- Биологическая роль пентозофосфатного пути окисления глюкозы. Основные этапы и промежуточные продукты.
Обмен белков и нуклеиновых кислот
Какова биологическая роль белков?
- Какие белки относят к полноценным? Почему?
- Виды азотистого баланса.
- Процессы трансаминирования аминокислот: основные ферменты, коферменты, механизм трансаминирования.
- Дезаминирование аминокислот: виды дезаминирования, ферменты, коферменты.
- Процессы декарбоксилирования аминокислот. Образование биогенных аминов. Какова их биологическая роль?
- Как происходит процесс обезвреживания аммиака? Орнитиновый цикл: субстраты, ферменты, биологическая роль.
- Синтез пуриновых и пиримидиновых нуклеотидов. Основные субстраты, биологическая роль.
- Биосинтез нуклеиновых кислот: локализация процесса, основные субстраты, ферменты, источники энергии, этапы синтеза.
- Как происходит передача наследственной информации с молекулы ДНК на белок?
- Виды РНК. Строение и роль тРНК.
- Биосинтез белка: основные субстраты, этапы синтеза, регуляция процесса (схема Жакоба и Моно).
Обмен липидов
Внутриклеточный липолиз, его механизм, биологическая роль.
- Бета-окисление жирных кислот: основные этапы процесса, биологическая роль.
- Энергетический баланс окисления жирных кислот. Подсчитать количество молекул АТФ при окислении масляной кислоты, пальмитиновой, стеариновой кислот, при окислении трипальмитина.
- Синтез жирных кислот: этапы процесса, его биологическая роль. Какую функцию выполняет биотин в реакциях синтеза жиров?
Взаимосвязь различных звеньев обмена
Какие этапы являются общими при окислении глюкозы и глицерина?
- Какие аминокислоты называются кетогенными и при расщеплении превращаются в ацетил-КоА?
- Через какие промежуточные продукты аминокислоты могут включаться в цикл Кребса?
- Какую роль играет ацетил-КоА в обмене веществ?
- Взаимопревращения белков, жиров, углеводов.
4 КОНТРОЛЬНЫЕ ЗАДАНИЯ (РАБОТЫ)
Каждый студент выполняет контрольное задание. Литература для освоения курса биохимии и выполнения контрольной работы приведена на страницах 14-16 данных методических рекомендаций. В процессе подготовки и составления контрольной работы можно использовать и другую литературу по биохимии, освещающую более глубоко или с новых позиций материал изучаемого раздела.
Материал контрольной работы отражает степень усвоения студентом отдельных разделов программы, его умение самостоятельно анализировать прочитанное. Ответы на вопросы необходимо давать своими словами, не переписывая соответствующих разделов учебника. Материал излагать ясно, четко и именно так, как вы его поняли.
Оформление контрольной работы должно отвечать следующим требованиям.
1. Работа должна быть написана разборчиво и аккуратно, страницы тетради пронумерованы.
2. На специальном бланке, приклеенном к передней части обложки тетради, напишите фамилию, имя, отчество, шифр, индекс группы, номер контрольной и варианта, точный домашний адрес.
3. Работу необходимо начинать с формулировки вопроса. Ответы писать непосредственно на вопрос, без лишних рассуждений, кратко, но исчерпывающе, подтверждая их уравнениями реакций, формулами, схемами или рисунками.
4. В конце работы должны быть:
а) список использованной литературы;
б) подпись студента, выполнившего контрольную работу;
в) дата выполнения.
5. Для замечания рецензента необходимо оставлять поля и в конце тетради два листа для заключительной рецензии.
Каждый студент выполняет вариант контрольного задания в соответствии с последними двумя цифрами его шифра до номера 50. Если две последние цифры шифра больше 50, то следует из них вычесть 50 и оставшиеся две цифры будут вариантом контрольного задания. Например, студент с шифром 5138 выполняет вариант 38, а с шифром 6259 выполняет вариант 9 (6259 - 50 = 6209); студент с шифром, оканчивающимся двумя нулями, выполняет вариант 50.
4.1 Варианты контрольных заданий
Вариант 1
1. Функции белков в живом организме. Элементный состав белков. Первичная структура белков.
2. Классификация углеводов и основные принципы, на которых она основана. Назовите и напишите структурные формулы глюкозы, фруктозы, сахарозы, крахмала, гликогена.
3. Строение и каталитические функции анаэробных (пиридиновых, пиридинзависимых) и аэробных (флавинзависимых, флавиновых) дегидрогеназ. Назовите по 2-3 представителя этих дегидрогеназ и напишите уравнение катализируемых ими реакций. Что такое оксидазы?
Вариант 2
1. Характеристика первичной структуры белков. Связи, обеспечивающие стабильность этой структуры, и механизм их образования.
2. Напишите структурные формулы глюкозы, фруктозы, рибозы, сорбита, глюкаровой, глюконовой и глюкуроновой кислот, покажите взаимосвязь между этими соединениями. Биологическое значение этих соединений.
3. Химическая природа, строение, пищевые источники и биологическое значение пантотеновой кислоты. Напишите структурную формулу кофермента, содержащего этот витамин.
Вариант 3
- Какую химическую природу имеют ферменты? Что такое апофермент, холофермент, кофермент, простетическая группа?
2. Состав и физико-химические свойства растительных масел. Напишите структурные формулы основных жирных кислот, входящих в состав растительных масел, и укажите температуру их плавления. Незаменимые жирные кислоты.
3. Современная теория биологического окисления.
Вариант 4
1. Кислые и основные белки. Функциональные группы белков. Почему растворы белков обладают свойствами коллоидных растворов?
2. На каких свойствах сахаров основано их количественное определение в пищевых продуктах и сырье? Особенности количественного определения сахарозы в сырье и продуктах.
3. Методы выделения и очистки ферментов. Принципы обнаружения ферментов в биологических объектах. Единицы активности ферментов.
Вариант 5
1. Влияние на скорость ферментативной реакции значения рН, температуры, концентрации фермента и концентрации субстрата. Использование этих факторов в практической деятельности инженера-технолога.
2. Общая характеристика обмена веществ. Понятие обмена веществ. Две стороны обмена. Пластический и энергетический обмен.
3. Крахмал и клетчатка: химическая природа, строение, свойства, биологическое значение, использование в пищевой промышленности.
Вариант 6
1. Первичная структура РНК. Типы РНК и их биологическое значение.
2. Оксидоредуктазы, участвующие при β-окислении жирных кислот. Напишите химические реакции, катализируемые этими ферментами в данном процессе.
3. Энергетика анаэробной и аэробной фазы окисления глюкозы.
Вариант 7
1. Напишите схемы химических реакций ферментативного катализа жиров и фосфоглицеридов. Назовите образующиеся при этом продукты.
2. Жирорастворимые витамины, назовите и напишите формулы представителей каждой группы этих витаминов. Какие из жирорастворимых витаминов обладают антиокислительными свойствами?
3. Окислительное дезаминирование аминокислот и обезвреживание аммиака в клетках органов и тканей.
Вариант 8
1. Окислительное и неокислительное декарбоксилирование пировиноградной кислоты. Назовите ферменты и коферменты, участвующие в каждом из этих процессов. Напишите структурные формулы продуктов, образующихся в результате этих видов декарбоксилирования.
2. Строение и свойства моносахаридов на примере глюкозы, фруктозы, галактозы.
3. Промежуточные и конечные продукты гидролиза белков в клетке.
Вариант 9
1. Химизм анаэробного расщепления глюкозы (гликолиз). Напишите формулы доноров и акцепторов водорода, образующиеся при молочнокислом (гомоферментативном) брожении.
2. Нативная конформация и денатурация белков. Значение денатурации белков в пищевой промышленности.
3. Напишите формулы дисахаридов – сахарозы, лактозы, мальтозы. Пищевые источники.
Вариант 10
1. Биосинтез аминокислот в клетках. Источники азота в растениях и для животных. Использование аммиака для биосинтеза аминокислот.
2. Нуклеотиды, их строение, биологическая роль.
3. Анаэробное окисление глюкозы в клетках животных (гликолиз).
Вариант 11
1. Назовите и напишите формулы всех мономерных единиц, входящих в состав белков. Что такое гидролиз белков? Назовите продукты полного и неполного гидролиза белков.
2. Липиды: определение, биологическое значение, классификация. Напишите формулы моно-, ди- и триацилглицеринов, эргостерола, воска. Опишите характерные признаки, отличающие эти соединения друг от друга. Функции фосфолипидов в клетках.
3. Современная теория биологического окисления.
Вариант 12
1. Дайте определение вторичной, третичной и четвертичной структуры белков. Какие связи поддерживают стабильность каждой из этих структур? Приведите примеры глобулярных и фибриллярных белков.
2. Химическая природа, строение, биологическое значение и пищевые источники витамина PP. Назовите отдельные ферменты и напишите структурные формулы коферментов, в состав которых входит этот витамин.
3. Роль цикла трикарбоновых кислот (ЦТК) в обмене веществ и энергии.
Вариант 13
1. Факторы, обусловливающие устойчивость коллоидных растворов. Обратимые и необратимые реакции осаждения белков.
2. Крахмал: химическая природа, строение, ферментативные превращения, роль в пищевой промышленности.
3. Однокомпонентные ферменты и их активные группы. Строение двухкомпонентных ферментов. Коферменты и простетические группы.
Вариант 14
1. Простые белки, классификация, методы разделения и очистки: высаливание, диализ, электрофорез.
2. Специфичность действия ферментов и ее разновидности. Приведите конкретные примеры каждого вида специфичности.
3. Окислительное декарбоксилирование пировиноградной кислоты (ПВК) как этап перехода анаэробного окисления углеводов в фазу аэробного окисления. Ферменты и коферменты, участвующие в этом процессе.
Вариант 15
1. Химическое строение и название мономерных единиц РНК.
2. Биосинтез жирных кислот в живом организме.
3. Что представляют собой ферменты мультимеры, изоферменты и мультиферментные комплексы? Название и состав мультиферментного комплекса, участвующего в окислительном декарбоксилировании пировиноградной кислоты.
Вариант 16
1. Ферментативные превращения дисахаридов (сахарозы, мальтозы, лактозы) и моносахаридов (фруктозы, галактозы, маннозы) в глюкозу. Значение этих превращений для брожения.
2. Что такое нуклеотиды, нуклеозиды и полинуклеотиды? Напишите структурные формулы аденозина, уридина, гуаниловой, тимидиловой, дезокситимидиловой и дезоксиадениловой кислот.
3. Амфотерность и изоэлектрическая точка белков. Назовите и напишите формулы аминокислот, от радикалов которых зависит заряд белковой молекулы.
Вариант 17
1. Напишите химические реакции процесса дыхания, сопровождающиеся образованием восстановленных нуклеотидов (НАДФ, ФАДН2, НАДФН2).
2. Назовите и опишите химизм качественных реакций на пептидную связь, радикалы циклических аминокислот и аминогруппу в
α-положении.
3. Общие реакции биосинтеза аминокислот в растениях.
Вариант 18
1. Напишите химические реакции спиртового брожения, катализируемые ферментами из класса лиаз.
2. Вторичная структура белков. Виды, схема образования, связи, поддерживающие вторичную структуру.
3. Строение АТФ и других макроэргических соединений, их роль в обмене веществ и энергии.
Вариант 19
1. Назовите основные стадии процесса дыхания. Напишите химические реакции этих стадий, сопровождающиеся образованием восстановленных нуклеотидов. Назовите конечный акцептор водорода при дыхании.
2. Что такое иммобилизованные ферменты? Перспективы использования иммобилизованных ферментов в отраслях пищевой промышленности.
3. Водородная снизь: схема образования, значение и место возникновения при образовании вторичной, третичной и четвертичной структур белковой молекулы.
Вариант 20
1. Протеиназы и пептидазы животного организма: определение, типы катализируемых реакций, отдельные представители и их характеристика, активаторы и ингибиторы протеиназ. Атакуемость белков протеиназами и факторы, ее обусловливающие.
2. Основные макро- и микроэлементы, необходимые для построения вещества клеток.
3. Пентозофосфатный цикл, его химизм и биологическое значение.
Вариант 21
1. Принцип деления простых белков на отдельные группы. Дайте общую характеристику каждой группы простых белков и назовите отдельные белки, входящие в эти группы.
2. Орнитиновый цикл (цикл мочевины).
3. Окисление стеариновой кислоты в клетках до СО2 и Н2О. Рассчитать количество АТФ, полученного в этом процессе.
Вариант 22
1. Общее строение, кислотно-основные свойства, стереохимия (стереоизомерия) аминокислот. Напишите и назовите структурные формулы незаменимых для организма взрослого человека аминокислот.
2. Пектиновые вещества: химическая природа, строение, свойства, биологическое значение, использование в пищевой промышленности.
3. Декарбоксилирование аминокислот в клетках. Общие промежуточные продукты этого процесса и их роль в организме.
Вариант 23
1. Альбумины и глобулины животных организмов: химическая природа, массовая доля в различных видах тканей животных. Физико-химические свойства, биологическое значение, отдельные представители.
2. Активный, субстратный и аллостерический центры ферментов. Принцип образования этих центров и роль их в катализе.
3. Взаимосвязь обмена углеводов и белков в организме животных.
Вариант 24
1. Дайте характеристику двух основных, наиболее распространенных в природе типов вторичной структуры белка.
2. Напишите химические реакции брожения, в которых происходит образование и превращение фосфорных эфиров глюкозы и фруктозы.
3. Общая характеристика, классификация и биологическая роль липидов.
Вариант 25
1. Напишите химические реакции спиртового брожения, катализируемые ферментами класса трансфераз.
2. Ингибиторы ферментов: общие и специфические, конкурентные и неконкурентные, аллостерические. Механизм действия ингибиторов и значение их в ферментативном катализе.
3. Витамины: определение, история открытия, названия, классификация. Понятие о провитаминах, антивитаминах, гиповитаминозах.
Вариант 26
1. Биосинтез гликогена в организме. Роль УТФ в этом процессе.
2. Нейтральные жиры: состав, физические и химические константы, прогоркание, высыхание. Незаменимые жирные кислоты.
3. Цитохромная система, ее строение и роль в дыхательной цепи.
Вариант 27
1. Фотосинтез: световая и темновая фазы, образование НАДФН и АТФ. Продукты темновой фазы фотосинтеза.
2. Напишите структурные формулы незаменимых жирных кислот и назовите источники этих кислот в питании человека.
3. Биосинтез белка (трансляция) в клетке. Роль матричной или информационной, рибосомной и транспортной РНК в этом процессе.
Вариант 28
1. Первичная и вторичная структуры нуклеиновых кислот; природа химических связей, стабилизирующих эти структуры.
2. Световая фаза фотосинтеза.
3. Классификация аминокислот по полярности радикалов
(R-группа). Кислые и основные белки.
Вариант 29
1. Взаимосвязь между процессами брожения и дыхания. Значение пировиноградной кислоты в общей системе реакций брожения и дыхания.
2. Назовите и напишите структурные формулы коферментов, участвующих в β-окислении жирных кислот. Приведите схемы этих реакций.
3. Цикл трикарбоновых кислот (ЦТК). Вещества, окисляемые в этом процессе. Конечные продукты окисления.
Вариант 30
1. На каких свойствах белков основаны их качественное обнаружение и количественное определение? Назовите и дайте общую характеристику наиболее распространенных химических методов количественного определения белков в биологических объектах и продуктах.
2. Химическое строение ферментов, коферментов и витаминов, принимающих участие в реакциях дезаминирования, декарбоксилирования аминокислот.
3. Анаэробное окисление углеводов клетками дрожжей – спиртовое брожение. Биологическая роль процесса.
Вариант 31
1. Сложные белки, их состав, классификация и биологическое значение отдельных групп сложных белков.
2. Химическая природа, строение, биологические свойства и пищевые источники тиамина. Назовите ферменты и напишите формулы коферментов, в состав которых входит тиамин.
3. Биосинтез жирных кислот. Ферменты и коферменты, участвующие в этом процессе.
Вариант 32
1. Нативная конформация и денатурация белков. Факторы, вызывающие денатурацию белков. Значение денатурации белков в пищевой и ферментативной промышленности.
2. Химическая природа, строение, биологическое значение и пищевые источники витаминов группы Д. Химическое строение провитаминов этой группы.
3. Значение гликолиза и цикла трикарбоновых кислот (ЦТК) во взаимосвязи обмена углеводов, липидов и белков.
Вариант 33
1. Крахмал: строение, свойства, биологическая роль, распространение в пищевых продуктах.
2. Ферменты: определение, значение для жизнедеятельности организма, применение в промышленности, отличие от неорганических катализаторов; иммобилизованные ферменты и их преимущества.
3. Аэробное окисление глюкозы в живой клетке.
Вариант 34
1. Нуклеопротеины: химическая природа, состав, биологическое значение, отдельные представители.
2. Современная номенклатура и классификация ферментов. К каким классам, подклассам и подподклассам относятся ферменты амилаза и каталаза?
3. Взаимосвязь обмена углеводов и белков.
Вариант 35
1. Химическое строение и название мономерных единиц ДНК.
2. Биосинтез ацилглицеринов (нейтральных жиров) и фосфоглицеринов в тканях.
3. Окислительно-восстановительные ферменты, их строение, свойства, примеры реакций, катализируемых этими ферментами.
Вариант 36
1. Глюконеогенез. Биосинтез гликогена.
2. Назовите и напишите структурные формулы азотистых оснований, входящих в состав ДНК и РНК.
3. Хромопротеиды и металлопротеиды: химическая природа, состав, физико-химические и биологические свойства, отдельные представители.
Вариант 37
1. Брожение: определение, виды, роль в пищевой технологии, эффект Пастера и его механизм.
2. Напишите формулы восстанавливающих и невосстанавливающих дисахаридов. Объясните, почему одни дисахариды восстанавливают, а другие не восстанавливают Феллингову жидкость? Практическое использование этих свойств дисахаридов.
3. Характеристика процесса катаболизма «устаревших белков», аминокислот в клетках тканей.
Вариант 38
1. Классификация сложных белков на основании химической природы их простетических групп. Общая характеристика каждой группы сложных белков. Отдельные представители групп сложных белков.
2. Общая характеристика и биологическое значение цикла Кребса. Напишите реакции, в результате которых в этом цикле образуются восстановленные нуклеотиды, СО2 и АТФ.
3. В результате каких реакций образуются при обмене углеводов и обмене липидов 3-фосфоглицериновый альдегид и ацетил-КоА?
Вариант 39
1. Что такое лиазы, лигазы, изомеразы, трансферазы? Назовите по одному представителю из каждого класса этих соединений и напишите уравнение катализируемых ими реакции.
2. Темновая фаза фотосинтеза; продукты реакций.
3. Распад аминокислот в клетке, дезаминирование, декарбоксилирование, связывание аммиака в клетках.
Вариант 40
1. Взаимопревращение моносахаридов в клетке и синтез гликогена в организме. Роль ферментов в этом процессе.
2. Напишите структурные формулы нуклеозидов, нуклеотидов и АТФ.
3. Синтез ацилглицеринов из продуктов углеводного обмена. Роль гликолиза и пентозофосфатного цикла в этом процессе.
Вариант 41
1. Что представляют собой пептиды, полипептиды, белки? Молекулярная масса белков и методы ее определения: химический, ультрацентрифугирование, молекулярных сит (гель-фильтрация).
2. Строение гликогена, его мономер, связи в молекуле гликогена и его роль в организме.
3. Химическая природа, строение, физико-химические свойства и значение фосфоглицеридов и гликолипидов.
Вариант 42
1. Растворимость, амфотерность и изоэлектрическая точка белков. Кислые и основные белки.
2. Сахароза, мальтоза, целлобиоза: химическая природа, строение, свойства, значение в пищевой промышленности.
3. Активный и аллостерический центры ферментов, их строение и функции. Формирование активного центра.
Вариант 43
1. Роль ДНК и РНК в биосинтезе белка. Рибосомы и полисомы.
2. Активаторы и ингибиторы ферментов и механизм их действия. Аллостерические ферменты и механизм регулирования их активности.
3. Строение и биологическая роль фосфоглицеридов и восков.
Вариант 44
1. Химическая природа, строение, биологическое значение нуклеопротеидов и нуклеотидов. Напишите структурные формулы адениловой, дезоксигуаниловой, дезоксицитидиловой и уридиловой кислот.
2. Общий механизм ферментативного катализа. Что такое энергия активации? Приведите примеры снижения энергии активации катализаторами неорганического и биологического происхождения.
3. Взаимосвязь обмена белков и углеводов. Значение гликолиза и цикла трикарбоновых кислот (ЦТК) в этих процессах.
Вариант 45
1. УДФ-глюкоза: химическая природа, строение, биосинтез, участие в обмене веществ.
2. Первичная, вторичная, третичная структуры ДНК, связи, обеспечивающие стабильность этих структур. Принцип комплементарности. Правило Чаргаффа.
3. Взаимосвязь обмена углеводов и липидов. Роль ЦТК (цикла трикарбоновых кислот) в этих процессах.
Вариант 46
1. Напишите реакции спиртового брожения, катализируемые ферментами из оксидоредуктаз и изомераз.
2. Биосинтез жирных кислот в клетке, роль ацилпереносящего белка и кофермента А в этом процессе.
3. Нуклеиновые кислоты, их строение и значение для организма.
Вариант 47
1. Темновая стадия фотосинтеза. Химизм ассимиляции СО2 растениями. Конечные продукты фотосинтеза.
2. Принципы современной (систематической) классификации ферментов.
3. Биосинтез белка в клетках. Роль ДНК и РНК (матричной, транспортной, рибосомальной) в этом процессе.
Вариант 48
1. Дыхательная цепь: определение, основные компоненты и порядок их расположения, окислительное фосфорилирование и его место в этом процессе. Сколько молекул АТФ образуется при переносе одной пары водорода и электронов от восстановленного НАД и восстановленного ФАД к кислороду?
2. Сходство и различия в составе и строении ДНК и РНК. Апологическая роль этих соединений.
3. Специфичность действия ферментов. Виды специфичности. Чем обусловливается специфичность действия ферментов?
Вариант 49
1. Химическая природа, состав, строение, биологическое значение (описание и схемы реакций) пируватдекарбоксилазы, сукцинатдегидрогеназы.
2. Общие пути распада аминокислот (дезаминирование и декарбоксилирование).
3. Растворимые и нерастворимые белки. Химические методы количественного определения белков в продуктах и пищевом сырье; теоретическое обоснование этих методов.
Вариант 50
1. Олигомерные белки. Четвертичная структура белков и связи, обеспечивающие стабильность этой структуры. Биологическое значение четвертичной структуры белков.
2. Химическое строение, биологическая роль, содержание в пищевых продуктах каротинов и растительных стеринов. Что такое провитамины?
3. Биосинтез белков (основные этапы и их характеристика).
Вариант 51
- Окисление жирных кислот (β-окисление). Роль HS-КоА в этом процессе.
2. Гидролиз крахмала в биообъектах. Ферменты, участвующие в этом процессе
3. Химическая природа, строение, биологическое значение и пищевые источники витаминов группы А. Химическая структура и пищевые источники провитаминов этой группы.
Вариант 52
1. Значение работ А.Я. Данилевского, Э. Фишера и Л. Полинга в формировании современных представлений о строении белка.
2. Ферментативные превращения фруктозы и галактозы в глюкозу. Роль УТФ и фосфорных эфиров в этом процессе.
3. Синтез и использование гликогена в клетках печени и мышечной ткани.
Вариант 53
1. Напишите реакции ферментативного гидролиза сахарозы, мальтозы и лактозы. Назовите биологические объекты, содержащие каждый из этих ферментов.
2. Темновая фаза фотосинтеза (цикл Кальвина).
3. Биосинтез глицерина в клетках и значение этого процесса в обмене липидов.
Вариант 54
1. Химическая структура, биологическое значение, пищевые источники витамина С.
2. Пектиновые вещества: протопектин, растворимый пектин, пектовая кислота; химическая природа, строение, физико-химические и биологические свойства, значение для пищевой промышленности.
3. Глиоксилатный цикл
Вариант 55
1. Характеристика простых белковых веществ.
2. Ферментативный гидролиз жиров и фосфоглицеридов в растениях.
3. Пентозы, химическая природа, свойства, содержание в пищевом сырье.
Вариант 56
1. Химическая природа, строение, биологические свойства и пищевые источники рибофлавина. Назовите ферменты и напишите формулы коферментов, в состав которых входит рибофлавин.
2. Строение и свойства моносахаридов на примере глюкозы, фруктозы, галактозы.
3. Перечислите и охарактеризуйте ферменты, катализирующие гидролиз крахмала. Приведите схемы реакций, осуществляемых каждым из этих ферментов. Роль амилаз в переваривании пищи.
Вариант 57
1. Химическая природа, строение, физико-химические и биологические свойства, значение для пищевой промышленности фосфатидилхолинов (лецитинов) и фосфатидилэтаноламинов (кефалинов). Содержание этих соединений в различных биологических объектах.
2. Однокислотные и разнокислотные триацилглицерины, их физико-химические свойства. Физические и химические константы жиров.
3. Провитамины и антивитамины, их характеристика и роль. Примеры.
Вариант 58
1. Какие соединения называются нуклеотидами? Напишите формулы нуклеозидов, входящих в coстав ДНK и PНK.
2. В чем состоят сходства и отличия между свойствами белков и ферментов?
3. Стереоизомерия моносахаридов: соединения D- и L-ряда, правовращающие и левовращающие формы сахаров, оптические антиподы, рацематы, эпимеры. Биологическое значение стереоизомерии.
Вариант 59
1. Фосфатидилхолины (лецитины): химическая природа, полярность молекулы, распространение в природе, биологическое значение, применение в пищевой промышленности.
2. Напишите формулы восстанавливающих и невосстанавливающих дисахаридов.
3. Какие жирные кислоты называют незаменимыми и почему? Напишите структурные формулы этих кислот.
Вариант 60
1. Превращение крахмала в глюкозу при участии гидролаз. Промежуточные и конечные продукты, образующиеся при этом превращении.
2. Каким образом осуществляется регуляция биохимических процессов и для чего она нужна?
3. Особенности химического строения и физико-химические свойства мальтозы и сахарозы. Инвертный сахар.
Вариант 61
1. Строение первичной структуры белковых молекул; связи, поддерживающие первичную структуру.
2. Дисахариды: строение, свойства и значение в питании человека и животных.
3. Химическая природа, строение, биологическое значение и использование в пищевой промышленности фосфолипидов.
Вариант 62
1. Анаэробное окисление углеводов клетками молочнокислых бактерий – молочнокислое брожение. Химизм и биологическая роль.
2. Строение, свойства и биологическая роль высших жирных кислот и ацилглицеринов.
3. Каротины: химическая природа, строение, распространение в природе, биологическая роль в растениях и значение в питании.
Вариант 63
1. АТФ: химическая структура, биологическое значение, пути образования в клетке.
2. Незаменимые аминокислоты и их характеристика. Биологическая ценность белков. Полноценные и неполноценные белки.
3. Сахароза: структурная формула, свойства, применение в пищевой промышленности. Инверсия и инвертный сахар.
Вариант 64
1. Процесс элонгации белковой цепи.
2. Глютатион: химическая природа, строение, формы, биологическое значение, влияние на активность протеиназ.
3. Биосинтез жирных кислот и роль кофермента А в этом процессе.
Вариант 65
1. Водорастворимые витамины как составная часть двухкомпонентных ферментов.
- Какова природа основной формы энергии, используемой в процессах жизнедеятельности, и благодаря чему могут эффективно протекать эндергонические химические превращения?
3. Процессы инициации и терминации полипептидной цепи.
Вариант 66
- В чем главная причина, определяющая скорость любой биохимической реакции?
- Пентозофосфатный цикл. Его значение и энергетика.
- Нециклическое фосфорилирование в световой стадии фотосинтеза.
Вариант 67
- В чем биологический смысл специализации биомолекул и геометрического соответствия, комплементарности?
- Циклическое фосфорилирование в световой стадии фотосинтеза.
- Синтез пиримидиновых оснований.
Вариант 68
1. Мультиферментный комплекс (пируватдегидрогеназная система).
2. Для чего нужны структурированность и компартментализация биохимической работы клетки?
3. Катаболизм нуклеиновых кислот.
Вариант 69
1. Превращается ли в клетке простая молекула в сложную постепенно (или наоборот) в ходе только одного химического акта?
2. Окислительное фосфорилирование в митохондриях.
3. Процессинг мРНК эукариот.
Вариант 70
- Синтез пуриновых оснований.
- Пигменты пластид.
- Каким образом осуществляется регуляция биохимических процессов и для чего она нужна?
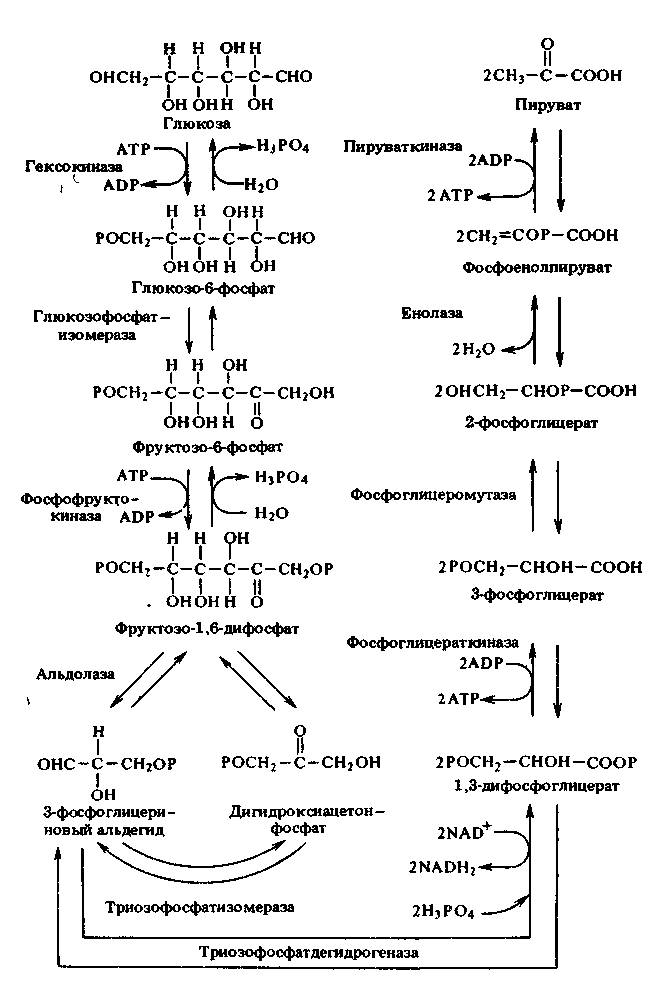
ПРИЛОЖЕНИЕ А
Схема гликолиза
ПРИЛОЖЕНИЕ Б
Б.1 Схема аэробного дыхания
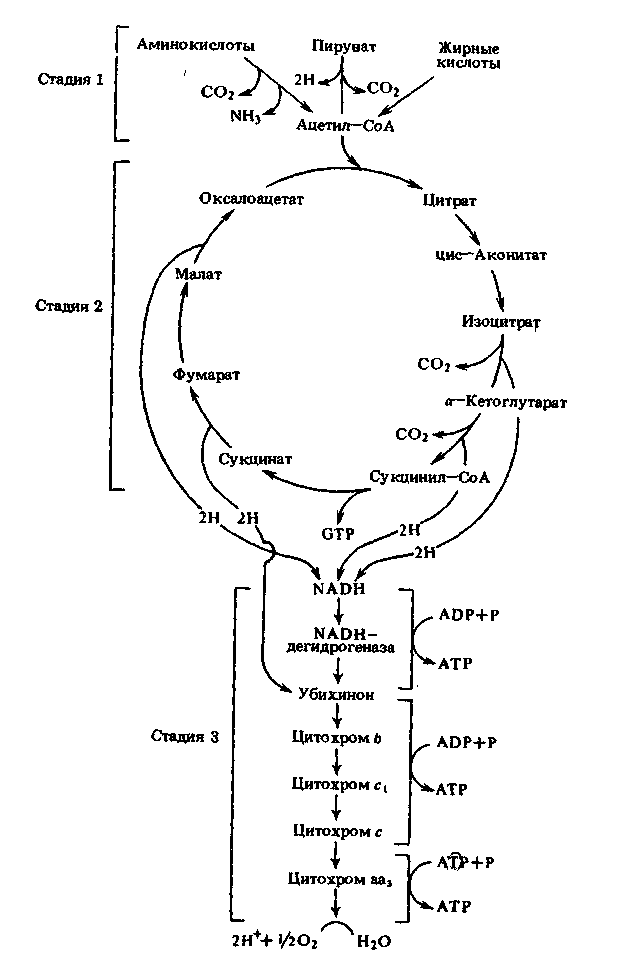
стадия 1 – мобилизация ацетил-КоА; стадия 2 – цикл Кребса;
стадия 3 – дыхательная цепь
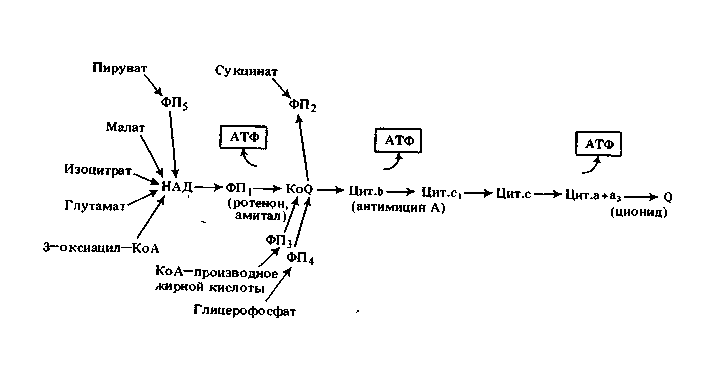
Б.2 Схема дыхательной цепи (ФП – флавопротеиды)
ПРИЛОЖЕНИЕ В
Схема цикла трикарбоновых кислот (Кребса)
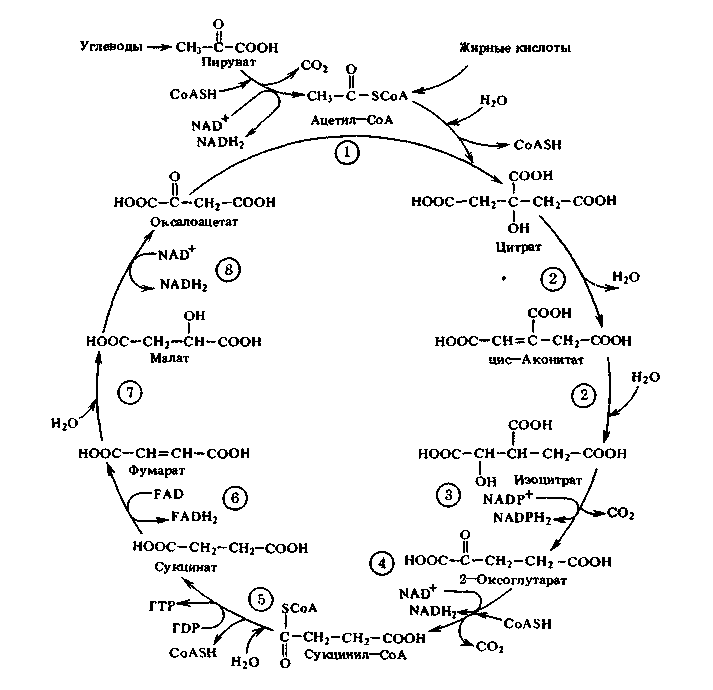
Ферменты цикла: 1 – цитрат-синтаза; 2 – аконитат-гидратаза;
3 – изоцитратдегидрогеназа; 4 – кетоглутаратдегидрогеназный
комплекс; 5 – сукцинил-КоА-синтетаза; 6 – сукцинатдегидрогеназа;
7 – фумарат-гидратаза; 8 – малатдегидрогеназа
ПРИЛОЖЕНИЕ Г
Глиоксилатный цикл
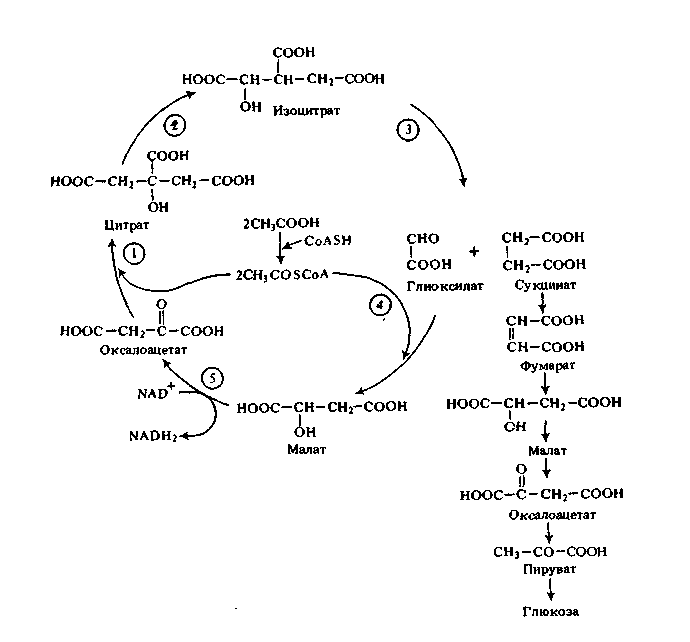
Ферменты цикла: 1 – цитрат-синтаза; 2 – аконитат-гидратаза;
3 – изоцитрат-лиаза; 4 – малат-синтаза; 5 – малатдегидрогеназа
ПРИЛОЖЕНИЕ Д
Пентозофосфатный цикл
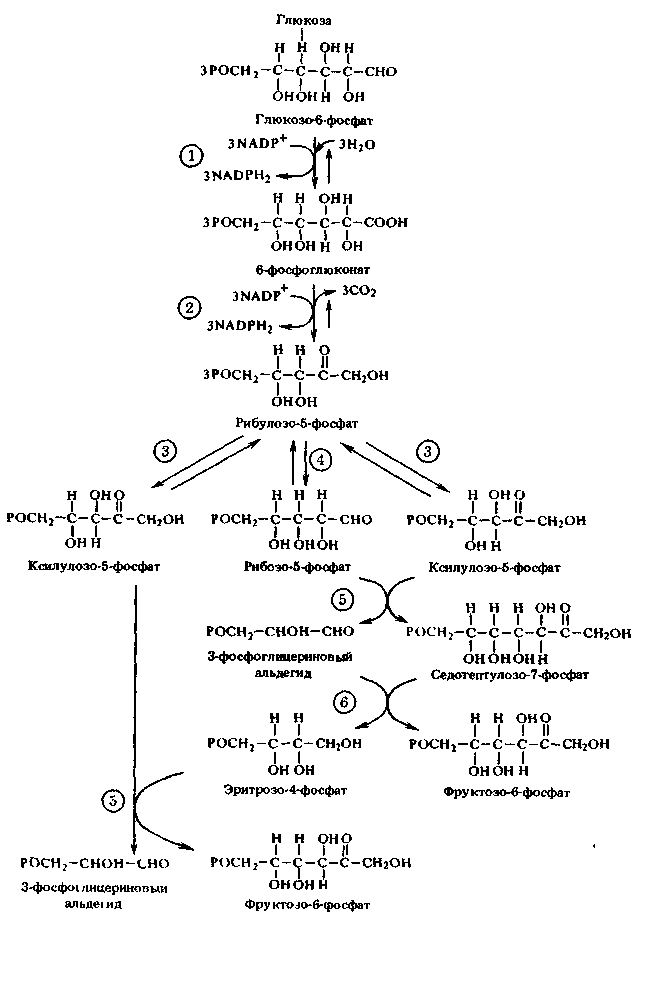
Ферменты цикла: 1 – глюкозо-6-фосфат-дегидрогеназа;
2 – 6-фосфоглюконатдегидрогеназа; 3 – эпимераза; 4 – изомераза;
5 – транскетолаза; 6 – трансальдолаза
ПРИЛОЖЕНИЕ Е
Е.1 Схема световой стадии фотосинтеза (z-схема)
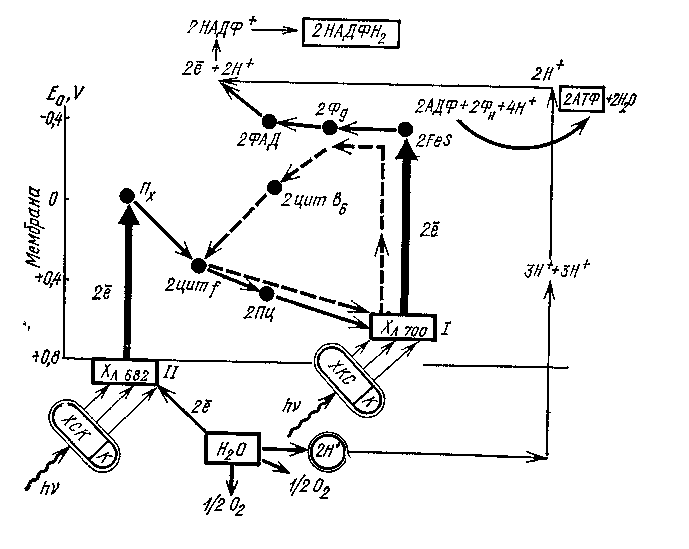
ХСК – хлорофиллсобирающий комплекс; К – каротиноиды;
Пх – пластохинон; Пц – пластоцианин; Цит b, f – цитохромы;
Фд – ферредоксин; Хл – хлорофилл; I – фотосистема; II – фотосистема
Е.2 Схема цикла Кальвина (темновая стадия фотосинтеза)
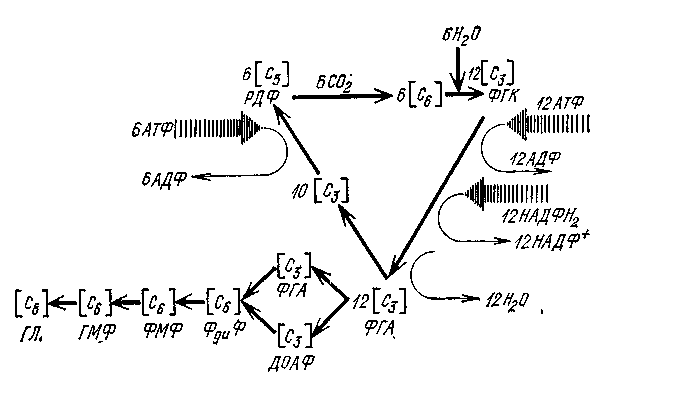
РДФ – рибулозодифосфат; ФГК – фосфоглицериновая кислота;
ФГА – фосфоглицериновый альдегид; ДОАФ – диоксиацетонфосфат;
ФдиФ – фруктозодифосфат; ФМФ – фруктозомонофосфат;
ГМФ – глюкозомонофосфат; ГЛ – глюкоза
ПРИЛОЖЕНИЕ Ж
Схема трех стадий синтеза белков (трансляция)
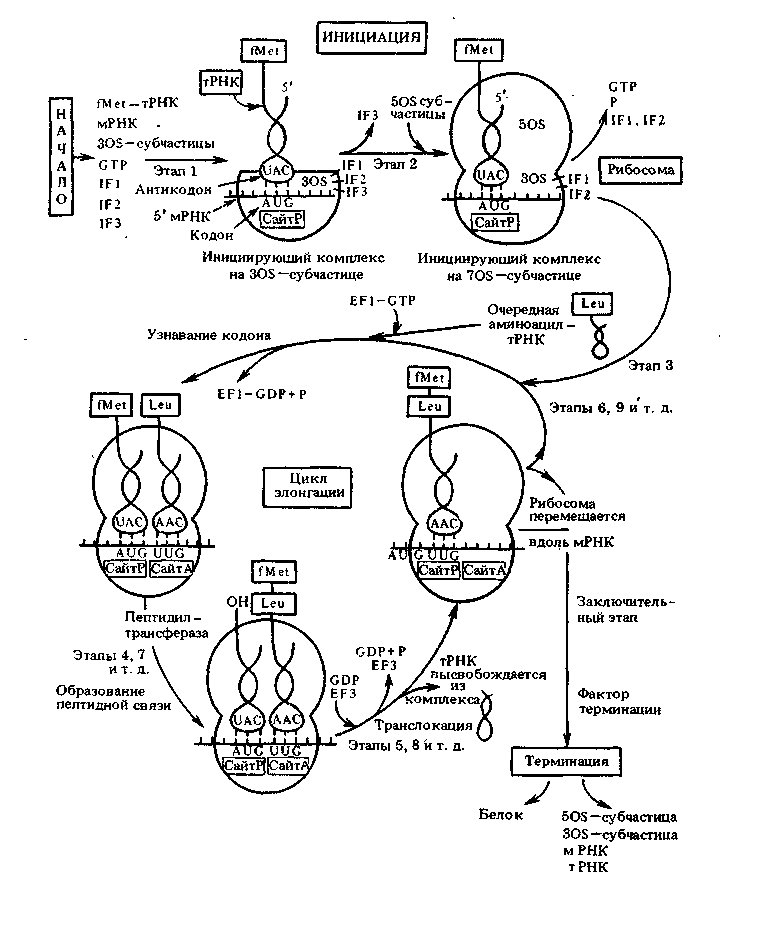
этап 1 – инициация; этап 2 – элонгация; этап 3 – терминация
Мезенцева Надежда Ивановна
Аверьянова Елена Витальевна
Лаптев Сергей Владимирович
БИОХИМИЯ
Методические рекомендации к изучению дисциплины
и выполнению контрольных работ для студентов всех форм
обучения по специальностям 260204 «Технология бродильных
производств и виноделие» и 240900 «Биотехнология» на основе
программы курса «Биохимия»
Редактор Идт Л.И.
Подписано в печать 4.12.2006. Формат 6084 1/16
Усл. п. л. 14,8. Уч.-изд. л. 16,0
Печать ризография, множительно-копировальный
аппарат «RISO TR-1510»
Тираж 50 экз. Заказ 2006-94
Издательство Алтайского государственного
технического университета
656038, г. Барнаул, пр. Ленина, 46
Оригинал-макет подготовлен ИИО БТИ АлтГТУ
Отпечатано в ИИО БТИ АлтГТУ
659305, г. Бийск, ул. Трофимова, 29
