На правах рукописи
| Вид материала | Автореферат |
- Печатная или на правах рукописи, 21.09kb.
- Удк 796/799: 378 , 770.24kb.
- На правах рукописи, 399.58kb.
- На правах рукописи, 726.26kb.
- На правах рукописи, 1025.8kb.
- На правах рукописи, 321.8kb.
- На правах рукописи, 552.92kb.
- На правах рукописи, 514.74kb.
- На правах рукописи, 670.06kb.
- На правах рукописи, 637.26kb.
На правах рукописи
Стафеева
Ирина Владимировна
Динамика электрофизиологических показателей состояния
головного мозга при ишемическом инсульте в бассейне
внутренних сонных артерий
(клинико-нейрофизиологическое исследование)
14.00.13 - нервные болезни
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Санкт-Петербург
2009
Работа выполнена на кафедре неврологии Государственного образовательного учреждения высшего профессионального образования «Петрозаводский государственный университет»
Научный руководитель: доктор медицинских наук, доцент
Субботина Наталья Сергеевна
Научный консультант: член-корреспондент РАМН,
доктор медицинских наук, профессор
Дуданов Иван Петрович
Официальные оппоненты:
доктор медицинских наук, профессор Клочева Елена Георгиевна
доктор медицинских наук, профессор Помников Виктор Григорьевич
Ведущее учреждение Российская Военно-медицинская академия имени С.М. Кирова (Санкт - Петербург)
Защита состоится «____» ______________ 2009 г. в ___ час. на заседании диссертационного совета Д.208.090.06 ГОУ ВПО «Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова Министерства здравоохранения и социального развития РФ» (197022, г. Санкт-Петербург, ул. Л. Толстого, д. 6/8)
С диссертацией можно ознакомиться в научной библиотеке ГОУ ВПО «Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова Министерства здравоохранения и социального развития РФ» (197022, г. Санкт-Петербург, ул. Л. Толстого, д. 6/8)
Автореферат разослан: «___» __________________2009г.
Ученый секретарь
диссертационного совета,
доктор медицинских наук, доцент И.В.Юрков
Общая характеристика работы
Актуальность проблемы
Механизмы восстановления нарушенных функций центральной нервной системы после ишемического повреждения ткани головного мозга являются довольно сложными и малоизученными. Между тем разработка этой проблемы имеет большую практическую значимость.
В настоящее время в промышленно развитых странах мира, в том числе и в России, наблюдается рост заболеваемости ишемическим инсультом (ИИ) и смертности от него (Гусев Е. И. и соавт., 2000 , 2003, 2008; Преображенский Д. В. и соавт., 2002; Скворцова В. И., 2007; Chalmers J. et al., 2000; Warlow C. R., 1998). К прежним профессиональным обязанностям возвращается около 10-12% пациентов, 25-30% остаются инвалидами (Виленский Б. С., 1995; Скворцова В. И., 2007; Chalmers J. еt al., 2000; Warlow C. R., 1998). В течение 5 лет примерно у 25% больных развивается повторное нарушение мозгового кровообращения (НМК) (Ахметов В. В. и соавт., 2006; Спиридонов А. А. и соавт., 2001; Barnett H. J., 2007). Поэтому реабилитация больных, перенесших ИИ, и разработка эффективных методов его вторичной профилактики являются очень важной и актуальной проблемой, как медицинской, так и социальной.
Развитие ИИ в 60-75% случаев связано с патологией брахиоцефальных артерий (БЦА) (Вачев А. Н. и соавт., 2003; Покровский А. В., 2005, 2007; Скворцова В. И. и соавт., 2005). Ведущим этиологическим фактором стенотических поражений БЦА является атеросклероз (Покровский А. В., 2007, 2009), в 84-90% случаев приводящих к ишемическим поражениям головного мозга (Скворцова В. И. и соавт.., 2005; Покровский А. В., 2005, 2007). Мультицентровые рандомизированные исследования эффективности каротидной эндартерэктомии при клинически проявляющемся стенозе внутренней сонной артерии (NASCET, ESCT, ACAS) убедительно доказали, что она снижает риск развития повторного инсульта в бассейне оперированного сосуда при стенозе более 70% просвета (Вачев А.Н., 2009; Покровский А. В., 2003, 2005, 2009; Скворцова В. И. и соавт., 2005).
В последние годы наибольшую актуальность приобрели нейрофизиологические методы исследования спонтанной и вызванной активности головного мозга, которые, будучи одними из наиболее чувствительных основных методов динамического контроля функционального состояния головного мозга и характера взаимодействия различных его структур, способны выявить как можно раньше те функциональные нарушения, которые имеют важное прогностическое значение, влияют на исход заболевания и определяют возможности восстановления нарушенных при ИИ функций (Гусев Е. И, 1992; Гехт А. Б., 1993, 1998; Павлов Н. А., 2001; Скворцова В. И., 1993; 2002; Шкловский В. М., 2003). Решение этих проблем требует расширения применяемых в традиционных диагностических исследованиях параметров оценки спонтанной и вызванной биоэлектрической активности (БЭА) головного мозга, прежде всего за счет привлечения характеристик, наиболее отражающих состояние мозга как целостной системы. Это в первую очередь касается динамических изменений показателей внутриполушарной когерентности ЭЭГ, которые отражают специфику интракортикальных отношений и функциональные свойства очага поражения мозга (Русинов В.С., 1987; Болдырева Г.Н. и соавт., 1989, 1992; Жаворонкова Л.А. и соавт., 1993, 2001).
Многочисленными исследованиями показана высокая информативность когнитивных вызванных потенциалов (Р300) при очаговых поражениях головного мозга (Корепина О. С., 1999; Окнина Л. Б. и соавт.., 2003; Tarkka I. M. et al., 1996). Являясь отражением процессов, связанных с неспецифическими мозговыми системами общей активации, лимбико-ретикулярными и неокортикальными механизмами, Р300 представляют особый интерес в исследовании восстановительных процессов у больных ИИ. Частая локализация ИИ в бассейне средней мозговой артерии предполагает использование для динамического изучения функциональной активности мозга когнитивных вызванных потенциалов (Р300), в генерации которых предположительно участвуют данные структуры (Шарова Е. В. и соавт.., 1998; Rappaport M. et al., 1991; Tarkka I.M. et al., 1996).
Таким образом, все изложенное обусловило актуальность изучения клинико-неврологических и нейрофизиологических особенностей у больных в процессе восстановления нарушенных функций в остром и раннем восстановительном периодах ИИ, что определило цель исследования.
Цель исследования: улучшить качество оказания медицинской помощи больным ишемическим инсультом путем расширения арсенала электрофизиологических показателей, используемых для динамического исследования состояния головного мозга
Задачи исследования:
- Оценить динамику клинико-неврологических изменений и показателей спектральной мощности, внутриполушарной когерентности электроэнцефалограммы у больных ишемическим инсультом в остром и раннем восстановительном периодах.
- Изучить особенности изменений показателей внутриполушарной когерентности электроэнцефалограммы пораженного и клинически интактного полушария в остром и раннем восстановительном периодах ишемического инсульта.
- Выявить особенности изменений биоэлектрической активности мозга у больных с гемодинамически значимым стенозирующим поражением сонных артерий, перенесших каротидную эндартерэктомию в восстановительном периоде ишемического инсульта до и после операции.
- Проанализировать динамику изменений когнитивных вызванных потенциалов (Р300) в остром и раннем восстановительном периодах в зависимости от степени тяжести неврологического дефицита и локализации очага ишемии.
- Определить прогностическую значимость изменений показателей спектральной мощности, внутриполушарной когерентности электроэнцефалограммы и когнитивных вызванных потенциалов (Р300) в процессе восстановления нарушенных функций в остром и раннем восстановительном периодах ишемического инсульта.
Научная новизна
Впервые проведено комплексное нейрофизиологическое исследование пациентов в остром и раннем восстановительном периодах ишемического инсульта с использованием спектрально-когерентных характеристик электроэнцефалограммы и когнитивных вызванных потенциалов (Р300).
Выявлены особенности изменений внутриполушарной когерентности в пораженном и клинически интактном полушариях в зависимости от тяжести ишемического инсульта.
Определено прогностическое значение изменений внутриполушарной когерентности для восстановления нарушенных функций у больных ишемическим инсультом.
Определено прогностическое значение изменений спектральной мощности и внутриполушарной когерентности для восстановления нарушенных функций у больных ишемическим инсультом с стенозирующим поражением сонных артерий.
Выявлены особенности изменений спектральной мощности и внутриполушарной когерентности у пациентов, которым была выполнена каротидная эндартерэктомия в восстановительном периоде ишемического инсульта, и определено ее значение в реабилитации пациентов.
Получены данные об особенностях изменений когнитивных вызванных потенциалов (Р300) в зависимости от тяжести ишемического инсульта и локализации полушарного ишемического очага.
Практическая значимость работы
Результаты исследования способствуют совершенствованию нейрофункциональной диагностики в остром и раннем восстановительном периодах ишемического инсульта. Предложенный метод комплексного нейрофункционального обследования позволит объективно оценить функциональное состояние головного мозга; выявить основные закономерности течения восстановительных процессов мозга в зависимости от тяжести ишемического инсульта и определить прогностическое значение показателей биоэлектрической активности мозга в процессе реабилитации пациентов. Полученные данные могут быть использованы для мониторинга функционального состояния мозга в нейрореанимационных палатах сосудистых отделений для ранней диагностики и своевременной коррекции терапии отека мозга.
Методы нейрофункциональной диагностики позволяют выявить закономерности изменений функциональной активности головного мозга у пациентов с стенозирующими поражениями брахиоцефальных артерий и обосновать значимость выполнения реконструктивных операций на внутренних сонных артериях с целью расширения возможностей реабилитации пациентов, перенесших ишемический инсульт.
Использование показателей внутриполушарной когерентности и Р300 позволит расширить диагностические и прогностические возможности обследования больных в остром и раннем восстановительном периодах ишемического инсульта.
В настоящей работе предлагаются дополнительные критерии для оценки характера реактивности мозга человека, которые позволяют в определенной степени представить перспективы того или иного больного в процессе реабилитации.
Основные положения, выносимые на защиту:
- Комплексное нейрофизиологическое исследование пациентов в остром и раннем восстановительном периодах ишемического инсульта позволяет объективно оценить изменения функционального состояния головного мозга в процессе восстановления нарушенных функций в зависимости от тяжести инсульта.
- Тяжесть инсульта обусловливает особенности клинико-неврологических нарушений и изменений спектральной мощности и внутриполушарной когерентности электроэнцефалограммы у больных в остром и раннем восстановительном периодах ишемического инсульта.
- Особенности изменений внутриполушарной когерентности в пораженном и клинически интактном полушариях связаны с тяжестью ишемического инсульта и имеют важное прогностическое значение в процессе восстановления нарушенных функций.
- Наличие гемодинамически значимых стенозирующих поражений внутренних сонных артерий замедляет процессы восстановления нарушенных функций в раннем восстановительном периоде ишемического инсульта. Выполнение каротидной эндартерэктомии в восстановительном периоде позволяет ускорить темпы реабилитации пациентов.
- У больных ишемическим инсультом имели место выраженные изменения показателей Р300 в виде достоверного увеличения латентного периода и снижения амплитуды на стороне очага поражения, которые связаны с тяжестью инсульта.
Личный вклад диссертанта в проведение исследования
Автор лично проводил всем пациентам клинико-неврологическое обследование, выполнял электроэнцефалографию и исследование когнитивных вызванных потенциалов. Самостоятельно осуществил статистическую обработку и анализ всего клинического материала.
Внедрение результатов исследования
Предложенные методы используются в практической работе отделения ОНМК и консультативно-диагностической поликлиники Республиканской больницы им. В.А.Баранова, неврологического отделения Больницы скорой медицинской помощи г. Петрозаводска. Основные положения диссертации используются в лекциях и практических занятиях на кафедре неврологии Петрозаводского государственного университета.
Апробация работы
Основные положения диссертационной работы доложены на II Всероссийской научно-практической конференции «Социальные медикобиологические и гигиенические аспекты здоровья человека» (Пенза, 2004), V Международной научно-практической конференции «Здоровье и образование в XXI веке» (Москва, 2004), VI Международной научно-практической конференции «Здоровье и образование в XXI веке» (Москва, 2005), IX всероссийском съезде неврологов(Ярославль, 2006), VIII Международной научно-практической конференции «Здоровье и образование в XXI веке» (Москва, 2007), II региональной научно-практической конференции неврологов Северо-Западного Федерального округа «Актуальные проблемы неврологии» (Сыктывкар, 2009), 4 Всероссийской конференции молодых ученых «Поленовские чтения» (Санкт - Петербург, 2009), II Всероссийской научно-практической конференции «Количественная ЭЭГ и нейротерапия» (Санкт - Петербург, 2009), Всероссийской юбилейной научно-практической конференции «Актуальные проблемы клинической неврологии» (Санкт - Петербург, 2009).
Публикации работы
Результаты исследования и основные положения работы представлены в 14 печатных работах, из них в 12 тезисах и 2 статьях (журнале, рекомендованном ВАК РФ).
Объем и структура диссертации
Диссертационная работа изложена на 208 страницах машинописного текста, содержит 26 таблиц и 21 рисунок. Состоит из введения, 6 глав, включая обзор литературы, характеристики собственных наблюдений и методов исследования, обсуждения результатов, заключения, выводов и списка литературы, содержащего 131 отечественных и 132 зарубежных источника.
Содержание работы
Материалы и методы исследования
В основу работы положены результаты обследования 107 пациентов с первым в анамнезе НМК по ишемическом типу с полушарной локализацией инфаркта, находившихся на лечении в неврологическом и хирургическом отделениях Больницы скорой медицинской помощи г. Петрозаводска и неврологическом отделении городской клинической больницы №1 им. Н. И. Пирогова (n=45) с 2000 по 2007 гг. Пациенты обследованы в динамике в острый и ранний восстановительный периоды. Среди них мужчин было 63 человека (58,9%), женщин – 44 человека (41,1%). Средний возраст пациентов составил 67,3±6,3 лет.
На основании величины интегральной оценки по шкале NIHS, все пациенты на момент поступления, в зависимости от тяжести состояния, были разделены на три клинические группы: с легким неврологическим дефицитом (NIHS менее 7) (n=11), с неврологическим дефицитом средней тяжести (NIHS 7-14) (n=50), и тяжелым неврологическим дефицитом (NIHS более 14) (n=46). Оценка динамики неврологических нарушений по шкале NIHS проводилась на 1,3,7,14 и 21 сутки. В раннем восстановительном периоде заболевания больные основных групп были разделены на подгруппы по степени тяжести неврологического дефицита по шкале Lindmark: с инсультом с ограниченными последствиями (Lindmark 400-448) (n=30), с инсультом средней тяжести (Lindmark 350-399) (n=37) и с тяжелым инсультом (Lindmark менее 350) (n=25). Оценка степени тяжести неврологического дефицита по шкале проводилась на 21, 30 сутки инсульта, а также спустя 3 и 6 мес. Для объективной количественной оценки функциональных возможностей больного в процессе реабилитации использовалась шкала Barthel. Тяжелая степень инвалидизации соответствовала суммарному баллу менее 50, средняя степень (умеренное ограничение функций) – 50-75, легкая степень с минимальным ограничением функций – выше 75 (Shah S., 1989). Оценка функционального статуса по шкале проводилась на 21, 30 сутки инсульта, а также спустя 3 и 6 мес.
В группе пациентов с неврологическим дефицитом средней степени тяжести (по шкале Lindmark) была выделена подгруппа пациентов (n=28) с односторонним стенозом высокой степени (75% и более просвета артерии) внутренней сонной артерии на ипсилатеральной стороне инсульта. Данным пациентам в течение 6 мес-1 года после перенесенного ИИ была выполнена каротидная эндартерэктомия (КЭАЭ). Оценка степени тяжести неврологического дефицита по шкале Lindmark и Barthel этим больным проводилась на 7 сутки, спустя 1 и 3 месяца после операции.
В зависимости от расположения зоны инфаркта мозга по данным КТ головного мозга было выделено 3 группы локализации: 1 – корковая; 2 – корково-подкорковая; 3 – подкорковая.
Контрольную группу (группа сравнения) составили 35 практически здоровых лиц, сопоставимых по возрасту и полу, без неврологических нарушений. Все исследуемые были правшами.
Клинико-неврологическое обследование включало в себя тщательный сбор анамнеза с учетом факторов риска ИИ. Обследование больных включало подробное исследование неврологического и соматического статуса пациентов. Для оценки соматического состояния всем пациентам в динамике исследовали клинический и биохимический анализы крови (в том числе уровень холестерина, триглицеридов, липопротеидов высокой и низкой плотности), общий анализ мочи; проводили осмотр глазного дна, ЭКГ, эхокардиографию и рентгенографию органов грудной клетки; большинству пациентов выполнены исследования состава спинномозговой жидкости, КТ или МРТ головного мозга (n=89), УЗДГ магистральных сосудов головы и шеи (n=95). Части пациентам проведены триплексное сканирование (n=40) и магнитно-резонансная ангиография сосудов головного мозга (n=30). Больные с афатическими нарушениями были проконсультированы логопедом.
Всем пациентам выполняли электроэнцефалографию. Исследования проводили на 19 канальном цифровом электроэнцефалографе нейрокартографе фирмы “МБН” (Россия). Использовали монополярные с референтными ипсилатеральными ушными электродами (A1 – A2) и биполярные отведения. Регистрировали запись фоновой ЭЭГ и при нагрузках: открывание-закрывание глаз, гипервентиляция в течение 3 мин, ритмическая фотостимуляция. Запись ЭЭГ проводили на 1, 7, 14, 21, 30 сутки, части больным – спустя 3 и 6 мес. после ИИ. Больным, которым была выполнена КЭАЭ, запись ЭЭГ выполняли на 7 сутки, спустя 1 и 3 месяца после операции. При личном участии автора выполнено 242 ЭЭГ. Визуальный анализ ЭЭГ включал общую оценку активности и определение межполушарной асимметрии, патологической активности постоянного и пароксизмального характера, наличие очаговых и диффузные изменений. Для количественной оценки ЭЭГ использовали программу анализа «Нейрокартограф», позволявшую методом быстрого преобразования Фурье проводить количественную оценку мощностей основных диапазонов частот ЭЭГ: дельта (0-4 Гц), тета (4-8 Гц), альфа-1 (8-10 Гц), альфа-2 (10-13 Гц), бета-1 (13-20 Гц), бета-1 (20-30 Гц) и значений когерентности для основных диапазонов частот ЭЭГ: дельта (0-4 Гц), тета (4-8 Гц), альфа-1 (8-10 Гц), альфа-2 (10-13 Гц), бета (13-30 Гц). Определяли значения мощности спектра в мкВ²\Гц в различных частотных диапазонах по каждому отдельному отведению. Анализировали показатели внутриполушарной когерентности для Fp1-C3, Fp2-C4, C3-O1, C4-O2, Fp1-T3, Fp2-T4, T3-O1, T4-O2 для каждого частотного диапазона и всей частотной полосы.
Исследование когнитивных вызванных потенциалов (n=45) проводили у пациентов с ясным сознанием при отсутствии нарушений понимания инструкций, функции счета. Исследовали когнитивные вызванные потенциалы на 19-канальном приборе «МБН» (Россия) в ситуации случайно возникающего события (odd-ball paradigm) в условиях активного восприятия стимула. При личном участии автора выполнено 192 исследования. Анализ компонента Р300 осуществляли с использованием программы «Нейрокартограф» фирмы МБН (Россия). Выделяли основные пики когнитивного вызванного потенциала – Р1, N1, P2, N2, P3, N3. Вычисляли латентный период компонента Р300 как латентный период пика Р3 в мс, амплитуду Р300 как межпиковую амплитуду N2P3 в мкВ. Исследования выполняли на 1, 7, 14, 21, 30 сутки, части больным спустя 3 и 6 мес. после инсульта.
Для статистической обработки данных использовали лицензионный пакет статистических программ «STATISTICA 7.0» с использованием методов непараметрической статистики. Для выявления достоверных различий между средними выборок применяли критерии Вилкоксона и Колмогорова. Для выявления взаимосвязи между показателями внутриполушарной когерентности и тяжести неврологического дефицита использовали корреляционный анализ с расчетом коэффициента ранговой корреляции Кенделла. Уровень значимости считали достоверным при p < 0,05.
Результаты исследования и обсуждение
У пациентов с тяжелым неврологическим дефицитом (по шкале NIHS) достоверно чаще преобладало стенотическое поражение сонных артерий средней и высокой степени (58,5%); среди факторов риска преобладали выраженный атеросклероз сосудов головного мозга (56,5%), нарушения ритма сердца в виде мерцательной аритмии (45,6%), сахарный диабет II типа (23,9%). По данным КТ головного мозга преобладали очаги подкорковой локализации (69,6%). При клиническом исследовании в первые сутки ИИ отмечались выраженные общемозговые (39,1%) и очаговые симптомы (100%), особенно касающиеся двигательных (100%) и чувствительных (60,9%) систем, чаще выявляли афатические нарушения (45,6%). В динамике исчезновение общемозговых симптомов наблюдалось только к концу острейшего периода (7 сутки от начала заболевания). Среди пациентов данной группы в остром периоде ИИ отмечался более высокий процент летальных исходов (21,7%) в большинстве случаев вследствие прогрессирования отека мозга и развития дислокационного стволового синдрома. Наихудший прогноз течения был у исходно крайне тяжелых пациентов с суммарным баллом по шкале NIHS более 25 баллов, у которых в клинической картине острейшего периода выявлялось нарастание общемозговой и очаговой симптоматики. Данную группу пациентов составили преимущественно пациенты с левополушарной локализацией очага поражения. В клинической картине у почти половины (48,5%) пациентов наблюдались признаки вторичного стволового синдрома. Регресс очаговой симптоматики у пациентов этой группы к концу острого периода был слабо выражен, поэтому в начале раннего восстановительного периода они составили основную группу наблюдения пациентов с тяжелым ИИ (37%) и с инсультом средней тяжести (41,3%) (по шкале Lindmark). Для группы тяжелого неврологического дефицита (по шкале NIHS) были характерны выраженные изменения ЭЭГ в виде угнетения альфа- и бета – активности и увеличения мощности спектра медленноволновой активности в обоих полушариях (p< 0,05) с некоторым преобладанием указанных изменений на стороне очага, которые сохранялись в течение всего острого периода ИИ. При динамическом исследовании ВПК в 1 сутки заболевания отмечалось достоверное увеличение показателей в большинстве, за исключением лобно-височных, областей обоих полушарий. Однако, начиная с 7 суток, после окончания острейшего периода, выявлялось снижение ВПК в интактном полушарии (рис.1).
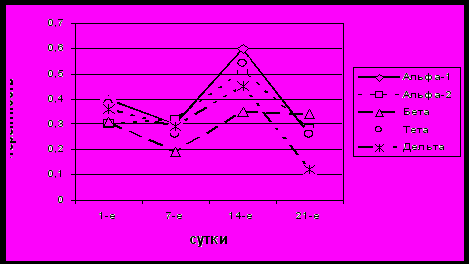
Рис. 1. Динамика показателей внутриполушарной когерентности в лобно-височных областях клинически интактного полушария у пациентов с тяжелым неврологическим дефицитом (по шкале NIHS) в остром периоде ИИ (по оси ординат – значения внутриполушарной когерентности, по оси абсцисс – сроки ИИ)
Несмотря на некоторое увеличение этого показателя на второй недели заболевания, к концу острого периода отмечалось дальнейшее его снижение, что, можно рассматривать как неблагоприятный прогностический признак течения ИИ. Изменения когерентности коррелировали с изменениями тяжести неврологического дефицита по шкале NIHS (p<0,05).
У больных с летальным исходом, начиная с 1 суток заболевания, наблюдалось достоверное увеличение ВПК в большинстве областей обоих полушарий (рис. 2). С 7 суток, после окончания острейшего периода, при неблагоприятном течении заболевания отмечалось прогрессирующее снижение ВПК в обоих полушариях (p<0,05) во всех частотных диапазонах, что, можно рассматривать как неблагоприятный прогностический признак течения ИИ. По сравнению с пациентами подгруппы положительной динамики, наиболее выраженное снижение ВПК наблюдалось в лобно-височных областях обоих полушарий (p<0,05) (рис. 2). Эти данные также коррелировали с изменениями тяжести неврологического дефицита по шкале NIHS (p<0,05).
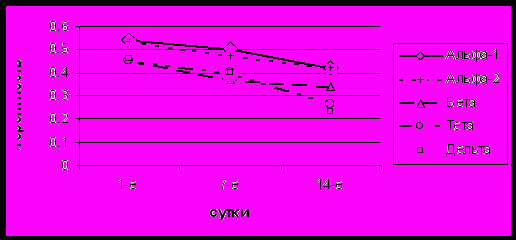
Рис. 2. Динамика внутриполушарной когерентности у больных с летальным исходом в лобно-височных отделах пораженного полушария (по оси ординат – значения внутриполушарной когерентности, по оси абсцисс – сутки развития ИИ)
У пациентов с неврологическим дефицитом средней тяжести (по шкале NIHS) среди факторов риска преобладали сочетание атеросклероза сосудов головного мозга с артериальной гипертензией (62%), нарушения ритма сердца по типу мерцательной аритмии (30%), ишемическая болезнь сердца (30%) в анамнезе. В большинстве случаев отмечалось одностороннее стенотическое поражение сонных артерий различной степени выраженности (66%), преимущественно средней и высокой степени. По данным КТ головного мозга преобладали очаги корково-подкорковой локализации (78%). Первые сутки инсульта характеризовались умеренной очаговой и общемозговой симптоматикой. Однако, как и у пациентов с тяжелым неврологическим дефицитом, выявляли высокую долю афатических нарушений (34%). Исчезновение общемозговых симптомов и восстановление сознания наблюдалось в течение 3 суток от начала заболевания. В течение острого периода отмечалось значительно более полное восстановление нарушенных функций по сравнению с группой пациентов с тяжелым неврологическим дефицитом. В начале раннего восстановительного периода пациенты данной группы по шкале Lindmark распределялись следующим образом: с тяжелым ИИ – 16%, с инсультом средней тяжести – 36% и с инсультом с ограниченными последствиями – 44%. Летальность у пациентов с инсультом средней тяжести (по шкале NIHS) в остром периоде была соответственно 4%. В первые сутки инсульта было характерным достоверное увеличение (p< 0,05) мощности спектра медленноволновой активности, которое было наиболее выражено в лобных, центральных и теменных отделах обоих полушарий. К концу острейшего периода наблюдалось угнетение альфа-активности, преимущественно альфа-2-диапазона в пораженном полушарии, которое нарастало ко второй неделе заболевания и распространялось на передние отделы. В то же время, в обоих полушариях отмечалось уменьшение показателей мощности спектра медленноволновой активности, статистически значимое (p< 0,05) для лобного и височного отделов пораженного полушария. К концу острого периода имело место дальнейшее уменьшение медленноволновой активности и выявлялось увеличение показателей мощности спектра альфа-2-активности. Для данной группы пациентов было характерно достоверное компенсаторное увеличение внутриполушарных взаимосвязей в большинстве, за исключением лобно-височных и лобно-центральных, областей клинически интактного полушария в течение острейшего периода инсульта (рис. 3).

Рис. 3. Динамика внутриполушарной когерентности у больных с неврологическим дефицитом средней степени тяжести (по шкале NIHS) в центрально-височных отделах пораженного полушария (по оси ординат – значения внутриполушарной когерентности, по оси абсцисс – сутки ИИ)
В конце острейшего периода отмечалось резкое статистически значимое уменьшение (p<0,05) ВПК в пораженном полушарии, однако в конце второй недели от начала заболевания наблюдалось усиление взаимосвязей внутри пораженного полушария. Затем в конце острого периода выявлялось некоторое уменьшение взаимосвязей внутри пораженного полушария, за исключением центрально-височных отделов (рис. 3).Тем не менее показатели ВПК в клинически интактном полушарии оставались высокими в сравнении с группой здоровых испытуемых в течение всего острого периода ишемического инсульта, что, по нашему мнению, имело благоприятное прогностическое значение для восстановления нарушенных функций, прежде всего двигательной системы, у пациентов данной группы. Эти данные коррелировали с тяжестью клинического состояния, оцениваемого по шкале NIHS(p<0,05).
В группе легкого неврологического дефицита (по шкале NIHS) у трети пациентов отмечалось одностороннее стенотическое поражение сонных артерий средней степени (36,3%). Среди факторов риска преобладали сочетание атеросклероза сосудов головного мозга с артериальной гипертензией (72,7%), нарушения ритма сердца по типу мерцательной аритмии (45,4%), инфаркты миокарда в анамнезе (36,4%). По данным КТ головного мозга преобладала корковая локализация очага (72,7%). В первые сутки заболевания отсутствовали общемозговые симптомы, отмечалась небольшая выраженность очаговой симптоматики. Неврологическая симптоматика в первые сутки заболевания характеризовалась наличием умеренного неврологического дефицита в виде центрального гемипареза равномерного характера или преимущественно выраженного в верхней конечности в сочетании с центральным поражением VII, XII пар черепных нервов (81,2%). У пациентов с левополушарной локализацией очага поражения выявлялись афатические нарушения (27,2%). К концу острого периода отмечался значительный регресс очаговой симптоматики с полным исчезновением очаговых симптомов у 27,2 % пациентов данной группы (вариант малого инсульта). Для данной группы в остром периоде ИИ было характерно появление изменений показателей мощности спектра основных частотных диапазонов ЭЭГ в конце острейшего периода инсульта. В этот период отмечалось значительное увеличение альфа-1-активности в пораженном полушарии и достоверное увеличение (p< 0,05) показателей мощности спектра медленноволновой активности, преимущественно тета-активности, в передних отделах пораженного полушария. Со второй недели и до окончания острого периода инсульта наблюдалось уменьшение медленноволновой активности в обоих полушариях и статистически значимое усиление альфа-активности, преимущественно в альфа-1-диапазоне (p< 0,05), более выраженное в лобных, центральной и височной областях пораженного полушария. Установлено, что для пациентов этой группы было характерным усиление внутриполушарных связей в острейший период инсульта сначала в пораженном, а к концу первой недели – в интактном полушарии, преимущественно в передних областях. При этом увеличение показателей было достоверно больше (p<0,05) по сравнению с таковыми в группе неврологического дефицита средней тяжести. К концу острого периода показатели когерентности приближались по своим значениям к показателям группы здоровых испытуемых.
При динамическом обследовании в раннем восстановительном периоде у всех пациентов с тяжелым ИИ (по шкале Lindmark) сохранялись очаговые неврологические нарушения в виде выраженного контралатерального гемипареза, анизорефлексии, патологических рефлексов. У всех пациентов были признаки гемигипестезии. У 36% пациентов данной подгруппы с поражением левого полушария наблюдались афатические нарушения. В течение всего периода отмечалась незначительная динамика неврологического дефицита (средний балл по шкале Lindmark в начале и конце периода, соответственно, 257,3±53,8 и 366,4±21,3). Большинство пациентов к концу данного периода имели тяжелую степень инвалидности (средний балл по шкале Barthel 55,0±5,3). Летальность в этой группе пациентов составила 24% в результате повторного НМК. Для пациентов данной группы была характерна слабоположительная динамика показателей мощности спектра основных частотных диапазонов. В течение всего периода сохранялось преобладание медленноволновой активности на стороне поражения, причем к концу периода отмечалось некоторое нарастание показателей в обоих полушариях. Выявлялась более выраженная межполушарная асимметрия по сравнению с другими подгруппами (по шкале Lindmark). Изменения альфа- и бета-активности характеризовались уменьшением их в обоих полушариях, преимущественно на стороне поражения. Для показателей ВПК было характерно постепенное уменьшение показателей в обоих полушариях. В начале этого периода наблюдалось уменьшение показателей в передних отделах интактного полушария и задних отделах пораженного полушария, а к концу раннего восстановительного периода – в передних отделах пораженного полушария и в задних отделах интактного полушария. Эти данные коррелировали с изменениями тяжести неврологического дефицита по шкале Lindmark (p<0,05).
У пациентов с инсультом средней тяжести (по шкале Lindmark) в этот период отмечалось более полное восстановление нарушенных функций, преимущественно двигательной и сенсорной системы (средний балл по шкале Lindmark в начале и конце периода, соответственно, 377,5±20,5 и 429,3±23,9). Однако восстановление речевых нарушений было наименее полным (исчезновение моторной афазии наблюдалось в 14,3%). В конце раннего восстановительного периода все пациенты имели легкую степень инвалидизации (средний балл по шкале Barthel 88,3±7,6). Летальность составила 10,8% в большинстве случаев в результате повторного НМК. Характерной особенностью течения раннего восстановительного периода было возрастание медленноволновой активности, преимущественно на стороне очага поражения, которое начиналось спустя 1 месяц от развития заболевания и достигало максимальных величин к 3 месяцу заболевания. Однако к концу раннего восстановительного периода отмечалось уменьшение медленноволновой активности, преимущественно тета-диапазона в обоих полушариях. Наблюдалось увеличение альфа- и уменьшение бета-активности, преимущественно в клинически интактном полушарии. В начале раннего восстановительного периода отмечалось увеличение ВПК в большинстве областей обоих полушарий, за исключением лобно-височных областей, в большинстве частотных диапазонов. Спустя 3 месяца у всех пациентов данной группы выявлялось снижение показателей ВПК: в передних отделах преимущественно в интактном, а в задних отделах – преимущественно в пораженном полушарии. Наибольшее уменьшение показателей наблюдалось в бета-диапазоне. К концу раннего восстановительного периода регистрировалось увеличение когерентности в передних отделах обоих полушарий и уменьшение ее в задних, преимущественно на стороне очага поражения. Эти данные также коррелировали с изменениями тяжести неврологического дефицита по шкале Lindmark (p<0,05).
У части пациентов этой группы (n=28) в восстановительном периоде инсульта была выполнена КЭАЭ. В клинической картине заболевания у всех пациентов в начале раннего восстановительного периода сохранялся умеренный гемипарез, анизорефлексия с повышением сухожильных и периостальных рефлексов на стороне пареза, у 9 (32,1%) пациентов выявлялся рефлекс Бабинского. Отмечалось умеренное повышение мышечного тонуса по спастическому типу на стороне гемипареза. У 6 (21,4%) пациентов данной группы с локализацией инфаркта в левом полушарии наблюдались симптомы умеренной моторной афазии. Чувствительные нарушения по гемитипу выявлены у 15 (53,6%) пациентов, симптомы аутотопогнозии – у 4 (14,3%) пациентов с правополушарной локализацией инфаркта. На 21 сутки средний балл по шкале Lindmark составил 376,7±15,2 балла, средний балл по шкале Barthel – 70,5±4,5, что соответствовало умеренной инвалидизации. В течение всего периода отмечался незначительный регресс симптоматики в отличие от основной группы (средний балл по шкале Lindmark до 417,4±19,6). Большинство пациентов к концу раннего восстановительного периода имели умеренное ограничение к самообслуживанию (средний балл по шкале Barthel до 80,7±7,5). К концу раннего восстановительного периода у пациентов данной подгруппы, в отличие от основной группы, наблюдались высокие показатели медленноволновой, преимущественно тета-активности (р<0,05), с преобладанием ее на стороне поражения и сохранением межполушарной асимметрии. Отмечалось увеличение показателей когерентности во всех областях обоих полушарий, преимущественно в альфа-, бета- и тета-диапазонах по сравнению с предыдущим исследованием. Выявлялось достоверное увеличение (р<0,05) ВПК в лобно-височных, центрально-височных и лобно-центральных областях обоих полушарий.
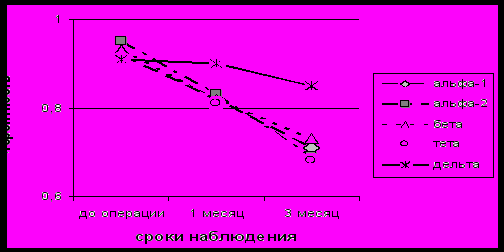
Рис. 4. Динамика внутриполушарной когерентности у больных, перенесших каротидную эндартерэктомию, в лобно-центральных отделах пораженного полушария (по оси ординат – значения внутриполушарной когерентности, по оси абсцисс – сутки ИИ)
В послеоперационном периоде в данной подгруппе пациентов наблюдалось практически полное восстановление двигательных и чувствительных функций и способности к самообслуживанию. Наиболее выраженная динамика изменений наблюдалась спустя 1 месяц после операции (p<0,05) (средний балл по шкале Lindmark и Barthel соответственно 436,5±10,2 и 90,7±5,5). Выживаемость в послеоперационном периоде составила 100%. В течение 7 суток после выполнения КЭАЭ значимых изменений спектральной мощности не выявлено. Однако, к концу 1 месяца отмечалось уменьшение тета- и дельта- активности с уменьшением межполушарной асимметрии (р<0,05). Отмечалось увеличение альфа- и бета- активности (р<0,05) в лобно-центральном, лобно-височном, височном и затылочном отделах обоих полушарий с преобладанием изменений на стороне поражения по сравнению с дооперационными показателями. Выявлялось достоверное уменьшение (p<0,05) показателей ВПК в большинстве областей пораженного полушария, преимущественно в альфа-, бета- и тета- диапазонах. Наиболее выраженное снижение показателей наблюдалось в бета-диапазоне. Спустя 3 месяца после операции эти изменения сохранялись. При этом значения показателей приближались к показателям группы здоровых лиц (рис. 4). В течение всего послеоперационного периода отмечалось также снижение показателей ВПК в интактном полушарии, но оно было менее выражено, чем в пораженном полушарии.
В раннем восстановительном периоде у пациентов с инсультом с ограниченными последствиями (по шкале Lindmark) отмечали практически полное восстановление утраченных функций и способности к самообслуживанию. Выживаемость в этот период составила 100%. Исследование динамики ЭЭГ-показателей в раннем восстановительном периоде показало, что в течение этого периода происходило значительное уменьшение (p<0,05) показателей мощности спектра медленноволновой активности и увеличение альфа- и бета-активности в обоих полушариях с преобладанием изменений на стороне очага. В начале раннего восстановительного периода показатели ВПК в передних и центральных областях обоих полушарий были ниже, а в задних областях выше по сравнению с таковыми в группе здоровых испытуемых. Через 1 месяц наблюдалось достоверное увеличение ВПК в обоих полушариях, преимущественно в лобно-центральной и лобно-височной областях в альфа-бета- и тета-диапазонах (р<0,05), при этом показатели ВПК в интактном полушарии превышали показатели в пораженном полушарии. К 3-му месяцу от начала инсульта происходило снижение ВПК в большинстве областей полушарий, при этом отмечалась межполушарная асимметрия с преобладанием значений показателей в пораженном полушарии. Эти данные коррелировали с изменениями тяжести неврологического дефицита по шкале Lindmark (p<0,05). К концу раннего восстановительного периода регистрировалось увеличение ВПК в передних отделах и снижение – в задних отделах обоих полушарий с одновременным выравниванием межполушарной асимметрии. По-видимому, преобладание показателей ВПК в лобно-височных и лобно-центральных областях в альфа- и бета-диапазонах в начале в клинически интактном, а в конце раннего восстановительного периода – в пораженном полушарии явилось благоприятным прогностическим признаком течения восстановительных процессов у больных с инсультом с ограниченными последствиями.
Нами была также исследована динамика амплитудно-латентных показателей когнитивных вызванных потенциалов (Р300) у больных различной степени тяжести в остром и раннем восстановительном периодах ишемического инсульта. У больных с легким и тяжелым неврологическим дефицитом (по шкале NIHS) уже в первые сутки заболевания отмечались достоверно (p<0,05) высокие показатели латентности Р300 по сравнению с таковыми в группе здоровых испытуемых (рис. 5). У пациентов с легким неврологическим дефицитом латентность была выше в передних, центральных и теменных отделах пораженного полушария, а у больных с тяжелым неврологическим дефицитом – во всех областях обоих полушарий.
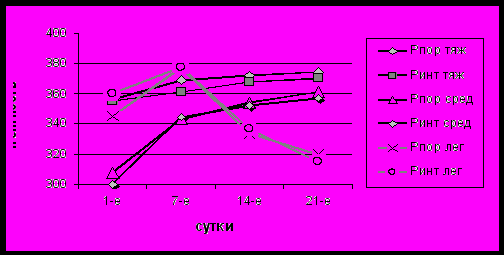
Рис. 5. Динамика показателей латентности Р300 в теменных отделах у больных различной степени тяжести в остром периоде ишемического инсульта (по оси ординат – значения латентности, по оси абсцисс – сутки ИИ)
При этом у больных с легким неврологическим дефицитом отмечалось снижение амплитуды Р300 на стороне очага поражения, а у пациентов с тяжелым дефицитом – ее повышение по сравнению с группой здоровых испытуемых (рис. 6).
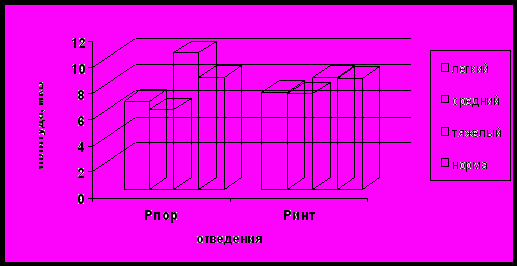
Рис. 6. Характеристика показателей амплитуды Р300 в теменных отделах у больных различной степени тяжести в 1 сутки ИИ (по оси ординат – значения латентности, по оси абсцисс – отведения)
В конце острейшего периода у пациентов с тяжелым неврологическим дефицитом наблюдалось дальнейшее увеличение латентности Р300 и снижение амплитуды Р300 во всех областях, преимущественно пораженного полушария. Эти изменения сохранялись в течение всего острого периода (рис. 5). У пациентов с легким неврологическим дефицитом в конце второй недели от начала заболевания отмечалось уменьшение латентности Р300 и увеличение амплитуды Р300. При этом к концу острого периода в большинстве областей, за исключением лобно-центральной, центральной и височной областях пораженного полушария, значения латентности Р300 достигали значений группы здоровых испытуемых (рис. 5). У пациентов с неврологическим дефицитом средней тяжести в первые сутки инсульта отмечалось снижение амплитуды Р300 в большинстве областей пораженного полушария (рис. 6). Патологические изменения Р300 в виде увеличения латентности выявлялись в конце острейшего периода инсульта. В течение острого периода наблюдалось дальнейшее удлинение латентности и увеличение амплитуды Р300, за исключением центральных и теменных отделов преимущественно пораженного полушария (рис. 5).
В остром периоде ИИ у пациентов с левополушарной локализацией ишемического очага патологические изменения в виде удлинения латентного периода и снижения амплитуды Р300 были более выраженными, преобладали на стороне очага поражения и сохранялись в течение всего острого периода заболевания. У пациентов с правополушарной локализацией очага поражения патологические изменения Р300 появлялись в конце острейшего периода инсульта, и к концу острого периода выраженность этих изменений уменьшалась.
В раннем восстановительном периоде у пациентов с тяжелым инсультом (по шкале Lindmark) динамики показателей не наблюдали. У пациентов средней тяжести (по шкале Lindmark) отмечалась положительная динамика показателей, однако к концу данного периода латентность Р300 была достоверно больше (p<0,05), а амплитуда достоверно меньше (p<0,05) по сравнению с таковыми в группе здоровых испытуемых. У пациентов с инсультом с ограниченными последствиями (по шкале Lindmark) происходила нормализация амплитудных и латентных показателей Р300. У пациентов с левополушарной локализацией ишемического очага в течение раннего восстановительного периода сохранялись патологические изменения когнитивных вызванных потенциалов (Р300) в виде увеличения латентности и снижения амплитуды. У больных с правополушарной локализацией очага исчезновение патологических изменений наблюдалось к 3-му месяцу заболевания.
Таким образом, патологические изменения Р300 в виде увеличения латентности и снижения амплитуды в остром и раннем восстановительном периодах ИИ являются, по-видимому, отражением функциональной дезынтеграции центральной нервной системы, преимущественно неспецифических в том числе лимбических, систем мозга. Патологические изменения Р300 связаны, по-видимому, с нарушением генерации потенциала в этих структурах.
Выводы
- Комплексное нейрофизиологическое исследование пациентов в остром и раннем восстановительном периодах ишемического инсульта с использованием спектрально-когерентных характеристик электроэнцефалограммы и когнитивных вызванных потенциалов (Р300) позволяет объективно оценить функциональное состояние головного мозга и выявить основные закономерности течения восстановительных процессов мозга в зависимости от тяжести инсульта.
- Характер изменений внутриполушарной когерентности в остром периоде связаны с тяжестью ишемического инсульта. Достоверное снижение показателей внутриполушарной когерентности (p<0,05) в лобно-височных и центрально-височных областях, начиная с 7 суток и до окончания острого периода, отражает выраженное нарушение двигательных функций у пациентов с тяжелым неврологическим дефицитом (по шкале NIHS) и является неблагоприятным прогностическим признаком для их восстановления. Повышение показателей внутриполушарной когерентности в этих областях в остром периоде ишемического инсульта характерно для пациентов с легким и среднетяжелым неврологическим дефицитом (по шкале NIHS) и является благоприятным прогностическим признаком восстановления двигательных нарушений
- Особенности изменений внутриполушарной когерентности в пораженном и клинически интактном полушариях имеют важное прогностическое значение для функционального исхода заболевания. Низкие показатели внутриполушарной когерентности в большинстве частотных диапазонов в лобно-височной и лобно-центральной областях клинически интактного полушария в остром и раннем восстановительном периодах отражают тяжелое течение ишемического инсульта и медленное восстановление двигательных и речевых функций. Увеличение показателей внутриполушарной когерентности в альфа-, бета- и тета-диапазонах в лобно-височной и лобно-центральной областях клинически интактного полушария – в остром периоде; пораженного полушария – в раннем восстановительном периоде свидетельствуют о благоприятном течении инсульта и восстановлении двигательных и речевых функций.
- Выполнение каротидной эндартерэктомии улучшает динамику регресса неврологических нарушений и электрофизиологических показателей состояния головного мозга в виде увеличения спектров мощности альфа- и бета-активности (р<0,05) в лобно-центральных, лобно-височных, височных и затылочных отделах обоих полушарий с преобладанием изменений на стороне поражения и достоверного уменьшения (p<0,05) показателей когерентности в большинстве областей пораженного полушария в альфа-, бета- и тета-диапазонах.
- Патологические изменения Р300 в виде увеличения латентности и снижения амплитуды на стороне поражения являются наиболее ранними и чувствительными критериями гипоксии головного мозга по сравнению с показателями внутриполушарной когерентности, а у пациентов с легким неврологическим дефицитом – и по сравнению с показателями мощности спектра, отражая функциональную дезынтеграцию коры головного мозга вследствие структурных изменений и разобщения функциональных связей.
- У пациентов с левополушарной локализацией ишемического очага патологические изменения в виде удлинения латентного периода и снижения амплитуды когнитивных вызванных потенциалов (Р300) в течение острого и раннего восстановительного периодов заболевания более выражены, преобладают на стороне очага поражения. У пациентов с правополушарной локализацией очага поражения увеличение латентности и снижение амплитуды когнитивных вызванных потенциалов (Р300) происходит в конце острейшего периода инсульта и исчезает к 3-му месяцу заболевания.
Практические рекомендации
1. С целью объективной оценки функционального состояния головного мозга, прогнозирования восстановления нарушенных функций и последующего динамического наблюдения и контроля за процессом восстановления необходимо провести комплексное нейрофизиологическое исследование с использованием спектрально-когерентных показателей электроэнцефалограммы и когнитивных вызванных потенциалов (Р300) в остром и раннем восстановительном периодах ишемического инсульта.
2. Для объективной оценки состояния внутриполушарных отношений и последовательности их восстановления в пределах каждого полушария показано использование показателей внутриполушарной когерентности при мультиканальной регистрации электроэнцефалограммы в остром и раннем восстановительном периодах.
3. С целью разработки оптимальной программы и темпов реабилитации на основании данных динамики изменений выраженности неврологического дефицита, показателей спектров мощности, внутриполушарной когерентности основных частотных диапазонов электроэнцефалограммы в пораженном и клинически интактном полушарии целесообразно составление индивидуальной карты функциональной активности пациентов.
4. Для объективной оценки функционального состояния неспецифических систем головного мозга и определения прогноза восстановления корковых функций у больных в остром и раннем восстановительном периодах ишемического инсульта целесообразно исследование когнитивных вызванных потенциалов (Р300).
Список работ, опубликованных по теме диссертации
- Стафеева И.В. Хирургия ветвей дуги аорты/Дуданов И.П., Субботина Н.С., Стафеева И.В., Капутин М.Ю., Абуазаб Б.С., Орлова Р.И., Соболева Н.Г., Платонов С.А.//Медицинский академический журнал. – 2009. – Т. 9. – № 1. – С. 50-59.
- Стафеева И.В. Изменение внутриполушарной когерентности у пациентов с острым ишемическим инсультом, осложненным отеком мозга/Стафеева И.В., Субботина Н.С.//Медицинский академический журнал. – 2009. – Т. 9 – №2. – С. 73-79.
- Стафеева И.В. Динамика внутриполушарной когерентности у пациентов с ишемическим инсультом, осложненным отеком мозга, при неблагоприятном течении заболевания/Дуданов И.П., Стафеева И.В., Субботина Н.С//Материалы второй региональной научно-практической конференции неврологов Северо-Западного Федерального округа «Актуальные проблемы неврологии». Сыктывкар, 2-3 апреля 2009 г. – Сыктывкар, 2009. – С. 44-46.
- Стафеева И.В. Характеристика когнитивных вызванных потенциалов (Р300) у пациентов в остром периоде ишемическоого инсульта в зависимости от тяжести и локализации поражения/Дуданов И.П., Субботина Н.С., Стафеева И.В.//Материалы Всероссийской юбилейной научно-практической конференции «Актуальные проблемы клинической неврологии». Санкт – Петербург, 29-30 сентября 2009г. – Санкт - Петербург, 2009. – С. 119-120.
- Стафеева И.В. Характеристика и прогностическое значение показателей внутриполушарной когерентности в остром периоде ишемического инсульта/Дуданов И.П., Субботина Н.С., Стафеева И.В.//Материалы Всероссийской юбилейной научно-практической конференции «Актуальные проблемы клинической неврологии». Санкт – Петербург, 29-30 сентября 2009г. – Санкт - Петербург, 2009. – С. 119.
- Стафева И.В. Роль методов нейрофункциональной диагностики в реабилитации больных, перенесших инсульт/Стафеева И.В.//Сборник статей II Всероссийской научно-практической конференции «Социальные медикобиологические и гигиенические аспекты здоровья человека». Пенза, сентябрь 2004 г. – Пенза, 2004. – С. 99-101.
- Стафеева И.В. Особенности когнитивных вызванных потенциалов (Р300) у больных в раннем восстановительном периоде ишемического инсульта/Стафеева И.В.//Научные труды V Международной научно-практической конференции «Здоровье и образование в XXI веке». – Москва, 21-23 октября 2004 г. – Москва, 2004. – С. 355-356.
- Стафеева И.В. Показатели внутриполушарной когерентности у больных различной тяжести в остром периоде ишемического инсульта/Стафеева И.В.//Научные труды VI Международной научно-практической конференции «Здоровье и образование в XXI веке». – М., 2005. – С. 446-447.
- Стафеева И.В. Изменения когнитивных вызванных потенциалов (Р300) у больных в остром периоде ишемического инсульта/Стафеева И.В., Алферова В.В., Павлов Н.А., Гехт А.Б.// Материалы IX всероссийского съезда неврологов. Ярославль, 29 мая – 2 июня 2006 г. – Ярославль, 2006. – С. 485.
- Стафеева И.В. Особенности когнитивных вызванных потенциалов (Р300) у больных в остром периоде ишемического инсульта в зависимости от локализации очага поражения /Стафеева И.В.//Научные труды VIII Международной научно-практической конференции «Здоровье и образование в XXI веке». Москва, 14-17 ноября 2007 г. - Москва, 2007. – С. 592.
- Стафеева И.В. Особенности межполушарной асимметрии по показателям внутриполушарной когерентности у больных различной тяжести в остром периоде ишемического инсульта/Стафеева И.В., Дуданов И.П., Субботина Н.С.//Материалы II Всероссийской научно-практической конференции «Количественная ЭЭГ и нейротерапия». Санкт - Петербург, 27-30 апреля 2009 г. – Санкт – Петербург, 2009. – С. 52.
- Стафеева И.В. Особенности когнитивных вызванных потенциалов (Р300) у больных в остром периоде ишемическоого инсульта/Стафеева И.В., Субботина Н.С., Дуданов И.П.//Материалы II Всероссийской научно-практической конференции «Количественная ЭЭГ и нейротерапия». Санкт - Петербург, 27-30 апреля 2009 г. – Санкт – Петербург, 2009. – С. 52.
- Стафеева И.В. Прогностическое значение показателей внутриполушарной когерентности в остром периоде ишемического инсульта/Стафеева И.В., Субботина Н.С., Дуданов И.П.//Материалы второй региональной научно-практической конференции неврологов Северо-Западного Федерального округа «Актуальные проблемы неврологии». Сыктывкар, 2-3 апреля 2009 г. – Сыктывкар, 2009. - С. 93-95.
- Стафеева И.В. Прогностическое значение показателей внутриполушарной когерентности в остром периоде ишемического инсульта/Стафеева И.В., Субботина Н.С., Дуданов И.П.//Материалы 4 Всероссийской конференции молодых ученых «Поленовские чтения». Санкт - Петербург, 21-24 апреля 2009. – Санкт – Петербург, 2009. – С. 237-238.
Список сокращений
БЦА – брахиоцефальные артерии
ВПК – внутриполушарная когерентность
ИИ – ишемический инсульт
КТ – компьютерная томография
КЭАЭ – каротидная эндартерэктомия
МРТ – магнитно-резонансная томография
НМК – нарушение мозгового кровообращения
ОНМК – острое нарушение мозгового кровообращения
УЗДГ – ультразвуковая допплерография
ЭКГ – электрокардиография
ЭЭГ – электроэнцефалография
