Приложение б памятка по изучению дисциплины
| Вид материала | Памятка |
Содержание2 Практические занятия (17 часов) Вес в итоговом рейтинге Контрольная работа по темам 1 – 3 Контрольная работа по теме 4 – 5 Посещение лекций |
- Памятка для студентов гр. Сапр-71, 72 по изучению дисциплины «физика» ( 3 семестр), 51.62kb.
- Памятка для студентов гр. Тгв-71,72,мас-71,ВиВ-71 по изучению дисциплины «физика. Электричество, 57.57kb.
- Памятка для студентов групп пкм по изучению дисциплины "Технология материалов и покрытий", 79.64kb.
- Памятка для студентов группы пкм-21 по изучению дисциплины "Металлы и неметаллические, 97.41kb.
- Памятка для студентов групп мо 91 по изучению дисциплины «Организационное поведение», 103.6kb.
- Памятка для студентов групп мапп-51; мапп-52 по изучению дисциплины "Основы научных, 30.1kb.
- Примерный тематический план список литературы, рекомендуемый к изучению дисциплины, 547kb.
- Памятка для студентов групп тгв-11 и тгв-12 по изучению дисциплины «Автоматизация, 43.47kb.
- Памятка для студентов групп тгв по изучению дисциплины «Вентиляция» (7 семестр), 205.82kb.
- Памятка для студентов групп мапп по изучению дисциплины «Механизация и автоматизация, 43.86kb.
СТП 15.033-04
ПРИЛОЖЕНИЕ Б
Памятка по изучению дисциплины
Алтайский государственный технический университет им. И.И.Ползунова
Памятка для студентов групп ПКМ-11 по изучению дисциплины ЕН.Ф.04.3 «Физическая химия», (4семестр)
Составил _____________ Утверждаю:
Зав. кафедрой________________
«___ »________200_ года
1. Содержание дисциплины
В 4 семестре изучается дисциплина «Физическая химия». Будут рассмотрены следующие темы.
1 Лекции (34 часа)
Тема 1. Принципы и начала термодинамики.
Литература: [1], [2], [3]
Тема 2. Метод термодинамических потенциалов
Литература: [1], [2], [3], [4], [5]
Тема 3. Общие условия равновесия термодинамических систем. Химическое равновесие.
Литература: [1], [6], [5]
Тема 4. Термодинамические свойства газов и газовых смесей.
Литература: [1], [6], [5]
Тема 5. Фазовые равновесия в одно- и многокомпонентных системах.
Литература: [1], [2]
Тема 6. Элементы термодинамики неравновесных процессов.
Литература: [1], [2]
2 Практические занятия (17 часов)
Принципы термодинамики. (2 часа).
Термодинамический и статистический методы, их преимущества и недостатки. Основные понятия и определения термодинамики. Постулаты термодинамики. Существование состояния равновесия термодинамической системы, принцип температуры.
Литература: [1], [1]
2. Начала термодинамики. (2 часа).
Закон сохранения энергии для термодинамических систем, первое начало термодинамики. Второе начало термодинамики. Формулировки Кельвина и Клаузиуса, их эквивалентность. Энтропия, формула Больцмана. Статистический смысл второго начала термодинамики.
Литература: [1], [10], [15]
3. Функции состояния термодинамической системы. (2 часа).
Термическое и калорическое уравнения состояния. Независимые переменные.
Литература: [1], [10], [15]
4. Метод термодинамических потенциалов (2 часа).
Термодинамические потенциалы: внутренняя энергия, свободная энергия, энтальпия, энергия Гиббса. Связь между термодинамическими потенциалами. Преимущества и недостатки метода.
Литература: [1], [10], [15]
5. Равновесие и устойчивость термодинамической системы (2 часа).
Теория устойчивости Гиббса. Общие условия равновесия изолированной системы, системы при постоянной температуре, внешнем давлении.
Равновесие двухфазной однокомпонентной системы. Многокомпонентные системы, правило фаз Гиббса.
Литература: [1], [10], [15]
6. Термодинамическое, механическое, химическое равновесие. (2 часа).
Термодинамическое, механическое, химическое равновесие. Устойчивое равновесие однородной системы. Матрица устойчивости. Изотермы Ван-дер-Ваальса, анализ устойчивости. Принцип Ле Шателье – Брауна, проявление принципа в различных процессах.
Литература: [1], [10], [15]
7. Фазовые переходы и критические явления (2 часа).
Классификация фазовых переходов Эренфеста. Фазовые переходы первого рода. Уравнение Клапейрона – Клаузиуса. Фазовые переходы второго рода. Уравнение Эренфеста. Примеры фазовых переходов первого и второго рода.
Литература: [11], [10], [15]
8. Линейная термодинамика необратимых процессов (2 часа).
Исходные положения и основные уравнения. Принцип симметрии Кюри. Диссипативные функции. Вариационный принцип Онзагера. Принцип минимума производства энтропии Пригожина. Устойчивость стационарных состояний. Функции Ляпунова.
Литература: [1], [10], [15]
9. Нелинейная, неравновесная термодинамика (2 часа).
Функция Ляпунова системы далекой от равновесия. Условия образования неравновесных упорядоченных состояний термодинамической системы. Примеры диссипативных структур. Понятие бифуркации. Принципы теории катастроф. Когерентные структуры..
Литература: [1], [10], [15]
2 Литература и учебно-методические материалы (более полный список – у преподавателя)
Основная литература
1. Базаров И. П. Термодинамика. М.: Высшая школа. - 1983. 344с. (10)
2. Эткинс П. Молекулы. М.: Мир. - 1985.- 326с. (1)
3.1.3. Эбелинг В. Образование структур при необратимых процессах. М.: Мир. - 1979. 280с. (10)
4. Еременко В.И. Физическая химия границы раздела контактирующих фаз. – М.: Высшая школа, 1995.–463 с. (1)
5. Румер Ю.Б., Рывкин М.Ш. Термодинамика, статистическая физика и кинетика. – М.: Наука, 1977. – 552 с. (2)
6. Исаев С.И. Термодинамика: Учеб. для ВУЗов. – М.: Изд-во МГТУ им. Н.Э. Баумана, 2000. – 416 с. (6)
7. Паташинский А.З. , Покровский В.Л. Флуктуационная теория фазовых переходов. – М.: Наука, 1975. – 238 с. (2)
8. Липатов Ю.С. Физико-химические основы наполнения полимеров. – М.: Химия, 1991. – 356 с. (3)
9. Задачник по технической термодинамике и теории тепломассообмена / В. Н. Афанасьев, С.И. Исаев, И.А. Кожинов и др М.: Высшая школа, 1986. – 135 с. (1)
Дополнительная литература
10 Дирак П. Принципы квантовой механики. М.: Наука. - 1979. 480с. (1)
11. Сиротин Ю.И., Шаскольская М.П. Основы кристаллофизики. М.: Наука. - 1975.- 640с. (1)
3.1.3 Шварц К., Гольдфарб Т. Поиски закономерностей в физическом мире. - М.: Мир. - 1977.- 435с. (1)
12. Постон Т., Стюарт И. Теория катастроф и ее приложения. - М.: Мир - 1980.- 345с. (1)
13. Пайтген Х.-О., Рихтер П.Х. Красота фракталов. М.: Мир. - 1993. 176с. (10)
14. Томсон Дж. Неустойчивости и катастрофы в науке и технике. - М.: Мир. - 1985.- 255с. (1)
15. Матвеев А.Н. Молекулярная физика. М.: Высшая школа. - 1981. 400с. (8)
3 График контроля
| Тема | Контрольное испытание | Время проведения | Вес в итоговом рейтинге | Примечания |
| 1 | Практическое занятие №1 | 1 неделя | 0,022 | Максимальная оценка 100 баллов |
| 2 | Практическое занятие №2 | 3 неделя | 0,022 | Максимальная оценка 100 баллов |
| 3 | Практическое занятие №3 | 5 неделя | 0,022 | Максимальная оценка 100 баллов |
| | Контрольная работа по темам 1 – 3 | 6 неделя | 0,1 | 5 вопросов по 20 баллов |
| 4 | Практическое занятие №4 | 7 неделя | 0,022 | Максимальная оценка 100 баллов |
| 5 | Практическое занятие №5 | 9 неделя | 0,022 | Максимальная оценка 100 баллов |
| 6 | Практическое занятие №6 | 11 неделя | 0,022 | Максимальная оценка 100 баллов |
| | Контрольная работа по теме 4 – 5 | 12 неделя | 0,10 | 5 вопросов по 20 баллов |
| 7 | Практическое занятие №7 | 13 неделя | 0,022 | Максимальная оценка 100 баллов |
| 8 | Практическое занятие №8 | 15 неделя | 0,022 | Максимальная оценка 100 баллов |
| 9 | Практическое занятие №9 | 17 неделя | 0,022 | Максимальная оценка 100 баллов |
| Посещение лекций | семестр | 0,10 | Пропорционально посещению прошедших лекций при максимальной оценке 100 баллов | |
| Экзамен | Сессия | 0,50 | 3 вопроса по 20 баллов, 3 дополнительных вопроса – по 10 баллов | |
Примечания.
1. Любая контрольная точка, выполненная после срока без уважительной причины, оценивается на 5% за каждую просроченную неделю. Максимальная оценка в этом случае равна 100 - 5×а, где а – количество просроченных недель баллов.
2. К зачету допускаются студенты, имеющие не более двух задолжностей по контрольным точкам. При наличии одной или двух задолжностей студенту на экзамене выдаётся дополнительное задание.
4 Шкала оценок и правила вычисления рейтинга
В АлтГТУ принята 100-балльная шкала оценок. Именно эти оценки учитываются при подсчёте рейтингов, назначении стипендии и в других случаях. Традиционная шкала будет использоваться только в зачётных книжках. Соответствие оценок устанавливается следующим образом: 75 баллов и выше - «отлично», 50 - 74 балла «хорошо», 25 - 49 баллов - «удовлетворительно», менее 25 баллов - «неудовлетворительно».
Успеваемость студента оценивается с помощью текущего рейтинга (во время каждой аттестации) и итогового рейтинга (после сессии). Во всех случаях рейтинг вычисляется по формуле:
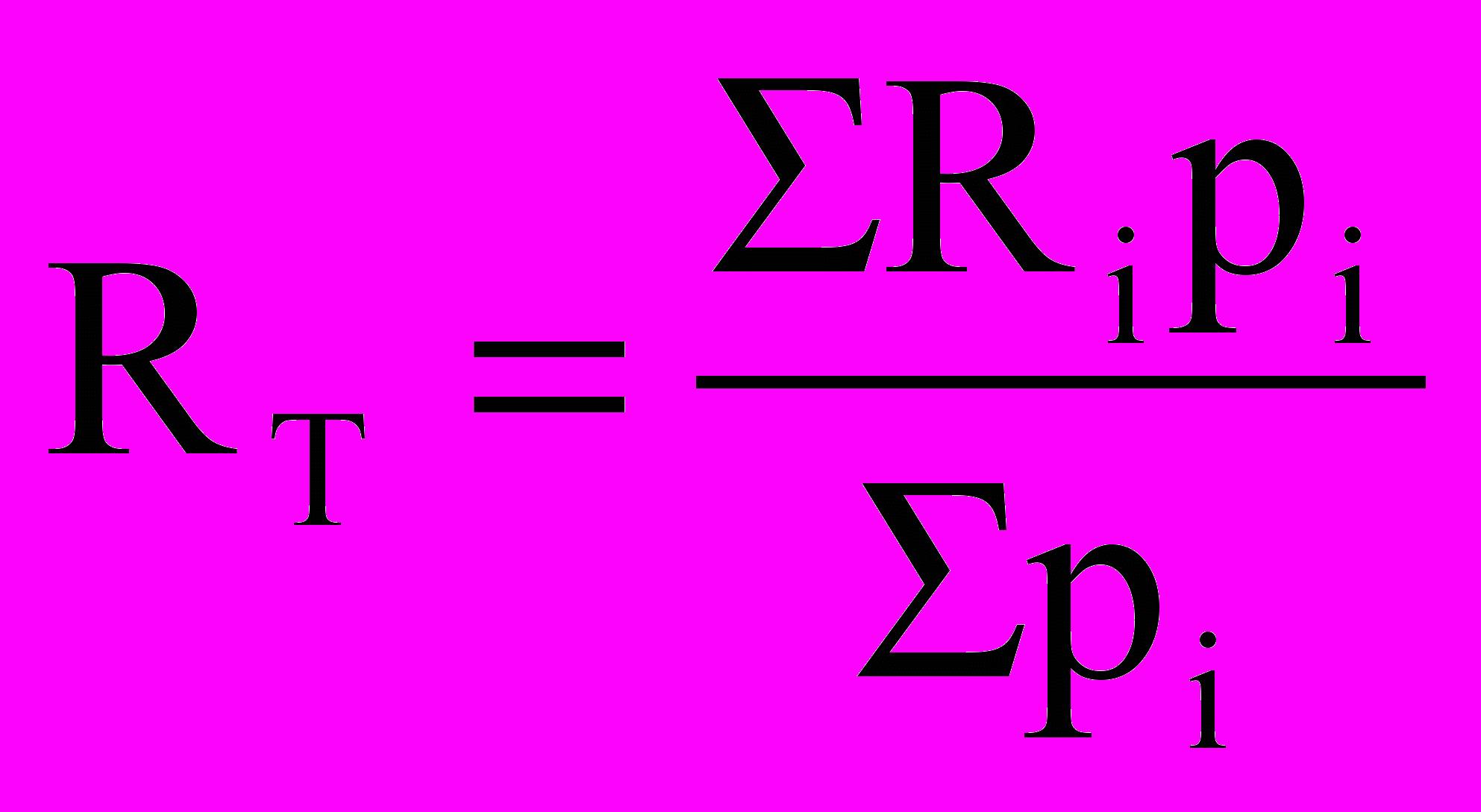 ,
,где Ri – оценка за i-ю контрольную точку, рi – вес этой контрольной точки. Суммирование проводится по всем контрольным точкам с начала семестра до момента вычисления рейтинга.
Приведём пример. Пусть студент Сидоров Иван Петрович получил следующие оценки. Контрольная работа по теме 5 – 38 баллов, коллоквиум – 60, индивидуальные задания выполнены, контрольная работа по теме 7 – 32 балла, контрольная работа по теме 8 – 80, контрольная работа по темам 9, 10 – 58, оценка за ответ на экзамене – 70 баллов. На 1-й аттестации (7 неделя) его рейтинг равен:
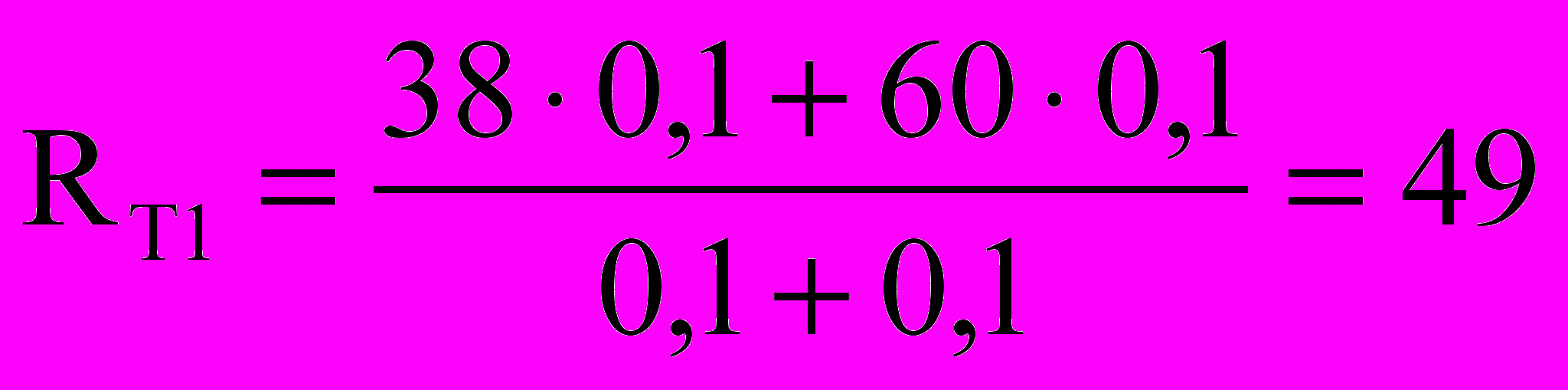 ,
,На 2-й аттестации (13 неделя):
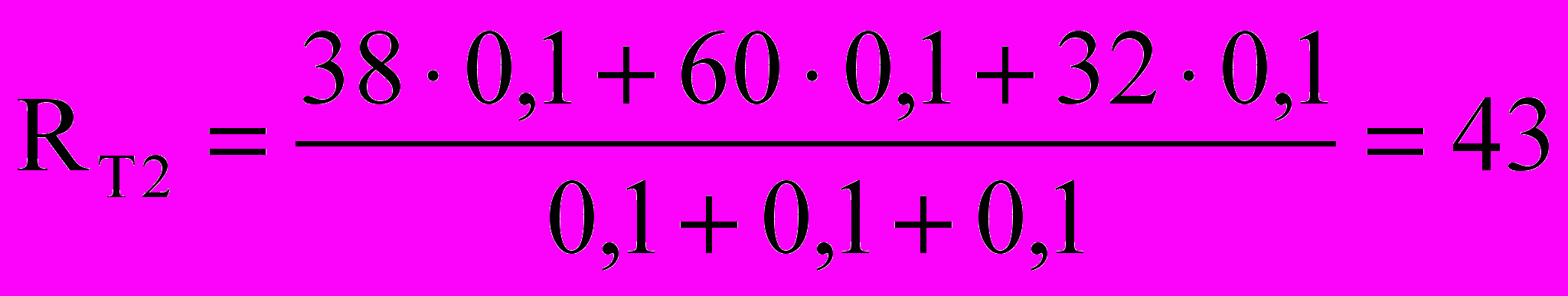 ,
,Перед началом сессии вычисляется семетровый рейтинг:
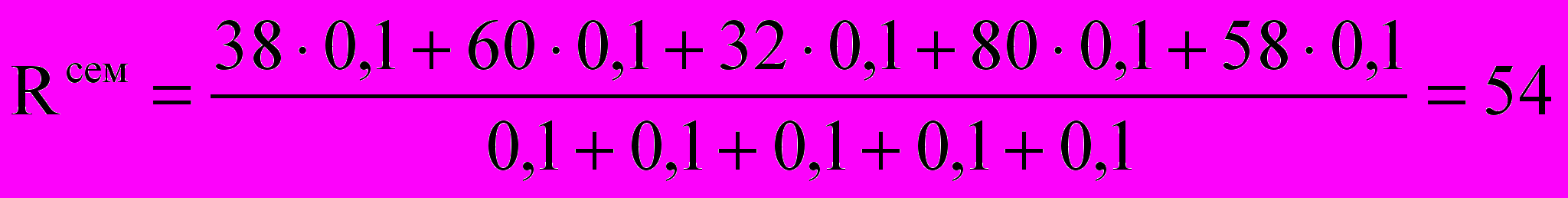
Итоговый рейтинг, учитывающий экзамен:
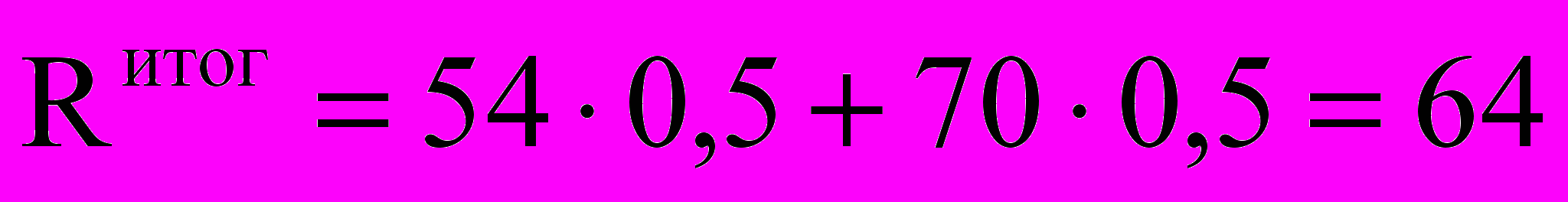
В зачётку выставляется оценка «хорошо».
5 Возможности повышения рейтинга
Для студентов с высоким текущим рейтингом по их желанию может быть организовано углубленное изучение предмета, выдано дополнительное задание. В этом случае проводится дополнительный контроль: либо решение задач (контрольная работа, олимпиада), либо защита реферата. После проведения такого контроля (с оценкой R*, текущий рейтинг пересчитывается:
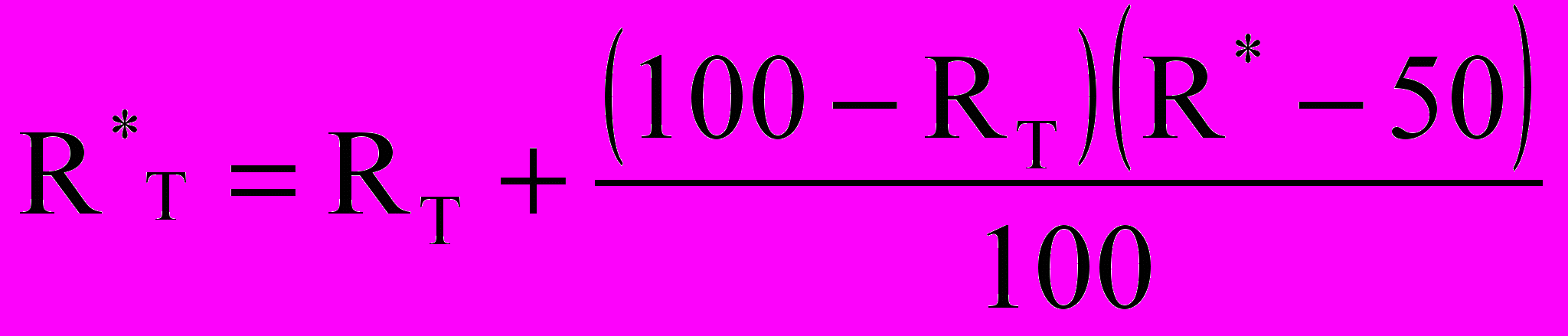
Деканат, учитывая рейтинги студента по каждой дисциплине, вычисляет комплексные рейтинги вывешивает рейтинг-листы специальности, курса, факультета.
