Типи акумуляторів
| Вид материала | Реферат |
- План Поняття особистості, її структура, формування, типи особистостей. Темперамент,, 77.82kb.
- 8. Типи комунікацій Тема Типи комутацій, 85.36kb.
- План Типи ринків Фактори впливу на попит І пропозицію ринку. Формування рівноважної, 104.24kb.
- Ресурси. Типи ресурсів, 449.07kb.
- План Сутнісна характеристика, структура І принципи організації виробничих процесів, 98.84kb.
- Назва модуля: Алгоритмічні мови та програмування Код модуля: кса 6022 С01, 22.16kb.
- Основні типи живих організмів біосфери: продуценти, консументи, редуценти. Кислотні, 112.8kb.
- Концепція 13 Конкуренція І типи ринкових структур Конкуренція сприяє раціональному, 268.15kb.
- Сучасне заняття: змістовні та структурні ознаки Основною формою навчання дошкільнят, 297.13kb.
- Контрольна робота, 356.13kb.
МІНІСТЕРСТВО ОСВІТИ УКРАЇНИ
НАЦІОНАЛЬНІЙ УНІВЕРСИТЕТ
“КИЄВО-МОГИЛЯНСЬКА АКАДЕМІЯ”
РЕФЕРАТ
НА ТЕМУ: ТИПИ АКУМУЛЯТОРІВ.
ВИКОНАВ: СТУДЕНТ ФПрН-1
САЙГАК М.В.
ПЕРЕВІРИВ: СТАРШИЙ ВИКЛАДАЧ
БАБИЧ Н.М.
Київ, 2003
Вступ 3
Свинцеві акумулятори 3
Нікель-кадмієві акумулятори 6
Нікель-металгідридні акумулятори (Ni-MH) 8
Літій-йонні акумулятори. 9
Літій-полимерні елементи (Lithium Polymer) 10
Літій-залізодисульфідні елементи (Lithium-Iron Disulfide) 10
Цинково-повітряні аккумулятори (Zinc-Air) 11
Перелік використаної літератури.
13
Вступ
Акумулятором називається – вторинне хімічне джерело, яке здатне накопичувати (акумулювати) електричну енергію і в міру потреби віддавати її споживачам. Накопичування електричної енергії в акумуляторі відбувається при пропусканні через нього електричного струму від стороннього джерела. Цей процес називають зарядкою акумулятора, при якій відбувається перетворення електричної енергії у хімічну, внаслідок чого акумулятор стає джерелом електричної енергії. При розрядці відбувається зворотне перетворення хімічної енергії в електричну.
В залежності від роду електроліту акумулятори поділяються на лужні й кислотні.
Свинцеві акумулятори
Сучасна техніка має багато моделей електронакопичувальних пристроїв. Це свинцеві, залізно-никелеві, никель-кадмієві, срібляно-цинкові, сірчасто-натрієві, мідно-литієві та інші типи акумуляторів. Найбільш поширеними є свинцеві акумулятори.
Економічніше за свинцевий акумулятор до сих пір нічого не винайдено. Широке поширення вони набули через високу надійність та невисоку ціну. Експерти ООН вважають, що в майбутньому свинцеві акумулятори збережуть своє значення як одні з найбільш зручних джерел електричного струму.
Основною перевагою свинцевих акумуляторів є те, що вони забезпечують стабільність електричної напруги при змінах струму навантаження та температури. Електрична напруга акумулятора – це різність потенціалів при фіксованому навантаженні. В залежності від електрохімічної системи різність потенціалів на клемах може складати від 1.2В до 2В.
Існує помилкова думка, що основною сферою використання свинцю є виготовлення боєприпасів. Щорічно тільки на свинцеві акумулятори витрачається більше половини всього видобутого свинцю у світі.
Перший працездатний свинцево-кислотний акумулятор був виготовлений французьким дослідником Г. Планте (в 1859р.). Електроди першого акумулятора були виготовлені з листового свинцю, а сепаратором слугувало полотно. Вся конструкція була звернута в спіраль і занурена у 10%-й розчин сірчаної кислоти.
Для збільшення ємності такого акумулятора проводили багаторазові цикли заряду-розряду, чим формували розвинену поверхню платівок. Для такого тренування було потрібно від 1000 годин до двох років. В майбутньому поверхневі платівки формувались гальванічним методом. Єдиним джерелом енергії на той час були первинні елементи. Від них (в основному це були елементи Бунзена) заряджали акумулятори.
Значно збільшити ємність акумуляторів удалося в 1880 р. К. Фор почав виготовляти намазні електроди нанесенням на поверхню платівок окислів свинцю. Вже в 1881р. Е. Фолькмар запропонував намазну решітку в якості електродів. В тому ж році Селлону був виданий патент, в якому було запропоновано виготовляти решітку фолькмара із сплаву сурьми та свинцю.
Прискоренню робот над удосконаленням свинцевого акумулятора сприяло винайдення Едісоном лампи накалювання.
В 1890 році в промислово розвинених країнах свинцево-кислотні акумуляторі вироблялись серійно. Першою патенти Фора, Фолькмара та Селлона викупила Electrical Power
Storage Company. В 1900 році VARTA випустила стартерний акумулятор для запуска автомобільного двигуна.
Найпростіший кислотний акумулятор складається з двох свинцевих платівок, занурених в розчин соляної кислоти. В такому вигляді він не дає ніякої різниці потенціалів. Щоб в акумуляторі виникла ЕДС його потрібно зарядити, тобто пропустити постійний струм від будь-якого джерела. Під час заряджування в акумуляторі відбувається хімічне розкладання сірчаної кислоти. При цьому на катоді виділяється водень, а на аноді – кисень. Останній покриває поверхню анодної платівки і на ній утворюється коричневий шар оксиду свинцю. Катодна платівка залишається без змін. В результаті ми маємо елемент з двома різними платівками в розчині кислоти. Якщо тепер від’еднати джерело струму, то виявиться, що акумулятор має деяку ЕДС та при підключенні до зовнішньої мережі може дати струм.
Під час розряду акумулятора направлення струму протилежне направленню зарядного струму і хімічні процеси проходять в зворотному порядку: на позитивній платівці виділяється водень, а на негативній – кисень. Внаслідок цього через деякий час обидві платівки становляться однаковими та ЕДС знижується до нуля. Якщо акумулятор зарядити, то він знову буде давати струм доки не розрядиться.
Енергія зарядного струму витрачається на створення нових хімічних сполук, а при розряді вони розлагаються і майже повністю віддають енергію, яка була витрачена на їх утворення. При нормальному режимі роботи акумулятор віддає близько 75% енергії отриманої при зарядці. Свинцевий акумулятор має ЕДС близько 2В. Внутрішній опір у нього невеликий тому робоча напруга майже дорівнює ЕДС. Коли акумулятор майже заряджений ЕДС збільшується до 2,7В, але при розряді спочатку швидко зменшується до 2В, а потім досить довго залишається на цьому рівні. Лише в кінці розрядження ЕДС зменшується до 1,8В.
Процеси, які відбуваються в свинцевому акумуляторі.
Свинцеві платівки на повітрі завжди вкриті шаром окису свинцю PbO. Під дією сірчаної кислоти окис свинцю перетворюється на сульфат свинцю - PbSO4 , за рівнянням
PbO + Н2SO4 = PbSO4 + Н2О
Під час заряджання сірчана кислота разлагається на йони Н2 і SO4. негативні йони SO4підходять до аноду і перетворюють сульфат свинцю на диоксид свинцю PbO2.
PbSO4 + SO2 + 2Н2О = PbO2 + 2Н2SO4.
Йони водню в цей час підходять до катоду і відновлюють на його поверхні чистий свинець:
PbSO4 + Н2 = Pb + Н2SO4.
Я

 к ми можемо бачити, під час заряду утворюється сірчана кислота, тобто збільшується її концентрація в розчині. Оскільки розрядний струм протилежний за напрямком зарядному, то реакції відбуваються в зворотному напрямку. Тому в кінці розряду пластини будуть знову вкриті сульфатом свинцю. Концентрація сірчаної кислоти при розряді зменшується.
к ми можемо бачити, під час заряду утворюється сірчана кислота, тобто збільшується її концентрація в розчині. Оскільки розрядний струм протилежний за напрямком зарядному, то реакції відбуваються в зворотному напрямку. Тому в кінці розряду пластини будуть знову вкриті сульфатом свинцю. Концентрація сірчаної кислоти при розряді зменшується.Акумулятор з свинцевих пластин не дуже придатний до використання оскільки має досить маленьку ємність і може давати струм протягом не дуже довгого часу, оскільки диоксиду свинцю при розряді утворюється мало.
Платівки сучасних акумуляторів виготовляють решітчастими (рис. 1) та заповняють активною масою, яка складається з диоксиду свинцю та губчатого свинцю.
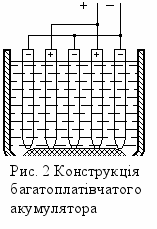
Застосування пластин з активною масою значно збільшує ємність акумулятора. Окрім того для збільшення ємності в акумуляторі встановлюють не одну платівку, а більше, наприклад 5, 7, 9. Кількість негативних платівок буває на одну більше ніж позитивних. Кожну позитивну платівку розташовують між двома негативними (рис. 2). При цьому поверхня платівок використовується з обох боків; тілки у крайніх платівок в роботі використовується одна поверхня. Щоб не допустити короткого замикання між пластинами ставлять пористі прокладки-сепаратори. Сосуди акумуляторів виробляють найчастіше з кислотоупорної пластмаси.
Електроліт виготовляється з хімічно чистої сірчаної кислоти та дистильованої води. Електроліт повинен мати густину 1,25 – 1,26 при температурах вище нуля та 1,30 – 1,35 при температурах нижче нуля. Якщо температура вище 30°, то густину електроліту знижуюють до 1,20 – 1,21.
Нікель-кадмієві акумулятори
В якості електроліту використовують 20 відсотковий розчин гідроксид калію (їдке калі) КОН. Позитивні і негативні пластини виготовлені з нікельованої решітки. В комірки решіток запресовано плоскі коробочки (панелі), виготовлені з нікельованої жесті, з великою кількістю дрібних отворів для проходу електроліту до активної маси.
Активна маса, позитивних пластин складається з гідроксиду нікелю Ni(ОН)3 з домішкою певної кількості графіту для збільшення електропровідності. Активна маса негативних пластин у залізо-нікелевих акумуляторів складається з губчастого заліза Fe (порошок відновленого заліза), а у кадмій – нікелевих – з суміші губчастого кадмію Сd з порошком відновленого заліз. Робота обох типів акумуляторів заснована на окислювальних реакціях при розряді і заряді.
Розглянемо електрохімічні процеси, що відбуваються на електродах кадмій-нікелевого акумулятора. При розрядці на позитивному електроді гідроксид нікелю Ni(ОН)3 переходять в гідроксид нікелю Ni(ОН)2, а на негативному електроді кадмій переходимо в гідроксид кадмію Сd(OH)2 отже на позитивному електроді
2Ni(ОН)3 + 2
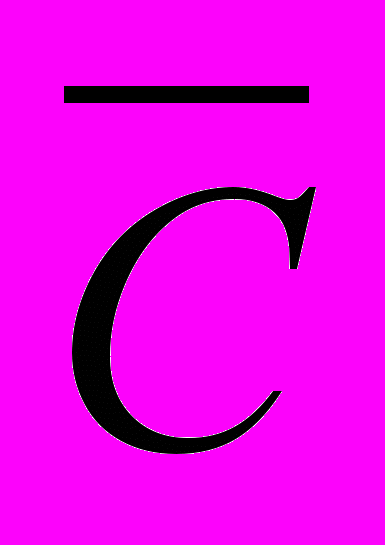 = 2Ni(ОН)2 + “ОН-;
= 2Ni(ОН)2 + “ОН-;На негативному
Сd - 2
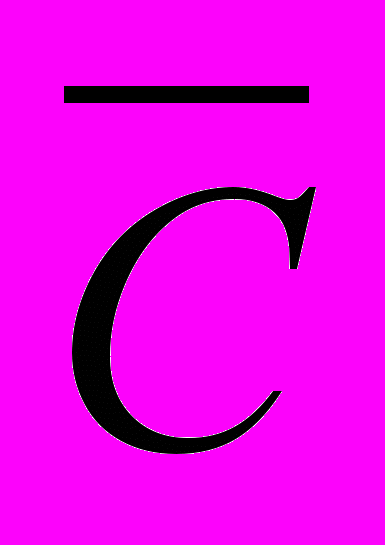 + 2ОН- = Сd (ОН)2
+ 2ОН- = Сd (ОН)2Загальне рівняння розряду одержується сумуванням двох попередніх
2Ni(ОН)3 + Сd + 2Ni(ОН)2 + Сd(ОН)2
Електрони, що утворюються в процесі реакцій, переходять по зовнішньому колу через споживачі електричної енергії, виконуючи певну роботу. При зарядці акумулятора під дією електричної енергії, що надходить від зовнішнього джерела струму, відбувається окислення активної маси позитивних пластин, що супроводжується переходом гідроксиди нікелю 2Ni(ОН)2 в гідроксид нікелю 2Ni(ОН)3 .
В цей час активна маса негативних пластин відновляється з утворенням губчастого кадмію Сd.
Отже на позитивному електроді рівняння заряду буде
2Ni(ОН)2 - 2
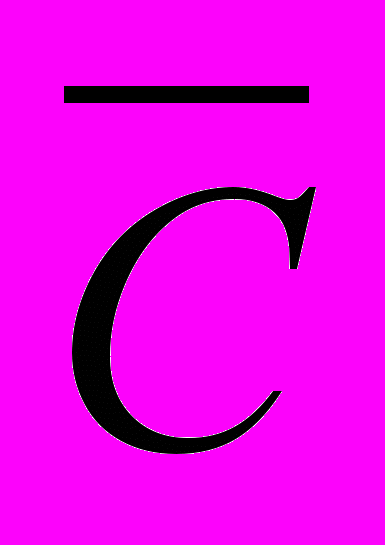 + 2ОН- = 2Ni(ОН)3 ,
+ 2ОН- = 2Ni(ОН)3 ,а на негативному –
Сd (ОН)2 + 2
 + Сd + 2ОН-,
+ Сd + 2ОН-,сумарне рівняння заряду
2Ni(ОН)2 +Сd(ОН)2 = 2Ni(ОН)3 +Сd.
Електроліт в процесі хімічних реакцій не витрачається. Тому його густина не змінюється. Він забезпечує рух іонів. Всі хімічні процеси, що виникають у залізо нікелевому акумуляторі, аналогічні, лише замість кадмію Сd в рівняння входить залізо Fe.
Повністю заряджений акумулятор має ЕРС біля 1,5В. Напруга акумулятора значно нижча ніж ЕРС, внаслідок великого внутрішнього опору. V=Е-Іr, де r – внутрішній опір акумулятора, І – струм навантаження..
В процесі зарядки і розрядки акумулятора його напруга змінюється. При розрядці напруга спочатку швидко спадає до 1,3В, а потім повільно 1 В, в цей момент розрядку слід припинити. При зарядці, навпаки напруга спочатку швидко спадає до 1,7В, а потім повільно піднімається до 1,8 В. Ємність лужних акумуляторів залежить від кількості активної маси, отже від кількості пластин. Для одержання більшої ємності і напруги однотипні акумулятори з'єднують відповідно паралельно, або послідовно. Економічність роботи акумулятора характеризується його коефіцієнтом корисної дії і віддачі. Коефіцієнтом корисної дії ККД акумулятора називається відношення кількості енергії в кіловат/годинах, яку одержано від нього під час розрядки Wp, до кількості енергії, витраченої при зарядці W3, nW= Wp/W3 100%.
Для сучасних кадмій – нікелевих (КН.) і залізо-нікелевих (ЗН) акумуляторів К, К. Д дорівнює 55-65% Коефіцієнтом віддачі акумулятора по ємності nа називається відношення кількості електрики, одержаної при розрядці акумулятора Qp, до кількості електрики, відданої йому при зарядці Q3 і становить 75-80%: na = Qp3 100%.
Нікель-металгідридні акумулятори (Ni-MH)
З точки зору хімії, найкращім матеріалом для катода акумуляторів був би водень, але створити такий катод досить проблематично. Наприкінці шістдесятих років вчені винайшли, що деякі металічні сплави здатні утримувати атомарний водень в об’ємах, які в тисячі раз більші за власні. Ці сплави називаються гідридами і зазвичай складаються з таких сполук як LiNi5 або ZrNi2. В добре продуманих системах гідриди можуть зберігати досить багато водню, який може вступати в зворотні реакції.
В більшості акумуляторів, які використовують гідридні катоди, аноди зроблені з нікелю, як і в нікель-кадмієвих. Зазвичай в якості електроліту в таких акумуляторах використовується розбавлений розчин гідроксиду калію. При заміні кадмію на гідрид досягаються певні переваги. По-перше, це невикористання токсичного кадмію. Відсутність кадмію позбавляє акумулятор від ефекту пам’яті. Також завдяки використання водню густина акумуляторів збільшується на 50% відносно нікель-кадмієвих.
Н
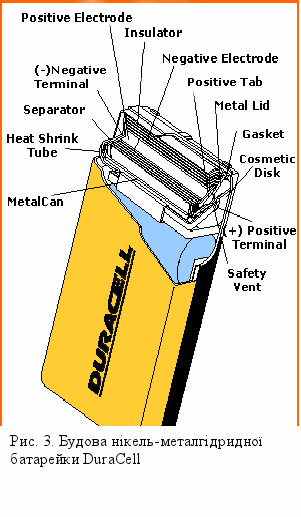 ікель-металгідридні акумулятори мають декілька недоліків. Основним з них є висока швидкість саморозряду у порівнянні з нікель-кадмієвими. Деякі з нікель-металгідридних акумуляторів за добу втрачають до 5% заряду. Як і у нікель-кадмієвих акумуляторів, у нікель-металгідридних напруга складає 1,2В і вона залишається відносно стабільною протягом всього циклу розряду. При наближенні до повного розрядження напруга різко падає. Повністю заражений акумулятор видає напругу 1,4В, але вона швидко знижується до 1,2В.
ікель-металгідридні акумулятори мають декілька недоліків. Основним з них є висока швидкість саморозряду у порівнянні з нікель-кадмієвими. Деякі з нікель-металгідридних акумуляторів за добу втрачають до 5% заряду. Як і у нікель-кадмієвих акумуляторів, у нікель-металгідридних напруга складає 1,2В і вона залишається відносно стабільною протягом всього циклу розряду. При наближенні до повного розрядження напруга різко падає. Повністю заражений акумулятор видає напругу 1,4В, але вона швидко знижується до 1,2В.В багатьох випадках нікель-металгідридні акумулятори можна замінити на нікель-кадміеві. Вони мають практично однакові електричні показники. Але не дивлячись на те, що характеристики розряду у них однакові, процес заряду цих акумуляторів відрізняється. Особливо помітна різниця в теплових режимах - ,нікель-кадмієві акумулятори ендотермічні, а нікель-металгідридні – екзотермічні, тобто під час зарядки вони виділяють тепло. Як тільки вони наближуються до стану повного заряду їх температура різко збільшується.
Літій-йонні акумулятори.
Літій – найбільш хімічно активний метал. На його основі працюють сучасні акумулятори в ноутбуках. Практично всі хімічні джерела струму використовують літій через його особливі властивості. Кілограм літію здатен зберігати 3860 ампер-годин. Для порівняння, цей показник у цинку – 820, а у свинцю – 260.
В залежності від типу аноду літієві акумулятори можуть видавати струм від 1,5В до 3,6В, що вище, ніж у інших типів акумуляторів.
Проблема використання літію заключалась в тому, що він дуже активний. Він настільки бурно реагує з водою, що може спалахнути. Комерційне виробництво простих літієвих елементів живлення почалося в сімдесятих. А уже у вісімдесятих деякі компанії почали серійно випускати літієві акумулятори. Такі батарейки досить швидко набули репутацію елементів із сумнівною безпекою.
Для того щоб вирішити цю проблему виробники акумуляторів передивились технологію та почали використовувати літій в йоннуму стані. Таким чином було використано потенціал літію при задовільному стані безпеки. В таких елементах йони літію знаходяться в активних речовинах електродів, а не в металічних платівках.
Зазвичай в таких елементах анод виробляють з вуглю, а катод – з літійкобальтдиоксиду. В якості електроліту використовують соляний розчин літію.
Внутрішній опір у сучасних літієвих елементів вище ніж у нікель-кадмієвих. Відповідно вони не можуть забезпечити великого струму. Якщо нікель-кадміеві елементі здатні розплавити викрутку, то літієві на це не здатні.
Оскільки в літій-іонних елементах використовується рідкий електроліт, зазвичай вони мають форму циліндру. Хоча така форма не гірша за форму інших елементів, з появою полімеризованих електролітів літій-іонні елементи набувають більш компактних форм.
Літій-полимерні елементи (Lithium Polymer)
Найбільш перспективною серед сучасних технологій вважається доработка вже знайомих нам літієвих реакцій та створення на їх основі літій-твердоплімерного елемента. В сьогодення більшість виробників акумуляторів переключаються на цю технологію.
В той час як в традиційних літій-іонних елементах використовується рідкий електроліт, в твердополімерних елементах електроліт запакован в полімерну пластикову прокладку, розташовану між електродами акумулятора.
В якості електроліту такі елементи використовують полімерні композитні матеріали (такі як поліакрілонітріл) із вмістом солей літію. Оскільки це вже не рідина а тверде тіло, нові батарейки не потребують громіздких циліндричних корпусів, як у традиційних елементів. Виробники з радістю використовують цю особливість і компенсують відносно невисоку щільність таких елементів (яку можна порівняти із звичайними літій-іонними) тим, що використовують більше вільного місця, яке раніше займали циліндричні корпуса. При цьому ефективність використання цього простору збільшується на 22%. Літій-твердополімерні елементи екологічно чистіші звичайних, оскільки не мають металевої оболонки. Також вони більш безпечні оскільки не містять легкозаймистих розчинників.
Літій-залізодисульфідні елементи (Lithium-Iron Disulfide)
На відміну від інших типів літієвих елементів, де намагаються збільшити щільність, в цих елементах реалізовано компромісне рішення. Вони розроблені для стандартних приладів із стандартною напругою 1,5В (традиційні літієві виробляють вдвічі більшу напругу). Але на відміну від інших типів літієвих елементів ці не можна перезарядити.
Внутрішньо вони являють собою шар літієвого аноду, сепаратор та залізосульфідний катод з алюмінієвим катодним струмоз’ємником. Ці елементи запечатано, але вони мають отвори для вентиляції.
Порівняно з іншими лужними елементами, які також не перезаряджаються, літій-залізосульфідні елементи легші (їх маса складає 66% від маси лужних), у них більша ємність і строк використання. Навіть якщо взяти такий елемент після десятирічного зберігання він буде практично повністю зарядженим.
Літій-залізосульфідні елементи легко витримують великі навантаження. Ця перевага непомітна при невеликих навантаженнях. Наприклад, якщо струм навантаження 20мА, виробники вказують, що елемент буде працювати 122 години, а виробники лужних – 135 годин. Але зовсім інша картина, якщо струм навантаження 1А – 2,1 година проти 0,8.
Такі елементи можна використовувати тим же, де і вуглеценкові. Але свою цену вони відпрацьовують лише там де є високе навантаження – в великих ліхтарях, приладах з моторами та в потужній електроніці. Використовувати їх для годинників чи кишенькових радіоприймачів нерозумно.
Цинково-повітряні аккумулятори (Zinc-Air)
Ці елементи відрізняються самою високою щільністю із всіх сучасних технологій. Причиною тому стали компоненти, які використовуються в цій технології. В якості катодного реагенту в цих елементах використовується атмосферний кисень. Для того щоб повітря реагувало з цинковим анодом, в корпусі елемента зроблено невеликі отвори. В якості електроліту в цих елементах використовується гідроксид калію, який має високу провідну здатність.
Спочатку ці елементи були створені як неперезаряджаємі. Вони мають довгий та стабільний строк зберігання. Принаймні, якщо зберігати їх окремо від повітря в неактивному стані. В такому разі за рік ці елементи втрачають 2% ємності. Як тільки повітря потрапляє до цього елемента термін зберігання зменшується до місяця, незалежно від того чи будуть вони використовуватись, чи ні.
Деякі виробники почали використовувати ту само технологію в перезаряджаємих елементах. Найкраще такі елементи зарекомендували себе при тривалій роботі в малопотужних приладах. Основним мінусом цих елементів є дуже високий внутрішній опір, що означає, що для того щоб досягти високої потужності елементи мають бути велетенських розмірів.
Перелік використаної літератури.
- Багоцкий В.С., Скундин А.М. Химические источники тока. М.: Энергоиздат, 1981. 360с.
- герметичных батарей А/О ВАРТА Беттери Научно-исследовательский центр
- Д-р Дитрих Берндт Конструкторский уровень и технические границы применения
- Коровин Н.В. Новые химические источники тока М.: Энергия, 1978. 194 с.
- Лаврус В.С. Батарейки и аккумуляторы К.: Наука и техника, 1995. 48 с.
- Мурыгин И.В. Электродные процессы в твердых электролитах М.: Наука, 1991. 351 с.
- Наука и жизнь, No1, 1991 г. М.: Правда.
- Наука и жизнь, No10, 1986 г. М.: Правда.
- Наука и жизнь, No11, 1991 г. М.: Правда.
- Наука и жизнь, No5...7, 1981 г. М.: Правда.
- Техника молодежи, No5, 1990 г.
- Феликс Р. Патури Зодчие ХХI века М.: ПРОГРЕСС, 1979. 345 с.
