Контроля успеваемости студентов
| Вид материала | Лекция |
- Положение о балльно-рейтинговой системе контроля знаний студентов Общие положения, 84.83kb.
- Тематический план изучения дисциплины распределение часов курса дисциплины по темам, 111.42kb.
- Учебно методическое обеспечение самостоятельной работы студентов. Оценочные средства, 142.86kb.
- Положение о проведении текущего контроля успеваемости и промежуточной аттестации студентов, 404.88kb.
- Малковой Светланы Васильевны по теме Методы контроля эффективности учебного процесса, 110.35kb.
- Самостоятельная работа 53 Подготовка к семинарским занятиям Формы контроля: устный, 5.96kb.
- Рабочая программа дисциплины (модуля) История экономики, 512.57kb.
- Рабочая программа дисциплины (модуля) Финансы и кредит, 694.57kb.
- Итоги успеваемости в 2010-2011 начальная школа Итоги успеваемости основная школа, 584.62kb.
- Задачи текущего контроля знаний обучающихся, 41.57kb.
Лекция № 1
Порядок ведения курса:
Бально-рейтинговая система контроля успеваемости студентов
1 курса медицинского факультета специальности “лечебное дело”
по курсу “Биоорганическая химия”
Соответствие систем оценок (используемых ранее оценок итоговой академической успеваемости, оценок ECTS и балльно-рейтинговой системы (БРС) оценок текущей успеваемости) (В соответствии с Приказом Ректора №996 от 27.12.2006 г.):
| Баллы за семестр | Итоговая оценка | Баллы за итоговый контроль знаний | Общая сумма балов | Итоговая оценка |
| 86 | 5 | 0 - 14 | 96 - 100 | 5+ (А) |
| 71 - 85 | 4 | 0 - 14 | 84 - 95 | 5 (В) |
| 64 - 70 | 3 | 0 - 14 | 68 - 83 | 4 (С) |
| 51 - 63 | 3 | 0 - 14 | 59 - 67 | 3+ (D) |
| 44 - 50 | нет | 0 - 14 | 51 - 58 | 3 (Е) |
| 34 - 43 | нет | 0 - 14 | 36 - 50 | 2+ (FX) |
| <29 | 2 | нет | 3-35 | 2 (F) |
- ставится зачёт, если он предусмотрен учебным планом;
- студент имеет право не проходить итоговый контроль знаний
-
Вид работы
Количество работ
Количество баллов
Общая сумма баллов
Лабораторные работы (подготовка, выполнение, защита)
9
1
9
Контрольные работы
5
10
50
Домашние задания
9
3
27
Итого за семестр
86
Итоговая аттестация
14
ИТОГО
100 баллов
- Студенты обязаны сдавать все задания в сроки, установленные учебным планом. Работы, предоставленные с опозданием, не оцениваются, контрольные работы не переписываются.
- Подготовка и последующее выполнение лабораторных работ является обязательным условием для допуска студента к контрольной работе, включающей тематику лабораторных работ. Отсрочка выполнения лабораторных работ и написание контрольных работ считается уважительной только в случае болезни студента, что подтверждается наличием у него медицинской справки. Невыполненные лабораторные работы должны быть отработаны в десятидневный срок после даты закрытия медицинской справки.
- Для успешного выполнения домашних заданий и подготовке к контрольным работам студентам настоятельно рекомендуется посещение еженедельных консультаций, проводимых преподавателем.
- Если в итоге за семестр студент получил менее 29 баллов, то ему выставляется оценка F и студент должен повторить эту дисциплину в установленном порядке.
- Студенты, получившие в течение семестра, оценку: 2+ (FX), 3 (E), 3+ (D) или 4 (C) и желающие повысить свою оценку, допускаются к экзамену (итоговая аттестация). Итоговая работа оценивается из 14 баллов.
Литература:
1. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. “Дрофа”, Москва, 2005.
2. Тюкавкина Н.А, Белобородов В.Л., Зурабян С.Э., Лузин А.П. и др. Органическая химия. “Дрофа”, Москва, т.1(2002), т.2 (2008).
3. Грандберг И.И, Органическая химия. “Дрофа”, Москва, 2002.
4. Степаненко Б.Н. Курс органической химии. "Высшая школа", 1987.
5. Простаков Н.С. Начала биоорганической химии. Изд. УДН,
Москва, 1988.
6. Варламов А.В., Сорокина Е.А., Никитина Е.В. Методические указания к выполнению лабораторных работ по биоорганической химии, Москва, РУДН, 2009. или (Борисова Т.Н., Солдатова С.А., Воскресенский Л.Г., Зубков Ф.И. Методические указания к выполнению лабораторных работ по биоорганической химии, Москва, РУДН, 2003).
Дополнительная
1. Простаков Н.С. “Начала органической химии”, М., РУДН, часть 1-3, 1993.
2. Шабаров Ю.С. “Органическая химия”, М., Химия, 2000.
3. Ким А.М. “Органическая химия”, Новосибирск, Сибирское университетское издательство, 2004.
4. Терней А. Современная органическая химия, т.1,2, Москва,
"Мир", 1981.
Введение
Органическая химия - это химия соединений углерода. В состав органических соединений входят кроме атомов углерода атомы водорода, азота, серы, фосфора, кремния, металлы, галогены. Название “органическое соединение ” употреблялось уже в конце ХVIII в., а термин “органическая химия” впервые введен в начале XIX в. Берцелиусом который считал, что органические вещества образуются только в организмах в результате жизнедеятельности при участии “жизненной силы” (“теория витализма”). В 1828 г. Ф. Велер синтезировал из неорганического вещества (циaнат аммония NH4OCN) органическое вещество – мочевину (NH2C(O)NH2) и “теории витализма” был нанесен сокрушительный удар. Теоретической основой органической химии является теория химического строения. Основоположником которой был Александр Михайлович Бутлеров – великий русский химик (1861 г.) Ее фундаментальные положения объясняют строения, свойства, реакционную способность органических соединений:
1. Атомы в молекулах соединены друг с другом в строгой последовательности согласно их валентностям. Такая последовательность называется химическим строением молекулы. возможность установления химического строения соединения.
2. Свойства молекул зависят не только от числа и природы атомов, входящих и состав молекул, но и от строения молекулы.
3. Атомы и группы атомов взаимно влияют друг на друга, что отражается на свойства молекул.
4. Зная свойства молекулы, можно предположить ее строение. Зная строение молекулы, можно описать ее свойства.
Кратко: Свойства соединений зависят не только от природы и числа входящих в них атомов, но и от химического строения молекул, под которым понимается определенная последовательность связей между атомами.
Алканы
Алканами (предельные углеводороды, парафины) называют насыщенные углеводороды (состоящие из атомов углерода и водорода) общей формулы СnH2n+2, соединенные только -связями и несодержащих циклов. В соответствии с общей формулой алканы образуют гомологический ряд (от греч. homolog - сходный), в котором гомологи отличаются друг от друга на гомологическую разность (-СН2-).
Первые четыре представителя имеют полусистематические названия – метан (CH4), этан (С2H6), пропан (С3H8), бутан (С4H10). Названия последующих членов ряда строятся из корня (греческие числительные) и суффикса –ан: пентан (С5H12), гексан (С6H14), гептан (С7H16), октан (С8H18), нонан (С9H20), декан (С10H22).
Молекулы нормальных алканов имеют линейное строение и содержат только первичные (имеет лишь один соседний атом С) и вторичные (имеет два соседних атома С) атомы углерода.

Молекулы изоалканов содержат кроме первичных и вторичных еще третичные и (или) четвертичные атомы углерода.

Разветвленные алканы получают названия на основе наиболее длинной углеводородной цепи с добавлением префиксов, обозначающих радикалы боковых цепей. Нумерацию цепи производят таким образом, чтобы локанты заместителей были наименьшими.
Одновалентные радикалы, образуемые в результате формального удаления атома водорода от атома углерода, называют, заменяя суффикс –ан на –ил: – метил (CH3 -), этил (СH3-СН2- ), пропил (СH3-СН2-СH2-) и т.д.
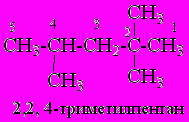
Атомы углерода в алканах находятся в sp3-гибридном состоянии. Атом углерода способен образовать четыре равноценные связи (-связи). Оси четырех sp3-орбиталей направлены к вершинам тетраэдра, валентные углы равны 109о 28. Основное состояние:
6C 1s22s22p2 *C 1s22sp3

sp3: 1s+3p=4sp3

Пространственное строение метана: метан – идеальный тетраэдр Такая геометрия обеспечивает минимальное отталкивание между четырьмя связывающими парами электронов.
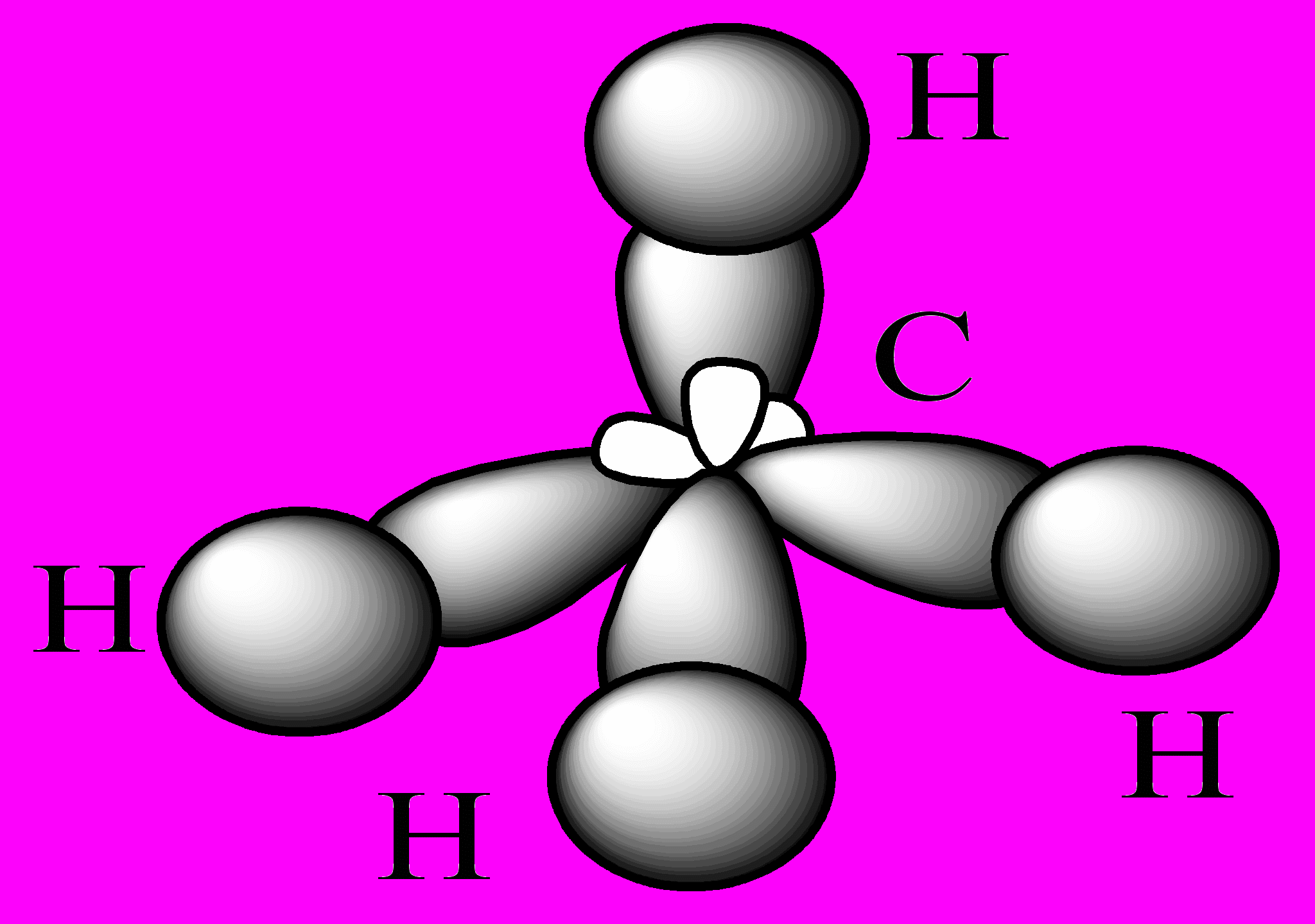
Характеристики связи:
Энергия С-С связи ЕС-С= 351 кДж/моль
Длина С-С связи 0,154 нм; =109028 (Н-С-Н); Э.о. 2,5
Фрагменты молекул могут свободно вращаться относительно друг друга вокруг углерод-углеродных связей. И поэтому алканы, начиная с этана CН3–СН3, существуют в различных пространственных формах (конформациях), обусловленных внутримолекулярным вращением по -связям С–С, и проявляют так называемую поворотную (конформационную) изомерию.
Связь С–С в алканах является ковалентной неполярной. Связь С–Н - ковалентная слабополярная, т.к. углерод и водород близки по электроотрицательности (2,5 - для углерода и 2,1 - для водорода).
Для алканов, начиная с бутана, существуют структурные изомеры (изомеры строения), различающиеся порядком связывания между атомами углерода, с одинаковым качественным и количественным составом и молекулярной массой, но различающихся по физическим свойствам.
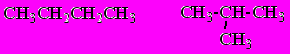
н-бутан 2-метилпропан (изобутан)
Ткип -0,50С Ткип -11,40С
С увеличением числа атомов углерода в составе молекул увеличиваются возможности для разветвления цепи, т.е. количество изомеров растет с ростом числа углеродных атомов молекуле (бутан – изобутан; 3 пентана, 5 гексанов, 9 гептанов, 11 октанов и т.д.).
Физические свойства
При обычных условиях С1-С4 – газы без запаха; С5-С15 – жидкости с характерным бензиновым запахом; с С16 – высшие алканы – твердые вещества без запаха. Алканы практически нерастворимы в воде, но хорошо растворимы в углеводородах и их галогенопроизводных.
Способы получения
Промышленными источниками алканов служат природный газ, нефть и ее фракции, перерабатываемые различными методами, важнейшими из которых являются крекинг (crack –растрескивать, ломать; гомолиз С-С связей), пиролиз (высокотемпературный крекинг 10000С) и риформинг (каталитический крекинг с одновременным каталитическим облагораживанием низкооктановых бензинов).
I. Промышленные способы.
1) Фракционная перегонка нефти, для первых членов гомологического ряда – природный газ.
2) Из каменного угля (газификация)

3) Синтез Фишера-Тропша
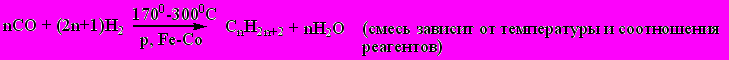
II. Препаративные способы получения.
При промышленных способах получения алканы выделяются в виде смесей и выделить из таких смесей индивидуальные соединения сложно. По этой причине для получения некоторых алканов используют синтетические методы.
1. Гидрирование алкенов и алкинов.


2. Реакция Вюрца
:R-X + 2Na + X-R’ → R-R’ + R-R + R’-R’+ 2 NaX.
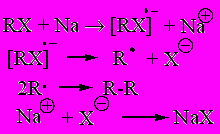
Удобна для получения алканов с четным числом атомов углерода; смесь двух различных моногалогенопроизводных дает смесь трех алканов.
3. Сплавление солей карбоновых кислот со щелочью (Дюма).

4. Электролиз водных растворов солей карбоновых кислот (Кольбе)

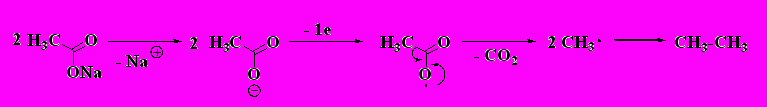
Химические свойства
Алканы относятся к наиболее инертным в химическом отношении веществам. Причиной химической устойчивости алканов является высокая прочность -связей С-С и С-Н, а также неполярность связей С-С и очень низкая полярность связей С-Н.
Алканы устойчивы в обычных условиях к действию концентрированных кислот и концентрированной щелочи, не окисляются сильными окислителями КMnO4, К2Сr2O7/H2SO4, не взаимодействуют со щелочными металлами. Химические свойства связаны главным образом, с разрывом С-Н связей, а именно замещением водорода на другие атомы и группы. Все реакции происходят в специальных (довольно жестких) условиях и идут по радикальному механизму (SR).
Качественные реакции: отсутствие обесцвечивания растворов Br2 и KMnO4 в воде при 200С.
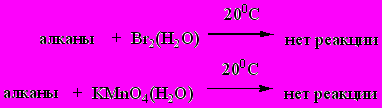
1. Галоидирование.

Механизм реакций галоидирования на примере бромирования пропана:
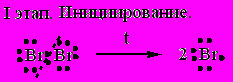



3. СnH2n+2 + SO2 + ½O2 СnH2n+1SO3H (сульфоокисление, условия реакции: облучение УФ)
h алкилсульфокислота
4. СH4
 C + 2H2; 2CH4
C + 2H2; 2CH4  C2H2 + 3H2 (разложение метана – пиролиз).
C2H2 + 3H2 (разложение метана – пиролиз).5 CH4 + 2H2O
 CO2 + 4H2 (конверсия метана).
CO2 + 4H2 (конверсия метана).6. 2 СnH2n+2 + (3n+1)O2 2nCO2 + (2n+2) H2O (горение алканов).
7. 2 н-C4H10 + 5O2 4CH3COOH + 2H2O (окисление алканов в промышленности; получение уксусной кислоты).
8. н-С4Н10 изо-С4Н10 (изомеризация, катализатор AlCl3).
Применение алканов. Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека. Газообразные алканы (метан и пpопан-бутановая смесь) используются в качестве ценного топлива. Жидкие углеводоpоды составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей. Паpафин (смесь твеpдых алканов С19-С35) - белая твеpдая масса без запаха и вкуса (Тпл= 50-70°C) - пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине и т.д. В современной нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ.
