Механизмы нарушения структуры коллагена при дестабилизации атеросклеротической бляшки в клинике и эксперименте
| Вид материала | Автореферат |
- Механизмы нарушения цитокинопосредованной кооперации эозинофилов и иммунокомпетентных, 369.32kb.
- Патапсихология раздел клинической психологии. Предмет нарушения психики, их психологические, 34.18kb.
- Патоморфологический анализ острого геморрагического панкреонекроза и его коррекция, 583.5kb.
- Функциональное состояние эндотелия сосудов у больных атеросклеротической энцефалопатией, 166.99kb.
- Анализ семейных взаимоотношений, 443.3kb.
- Ядерный магнитный резонанс в прижизненных исследованиях метаболизма мозга. Метаболические, 12.53kb.
- Varthamana international traders, 216.63kb.
- Тема: Нервно-мышечные заболевания пищевода Гришин, 28.15kb.
- Нейрофизиологические механизмы нарушения когнитивной деятельности при органическом, 392.7kb.
- Недостаточность кровообращения профессор А. С. Сенаторова (лекция), 768.69kb.
На правах рукописи
Овчинникова Ольга Андреевна
Механизмы нарушения структуры коллагена ПРИ ДЕСТАБИЛИЗАЦИИ АТЕРОСКЛЕРОТИЧЕСКОЙ БЛЯШКИ
В КЛИНИКЕ И ЭКСПЕРИМЕНТЕ
14.00.06 – кардиология
14.00.16 – патологическая физиология
А В Т О Р Е Ф Е Р А Т
диссертации на соискание ученой степени
кандидата медицинских наук
.
Санкт-Петербург
2008
Работа выполнена в ГОУ ВПО «Санкт-Петербургский государственный медицинский университет имени академика И.П.Павлова»
Научные руководители: доктор медицинских наук
член корр. РАМН профессор
Евгений Владимирович Шляхто
доктор медицинских наук профессор
Наталья Алексеевна Гавришева
Официальные оппоненты: доктор медицинских наук профессор
Алексей Владимирович Панов
доктор медицинских наук профессор
Андрей Глебович Васильев
Ведущее учреждение: Военно-медицинская академия имени С.М. Кирова
Защита состоится « 15 » декабря 2008 года в 13 ч. 15 мин. на заседании диссертационного Совета Д. 208.090.01 при ГОУ ВПО «Санкт-Петербургский государственный медицинский университет имени академика И.П.Павлова» (197089, г. Санкт-Петербург, ул. Л. Толстого, 6/8) в зале заседаний Ученого совета
С диссертацией можно ознакомиться в библиотеке университета
Автореферат разослан «____» ноября 2008 года
Ученый секретарь диссертационного совета
доктор медицинских наук профессор Т.В. Антонова
Список сокращений
ОКС – острый коронарный синдром
ЛПНП - липопротеины низкой плотности
ЛПВП - липопротеины высокой плотности
IFN- - интерферон- (interferon-)
TGF- - трансформирующий фактор роста-β (transforming growth factor-β)
IL-1β - интерлейкин-1β (interleukin-1β)
MHC - главный комплекс гистосовместимости (major-histocompatibility-complex)
П4Г - пролил-4-гидроксилаза
LOX - лизил-оксидаза (lysyl-oxidase)
ММР - матричные металлопротеиназы (matrix metalloproteinase)
TIMP - тканевой ингибитор металлопротеиназ (tissue inhibitor of metalloproteinases)
ПЦР - полимеразная цепная реакция
иАПФ – ингибиторы ангиотензин-превращающего фермента
АКТУАЛЬНОСТЬ
Сердечно-сосудистые заболевания, связанные с атеросклеротическим поражением сосудов, занимают ведущее место среди причин летальности во многих странах мира, в том числе в России. Существует угроза стремительного роста заболеваемости атеросклерозом уже в молодом возрасте в результате прогрессирующего увеличения метаболических факторов риска и недостаточной эффективности существующих методов диагностики, профилактики и лечения данной патологии (Харченко В.И. и соавт., 2005; Hansson G.K., 2005; Lopez A.D. et al., 2006).
Согласно современным представлениям атеросклероз представляет собой многофакторное заболевание, в основе которого лежат два взаимосвязанных процесса: нарушение метаболизма липидов и воспаление сосудистой стенки (Климов А.Н. и соавт., 1999; Hansson G.K. et al., 2006; Libby P. et al., 2008). Воспалительный процесс играет ведущую роль на всех этапах атерогенеза, начиная с формирования атеросклеротической бляшки и заканчивая нарушением структуры атеромы с развитием тромботических осложнений (Нагорнев В.А. и соавт., 2001; Hansson G.K. et al., 2007; Ridker P.M. et al., 2008).
Стабильность атеромы зависит от целостности ее фиброзной капсулы, основными компонентами которой являются миофибробласты и фибриллярный коллаген I и III типов (Шехонин Б.В. и соавт., 1984; Barnes M.J. et al., 1999; Libby P. et al., 2005; Hansson G.K., 2005). К признакам нестабильной атеромы относят увеличение липидного “ядра”, истончение фиброзной капсулы, а также воспалительную инфильтрацию (Falk E. et al., 1995; Hansson G.K., 2005; Aikawa М. et al., 2006). Одной их причин дестабилизации атеросклеротической бляшки является дисбаланс между синтезом коллагена и его протеолизом в атероме, в результате чего возникает нарушение механической прочности фиброзной капсулы (Libby P. et al., 2005; Hansson G.K. et al., 2006; Schwartz S.M. et al., 2007).
Показано, что нарушение синтеза коллагена в атеросклеротической бляшке может быть связано с действием провоспалительных факторов, среди которых ведущую роль играет медиатор Т-лимфоцитов - интерферон-, обладающий способностью уменьшать пролиферацию миофибробластов и снижать экспрессию гена коллагена (Robertson A.K. et al., 2006; Tedgui A. et al., 2006). Протеолитическая деградация коллагеновых волокон в фиброзной капсуле происходит под влиянием активных ферментов, в том числе матричных металлопротеиназ и цистеиновых протеаз, источником которых являются макрофаги, тучные клетки и другие (Aikawa M. et al., 2004; Newby A.C., 2005; Kovanen P.T., 2007; Raffetto J.D. et al., 2008).
Результаты многочисленных исследований по изучению патогенетических звеньев дестабилизации атеросклеротической бляшки имеют неоднозначный характер и в полной мере не освещают механизмы нарушений структуры коллагена в атероме, особенно на этапе до развития сердечно-сосудистых осложнений.
Использование линий генетически-модифицированных мышей позволяет целенаправленно изучать влияние факторов воспаления на морфофункциональные свойства и метаболизм коллагена на этапах, предшествующих разрыву фиброзной капсулы (Heeneman S. et al., 2008). Исследование клинического материала атеросклеротических бляшек открывает возможности для поиска взаимосвязи между патогенетическими факторами дестабилизации атером и особенностью течения атеросклероза, а также проводимой медикаментозной терапией (Niessner A. et al., 2008).
Понимание механизмов нарушения структуры коллагена в нестабильной бляшке на этапах, предшествующих развитию острых сосудистых катастроф, может служить основой для разработки диагностических и профилактических методов решения данной проблемы.
В настоящей работе для выполнения поставленных задач был использован комплексный подход с применением экспериментального и клинического материала. Представленная работа проводилась на кафедре факультетской терапии СПбГМУ им. И.П. Павлова, а также в Центре молекулярной медицины Каролинского Института (Стокгольм, Швеция) при научной консультации профессора Göran K. Hansson в рамках совместной международной исследовательской программы.
Цель исследования: Исследовать патогенетические факторы нарушения структуры коллагена при дестабилизации атеросклеротической бляшки у пациентов и в эксперименте.
Задачи исследования:
- Исследовать структуру и метаболизм волокон коллагена на экспериментальной модели нестабильной атеросклеротической бляшки.
- Оценить особенности структуры коллагена в зависимости от активности воспаления в атеросклеротической бляшке у пациентов.
- Определить влияние воспаления на процессы модификации коллагена при дестабилизации атеросклеротической бляшки у пациентов.
- Исследовать взаимосвязь между морфологическими характеристиками атеромы, биосинтезом коллагена в атеросклеротической бляшке и клиническими проявлениями атеросклероза.
Основные положения, выносимые на защиту. Преобладание незрелых волокон коллагена в нестабильной атероме у пациентов и в эксперименте связанно со снижением экспрессии внеклеточного коллаген-модифицирующего фермента лизил-оксидазы.
Нарушение структурной стабильности коллагена в условиях активного воспаления может быть фактором дестабилизации атеросклеротической бляшки.
Научная новизна. В комплексном исследовании с использованием клинического и экспериментального материала показано, что дестабилизация атеросклеротической бляшки связана с нарушением структуры коллагена в результате снижения экспрессии фермента лизил-оксидазы, участвующего в формировании зрелых коллагеновых волокон.
Установлена отрицательная тесная корреляционная связь между экспрессией гена лизил-оксидазы и активностью воспаления в атеросклеротических бляшках пациентов и генно-модифицированных мышей.
У пациентов с сахарным диабетом обнаружено значительное снижение экспрессии фермента лизил-оксидазы в атеромах.
Научно - практическая значимость. Полученные результаты о снижении экспрессии фермента лизил-оксидазы, как патогенетического звена нарушения структуры коллагена при дестабилизации атеромы до разрыва фиброзной капсулы, позволяют целенаправленно вести исследования по изучению предикторов острых сосудистых катастроф.
Снижение экспрессии фермента лизил-оксидазы в атеромах у пациентов, особенно при сахарном диабете, можно рассматривать одним из рисков дестабилизации атеросклеротической бляшки и патогенетической основой для проведения более активной противовоспалительной терапии, направленной на обеспечение структурной стабильности коллагена.
Создание биобанка атеросклеротических бляшек человека расширяет возможности для проведения исследований по изучению фундаментальных и клинических аспектов атеросклероза с целью разработки новых методов диагностики, лечения и профилактики сердечно-сосудистых осложнений.
Апробация работы. Материалы диссертации были представлены в виде докладов и тезисов на конгрессе европейского общества по изучению атеросклероза (Прага, 2005), международном конгрессе «Артериальная гипертензия – от Короткова до наших дней», Всероссийской научно-практической конференции молодых ученых «Актуальные проблемы кардиологии» (Москва, 2005), третьей европейской научной конференции «Сосудистая биология и медицина» (Гамбург, 2005), конгрессе международного общества по изучению атеросклероза (Рим, 2006), Российском национальном конгрессе кардиологов (Москва, 2006).
По теме диссертации опубликовано 8 научных работ, в том числе 1 статья в журнале, рекомендованном ВАК.
Внедрение результатов исследования. Результаты исследования внедрены в учебный и лечебный процесс кафедры факультетской терапии и в работу кафедры патофизиологии Санкт-Петербургского государственного медицинского университета имени академика И.П.Павлова, а также Центра молекулярной медицины Каролинского Института (Стокгольм, Швеция).
Структура и объем диссертации. Диссертация изложена на 119 страницах машинописного текста и состоит из введения, обзора литературы, описания характеристик обследованных пациентов и методов исследования, главы результатов собственных исследований, обсуждения, выводов, и практических рекомендаций. Список литературы содержит 244 источника, в том числе 24 отечественных и 220 иностранных.
Диссертация иллюстрирована 6 таблицами и 17 рисунками.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Общая характеристика обследованных пациентов.
Для изучения структурных особенностей и биосинтеза коллагена был использован материал атеросклеротических бляшек из сонных артерий человека, полученных в ходе операции эндартерэктомии по стандартному протоколу на основании диагноза ишемическая болезнь мозга, стеноз одного из брахиоцефальных сосудов более 80% (White C.J. et al., 2008). Контролем служили биопсийные образцы стенки артерий, не имеющие микро- или макро- признаков атеросклеротического поражения, которые были взяты у доноров во время операций трансплантации почки. Исследования проводили на материале двух биобанков атером человека - на базе Каролинского института (Стокгольм, Швеция), включающего 310 пациентов в возрасте от 40 до 88 лет (средний возраст 69 лет) (Paulsson-Berne G. et al., 2006), а также биобанка атеросклеротических бляшек от 117 пациентов в возрасте от 45 до 79 лет (средний возраст 62 года), созданного на клинической базе ФГУ «Федеральный центр сердца, крови и эндокринологии имени В.А. Алмазова Росмедтехнологий» и на отделении сосудистой хирургии городской многопрофильной больницы №2 Санкт-Петербурга.
Большую часть обследованных пациентов составили мужчины (80%). Средний процент стеноза внутренних сонных артерий по данным ультразвукового сканирования был 75,7 1,5%. У большинства обследованных пациентов наблюдалось генерализованное атеросклеротическое поражение сосудистого русла, при этом 83% пациентов страдали ишемической болезнью сердца различной степени тяжести и 37% пациентов имели атеросклеротическое поражение артерий нижних конечностей. У 38% пациентов в анамнезе были сведения о перенесенном остром коронарном синдроме (ОКС).
Все пациенты, включенные в обследование, имели один или несколько факторов риска атеросклероза. На момент операции эндартерэктомии курили 33% больных. Средний показатель холестерина крови составил 4,7 0,6 ммоль/л. Артериальная гипертензия была диагностирована у 78% больных, сахарный диабет типа 2 был у 23% больных. Индекс массы тела составил в среднем 26 0,3 кг/м2.
Во время операции эндартерэктомии удаленную атерому разрезали на две равные части поперечно ходу сосуда и использовали для анализа мРНК или гистологических исследований. При создании информационной базы данных учитывали основной и сопутствующие диагнозы, симптоматическую картину на момент операции, анамнез, факторы риска развития атеросклероза, данные лабораторных и инструментальных исследований, а также сведения о медикаментозной терапии.
Генетически-модифицированные мыши.
Экспериментальные исследования проводили на 2 группах генетически-мофицированных животных. Для контроля были использованы мыши с врожденной гиперлипидемией - Apoe-/- нокаутные (далее, контрольные мыши). У мышей из опытной группы (далее, трансгенные мыши), созданной на основе контрольной, на Т-лимфоцитах отсутствовал нормально функционирующий рецептор к противовоспалительному и основному профиброгенному цитокину - трансформирующему ростовому фактору-β (TGF-β), что приводило к гиперактивации Т-лимфоцитов и проявлялось большей инфильтрацией атеросклеротических бляшек макрофагами и Т-лимфоцитами, а также увеличенной экспрессией главного комплекса гистосовместимости II класса (MHC) на поверхности большинства клеток атером по сравнению с группой контрольных мышей (Robertson A.K. et al., 2003). Таким образом, у трансгенных мышей воспаление протекало более активно и, как следствие, наблюдалось раннее развитие и нестабильное течение атеросклеротического процесса.
В работе использовали самок трансгенных мышей в возрасте 12 недель и самок контрольных мышей в возрасте 18 недель, по 9 животных в каждой группе. Подобная разница в возрасте была обусловлена тем, что сравнимые по величине атеросклеротические бляшки формировались у мышей контрольной группы позже, чем у трансгенных мышей (Robertson A.K. et al., 2003). Все эксперименты проводили в соответствии с принятыми этическими нормами по работе с лабораторными животными (Baumans V., 2005; Radzikowski C., 2006).
Методы исследования.
- Исследование структуры коллагеновых волокон в атеросклеротических бляшках пациентов и экспериментальных мышей проводили гистологическим методом с красителем пикро-сириус красным (Picro-sirius Red) с последующей количественной оценкой содержания коллагена с помощью компьютерной морфометрии (Junqueira L.C. et al., 1979; Whittaker P. et al., 1994);
- Иммуногистохимическое окрашивание на маркеры миофибробластов (-актин гладкомышечных клеток), макрофагов (CD163) и Т-лимфоцитов (CD3) осуществляли на поперечных срезах атером пациентов и экспериментальных мышей с последующей количественной оценкой положительного сигнала в ткани с помощью компьютерной морфометрии (Автандинов Н.Г., 1990; Robertson A.K. et al., 2003);
- Определение экспрессии генов проводили с помощью метода количественной полимеразной цепной реакции (ПЦР) в реальном времени (Heid C.A. et al., 1996; Tricarico C. et al., 2002). В ходе экспериментальной части работы исследовали экспрессию мышиных генов интерферона- (IFN-), интерлейкина-1 (IL-1β), α-цепей проколлагена типа I и III, α-субъединицы коллаген-специфичного фермента пролил-4-гидроксилазы, фермента лизил-оксидазы, матричных металлопротеиназ (MMP) -2, -3, -8, -9, -12, -13 и -14, цистеиновых протеаз - катепсинов К, L и S, тканевого ингибитора металлопротеаз-1 (TIMP-1) и ингибитора цистеиновых протеаз - цистатина C. При анализе клинического материала оценивали экспрессию генов пролил-4-гидроксилазы и лизил-оксидазы, а также генов маркеров макрофагов (CD68) и главного комплекса гистосовместимости II класса (MHC). И в экспериментальных, и в клинических исследованиях определяли экспрессию гена ТАТА-бокс связывающего белка (ТАТАbbp), который принимали за внутренний контроль качества РНК. Результаты выражали в относительных единицах (отн.ед);
- Количественный анализ суммарной активности фермента пролил-4-гидроксилазы в атеромах мышей проводили методом оценки прироста радиоактивного продукта (4-гидрокси-14С-пролин). Результаты выражали в процентах от активности фермента у контрольных мышей (Kivirikko K.I. et al., 1982);
- Количественное определение белка фермента лизил-оксидазы в атеромах мышей проводили методом иммуноблоттинга (Вестерн блот гибридизация, Western blot). Результаты выражали в условных единицах (усл.ед.) (Csiszar K., 2001);
- Количественную оценку продуктов деградации коллагена в атеросклеротических бляшках мышей осуществляли методом иммуноферментного анализа (тест-система RatLaps, Дания) на автоматическом фотометре для микропланшетов (DRG Eliza-Mat 2000). Результаты выражали в нг/мл. (Garnero P. et al., 2003).
Методы статистической обработки.
Статистическую обработку полученных результатов проводили с помощью компьютерных программ Microsoft Excel 2003, StatView (SAS Institute, США) и Statistica 6 (StatSoft, Inc.). При проведении сравнительного анализа подсчитывали среднее арифметическое и стандартную ошибку средней. В случае нормального распределения анализ достоверности различий между группами выполняли с помощью t-критерия Стьюдента. В противном случае, а также с учетом малой выборки (экспериментальная часть работы), для оценки достоверности применяли непараметрические критерии Манна-Уитни. Для поиска связей и оценки их достоверности применяли корреляционный анализ с использованием показателя линейной корреляции Пирсона (r). Результаты считались достоверными при значении доверительной вероятности (риск ошибки, р) менее 0.05 (StatSoft, 1999).
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
Результаты исследований метаболизма коллагеновых волокон атеросклеротической бляшки в эксперименте.
По современным представлениям, метаболизм коллагена на посттрансляционном этапе включает процессы внутри- и внеклеточных модификации. Этапы внутриклеточной модификации заключаются в гидроксилировании некоторых остатков проколлагеновых -цепей под действием гидроксилаз, в том числе пролил-4-гидроксилазы, что является основой для образования внутри- и межмолекулярных связей и формирования трехспиральной конформации молекулы. После секреции проколлагена происходят отщепление N- и C- концевых пептидов и фермент-зависимая агрегация молекул в фибриллы с формированием поперечных связей зрелых волокон под действием фермента лизил-оксидазы (Замараева Т.В. и соавт., 1985; Буржанидзе Т.В., 1992, Myllyharju, 2001 #303; Gelse K. et al., 2003). В дальнейшем коллагеновые волокна утилизируются под действием большого спектра протеолитических ферментов (Steins M.B. et al., 1999; Aikawa M. et al., 2004; Newby A.C., 2005; Lutgens S.P. et al., 2007; Kovanen P.T., 2007).
Анализ состояния коллагеновых волокон атеросклеротических бляшек экспериментальных мышей выявил, что содержание зрелых коллагеновых волокон в атеромах трасгенных мышей составило 1,4 ± 0,4%, что было достоверно ниже, чем в атеромах контрольных мышей (3,6 ± 0,4%; p < 0,05). Незрелые волокна коллагена преобладали в бляшках трансгенных мышей по сравнению с контролем, однако указанное различие не достигло статистической достоверности (2,8 ± 0,4% и 1,8 ± 0,3%, соответственно; p = 0,09). Коэффициент соотношения толстых волокон к тонким (далее, “коэф. коллаген”) был значительно меньше в группе трансгенных мышей по сравнению с контрольной группой (0,6 и 2,6, соответственно). При этом общее количество коллагеновых волокон (4,4 ± 0,7% у трасгенных мышей и 5,4 ± 0,7% у контрольных мышей; p = 0,34) и количественное содержание миофибробластов, экспрессирующих -актин, достоверно не различалось в бляшках двух групп мышей (9,2 ± 1,7% и 6,0 ± 1,1%, соответственно; p = 0,22).
Таким образом, полученные результаты позволяют предположить, что у мышей с нестабильной бляшкой несостоятельность коллагена могла быть обусловлена как уменьшением экспрессии генов цепей коллагена в отдельных клетках, изменением посттрансляционной модификации волокон, так и повышенной их утилизацией. В нашей работе мы последовательно изучили все эти этапы метаболизма коллагена.
У трансгенных мышей экспрессия генов IFN-γ и IL-1β была достоверно выше по сравнению с контрольной группой, что является подтверждением высокой степени активности воспаления в атеромах этих животных. При этом достоверных изменений экспрессии генов α-цепей проколлагенов типов I и III в атеросклеротических бляшках опытной группы не отмечалось (табл. 1).
Анализ экспрессии генов ферментов пролил-4-гидроксилазы и лизил-оксидазы, принимающих участие в посттрансляционной стабилизации коллагеновых волокон, выявил достоверное снижение уровня экспрессии этих генов в атеромах трансгенных мышей (табл. 1).
Таблица 1.
Показатели экспрессии генов в атеросклеротических бляшках у экспериментальных животных.
| Название гена | Экспрессия гена (отн.ед.) | |
| Трансгенные мыши | Контрольные мыши | |
| IFN-γ | 9,7 ± 0,9 *** | 0,2 ± 0,03 |
| IL-1β | 1,6 ± 0,2 *** | 0,6 ± 0,1 |
| Проколлаген I типа, альфа цепь | 4,4 0,5 | 5,0 0,3 |
| Проколлаген III типа, альфа цепь | 5,9 0,5 | 6,9 0,7 |
| П4Г, -1 субъединица | 7,3 0,5 * | 11,3 1,0 |
| LOX | 0,6 0,2 * | 1,0 0,2 |
| MMP-13 | 8,4 ± 0,5 * | 2,8 ± 0,3 |
| Катепсин S | 10,1 ± 0,8 * | 3,5 ± 0,2 |
| ММР-9 | 1,5 ± 0,3 * | 1,0 ± 0,3 |
| Цистатин C | 0,42 ± 0,06 * | 0,82 ± 0,14 |
*** - р < 0,001; * - р < 0,05
В атеромах трансгенных мышей, несмотря на снижение экспрессии гена внутриклеточного фермента пролил-4-гидроксилазы, отмечалось повышение суммарной активности этого фермента на 33% по сравнению с контрольными животными. Полагают, что данные результаты могут быть связаны с компенсаторным увеличением экспрессии других изоформ фермента пролил-4-гидроксилазы для стабилизации ткани (Myllyharju J. et al., 2004). Проверка данной гипотезы требует проведения дальнейших целенаправленных исследований.
При изучении изменений внеклеточного коллаген-модифицирующего фермента лизил-оксидазы нами было обнаружено достоверное уменьшение количества активной формы данного фермента в атеромах трансгенных мышей (607 ± 364 усл. единиц и 1875 ± 696 усл. ед., соответственно; p < 0,05).
При исследовании двух групп протеолитических ферментов - ММР и цистеиновых протеаз - в атеросклеротических бляшках мышей показано, что у трансгенных мышей экспрессия генов ММР-13 и катепсина S были, соответственно, в 3 и 2,9 раза выше, чем у животных контрольной группы, а экспрессия генов ММР-9 и цистатина C была достоверно меньше (табл. 1). Нами не были обнаружены достоверные различия экспрессии генов MMP-2: MMP-3; ММР-8; ММР-12; ММР-14, TIMP-1, а также катепсинов К и L между двумя группами мышей.
В то же время, сравнительная оценка содержания фрагментированного коллагена не выявила достоверных различий количества продуктов протеолитического распада коллагена в атеромах экспериментальных животных (6,07 ± 1,36 нг/мл в группе трансгенных мышей и 5,1 ± 0,42 нг/мл – в контрольной группе; p = 0,53).
Таким образом, анализ экспериментальных результатов показал, что у трансгенных мышей в атеросклеротических бляшках с выраженным воспалением, нарушен синтез и активность фермента, участвующего во внеклеточной модификации коллагена, лизил-оксидазы, что позволяет сделать предположение об участии этого фермента в механизме дестабилизации атеромы.
Структура коллагена у пациентов в атеросклеротических бляшках с различной степенью выраженности воспаления.
Для исследования взаимосвязи между факторами нарушения структуры коллагена при дестабилизации атером и клиническими показателями течения атеросклероза нами были использованы образцы атеросклеротических бляшек их сонных артерий.
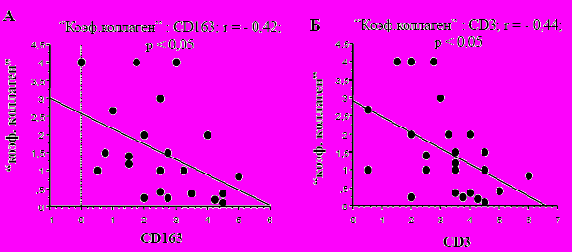
Рис. 1. Морфометрические показатели атеросклеротических бляшек: корреляция между структурой коллагена (“коэф. коллаген”) и маркерами макрофагов-CD163 (А) и Т-лимфоцитов-CD3 (Б).
Исследования гистологических препаратов обнаружили, что в атеромах пациентов с выраженной лимфоцитарной и макрофагальной инфильтрацией преобладали тонкие, незрелые волокна коллагена. В то время, как в участках атером с менее выраженной воспалительной инфильтрацией или в местах, где воспалительные клетки практически отсутствовали, были обнаружены толстые, зрелые коллагеновые волокна. При проведении морфометрического анализа окрашенных срезов, была выявлена достоверная линейная отрицательная корреляция между коэффициентом соотношения толстых волокон коллагена к тонким, как показателем структурных свойств коллагена (“коэф. коллаген”), и содержанием макрофагов (СD163) или Т-лимфоцитов (CD3) (рис. 1).
Инфильтрация атером макрофагами была достоверно выше у курящих пациентов по сравнению с некурящими (3,4 ± 0,3 баллов и 2,2 ± 0,4 баллов, соответственно; р = 0,03). Анализ взаимосвязи других клинических показателей (функциональный класс стенокардии напряжения, сведения о перенесенном ОКС, степень артериальной гипертензии, а также терапия ингибиторами АПФ (иАПФ) или статинами) со структурой коллагена или показателями воспалительной инфильтрации атером пациентов не выявил достоверных связей.
Биосинтез коллагена у пациентов в атеросклеротических бляшках с различной степенью выраженности воспаления.
Экспрессия гена лизил-оксидазы, фермента ответственного за внеклеточную стабилизацию коллагена, была достоверно ниже в атеромах пациентов по сравнению с ее экспрессией в стенке атеросклеротически неизмененной артерии (190,7 отн.ед. и 466,9 отн.ед, соответственно; p<0,0001). Экспрессия гена пролил-4-гидроксилазы, внутриклеточного фермента посттрансляционной модификации коллагена, в тканях атеромы и стенке контрольной артерии не различалась (4,8 отн.ед. и 4,8 отн.ед, соответственно; p = 0,95).
При исследовании корреляционной связи между экспрессией обоих коллаген-модифицирующих ферментов и генов маркеров воспаления в образцах атеросклеротических бляшек, была обнаружена отрицательная достоверная линейная корреляционная связь между экспрессией гена лизил-оксидазы и генами маркеров макрофагов (CD68) (r = - 0.63; p < 0,0001) и MHC II класса (r = -0,44; p = 0,002). В то время, как связи экспрессии гена пролил-4-гидроксилазы с теми же маркерами воспаления обнаружено не было (для макрофагов: r = - 0,23; p > 0,05, для MHC II класса: r = -0,05; p > 0,05).
Показано, что атеромы с низкой экспрессией гена фермента лизил-оксидазы (ниже 180 отн.ед.) характеризовались меньшим содержанием зрелых коллагеновых волокон (коэффициент соотношения зрелых толстых волокон к незрелым тонким: 0,97 ± 0,08). Тогда как в атеромах с высокой экспрессией гена лизил-оксидазы (более 180 отн.ед) преобладали зрелые волокна коллагена (коэффициент - 1,69 ± 0,27; p < 0,05). Группы пациентов с разным уровнем экспрессии гена лизил-оксидазы в атеросклеротических бляшках не отличались по возрасту и лабораторным показателям крови (табл.2).
Таблица 2.
Возраст и лабораторные показатели крови у пациентов с разным уровнем экспрессии гена лизил-оксидазы в атеромах.
| Показатели | Группа с высокой экспрессией LOX (>180 отн.ед) | Группа с низкой экспрессией LOX (<180 отн.ед) |
| Возраст (лет) | 70,8 ± 1,7 | 71,5 ± 0,8 |
| Индекс массы тела (кг/м2) | 25 ± 0,7 | 26 ± 0,35 |
| Уровень С- реактивного белка (мг/л) | 4,46 ± 0,9 | 6,5 ± 1,4 |
| Уровень холестерина (ммоль/л) | 4,58 ± 0,16 | 4,73 ± 0,12 |
| Уровень триглицеридов (ммоль/л) | 1,9 ± 0,19 | 1,73 ± 0,13 |
| Уровень ЛПНП (ммоль/л) | 2,6 ± 0,16 | 2,9 ± 0,12 |
| Уровень ЛПВП (ммоль/л) | 1,19 ± 0,07 | 1,2 ± 0,04 |
* - р < 0,05
Актуальной клинической проблемой являются сосудистые осложнения атеросклероза у пациентов с сахарным диабетом (Toutouzas K. et al., 2005; Bouhanick B. et al., 2006). Результаты проведенных нами исследований показали, что в атеромах у пациентов с сахарным диабетом типа 2 экспрессия гена лизил-оксидазы была достоверно ниже, чем при отсутствии данной патологии (log LOX = 0,37 ± 0,11 и 0,65 ± 0,08, соответственно; р = 0,02) (рис. 2).
Ретроспективный анализ образцов атером пациентов, получавших иАПФ и без терапии этими препаратами, показал отсутствие достоверных различий экспрессии гена лизил-оксидазы между этими группами больных, в то же время, отмечалась тенденция к положительному влиянию данных препаратов на экспрессию гена этого фермента (log LOX: при приеме иАПФ 0,55 ± 0,11, без приема иАПФ 0,47 ± 0,07; р = 0,94).
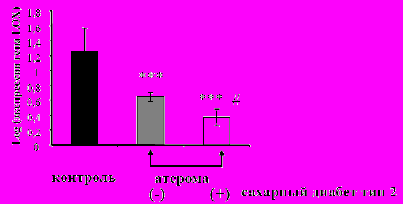
Рис. 2. Показатели экспрессии гена лизил-оксидазы (LOX) в ткани атеросклеротически неизмененной стенки артерии (контроль) и в атеромах пациентов с сахарным диабетом тип 2 и без данной патологии. *** - p < 0,001 по сравнению с контролем; # - p < 0,05 по сравнению с пациентами без сахарного диабета тип 2.
Таким образом, проведенные клинические и экспериментальные исследования выявили однонаправленные изменения структуры и биосинтеза коллагена атеросклеротических бляшек. Полученные результаты свидетельствуют о значении нарушения стабильности волокон коллагена фиброзной капсулы вследствие снижения синтеза фермента лизил-оксидазы, как патогенетического звена при дестабилизации атеросклеротической бляшки.
ВЫВОДЫ
- В нестабильной атеросклеротической бляшке у трансгенных мышей преобладают незрелые волокна коллагена в результате уменьшения синтеза внеклеточного коллаген-модифицирующего фермента лизил-оксидазы.
- У пациентов в атероме со значительной воспалительной инфильтрацией отмечаются структурные нарушения коллагена за счет преобладания незрелых волокон. При курении активность воспаления в атеросклеротических бляшках выражена в большей степени.
- В пораженных атеросклерозом сосудах пациентов наблюдается снижение экспрессии гена фермента лизил-оксидазы. В атеросклеротических бляшках с низкой экспрессией гена лизил-оксидазы отмечается уменьшение содержания зрелых волокон коллагена.
- При дестабилизации атеросклеротических бляшек пациентов установлена отрицательная корреляционная связь между экспрессией гена лизил-оксидазы и клеточно-молекулярными факторами воспаления (макрофаги и главный комплекс гистосовместимости II класса).
- В атеромах пациентов с сахарным диабетом экспрессия фермента лизил-оксидазы достоверно ниже, чем в атеромах больных без данной сопутствующей патологии.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
У пациентов для снижения риска осложнений при дестабилизации атеросклеротической бляшки, особенно при сахарном диабете, следует рекомендовать отказ от курения и проведение более активной противовоспалительной терапии для обеспечения структурной стабильности коллагена.
С целью разработки новых методов диагностики, лечения и профилактики сердечно-сосудистых осложнений атеросклероза можно использовать биобанк атеросклеротических бляшек человека для изучения патогенетических и клинических аспектов атерогенеза.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Шляхто Е.В. Влияние индуцированного воспаления на метаболизм коллагена в атеросклеротических бляшках у мышей / Гавришева Н.А, Овчинникова О.А., Ханссон Г.К. // Медицинская иммунология, - 2008, - том 11, - № 6, - С.527- 536.
- Шляхто Е.В. Состояние межклеточного матрикса в атеросклеротической бляшке в условиях воспаления / Гавришева Н.А, Овчинникова О.А., Робертсон АК., Ханссон Г.К. // Бюллетень НИИ Кардиологии им В.А. Алмазова, - 2005, - том 3, - №1, - с.29.
- Шляхто Е.В. Нарушение организации коллагена как причина нестабильности атеросклеротической бляшки при выраженном воспалении / Гавришева Н.А, Овчинникова О.А., Робертсон АК., Ханссон Г.К. // Материалы Всероссийской научно-практической конференции молодых ученых «Актуальные проблемы кардиологии», - 2005, - С.38.
- Ovtchinnikova O.A. Reduced collagen maturation in atherosclerotic lesions with excessive T cell-mediated inflammation / Robertson AKL, Gavrisheva NA, Shlyakhto EV, Hansson GK. // Atherosclerosis, suppl., - 2005, - № 6, - P.17.
- Ovchinnikova O.A. Atherosclerotic lesions with exaggerated inflammation show impaired collagen maturation / Robertson A-K, Gavrisheva NA, Shlyakhto EV, Hansson G.K. // J. Vasc. Research, suppl, - 2005, - P.II/80.
- Ovchinnikova O.A. Inhibited collagen maturation, but only modest proteolytic activity in hyperinflamed atherosclerotic lesions / Robertson AKL, Chaoyong Z, Ericsson P, Gavrisheva NA, Shlyakhto EV, Hansson GK. // Atherosclerosis, suppl., - 2006, - Vol.7, - Р. 242.
- Ovchinnikova OA. Mechanisms behind plaque vulnerability / Robertson AKL, Chaoyong Z, Ericsson P, Gavrisheva NA, Shlyakhto EV, Hansson GK. // CIS Cardiology, - 2006, - Vol.4, -№1, - P.108.
- Шляхто Е.В. Нарушение посттрансляционной модификации коллагена как причина дестабилизации атеросклеротической бляшки при экспериментальном воспалении / Гавришева Н.А, Овчинникова О.А., Робертсон АК, Ханссон ГК. // Тезисы Российского национального конгресса кардиологов, - 2006. – P.76.
