Оглы функциональная морфология органов иммунной системы при хронической наркотической зависимости 14. 03. 02 патологическая анатомия 14. 03. 05 судебная медицина
| Вид материала | Автореферат |
СодержаниеРезультаты исследования и их обсуждение |
- Рабочая программа учебной дисциплины патологическая анатомия, клиническая патологическая, 480.03kb.
- Общая патологическая анатомия, 283.39kb.
- Патологическая анатомия и дифференциальная диагностика рака большого сосочка двенадцатиперстной, 388.21kb.
- Примерная программа наименование дисциплины Патологическая анатомия, клиническая патологическая, 594.5kb.
- Скачко Борис Система оздоровления доктора Скачко при снижении иммунитета, синдроме, 145.55kb.
- Библиография и ссылки «Анатомия и морфология растений», 6.79kb.
- Промоторова Курс «Анатомия и морфология человека», 117.42kb.
- Примерная программа по дисциплине патологическая анатомия для аттестации на категорию., 363.01kb.
- Ф-программа вступительного экзамена в аспирантуру Утверждаю, 254.47kb.
- Патологическая анатомия это медико-биологическая наука, изучающая структурные и морфологические, 1590.52kb.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Опиатная хроническая наркотическая интоксикация
При опиатной ХНИ выраженные морфологические изменения органов иммунной и эндокринной систем, позволяющие диагностировать ВИДС, выявлены у 216 из всех 219 изученных наблюдений (98,6%), из них в 97,5% – при ХНИ длительностью до года, в 98,7% – от года до 2-х лет и в 100% – более 2-х лет. ВИДС не диагностирован только в трех случаях (1,4%), из них в двух – при ХНИ длительностью менее года и одном – менее 2-х лет, без инфекционных заболеваний и сочетания с ХАИ.
Одним из признаков ВИДС является повышенная частота и тяжесть инфекционных заболеваний [Дранник Г.Н., 2003; Иванец Н.Н., 2008]. Особенности выбора наблюдений в качестве материала исследования, обусловленные целью и задачами данной работы, не позволяют провести статистический анализ показателей заболеваемости и смертности при ХНИ. Однако даже в рамках материала исследования, без наблюдений ХНИ с ВИЧ-инфекцией, острыми и активными хроническими вирусными гепатитами, циррозами печени, в 33,7% случаев при разных видах наркомании выявлены бактериальные инфекционные заболевания, явившиеся первоначальными причинами смерти: в основном (15,2%), сепсис (инфекционный эндокардит, септикопиемия, вызванные условно-патогенной флорой), пневмонии (10,7%) или туберкулез (7,8%). При ХНИ их принято расценивать как оппортунистические [Дранник Г.Н., 2003; Иванец Н.Н., 2008]. В 2,9-3,8 раз чаще они были причиной смерти больных с опиатной (38,8%), по сравнению с каннабиноидной (13,6%) или полинаркоманией (10,1%). При каннабиноидной ХНИ, в отличие от опиатной и полинаркомании, такие инфекционные заболевания развивались только при длительности наркомании более 2-х лет и ее сочетании с ХАИ. Следовательно, при опиатной и полинаркомании можно предположить развитие ВИДС уже в первый год приема НС. По мере роста длительности ХНИ, частота бактериальных инфекций увеличивается с 19,2 до 53,8%, что иллюстрирует прогрессию ВИДС (Рис. 4).
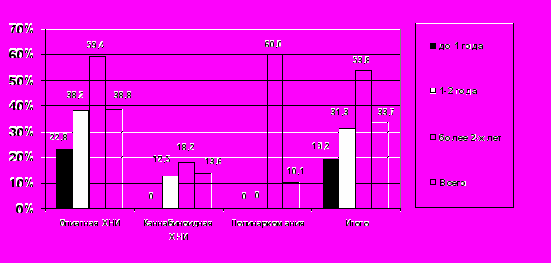
Рис. 4. Частота (%) оппортунистических бактериальных инфекций – первоначальных причин смерти при различных видах ХНИ разной длительности (р<0,05 для опиатной и каннабиноидной ХНИ по сравнению с другими видами наркомании, а также для всех видов ХНИ при их разной длительности)
Морфологическим субстратом ВИДС при парентеральной опиатной ХНИ, не осложненной вирусными или бактериальными инфекционными заболеваниями, является сочетание атрофии истинной паренхимы, атрофии или гиперплазии ВПП тимуса, атрофии Т-зависимых и разной степени гиперплазии, реже – атрофии В-зависимых зон периферической лимфоидной ткани: селезенки, лимфатических узлов, мукозассоциированной лимфоидной ткани (Табл. 2).
Гиперплазия ВПП тимуса и персистирующая фолликулярная гиперплазия В-зон периферических лимфоидных органов обнаружены в 37,4% наблюдений опиатной ХНИ (в 100% случаев без бактериальных инфекций и сочетания с ХАИ и только в 6,2% – в остальных наблюдениях). Такая компенсаторная гиперактивность гуморального звена ИС в условиях антигенной стимуляции при различных ВИДС с преимущественным поражением Т-системы иммунитета определенное время нивелирует иммунные нарушения и их клинические проявления [Рисберг В.Ю., 2002; Дранник Г.Н., 2003; Иванец Н.Н., 2008]. При этом, нередко, развивается дис- и гипоиммуноглобулинемия с сохранением продукции только IgM, что и было обнаружено в изученных наблюдениях.
Таблица 2
Морфометрические показатели изменений органов иммунной системы при опиатной, каннабиноидной, полинаркомании и в контрольной группе
| Вид наркомании, группы сравнения и контрольная | Тимус | Селезенка | Лимфатические узлы | |||||||
| Парен-хима | Кора | Мозговое вещество | Тельца Гассаля | ВПП | Лимфоидная ткань | Т-зоны | В-зоны | Т-зоны | В-зоны | |
| Опиатная | 47,2 ± 0,5* | 7,3 ± 0,7 *,** | 19,8 ± 0,4* | 5,3 ± 1,1* | 21,2 ± 0,6 *,** | 12,1 ± 1,5** | 1,3 ± 0,5* | 10,8 ± 0,7*,** | 6,4 ± 0,7** | 11,1 ± 0,9** |
| Каннабиноидная | 51,6 ± 0,3 | 11,7 ± 0,4 *,** | 18,3 ± 0,5* | 2,6 ± 0,5 | 21,5 ± 0,4 *,** | 7,9 ± 0,3** | 3,1 ± 0,5** | 4,8 ± 0,8,** | 7,1 ± 0,5** | 9,8 ± 0,9** |
| Полинаркомания | 17,1 ± 0,8* | 2,3 ± 0,5* | 9,1 ± 0,7*,** | 2,1 ± 0,8 | 4,9 ± 0,7 *,** | 13,2 ± 0,4** | 2,1 ± 0,2 *,** | 11,1 ± 0,3 *,** | 3,1 ± 0,4* | 9,2 ± 0,5** |
| Группа сравнения | 20,2 ± 1,2* | 3,6 ± 0,7* | 13,7 ± 0,3* | 3,3 ± 1,5* | 1,4 ± 0,3* | 3,4 ± 0,9* | 1,0 ± 0,3* | 2,4 ± 1,1* | 4,2 ± 0,6* | 4,5 ± 0,8* |
| Контрольная группа | 56,7 ± 0,8 | 20,1 ± 0,6 | 26,3 ± 1,2 | 1,8 ± 1,0 | 10,3 ± 1,6 | 10,2 ± 1,0 | 4,6 ± 0,2 | 5,6 ± 0,4 | 8,1 ± 0,5 | 10,3 ± 1,2 |
Примечание: * р<0,05 по сравнению с контрольной группой, ** - по сравнению с группой сравнения.
Генерализованная персистирующая фолликулярная гиперплазия лимфоидной ткани не всегда сопровождается макроскопическими изменениями лимфоузлов и селезенки. Однако выраженная гиперплазия В-зон приводит в части случаев к появлению таких феноменов, как кажущееся увеличение паренхимы тимуса (из-за гиперплазии его ВПП при атрофии истинной паренхимы) или даже лимфофолликулярной гиперплазии тимуса, спленомегалии, генерализованной лимфоаденопатии, которые оказались свойственны части наблюдений ХНИ без инфекционных заболеваний или с инфицированием вирусами гепатита В и С. В изученном материале гиперплазия ВПП тимуса, спленомегалия и генерализованная лимфаденопатия встретились в 26,5% наблюдений, были более характерны для II стадии ВИДС (66,7% случаев), достоверно, в 4 раза реже встретились в I (16%) или в 2 раза реже – в III стадию ВИДС (33,3%). Следовательно, компенсаторные процессы в ИС ярче проявляются к концу 1-го года и до 2-х лет приема опиатов и этот период можно охарактеризовать как фазу компенсации иммунных нарушений при ВИДС у больных опиатной ХНИ.
Главной особенностью ВИДС, обнаруженной при опиатной ХНИ, является тяжелое поражение Т-системы иммунитета с развитием дефицита Т-хелперов и инверсией иммунорегуляторного индекса (соотношения CD4+/CD8+). При таких нарушениях в системе регуляторных Т-лимфоцитов закономерно то, что гиперплазия В-зон лимфоидной ткани проявляется в формировании лимфоидных фолликулов I типа по B.Kellner et al. (1966) или IIб типа по В.Л.Белянину и Д.Э.Цыплакову (1999) с грубо нарушенной архитектоникой. Лимфоидные фолликулы отличались развитием крупных (нередко гигантских, сливных, неправильной формы) светлых центров, в которых снижена пролиферативная активность лимфоцитов, часто накапливаются эозинофильные гиалиноподобные или зернистого вида белковые массы (признак длительной гиперпродукции иммуноглобулинов [В.Л.Белянин, Д.Э.Цыплаков, 1999]), в них появляются группы Т-лимфоцитов, главным образом, супрессоров. Мантийная зона лимфоидных фолликулов неравномерно сужена, местами не прослеживается (как бы «изъедена»), также содержит больше Т-супрессоров, чем Т-хелперов.
Такие изменения Т- и В-зон лимфоидной ткани, как и генерализованная лимфаденопатия, не только характерны для многих ВИДС с дефицитом Т-хелперов при антигенной стимуляции, но особенно близки к детально морфологически описанным при ВИЧ-инфекции [Кригер О.В. и соавт., 2001; Сорокина В.В., 2004] и, светооптически, неотличимы от последних. Однако инфицирование ВИЧ было абсолютно исключено во всех отобранных для данной работы наблюдениях. Таким образом, описанная в 80-е годы «асимптоматичная лимфаденопатия наркоманов» была преждевременно отвергнута и объяснена возможным влиянием ВИЧ-инфекции [Кригер О.В. и соавт., 2001; Сорокина В.В., 2004; Иванец Н.Н., 2008; Toccanier M.F., Kapanci Y., 1985]. Она характерна для опиатной ХНИ и может быть использована как один из диагностических клинико-морфологических признаков опиатной ХНИ после исключения ВИЧ-инфекции.
Присоединение вирусной инфекции (гепатитов В или С) усиливает атрофию Т- и гиперплазию В-зон (особенно селезенки и лимфоузлов ворот печени), усугубляет дефицит Т-хелперов. Этот признак важно использовать в патологоанатомической и судебно-медицинской практике при диагностике вирусных поражений печени, в том числе и у больных ХНИ.
Развитие бактериальных инфекционных заболеваний ведет к увеличению атрофии Т-зон и вызывает атрофию В-зон, что указывает на развитие тяжелой декомпенсации ВИДС. Именно эти изменения ИС чаще встречаются в патологоанатомической, чем в судебно-медицинской практике, в случаях смерти больных опиатной ХНИ от различных заболеваний, а не от отравления НС или травм [Пиголкин Ю.И. и соавт., 2000; Кригер О.В. и соавт., 2001; Лунькова Л.К. и соавт., 2002].
При сочетании ХНИ с ХАИ или алкоголизмом преобладают атрофические изменения тимуса, Т- и В-зон периферической лимфоидной ткани, что делает ее изменения сходными с группой сравнения (с ХАИ или алкоголизмом без ХНИ), во многом утрачивается «нозологическая окраска» ВИДС и развивается тяжелый комбинированный ВИДС.
Важно отметить, что ВИДС не диагностирован только в трех наблюдениях (1,4%) опиатной ХНИ, не осложненных бактериальными и вирусными инфекциями или сочетанием с ХАИ или алкоголизмом. В случаях с инфекционными заболеваниями, а также при сочетании ХНИ с ХАИ или алкоголизмом, морфологические признаки ВИДС обнаружены во всех изученных наблюдениях. В этих трех наблюдениях без признаков ВИДС с длительностью ХНИ от 0,5 до 1,5 лет, отмечено повышение числа Т-хелперов, сохранение нормального индекса CD4+/CD8+, слабо выраженная атрофия Т-зон и выраженная гиперплазия В-зависимых зон, причем лимфоидные фолликулы периферических лимфоидных органов были нормального строения, с активными светлыми центрами. Органы эндокринной системы (гипофиз, надпочечники и щитовидная железа) в наблюдениях без признаков ВИДС были без явных патологических изменений (за исключением острых, обусловленных особенностями танатогенеза). Таким образом, с одной стороны, нельзя исключить, что в указанных случаях иммунные нарушения не проявлялись на светооптическом (гистологическом и иммуноморфологическом) уровне или отличались от типичных для опиатной ХНИ, но с другой – это подтверждает известный факт о большой роли индивидуальной реактивности и других факторов в реакциях иммунной и нейро-эндокринной систем на действие НС [Дранник Г.Н., 2003; Кибитов А.О. и соавт., 2007; Appenzeller B.M. et al., 2005]. Именно у таких больных следует особенно часто ожидать развитие аутоиммунных заболеваний, реакций гиперчувствительности, такая патология ИС способствует инфицированию и тяжелому течению ВИЧ-инфекции [Иванец Н.Н., 2008]. Однако важно отметить, что ВИДС с дефицитом Т-хелперов у опиатных наркоманов не менее отягощает течение ВИЧ-инфекции, и, также, как и другие ВИДС, может лежать в основе развития аутоиммунных и других иммунопатологических процессов. Так, например, в изученном материале в 2-х наблюдениях был диагностирован аутоиммунный тиреоидит.
В 0,5-3,2% наблюдений в ткани тимуса и окружающей его жировой клетчатке, лимфатических узлах и селезенке были выявлены типичные периваскулярные саркоидоподобные талькозные гранулемы со склерозом и гиалинозом [Гринберг Л.М. и соавт., 2009; Wong L.C. et al., 2003]. Для их клеточного состава было характерно преобладание среди немногочисленных лимфоцитов Т-супрессоров (CD8+), наличие гигантских клеток инородних тел и фибробластов. По-видимому, при любых парентеральных видах ХНИ с использованием плохо очищенных НС развитие таких гранулем достаточно типично и особенности их морфологии обусловлены антигенной инертностью патогенного агента в сочетании с ВИДС с дефицитом Т-хелперов [Солодун Ю.В. и соавт., 1998; Гринберг Л.М. и соавт., 2009; Wong L.C. et al., 2003]. Однако их следует дифференцировать с различными гранулематозными заболеваниями, которые могут возникать у опиатных наркоманов в ответ на различные антигены на фоне ВИДС.
Патологические изменения изученных эндокринных желез (гипофиза, надпочечников и щитовидной железы), выявленные при опиатной ХНИ, складывались из острых, обусловленных особенностями танатогенеза (острое полнокровие, отек, кровоизлияния, очаги некроза) и хронических, прогрессирующих по мере увеличения длительности ХНИ. Выраженные острые изменения аденогипофиза и надпочечников могут быть причиной развития парциального или тотального гипопитуитаризма, острого (а впоследствии и хронического) гипокортицизма. Хронические изменения представлены нарастающими атрофией и склерозом эндокринных желез с макро-микроузелковой трансформацией надпочечников и щитовидной железы. Для гипофиза характерно уменьшение числа базофильных и эозинофильных аденоцитов (но с очаговой гиперплазией и гипертрофией, полиморфизмом, вакуолизацией базофильных) и увеличение числа хромофобных (или утративших хромофильность клеток), склероз стромы и сосудов, уменьшение объема и обызвествление коллоида. В надпочечниках развиваются делипоидизация (истощение), атрофия и мако-микроузелковая трансформация коры, преимущественно пучковой зоны (Рис. 5).
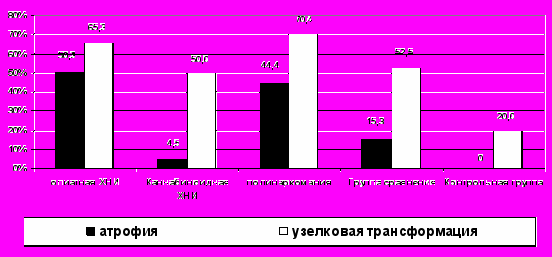
Рис. 5. Частота (%) атрофии и узелковой трансформации коры надпочечников при изученных видах ХНИ: опиатной, каннабиноидной и полинаркомании, группах сравнения и контрольной (р<0,05 для всех видов ХНИ по сравнению с контрольной группой, для атрофии при каннабиноидной ХНИ и для узелковой трансформации при полинаркомании по сравнению с другими видами наркомании)
В щитовидной железе нарастает частота микро-макрофолликулярного коллоидного, чаще узлового зоба (48,6%), а также атрофии со склеротическими изменениями (28,6%), узелковой трансформации (22,4%). В отдельных случаях был диагностирован аутоиммунный тиреоидит (1,7%) и аденомы (0,9%). Полученные показатели статистически достоверно отличались только от данных контрольной группы и были близки к группе сравнения, причем атрофия щитовидной железы даже достоверно чаще выявлялась при ХАИ в группе сравнения, чем при ХНИ (Рис. 6).
Выявленные изменения укладываются в фазы общего адаптационного синдрома с развитием, в итоге, истощения эндокринной системы. В основе патологии нейро-эндокринной системы, как известно, лежит непрямое (рецепторно-опосредованное) и прямое, в том числе токсическое действие опиатов и примесей к ним [Рисберг В.Ю., 2002; Александров С.Г., 2004; Sheridan P.A. et al., 2005; Azarang A. et al., 2007; Shu J. et al., 2009].

Рис. 6. Частота (%) зобных изменений, атрофии и узловой трансформации щитовидной железы при опиатной, каннабиноидной и полинаркомании, группах сравнения и контрольной (р<0,05 для всех видов ХНИ по сравнению с контрольной группой, для каннабиноидной ХНИ по сравнению с другими видами наркомании)
Исходя из концепции о единой нейро-эндокринно-иммунной системы, как основы гомеостаза и гомеокинеза, сочетание патологии органов ИС и эндокринной системы закономерно и их поражение взаимно усиливает друг друга [Дранник Г.Н., 2003; Иванец Н.Н., 2008]. Выявленные изменения гипофизарно-адреналовой системы могут сопровождаться развитием разных вариантов гипокортицизма, что часто усиливает гиперплазию В-зон периферической лимфоидной ткани и ВПП тимуса в условиях антигенной стимуляции [Дранник Г.Н., 2003]. Следовательно, эндокринные нарушения при опиатной ХНИ могут усиливать характерные для опиатного ВИДС морфологические изменения органов ИС. Важно отметить, что при клинически скрытом хроническом гипокортицизме, минимальный стресс любой природы может привести к развитию острого гипокортицизма с высокой летальностью.
Исследование показало, что изменения органов иммунной и эндокринной систем, характеризующие прогрессирование ВИДС при опиатной ХНИ носят фазовый (стадийный) характер и позволяют выделить 3 стадии развития иммуно-эндокринных нарушений, соответствующих стадиям становления, компенсации и декомпенсации общего адаптационного синдрома как реакции на хронический стресс. Длительность стадий, по-видимому, индивидуальна, зависит от многих факторов, но в целом выделение групп наблюдений с давностью ХНИ до 1 года (I), более 1 и до 2-х лет (II) и свыше 2-х лет, до 10,5 в проведенном исследовании (III), основанное на данных иммунологических исследований о стадийности развития иммунных нарушений [Рисберг В.Ю., 2002; Иванец Н.Н., 2008], оказалось адекватным для выявления их особенностей.
I стадия ВИДС – становления (опиатная ХНИ длительностью до 1-1,5 лет, ВИДС выявляется в 97,5% наблюдений). Изменения тимуса и периферической лимфоидной ткани наиболее гетерогенны (от минимальных до выраженных), однако преобладают следующие:
1) дефицит Т-хелперов с инверсией иммунорегуляторного индекса, сниженные пролиферативная активность лимфоцитов и продукция иммуноглобулинов (кроме IgM);
2) атрофия истинной паренхимы тимуса в сочетании с различной степенью выраженностью гиперплазии ВПП и увеличением числа и размеров телец Гассаля (IV-VIII типов); атрофия Т- и атрофия или гиперплазия В-зон лимфоидной ткани с формированием (особенно при вирусных хронических гепатитах В и С в селезенке и лимфоузлах ворот печени) крупных лимфоидных фолликулов с нарушенной архитектоникой (лимфаденопатия и спленомегалия в 16% наблюдений);
3) очаговая гиперплазия и гипертрофия преимущественно базофильных аденоцитов гипофиза, различные нарушения структуры коры надпочечников, указывающие на возможность как гипо-, так и гиперфункции, широкий спектр изменений щитовидной железы, от зобных до атрофических и аутоиммунных.
II стадия ВИДС – компенсации (опиатная ХНИ длительностью от 1-1,5 до 2-х лет). Изменения тимуса и периферической лимфоидной ткани относительно стереотипны:
1) дефицит Т-хелперов с инверсией иммунорегуляторного индекса, сниженная или повышенная продукция иммуноглобулинов;
2) умеренно выраженная атрофия истинной паренхимы тимуса в сочетании с гиперплазией ВПП, увеличением числа и размеров телец Гассаля (IV-VIII типов). Общий объем паренхимы тимуса вместе с ВПП (в которых формируются лимфоидные фолликулы) может быть увеличен (лимфофолликулярная гиперплазия тимуса); умеренно выраженная атрофия Т- и чаще выраженная гиперплазия В-зон лимфоидной ткани с формированием крупных лимфоидных фолликулов с нарушенной архитектоникой. Спленомегалия и генерализованная лимфаденопатия в 66,7% наблюдений. При вирусных хронических гепатитах В и С наиболее выражена фолликулярная гиперплазия лимфоидной ткани селезенки и лимфатических узлов ворот печени. В красной пульпе селезенки – склероз, гемосидероз и миелоз (даже в отсутствии бактериальных инфекций);
3) снижение числа хромофильных клеток с очаговой гиперплазией и гипертрофией преимущественно базофильных, реже – эозинофильных аденоцитов, преобладание атрофии коры надпочечников с ее узелковой трансформацией и выраженной делипоидизацией пучковой зоны, свидетельствующие в пользу ее истощения с развитием хронического гипокортицизма примерно в половине наблюдений (как следствие – усиление генерализованной фолликулярной гиперплазии лимфоидной ткани); преобладание в щитовидной железе умеренно выраженных зобных и атрофических изменений.
III стадия ВИДС – декомпенсации (опиатная ХНИ длительностью более 2-х лет). Изменения тимуса и лимфоидной ткани также достаточно стереотипны:
1) выраженный дефицит Т-хелперов с инверсией иммунорегуляторного индекса, пониженные пролиферативная активность лимфоцитов и продукция иммуноглобулинов (кроме IgM);
2) выраженная атрофия как истинной паренхимы, так и ВПП тимуса с увеличением числа обызвествленных телец Гассаля (VII-VIII типов); выраженная атрофия Т- и В-зон лимфоидной ткани; в селезенке – склероз, гемосидероз и миелоз (независимо от наличия инфекционных заболеваний) красной пульпы;
3) уменьшение числа в сочетании с очаговой гиперплазией хромофильных (главным образом, базофильных) аденоцитов гипофиза, склероз стромы и стенок сосудов, обызвествление коллоида, атрофия, делипоидизация и дистрофия эндокриноцитов, макро-микроузелковая трансформация коры надпочечников, что может сопровождаться скрытым или клинически выраженным хроническим, а при стрессе – острым гипокортицизмом; снижение частоты зобных изменений щитовидной железы, но нарастание атрофических и склеротических (в части наблюдений, возможно, как результат перенесенного аутоиммунного тиреоидита).
Стадийный характер поражения органов иммунной и эндокринной систем при опиатной ХНИ может быть нарушен при присоединении бактериальной инфекции или при сочетании с ХАИ или алкоголизмом, когда, независимо от длительности приема опиатов, развиваются изменения, характерные для III стадии ВИДС – выраженные декомпенсированные иммунные нарушения с глубокой атрофией тимуса, Т- и В-зон лимфоидной ткани, дефицитом Т-хелперов, снижением продукции иммуноглобулинов, атрофическими и склеротическими изменениями эндокринных желез.
