Встатье рассматривается одна из наиболее важных проблем педиатрии формирование синдрома полиорганного повреждения у детей в критических состояниях
| Вид материала | Документы |
- Протокол профилактики стресс-повреждения верхнего отдела жкт у больных в критических, 501.02kb.
- Научно-информационный материал «неотложные мероприятия на воздушном и водном транспорте», 654.54kb.
- Детское изобразительное творчество: что под этим следует понимать?, 456.59kb.
- Во время конференции планируется реализация политематической научной программы, посвященной, 31.37kb.
- Использование естественных экстремальных половодий и паводков в качестве аналогов при, 195.55kb.
- А. А. Богомольца " Утверджено" на методическом совещании кафедры педиатрии №1 Заведующая, 473.92kb.
- Учебно-методический комплекс дисциплины, 3257.29kb.
- Литература по Основам педиатрии и гигиены детей раннего и дошкольного возраста Литература., 12.65kb.
- «Новое поколение выбирает зож», 305.22kb.
- «трансфер фактор», 283.93kb.
Error: Reference source not found
Современные представления о метаболических изменениях и развитии расстройств питания в организме ребенка
в ответ на травматический стресс
Лекманов А.У.,1, 3 Ерпулева Ю.В.1, 2
1ДКБ № 9 им. Г.Н. Сперанского, 2ГУ Научный центр здоровья детей РАМН,
3ФГУ педиатрии и детской хирургии Росздрава, Москва, Россия
В статье рассматривается одна из наиболее важных проблем педиатрии – формирование синдрома полиорганного повреждения у детей в критических состояниях. Описываются механизмы и запускающие факторы развития данного синдрома. Показана роль искусственного лечебного питания в комплексной терапии детей при критических сосояниях.
Ключевые слова: стресс, критические состояния, синдром системного воспалительного ответа, полиорганная недостаточность, энергетические потребности, недостаточность питания.
В последние десятилетия возрастание интереса к проблеме госпитального голодания обусловлено не только ее клинической значимостью, но и пониманием биохимических и иммунологических нарушений при этом состоянии [11, 15, 36, 85, 86, 138]. Изменения метаболизма при оперативных вмешательствах также усиливают интерес исследователей к этой теме и позволяют выделить проблему питания как важную составляющую послеоперационного ведения больных [23, 32, 39, 67, 196, 227].
Понятие «недостаточности питания» (mal-nutrition) появилось в медицине в 40-50-е годы ХХ века при описании состояний, возникающих в результате неполноценного питания у детей в развивающихся странах Азии, Африки и Латинской Америки [3, 87, 135, 141, 145, 148]. По вопросам развития, распространенности, лечения и профилактики недостаточности питания были опубликованы сотни журнальных статей, десятки инструкций и методических рекомендаций, в которых детально рассмотрены особенности данной патологии, врачебная тактика, проведение мероприятий по устранению возникновения риска развития данных заболеваний [38, 50, 52, 73, 139, 155, 160, 293].
В конце 70-х годов учеными было установлено, что недостаточность питания наблюдается у большого числа госпитализированных в стационары больных, как взрослых, так и детей [72, 76, 84, 85, 88, 89, 90]. Установлено, что клинические проявления недоедания широко варьируют как по специфичности, так и по тяжести нарушения питания и всегда сопровождаются дефицитом витаминов и микроэлементов [120, 181, 188, 210, 222, 243, 300].
Анализ опубликованных данных [23, 86, 111, 113] выявил наиболее значимые и часто встречающиеся в клинической практике факторы риска развития питательной недостаточности (табл. 1).
Таблица 1
Факторы риска, приводящие к развитию питательной недостаточности
у больных в критических состояниях
| Факторы риска |
| - уменьшение массы тела более, чем на 5-10 % за последний месяц; |
| - масса тела на момент осмотра ниже 10-го процентиля или замедленный рост ребенка (по данным анамнеза); |
| - неполноценное питание (в анамнезе) или недостаточное (по существующим нормам) получение белка и калорий в течение длительного времени; |
| - наличие анорексии у ослабленного больного; длительное отсутствие возможности естественного, перорального приема пищи (5-7 дней); |
| - повышенные метаболические потребности и потери белка (травмы, в т.ч. операционные, ожоги, затянувшаяся лихорадка, сепсис, свищи); |
| - длительный прием медикаментов, снижающих аппетит (противоопухолевые препараты, антибиотики, сульфаниламиды, иммунодепрессанты). |
В таблице 2 представлены наиболее частые причины развития недостаточности питания и соответствующие им клинические состояния [23, 49, 146, 153, 159, 264, 276].
Таблица 2
Основные причины развития недостаточности питания
| Причины развития | Клинические состояния |
| 1. Нарушение приема пищи | -утрата сознания; -нарушение акта глотания; -неукротимая рвота; -нервная анорексия |
| 2. Нарушение пищеварения | -ферментная недостаточность; -панкреатит; -гастроэктомия; -резекция тонкой кишки; -биллиарная недостаточность |
| 3. Нарушения всасывания | -энтерит; -синдром короткой кишки; -болезнь Крона; -фистулы кишечника |
| 4. Нарушения обмена веществ (метаболизма) | - врожденные нарушения метаболизма; - катаболические состояния: сепсис, ожоги, травмы, инфекции, хирургические вмешательства |
Большинство авторов в зависимости от причины выделяют первичную и вторичную формы недостаточности питания [3, 274, 292, 308].
Первичная (алиментарная) недостаточность питания развивается на фоне недостаточного или полного прекращения поступления питательных веществ и микронутриентов в организм ребенка [3, 12, 23, 118, 141, 292]. Первостепенное значение в развитии алиментарной недостаточности питания имеют социально-экономи-ческие факторы, обусловливающие ограничение в количестве и качестве пищевого рациона ребенка. Высокие цены на продукты, в ряде случаев голодание, скудная и однообразная диета повышают риск развития питательной недостаточности у ребенка [3, 297].
Позднее была выделена вторичная форма недостаточности питания, которая часто наблюдается при длительном пребывании детей в стационаре, как у пациентов, страдающих хроническими заболеваниями, так и вследствие травм, ожогов, оперативных вмешательств [23, 27, 85, 103, 105]. Установлено, что около 50% больных с хирургической патологией, находящихся в стационаре, имеет высокий риск развития белково-энергетической недостаточности [18, 50, 90]. Нарушения питания предрасполагают к развитию инфекции, плохому заживлению ран, обусловливает более длительные сроки пребывания больных в стационаре, что в совокупности намного увеличивает затраты на медикаменты и инфузионные препараты и приводит к увеличению стоимости лечения [85, 122, 169, 176, 179, 182, 214].
В каждом из типов недостаточности питания выделяют три степени: легкую, среднюю и выраженную [23, 49, 128].
При голодании без каких-либо стрессорных воздействий первоначальным источником энергии является протекающий в печени гликолиз и расщепление висцеральных белков (транстиретина, альбумина, трансферрина), что приводит к потере 10-15 г азота в течение первых двух дней [62, 92, 98, 239]. В дальнейшем происходит распад белка скелетной мускулатуры с последующим образованием жира как источника энергии, понижается уровень глюкозы и инсулина в сыворотке крови, возрастает кетоацидоз, уменьшается количество белка. Избыточное поступление с пищей углеводов замедляет потерю азота, образующегося при катаболизме белка скелетной мускулатуры и внутренних органов. Период времени, в течение которого организм может переносить голодание, не осложненное стрессом, зависит от количества жира, накопленного к моменту голодания [16, 17, 62, 74, 143].
Изучение гемодинамических, иммунологических, метаболических изменений у больных в критических состояниях выявило, что независимо от причины (сепсис, травма, ожог) они протекают по единому образцу и регулируются одними и теми же медиаторами [18, 34, 142, 144, 158, 232]. В ответ на стресс или травму у больного наблюдаются значительные изменения интенсивности обмена веществ (рис. 1) [18, 22, 35, 70].
Оперативное вмешательство, независимо от вида сопровождающей его анестезии, травма, ожог, неотложные состояния вызывают мощные изменения метаболизма, опосредованные нейроэндокринными реакциями [6, 18, 22, 62, 104, 124]. Боль, обстановка перед оперативным вмешательством (мероприятия по диагностике основного заболевания, транспортировка в стационар, предоперационная подготовка), предшествующее психическое напряжение, усиливающееся чувство тревоги, разлука с родителями и друзьями вызывают нейровегетативные реакции у больного ребенка [22, 57, 126, 155, 214, 228]. Установлено, что у больных в послеоперационном периоде даже при неосложненном течении развиваются катаболические изменения, связанные с усиленным распадом белка, жира, гликогена, нарушением водно-электролитного баланса [218, 221, 225, 234, 240]. У этой категории больных метаболические процессы происходят стремительней, в связи с наибольшей уязвимостью к голоданию [121, 152, 159].
С 1992 года за системой воспаления, развивающейся в ответ на травматический стресс, закрепилось название «синдромом глобального воспаления» (SIRS-systemic inflammatory response syndrome) [18, 22, 46, 115, 246, 277].
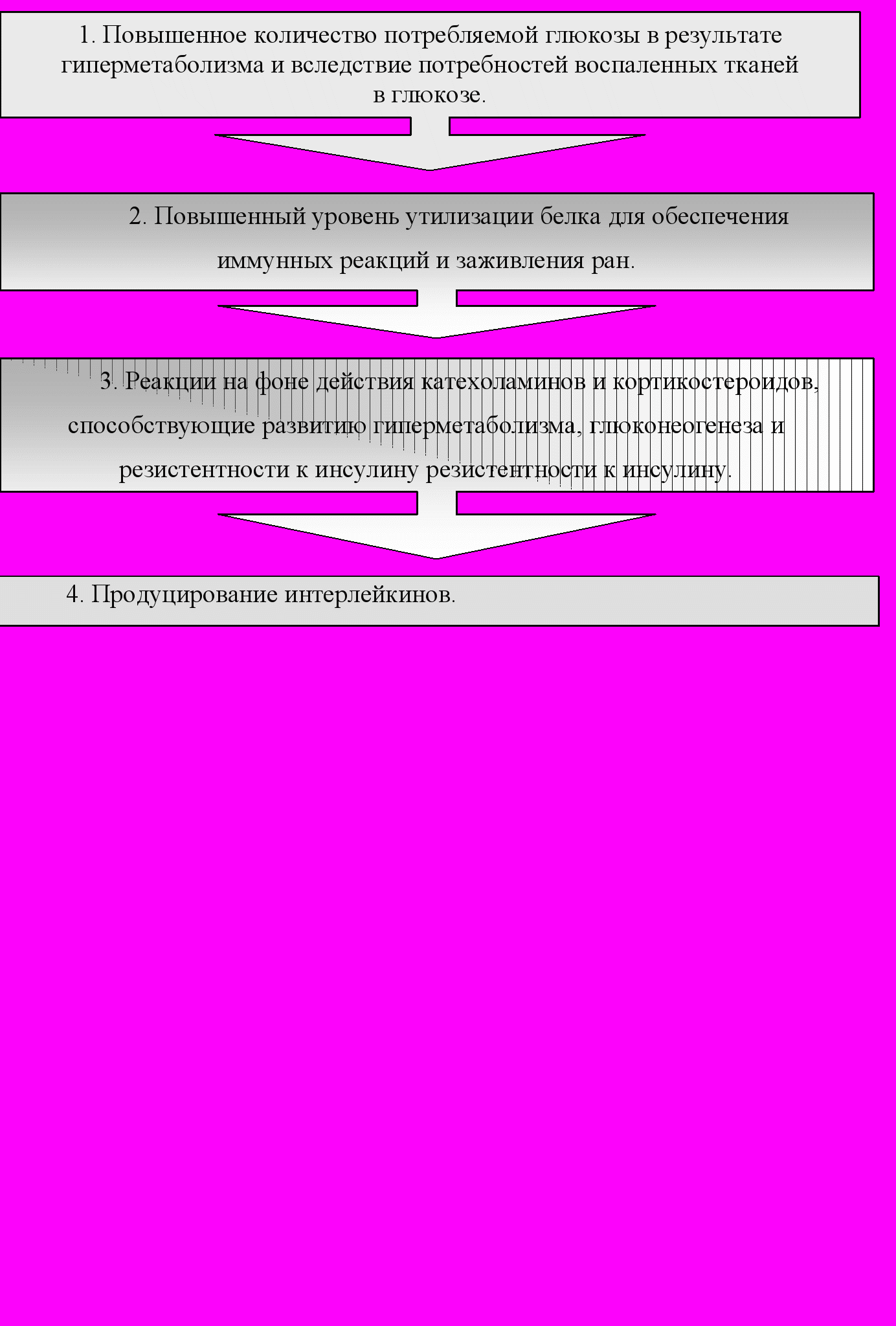
В условиях SIRS ускоряется катаболизм мышечной ткани, так как из-за двигательного ограничения тяжелобольного используются менее “нужные” белки скелетных мышц. Однако не все мышцы одинаково интенсивно вовлекаются в этот процесс. Белые мышечные волокна кратковременного и быстрого сжатия эксплуатируются сильнее, чем поддерживающие длительно тонус красные мышцы. Однако при метаболических изменениях катаболизм мышечных и висцеральных протеинов не компенсируется, что приводит к отрицательному азотистому балансу. Аминокислоты мобилизуются из скелетной мускулатуры, соединительной ткани. Дополнительно имеют место процессы перераспределения аминокислот, увеличение скорости их окисления, особенно в скелетной мускулатуре. Установлено, что аланин – инициатор глюконеогенеза в печени, глютамин играет роль в переносе азота, является поставщиком энергии для клеток мукозного слоя кишки и других быстроделящихся клеток [6, 18, 22, 104, 180, 250].
Одним из важнейших факторов формирования полиорганного повреждения при критических состояниях является бурное развитие синдрома гиперметаболизма – гиперкатаболизма, вызванного медиаторами системного воспалительного ответа (цитокинами, эйкозаноидами, продуктами перекисного окисления) [18, 34, 42, 74, 104, 177, 194]. Основными причинами этих нарушений являются катаболическое действие адренокортикотропного гормона (АКТГ) и глюкокортикоидов, адреналина и вазопрессина, повышенный протеолиз в тканях, потеря белка, увеличение энерготрат с использованием собственных белков [6, 16, 18, 62, 167, 175].
Активированные фагоциты высвобождают метаболически активные пептиды, что приводит к накоплению простагландина Е2 в головном мозге, печени, мышцах и жировой ткани, в результате чего начинается усиленный распад белка в мышцах, синтез в печени протеинов острой фазы, мобилизация жира [6, 34, 62, 180].
Исследования с использованием тяжелых изотопов подтвердили механизм катаболической реакции на травму. При голодании в отсутствие стресса скорость распада белка остается неизменной, тогда как скорость его синтеза уменьшается, в результате чего происходит потеря белка организмом [34, 62, 46, 168].
По мнению большинства специалистов [18, 22, 34, 136], первоначальный этиологический фактор вызывает разбалансировку нейровегетативного звена системы регуляции организма, что сопровождается нарушениями белково-липидно-углеводного обмена, вследствие чего происходит истощение компенсаторно-приспособительных механизмов. При этом разлаживается работа различных органов и систем, тормозятся механизмы, контролирующие синтез белка [18, 22, 62]. Расстройства белкового обмена характеризуются ускоренным распадом протеинов, мобилизацией аминокислот из миоцитов скелетной мускулатуры для активного печеночного глюконеогенеза и синтеза острофазных белков [18, 22, 48, 62, 238]. По мере истощения расходуются белковые запасы (белки поперечно-полосатой мускулатуры, паренхиматозных органов), происходит изменение обменных процессов. Энергообразовательные системы, локализованные в митохондриях, переходят на экономное функционирование [18, 22, 48, 62, 238]. Итогом является катаболическая направленность обмена веществ, ведущая к быстрому истощению пластических и энергетических ресурсов организма [62, 238, 255].
Синтез белка не компенсирует возрастающий катаболизм мышечных и висцеральных белков, что приводит к отрицательному азотистому балансу и сопровождается прогрессирующей потерей массы тела [18, 27, 36, 62]. Утрата функциональных протеинов приводит к снижению сопротивляемости организма и повышению риска присоединения инфекции [23, 38, 62, 82, 92, 137, 294]. Установлено, что на долю протеинов скелетной мускулатуры приходится 45% общего пула протеинов [6, 62]. Центральный участок выработки протеинов острой фазы – печень. В норме у ребенка за сутки обновляется 6 г белка (у взрослого – 3 г) [62]. Этот оборот белка соответствует фундаментальному биологическому закону непрерывного обновления белка, клеток. Для каждого вида белка этот оборот происходит с заданной скоростью, при этом 1/3 выделяемых в ходе оборота аминокислот, т.е. приблизительно 1 г/кг веса тела в сутки, не могут быть далее использованы для нового синтеза белка, и это количество выводится в основном в качестве мочевины [62, 293, 303]. Отмечено, что уже после простых оперативных вмешательств значительно увеличивается общий оборот белка [18, 22, 62, 238, 255]. Так, в экспериментах на крысах [311], при травме отмечалось нарастание синтеза протеинов печени на 40%, при септическом ожоге – до 164%.
Основными клиническими последствиями изменений метаболизма при травматическом, в том числе хирургическом стрессе, являются системные воспалительные реакции, проявляющиеся в быстром распаде белка скелетных мышц и нарастанию энерготрат [18, 32, 80, 95, 197]. В стрессовых состояниях интенсивность обмена веществ возрастает пропорционально степени стресса, колеблясь в пределах 5-100% выше нормального уровня [18, 89, 91, 124].
Это связано с высвобождением большого количества гормонов (в т.ч. катехоламинов и глюкокортикоидов), что приводит к угнетению секреции инсулина, понижению чувствительности к нему на клеточном уровне. Стимулируется выработка глюкагона и глюконеогенез. В результате секреции альдостерона и АДГ в организме задерживаются соли и вода. Все это приводит к быстрому распаду белка в организме, повышению уровня глюкозы в крови, максимальному окислению жиров [35, 89, 114, 122, 311]. Гиперпродукция катехоламинов и глюкокортикоидов приводит к относительной инсулиновой недостаточности и выраженной гипергликемии с недостаточной усвояемостью глюкозы тканями [62, 295, 305].
При «госпитальном голодании» картина крови больного характеризуется уменьшением объема крови, гематокритного числа, гемоглобина, общего числа лимфоцитов, снижением концентрации транстиретина, альбумина, трансферрина. В результате повышенной потребности в белке для синтеза глобина, развивается нормоцитарная и нормохромная анемия [5, 7, 20, 26, 42].
Исследования последних лет показали, что в процессе метаболических изменений в организме происходит постепенная ишемия и атрофия слизистой кишечника [8, 26, 27, 40, 46, 51]. Поражение желудочно-кишечного тракта – наиболее часто встречающаяся органная дисфункция у детей при экстремальных состояниях. [9, 18, 30, 42, 153]. Кишечник – это орган, отвечающий за обеспечение организма питательными веществами, выполняющий эндокринную, иммунную, метаболическую и барьерную функции [8, 10, 30, 26, 42]. Слизистая кишечника постоянно обновляется, имеет высокую степень метаболической активности. Для сохранения целостности слизистой самого кишечника необходимо наличие питательных веществ. В поддержании целостности и регенерации слизистого слоя ЖКТ участвуют желудочно-кишечные пептиды, тироксин, жирные кислоты, гормон роста, энтероглюкагон, пейеровы бляшки, лимфоциты, макрофаги, иммуноглобулин А в желчном секрете. Стенка кишечника богата лимфоидной тканью, которая взаимодействует с бактериальной флорой [42, 46, 62]. При критических состояниях изменяется проницаемость слизистой кишечника, что приводит к транслокации бактерий и токсинов в систему циркуляции [8, 18, 24, 46]. Метаболические нарушения приводят к морфологическим изменениям со стороны органов и систем [18, 27, 34, 62, 158]. Поэтому знания о происходящих метаболических нарушениях, лежащих в основе расстройств питания тяжелобольных детей, необходимы врачу любого отделения для быстрого выявления и купирования недостаточности питания.
