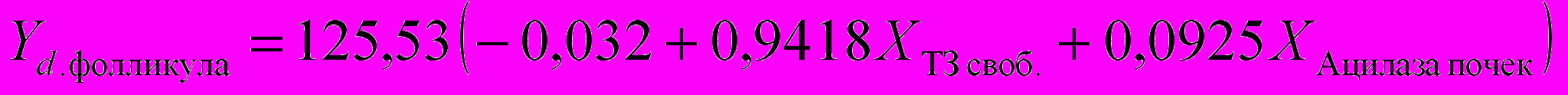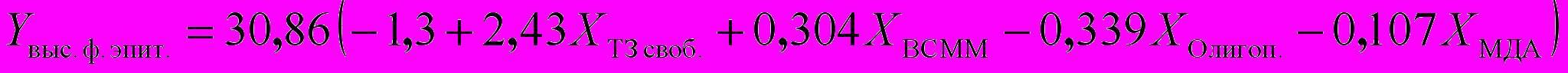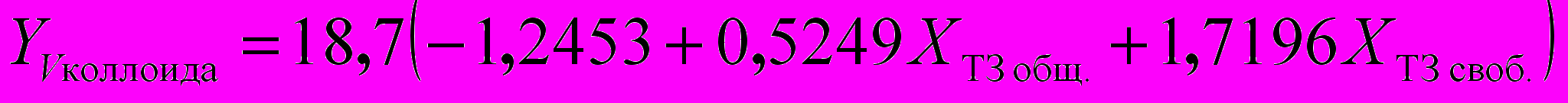Хронического эндотоксикоза
| Вид материала | Исследование |
- Задачи исследования: разработать новые хирургические технологии лечения хронического, 21.35kb.
- Диагностика и оперативное лечение хронического калькулезного холецистита и хронического, 231.98kb.
- Фундаментальна медицина практиці охорони здоров’я терапевтические подходы к лечению, 75.71kb.
- Значение показателей вязкости крови и мочи в комплексной диагностике степени тяжести, 490.41kb.
- Лечение хронического периодонтита с применением новой композиции «Коллапан-гель, 306.75kb.
- О. А. Возможности контроля за течением и эффективностью лечения хронического гепатита, 25.35kb.
- Лечение хронического урогенитального хламидиоза: сравнительный анализ применения нутрицевтиков, 965.76kb.
- На правах рукописи, 302.89kb.
- Комплексная терапия хронического алкоголизма, 140.82kb.
- В. Т. Ивашкин Современный взгляд на гепатоцеллюлярную карциному, 115.99kb.
Морфолические изменения инсулярного аппарата и дисбаланс инсулина у крыс при хроническом эндотоксикозе. В островках поджелудочной железы на 30-е сут ЭТ выявлялся отёк междольковых перегородок с умеренной лимфоцитарной инфильтрацией и очаговыми кровоизлияниями в жировой клетчатке по периферии органа. К 60-м сут в паренхиме железы отмечались участки с выраженным явлением перидуктального и периацинарного склероза. В этих зонах выявлялась пролиферация эпителия выводных протоков и формирование мелких протоков. Отдельные островки были полностью склерозированы. Для других островков было характерно выраженное полнокровие капилляров, в большинстве эндокриноцитов определялась гиперхромия ядер. Эти изменения становились более интенсивными к 90-м сут хронического ЭТ. При морфометрии установлено достоверное уменьшение ОД островков Лангерганса, (на 90-е сут ЭТ - в 1,65 раза по сравнению с показателями в контрольной группе, P<0,05). Соответственно, ОД инсулоцитов в островках снижалась на протяжении всего эксперимента, и к 90-м сут ЭТ была в 1,52 раза меньше, чем у крыс контрольной группы (P<0,05). Экспрессия NOS-3 в сосудах панкреатических островков увеличивалась с 3% до 23% к 90-м сут хронического ЭТ, иммунопозитивные эндотелиоциты локализовались преимущественно в капиллярах по периферии островков. При изучении экспрессии TRAIL на ранних сроках эксперимента определялось окрашивание единичных эндокриноцитов и ацинарных клеток (4%), к 90-м сут ЭТ иммунопозитивных инсулоцитов было значительно больше (29%), они располагались диффузно на территории островка. На 30-е сут хронического ЭТ единичные каспазо-позитивные клетки выявлялись на границе с ацинарной тканью, по мере увеличения сроков эксперимента появлялись все более многочисленные клетки с экспрессией каспазы-3 на периферии островков. При ультрамикроскопии островков Лангенгарса на 30-е сут ЭТ отмечено увеличение количества секреторных везикул в α-клетках при незначительном уменьшении количества везикул в β-клетках. В дальнейшем в большинстве α-клеток выявлялось большое количество секреторных везикул, а количество β-клеток продолжало снижаться, в них все чаще обнаруживались признаки пониженной секреторной активности: полиморфизм гранул и появление более крупных везикул. При морфометрии к 30-м сут выявлялись увеличение фактора формы кариолеммы и количества эухроматина в ядре, расцененные как признаки активации ядерного аппарата. Уменьшение ОД митохондрий (в 1,26 раза по сравнению с показателями в контрольной группе) на фоне увеличения их яркости (в 1,1 раза). К 60-м сут ОД митохондрий несколько увеличивалась, а относительная яркость их матрикса оставалась практически на том же уровне, что свидетельствовало о напряженности энергетических процессов в клетке. Секреторная активность β-клеток увеличилась, о чем можно судить по достоверному приросту ОД везикул (в 1,53 раза, P<0,05). К окончанию эксперимента (90-е сут) зарегистрировано уменьшение фактора формы, яркости активного хроматина, ОД митохондрий, их относительной яркости и ОД секретируемых везикул. Все это в совокупности расценено как признаки снижения секреторной активности β-клеток. Уровень инсулина при хроническом ЭТ на 30-е и 60-е сут в обеих моделях определялся в пределах 15-20% выше показателей контрольной группы, а к 90-м сут процесса значительно снижался, достигая лишь 2/3 от значений в контроле (P<0,05). У животных контрольной группы имелась сильная обратная корреляционная связь между содержанием АКТГ и инсулина в крови (r = -0,87). На 30-е сут эксперимента происходило ослабление зависимости (r = - 0,51), а к окончанию эксперимента обнаружена уже умеренная положительная связь (r = 0,63). Таким образом, исследование структурно-функциональных изменений эндокриноцитов поджелудочной железы при действии ЭТС, показало, что процессы повреждения и деструкции носили мозаичный характер и сочетались с процессами регенерации. Отчетливо выраженные изменения в эндокриноцитах сопровождались перестройкой ультрамикроскопического строения β-эндокриноцитов и снижением секреции инсулина. Гипоинсулинемия при SIRS и хронических токсических состояних ранее описывалась [Гельфанд Б.Р. с соавт., 2006; Federici M.et al., 2001; ссылка скрыта. et al., 2006], но нами детализированы отдельные механизмы ее формирования при хроническом ЭТ в составе общей гормональной дизрегуляции. Математический анализ и моделирование эндокринной дизрегуляции при хроническом эндотоксикозе. Доказательство участия эндокринной дизрегуляции в пато- и морфогенезе хронического ЭТ было проведено с системных позиций при использовании математического моделирования с использованием корреляционного анализа и построения регрессионных уравнений. В результате корреляционного анализа между гормонами периферической крови, входящих в состав основных гормональных осей, и биохимическими маркерами эндогенной интоксикации выявлено значительное количество сильных и умеренных математических связей (рис. 6). 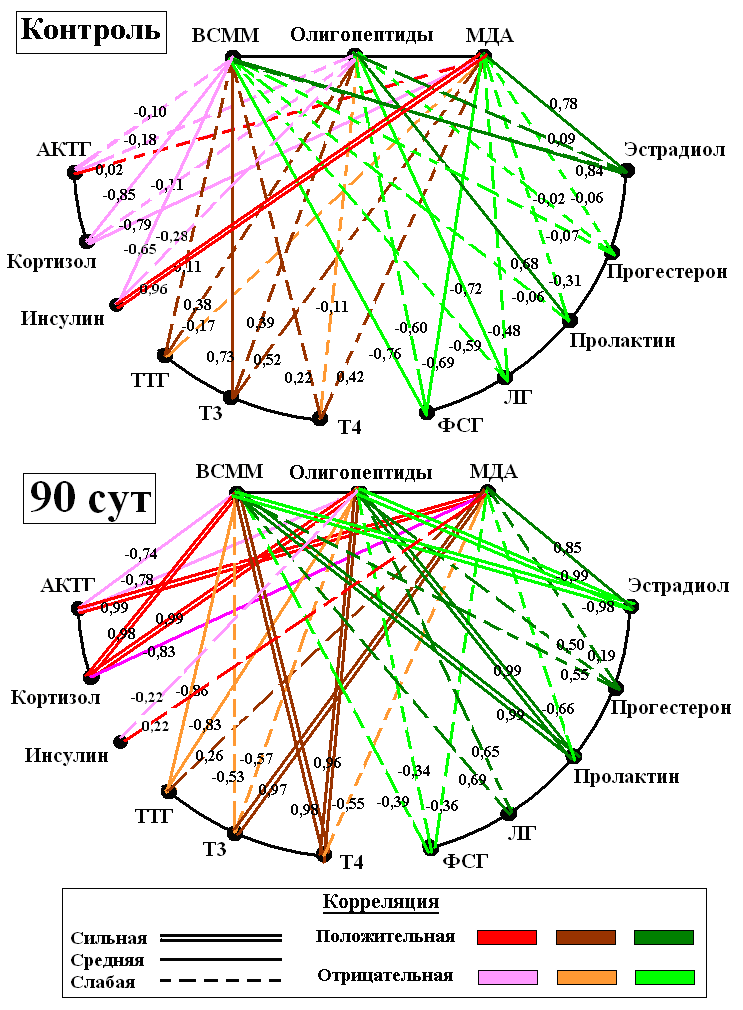 Рис. 6. Корреляционные связи между маркерами эндогенной интоксикации и профилем гормонов в крови у крыс контрольной группы и при хроническом ЭТ. У животных контрольной группы гормоны тиреоидной оси не имели значимых корреляционных связей с маркерами эндогенной интоксикации. Для адреналовой оси установлено наличие сильных обратных связей кортизола с ВСММ (-0,85) и МДА (-0,79). Среди гормонов гонадной оси наиболее сильные корреляционные связи обнаружены между ЛГ и олигопептидами (0,77) – у самцов, эстрадиолом и ВСММ (0,84) – у самок. На 30-е сут ЭТ произошло формирование сильных корреляционных связей между гормонами адреналовой оси и маркерами эндогенной интоксикации. На этом же сроке обнаружены значимые корреляции между гормонами тиреоидной оси: ТТГ, Т3, Т4. Гормоны гонадной оси имели сильные корреляционные связи с ВСММ, олигопептидами и МДА (r в пределах 0,78-0,98 по модулю). В динамике хронического ЭТ часть связей ослабло, однако основные гормоны осей сохраняли сильные связи с одним и более маркером эндогенной интоксикации. На 90-е сут сохранялась общая тенденция в образовании умеренных и сильных корреляционных зависимостей между гормонами эндокринных осей и маркерами эндогенной интоксикации. Отдельные закономерности выявлены в корреляциях между уровнями гормонов и показателями повреждения печени и почек. Установлено увеличение числа и усиление ранее существовавших корреляционных связей между гормонами тиреоидной оси и морфометрическими показателями печени и почек по мере увеличения срока эксперимента. Наиболее значимые корреляции: Т4 – ОД соединительной ткани печени (0,86), Т4 – ОД гепатоцитов (-0,84); Т4 – ОД интерстициальной ткани почек (0,88), Т4 – количество склерозированных клубочков (0,95). Корреляционный анализ между содержанием половых гормонов у самцов и тяжестью ЭТ выявил рост количества и силы связей в ряду: ЛГ – ФСГ – тестостерон – пролактин по мере увеличения сроков ЭТ. У самок при изучении корреляций между гормонами гонадной оси и морфометрическими показателями печени и почек наиболее сильные связи обнаружены у эстрадиола с ОД гепатоцитов (0,85), ОД соединительной ткани печени (-0,82) и количеством склерозированных почечных клубочков (-0,87). Аналогичные многочисленные корреляционные связи, имеющие логическое обоснование, были обнаружены при попарном сопоставлении между группами количественных показателей, описывающих изменения в эндокринных органах, гормональном профиле и маркеров ЭТ. В итоге, корреляционный анализ морфометрических показателей позволил нам на математическом уровне доказать участие различных элементов эндокринной системы в пато- и морфогенезе повреждения печени и почек при хроническом ЭТ (рис. 7). 1 ↑Коэффициент микроглия/нейрон в PV ядре гипоталамуса ↑ОД ацидофилов ↑Пролактин ↑АКТГ ↑ОД нейронов PV ядра гипоталамуса ↑ОД базофилов ↓ФСГ, ↑ЛГ, ↑ТТГ   ↓ОД ядер пучковой зоны коркового вещества надпочечника ↑ОД митохондрий, ↑ОД везикул фолликулярных эпителиоцитов яичника, ↑Эстрадиол ↑ОД α-клеток островков поджелудочной железы ↑ОД стромы ЩЖ, ↑Высота фолликулярного эпителия ↑Т3, ↑Т4  ,2 ,2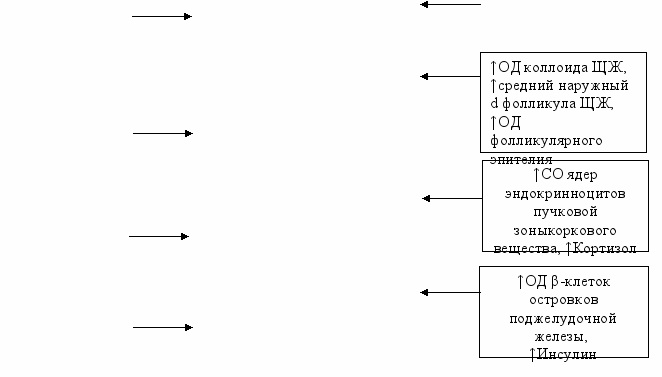 ↓Диаметр семенных канальцев, ↓тестостерона      - повреждающие влияния - компенсаторные влияния Рис. 7. Обобщенные представления о влиянии различных структур эндокринной системы на развитие морфофункциональных изменений в печени и почках при хроническом ЭТ. Одной из задач выполняемого статистического анализа является вычисление величин параметров, прижизненное измерение которых чрезвычайно инвазивно или практически невозможно, но сведения о которых диагностически значимы и весьма информативны. В то же время существуют показатели, с помощью которых оценивается тяжесть хронического ЭТ (биохимические маркеры эндогенной интоксикации) и/или наличие эндокринного дисбаланса (гормональный профиль). Они характеризуются малой инвазивностью при получении, точностью определения, технической простотой и экономической доступностью. Именно эти параметры были использованы для нахождения искомых морфометрических показателей. Из всей генеральной совокупности в качестве искомых параметров нами отобраны морфометрические показатели эндокринных органов, которые формируют основные гормональные оси, вовлекаемые в патологический процесс при хроническом ЭТ. После математических преобразований с пересчетом параметров в относительных единицах (Х) и учетом данных корреляционного анализа, в частности, для расчета ОД ацидофилов гипофиза было получено: 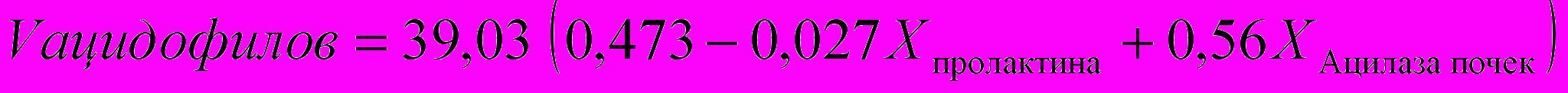 Для расчетного определения морфометрических показателей пучковой зоны коркового вещества надпочечников оказалось возможным построить следующую систему уравнений:
Для расчета функциональной активности щитовидной железы достаточно измерить параметры ″Т3своб.″, ″Т3общ.″, ″ВСММ″, ″Ацилаза почек″, ″МДА″, ″Олигопептиды″, ″Ацилаза почек″ и решить систему уравнений:
|

 )
) 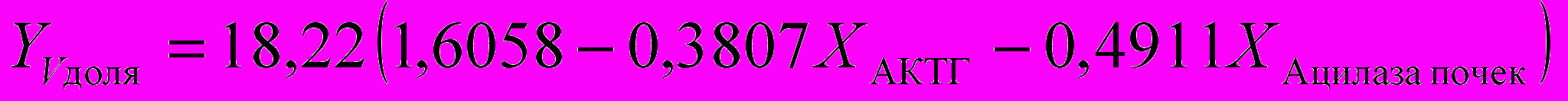
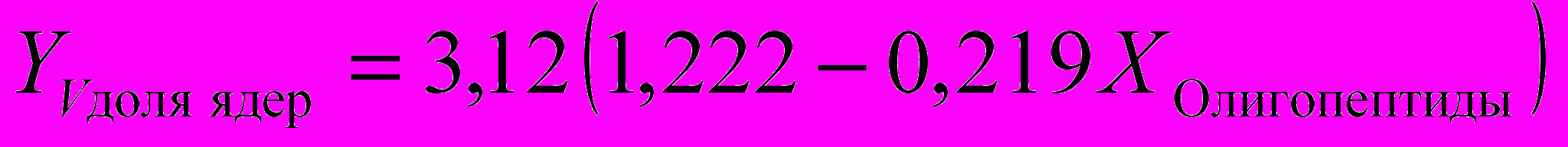
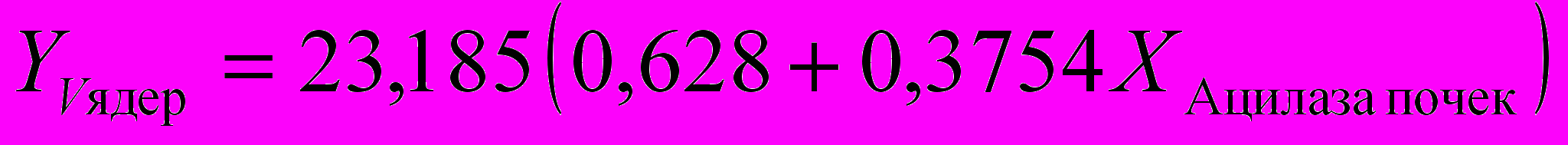
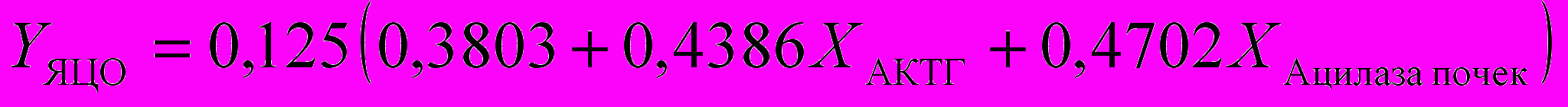
 )
)