Билиопанкреатодуоденальной зоны
| Вид материала | Автореферат |
- Рак печени и органов билиопанкреатодуоденальной зоны: современная диагностика и лечение, 411.75kb.
- Градостроительный кодекс российской федерации, 2584.06kb.
- Диагностика и хирургическое лечение заболеваний гепатопанкреатодуоденальной зоны. Целями, 71.79kb.
- «Введение в теорию полупроводников», 89.67kb.
- Реферат Невербальные элементы в общении. 27 страниц, 2229.13kb.
- А. И. Заиченко 22 декабря 1988 г. N 4945-88 методические указания, 2791.75kb.
- Урок по окружающему миру в 4-ом классе Тема: Леса, 104.4kb.
- Методические указания по определению вредных веществ в сварочном аэрозоле (твердая, 3900.72kb.
- 2 Мероприятия по социально-экономическому развитию центральной экологической зоны бпт, 2023.27kb.
- Экономические зоны (оэз) в современном мире один из инструментов социально-экономического, 93.68kb.
Примечание. * - с желчеистечением (n-1), c гемоперитонеумом (n-2)
Однако эти осложнения легко корректировались миниинвазивно и в меньшей степени влияли на развитие тяжелой печеночно-почечной недостаточности, которая явилась основной причиной летальных исходов в подгруппе I (табл. 8).
Таблица 8
Характер неспецифических осложнений послеоперационного периода
в подгруппах с наружным и наружно-внутренним желчеотведением
| Послеопе- рационные осложнения | Наружное желчеотведение (подгруппа I) n-12 | Наружное желчеотведение под УЗИ и РТВ (подгруппа II) n-88 | Нар-внутр. желчеотведение под УЗИ и РТВ (подгруппа III) n-15 |
| ОССН | | 1 (1,13%) | _____ |
| ОНМК | | 1 (1,13%) | _____ |
| ОППН | 5 (41,6%) | 7 (7,9%) | 2 (13,3%) |
| ВСЕГО | 5 (41,6%) | 9 (10,2%) | 2 (13,3%)* |
Примечание.* - у одного больного развитие ОППН сочеталось с
желчеистечением вследствие дислокации дренажа
В раннем послеоперационном периоде умерло 6 (50%) пациентов после наружного желчеотведения выполненного традиционным способом, 27 (30,6%) и 2 (13,3%) больных после чрескожного наружного и наружно-внутреннего желчеотведения.
Лучшая динамика состояния больных и лабораторных данных позволила сократить продолжительность пребывания пациентов с миниинвазивным подходом в стационаре по сравнению с первой контрольной группой (рис. 3).
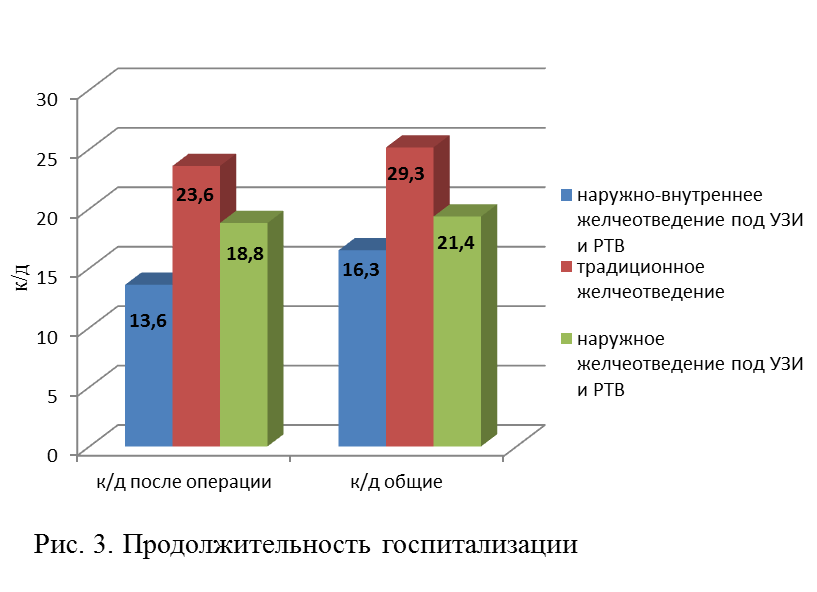
Сравнительный анализ результатов лечения подгрупп пациентов
с внутренним желчеотведением
Результаты эндобилиарного стентирования
Технически установка эндобилиарных стентов успешно достигнута в 100% случаев у 106 пациентов, что показало высокую эффективность метода.
В 3-х случаях вмешательство стало предварительным этапом, позволившим подготовить больных к последующему хирургическому лечению. У 1-й больной выполнено ЛГПДР, у 2-х – ГПДР из лапаротомного доступа. Такой способ подготовки не изменял анатомию БПДЗ, не вызывал выраженного адгезивного процесса, был удобен в связи с необходимостью проведения длительной предоперационной подготовки, а также учитывал нежелание пациента оставаться длительное время с наружным желчеотводящим дренажем.
По полу, возрасту, сопутствующим заболеваниям, продолжительности желтухи на этапе поступления в стационар статистически значимых различий среди подгрупп с внутренним желчеотведением не получено.
В подгруппе с одноэтапным стентированием интра- и специфические послеоперационные осложнения отсутствовали. Метод одноэтапного стентирования позволил в 100% случаев избежать такого серьезного осложнения наружного желчеотведения, как желчеистечение в свободную брюшную полость. Этого удалось достичь за счет эффекта двойного дренирования желчных протоков на этапе имплантации стента. Такая тактика исключила нежелательные наружные потери желчи и связанные с этим нарушения в ранние сроки от момента госпитализации. Сокращение числа вмешательств указывает на экономическую выгоду данной тактики, которая в том числе избавляет пациента и врача от дополнительной лучевой нагрузки.
У пациентов же с двухэтапным эндобилиарным стентированием уже за счет предварительно выполненного наружного желчеотведения осложнения развились в 9,89% случаях. У 6 (6,59%) из этих больных осложнения были непосредственно связаны с дренированием. У 5 пациентов была диагностирована дислокация холангиостомы за пределы билиарного дерева, в одном из этих случаев – с желчеистечением в свободную брюшную полость. Это потребовало не только редренирования протоковой системы, но и установки дополнительных дренажей в подпеченочном пространстве и полости малого таза под контролем УЗИ и РТВ. В 4-х других случаях поступления желчи в свободную брюшную полость не было выявлено, что позволило ограничиться только редренированием протоковой системы, либо коррекцией положения холангиостомического дренажа.
В одном случае установка наружной холангиостомы стала причиной развития гемобилии и последующей гемотампонады желчных протоков. Был установлен дренаж большего диаметра (12F) на следующие сутки по имеющемуся доступу. Протоковая система была полностью санирована от сгустков крови.
У 3-х пациентов (3,29%) осложнения не были непосредственно связаны с установкой или стоянием дренажа. В 2-х случаях развилась тяжелая печеночно-почечная недостаточность, у одного пациента – транзиторное нарушение мозгового кровообращения.
В среднем понадобился 31±19,8 койко-день для подготовки этих пациентов ко 2-му этапу вмешательства, тогда как этот показатель в группе с неосложненным течением составил всего 12±6,9 койко-дней.
Зависимости в особенностях течения второго этапа лечения от осложнений, развившихся во время наружного желчеотведения у пациентов V подгруппы, не было получено.
Сравнительный анализ подгрупп показал, что одномоментное стентирование (подгруппа VI) по сравнению с двухэтапным стентированием (подгруппа V) и, тем более, с традиционными билиошунтирующими операциями (подгруппа IV) требовало наименьших временных затрат (p<0,00) (рис. 4).
Сравнение лабораторных показателей между группами на 10-е сутки после операции показало достоверные различия по некоторым основным значениям (табл. 9).
В подгруппах пациентов с эндобилиарным стентированием отмечено более быстрое восстановление основных биохимических и общих показателей в крови.
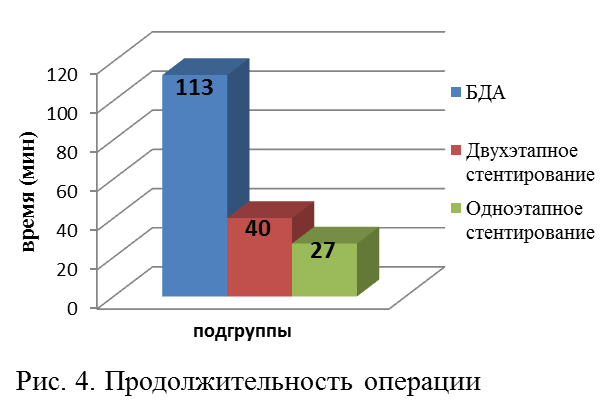
Таблица 9
Сравнительный анализ лабораторных показателей крови после операций
в подгруппах пациентов с внутренним желчеотведением
| Параметр, ед. Измерения | БДА (подгруппа IV) n-19 | Двухэтапное стентирование (подгруппа V) n-91 | Одноэтапное стентирование (подгруппа VI) n-15 |
| Белок г/л | 64,1±2,2 | 72,66±2,0*Р=0,01 | 68,12±4,47 |
| Билирубин общ., мкмоль/л | 108,1±35,8 | 67,6±14,8*р<0,05 | 72,1±80*р<0,05 |
| Билирубин прямой, мкмоль/л | 58,0±22,2 | 39,15±9,1 | 29,3±30,2*р<0,05 |
| АСТ, Е/л | 157,0±99,8 | 57,8±10,4*р<0,01 | 52,4±38,5*р<0,01 |
| АЛТ, Е/л | 131,9±53,7 | 73,9±16,9*р<0,05 | 42,75±14,4*р<0,05 |
| Мочевина, ммоль/л | 7,73±1,4 | 10,0±1,27 | 7,8±2,18 |
| Креатинин, мкмоль/л | 70,2 ±14,8 | 116,76±17,8*р<0,01 | 96±43,6 |
| Амилаза, Е/л | 105,3±41,49 | 108,13±66,0 | 41,25±25,2*р<0,05 |
| HGB г/л | 101,5±7,4 | 110±4,0 | 93,1±6,6 |
| СОЭ, мм/ч | 38,37±9,8 | 42,23±4,2 | 54,16±3,4 |
| Лейкоциты, 10⁹/мм³ | 9,7 ±3,0 | 11,15±1,4 | 11,19±5,4 |
Примечание. При парных сравнениях использован критерий Данна или Тьюки.
* – сравнение с IV подгруппой
Среди осложнений, которые развились непосредственно во время выполнения стентирования в V подгруппе больных, была гемобилия (n-8) и дислокация стента (n-2).
Важным фактом является то, что геморрагические осложнения не были гемодинамически значимыми и длительно продолжавшимися ни в одном из представленных наблюдений. Возникшие кровотечения не требовали использования дополнительных хирургических манипуляций и останавливались к концу вмешательства. В 7 (87,5%) из 8 случаев гемобилия развилась на фоне баллонной дилятации опухолевой стриктуры. В одном наблюдении умеренная внутрипротоковая геморрагия возникла после установки интродъюсера. В 3-х случаях диагностированная после баллонной дилятации гемобилия была сразу прекращена установкой в протоки графт-стента, покрытие которого тотчас тампонировало источник кровотечения.
При этом все геморрагические осложнения в данной группе отмечены в первых 26 наблюдениях. Использование саморасширяющихся стентов с покрытием в последующих 80 случаях и отказ от баллонной дилатации стриктур позволило избежать развития этих осложнений в V и VI подгруппах.
В подгруппе пациентов с БДА геморрагические проявления на фоне холемии во время операции встречались чаще, чем в других подгруппах, составив 11,47%.
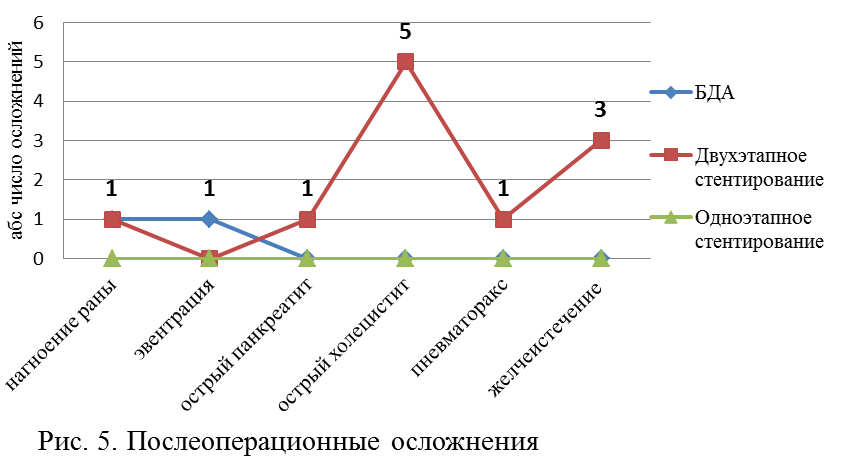
Несмотря на очевидные преимущества малотравматичного доступа, послеоперационные осложнения, непосредственно связанные с выполнением оперативного вмешательства, чаще всего отмечались в V подгруппе пациентов. Однако ни в одном из этих случаев нам не пришлось использовать лапаротомный доступ для их коррекции. Все пациенты были пролечены миниинвазивно с использованием только пункционно-дренажного метода, тогда как развившаяся в одном случае полная эвентрация кишечника в гнойную рану в IV подгруппе больных стала причиной релапаротомии (рис. 5).
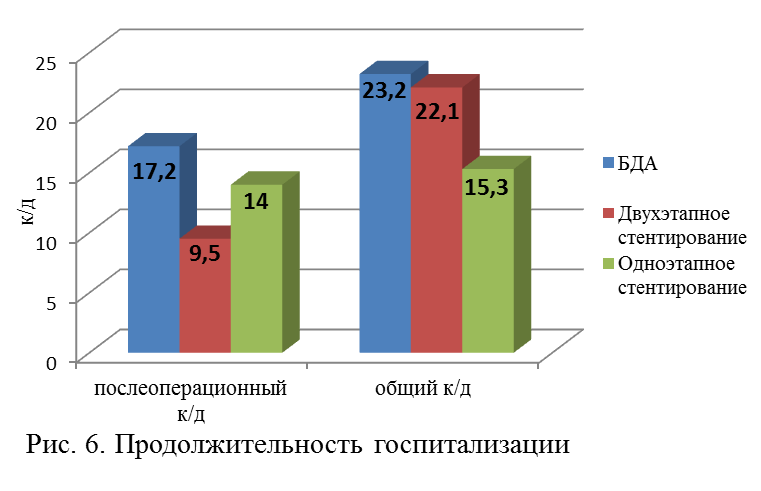
Сравнение продолжительности общего и послеоперационного койко-дня у больных с различными способами внутренного желчеотведения представлена на рисунке 6. Более длительное пребывание больных VI подгруппы в стационаре в послеоперационном периоде объяснялось необходимостью проведения дополнительных мероприятий, направленных на скорейшее разрешение желтухи, а также дообследованием больных.
Повторная госпитализация в стационар потребовалась 8 (8,79%) больным V подгруппы (табл. 10).
Развившиеся единичные осложнения в группе пациентов после перенесенного БДА (холангит и дуоденальная опухолевая обтурация), по всей видимости, были обусловлены неадекватным способом выбранного оперативного пособия в каждом конкретном случае.
Таблица 10
Характер выполненных вмешательств в отдаленном периоде
| № | ОСЛОЖНЕНИЕ | СРОК ОТ СТЕНТИР. (мес.) | ХАРАКТЕР ВЫПОЛНЕННЫХ ВМЕШАТЕЛЬСТВ |
| 1 | Опухолевый стеноз ДПК | 1 | Гастроэнтероанастомоз, межкишечный анастомоз по Брауну |
| 2 | Опухолевый стеноз ДПК | 10 | Лапароскопическийгастроэнтероанастомоз,межкишечный анастомоз по Брауну |
| 3 | Опухолевый стеноз ДПК | 6 | Лапароскопическая ГПДР |
| 4 | Нарушение функции стента (холангит) | 13 | Попытка эндоскопического удаления стента. Рестентирование «stent in stent» |
| 5 | Нарушение функции стента (холангит) | 24 | Лапаротомия. Холедохотомия. Удаление стента. Гепатикоеюностомия по Ру. |
| 6 | -Полная миграция стента -Нарушение функции стента (холангит) | 8 7 | -Рестентирование -Лапаротомия. Холедохотомия. Удаление стента. Гепатикое-юностомия по Ру |
| 7 | Плановая операция | 1,5 | ГПДР |
| 8 | Нарушение функции стента (желчный свищ) | 2 | ГПДР |
Медиана выживаемости в группах внутреннего желчеотведения не достигала года и не имела статистических значимых отличий при сравнении этого показателя между подгруппами. В IV, V и VI подгруппах она составила 204±60,65, 215±57,1 и 229±68,5 к/д соответственно.
Таким образом, сопоставление результатов лечения в подгруппах с внутренним желчеотведением показало, что эндобилиарное стентирование абсолютно показано пациентам с опухолью органов БПДЗ при высоком риске традиционного билиошунтирующего вмешательства. Одноэтапная схема стентирования является предпочтительнее двухэтапной, так как способствует уменьшению числа осложнений ближайшего после операции периода, сокращает продолжительность госпитализации, снижает летальность и уменьшает затраты на лечение. У больных с предполагаемым длительным прогнозом жизни традиционная операция улучшает отдаленные результаты лечения, так как выполнение БДА может быть дополнено формированием гастроэнтероанастомоза для профилактики дуоденальной непроходимости в последующем.
Основные интраоперационные результаты ЛПДР
Из 37 пациентов основной группы в 29 случаях (78,3%) резекция закончена полностью эндовидеохирургически в изначально намеченном объеме. Это подтвердило мировые данные о возможности и доступности применения данного способа наряду с традиционным.
В 7 (18,9%) случаях, в среднем, через 145 мин (от 65 до 240) от начала операции выполнена конверсия доступа. У 1-го больного из-за выявленной во время лапароскопического УЗИ (ЛУЗИ) инвазии опухоли в ВБА, сформирован БДА лапароскопическим способом (табл. 11).
Ни в одном из случаев изменение доступа не являлось экстренной мерой, а было спланированным шагом, позволяющим избежать значительной задержки операции по времени.
Таблица 11
Причины отказа выполнения запланированного вмешательства
| Причина конверсии доступа | n | Характер оперативных вмешательств (n) |
| Выраженный инфильтративно-спаечный процесс | 7 | ГПДР – 6 Гепатикоеюностомия по Ру – 1 |
| Лапароскопическая УЗ-картина инвазии опухоли в ВБА | 1 | Лапароскопическая резекция холецисто-энтероанастомоза, гепатикоеюностомия по Ру – 1 |
| Всего | 8 | 8 |
При анализе полученных результатов и сопоставлении их с данными предоперационного обследования,было отмечено, что на частоту конверсии влияли: уровеньпоказателя СА-19,9, размер опухоли, степень опухолевой инфильтрации тканей вокруг брыжеечных сосудов и выраженности изменений в тканях парапанкреатической клетчатки, по данным лучевых методов диагностики. Так, у 6 пациентов, где операция после конверсии заканчивалась из лапаротомного доступа в объеме ГПДР, уровень онкомаркера СА-19,9 до операции был в 7,58 раза выше при сравнении с аналогичным показателем в группе пациентов, где была выполнена ЛПДР.
Для оптимизации показаний к выполнению оперативного вмешательства лапароскопическим способом была построена ROC кривая. Оказалось, что при уровне СА-19,9 менее 301,5Ед в 75% случаев конверсия не потребовалась, тогда как в группе с уровнем онкомаркера более 301,5Ед конверсия произведена всего у 15% больных. Эти различия оказались статистически значимыми р=0,001 (рис. 7).
Размер опухоли также влиял на частоту конверсии доступа. Так, по данным УЗИ и КТ, средний размер опухоли в подгруппе без конверсии доступа составил 24,7±6,63 и 23,4±8,03 соответственно, тогда как в подгруппе пациентов, где доступ в брюшную полость был изменен, 31,75±3,8 и 32,6±3,6.
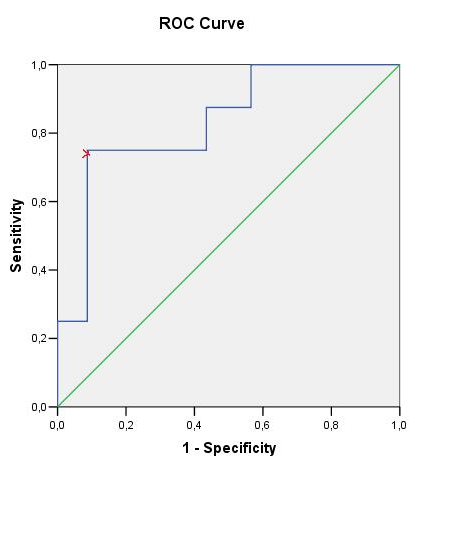
Рис.7. Оптимизация показаний к выбору эндовидеохирургического
метода операции по данным онкомаркера CA-19,9
Для оценки влияния размера опухоли на возможность выполнения операции полностью миниинвазивным способом мы разделили вторую основную группу пациентов на 2 подгруппы. При этом размер опухоли по данным КТ на предоперационном этапе в I подгруппе был меньше 31 мм, тогда как во II подгруппе – больше 31 мм. Таким образом, в I подгруппе в 13 из 15 случаев конверсии не потребовалось, тогда как во 2-й только в 4 из 10. Различия статистически значимы, р=0,022 (рис. 8).
При этом у всех пациентов, которым изначально запланированное вмешательство не было выполнено в полном объеме, опухоль располагалась в головке поджелудочной железы, что было подтверждено при последующем морфологическом исследовании.
У больных раком головки ПЖ с КТ- и МРТ-признаками опухолевой инфильтрации тканей вокруг брыжеечных сосудов переход к открытому доступу потребовался в 60% случаев. При сопоставлении этих данных с подгруппой больных, не имеющих паравазальной инфильтрации тканей, различия оказались достоверными (p=0,028).
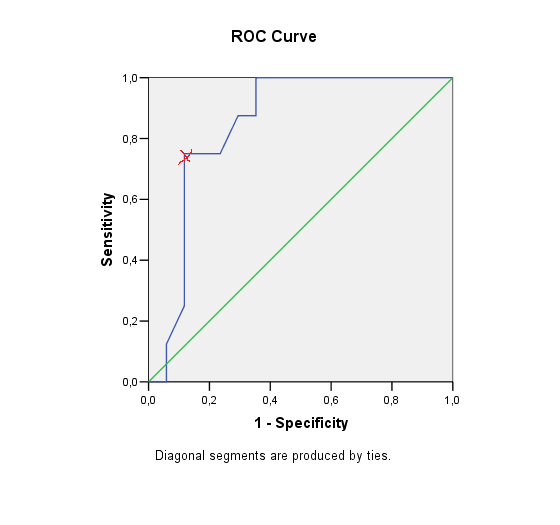
Рис.8. Оптимизация показаний к выбору эндовидеохирургического
метода операции по размеру опухоли
Схожая картина отмечена при выявлении КТ- и МРТ-признаков выраженности изменений в тканях парапанкреатической клетчатке. Из 10 больных с такими изменениями 7 потребовалась конверсия доступа. Только у 3-х пациентов удалось избежать перехода на лапаротомию. Различие оказалось статистически значимым (р=0,002). Во время вмешательства у 5 пациентов этой подгруппы выявлено, что опухоль была подпаяна к стенке ВВ или ВБВ. В одном из этих случаев ситуация потребовала выполнения краевой резекции вены. У одной больной, по данным ЛУЗИ, диагностирована инвазия опухоли в ВБА.
Переход к лапаротомному доступу не позволил уменьшить средний объем кровопотери в этой подгруппе, она составила 1293±176,38 мл, что было в 2 раза больше по сравнению с основной и в 1,12 раза при сопоставлении этого показателя с контрольной группой (рис. 9).
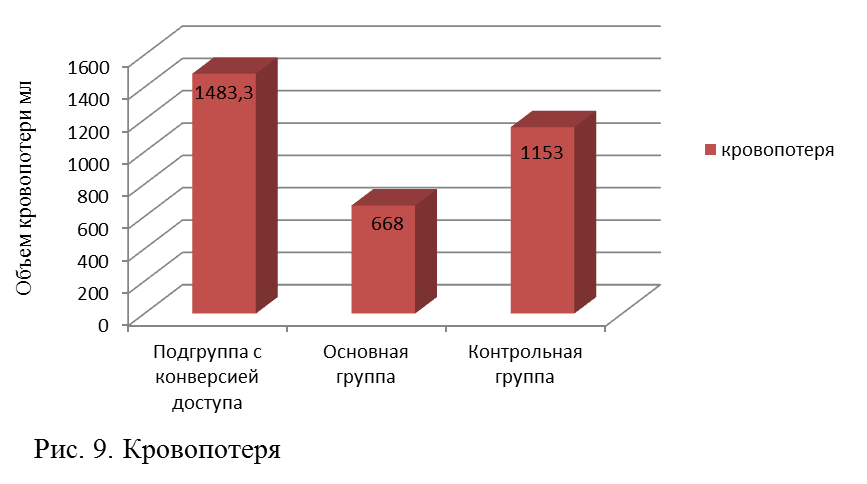
Различия между результатами в подгруппе пациентов с конверсией доступа и основной группой являлись статистически значимыми (р=0,008), тогда как при сравнении основной и контрольной групп различия были только близки к достоверным (р=0,025). Различия между кровопотерей в подгруппе с конверсией доступа и контрольной группе были недостоверны.
Смена доступа положительно не сказалась на продолжительности хирургического вмешательства. Время, затраченное на операцию, составило 529,1±16,8 мин, что было сопоставимо с аналогичным показателем в основной группе и отличалось в большую сторону при сравнении с контрольной (р<0,003) (рис. 10).
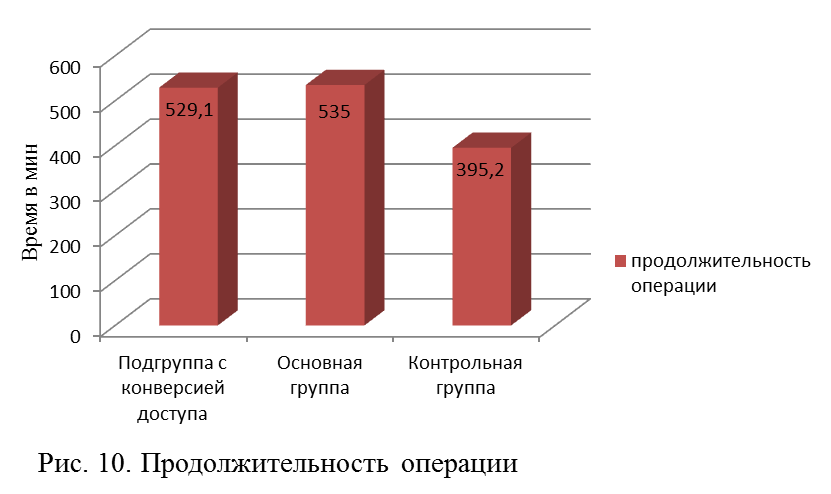
Произведено также сравнение средней продолжительности вмешательств на разных временных этапах освоения метода. До 20-го вмешательства этот показатель в среднем составлял 553 мин, тогда как у последующих 10 пациентов операция была выполнена за 497 мин (р˂0,05). При этом среднее время, затраченное на выполнение 5 последних операций, сократилось до 360 мин, а минимальная продолжительность одного из этих вмешательств составила 290 мин.
Особенности ведения больных
после лапароскопической панкреатодуоденальной резекции
Осложненное течение, связанное с операцией
Послеоперационные осложнения развились у 19 (65,5%) пациентов основной группы и у 26 (76,4%) – контрольной.
Наиболее часто в послеоперационном периоде выявляли гастростаз. Данное нарушение отмечено у 10 больных основной и 9 пациентов – контрольной группы, что составило 34,4% и 26,3% от общего числа оперированных пациентов в каждой группе (табл. 12).
Как в основной группе, так и контрольной задержка эвакуации из желудка встречалась чаще при сохранении пилорического его отдела, что составило 31% и 14,7% соответственно, тогда как при выполнении классической ПДР – 3,4% против 11,76%. Средняя продолжительность гастростаза составила 17 к/д в основной группе и 22 к/д – в контрольной.
Таблица 12
Осложнения послеоперационного периода
| ОСЛОЖНЕНИЯ | ГРУППЫ | |
| Основная n (%) | Контрольная n (%) | |
| Гастростаз | 10 (34,4%) | 9 (26,6%) |
| Несостоятельность ПЕА | 5 (17,2) | 6 (17,4) |
| Несостоятельность БДА | 1 (3,4%) | 2 (5,8%) |
| Жидкостные скопления | 2 (6,9%) | 2 (5,8%) |
| Эрозивные кровотечения | 1 (3,4%) | 3 (8,8%) |
| Гнойно-воспалительные процессы в ране | 0 (0%) | 4 (11,7%) |
| ВСЕГО | 19 (65,5%) | 26 (76,4%) |
Лучшие результаты коррекции этого осложнения в основной группе, по всей видимости, связаны с меньшей травматичностью операции и, как следствие, более быстрой реабилитацией основных функций организма, в том числе и моторно-эвакуаторных. Однако статистически эта разница была недостоверна (р>0,5).
Различий между основной и контрольной группами по числу несостоятельности ПЕА не получено (табл. 13). У 2 больных (9,5%) основной группы несостоятельность ПЕА в послеоперационном периоде привела к развитию жизнеугрожающих состояний. В одном случае развилась аррозия стенки общей печеночной артерии и тяжелое кровотечение, в другом сформировался стеноз ДЕА. В обоих случаях потребовались дополнительные оперативные вмешательства. Во втором случае операция выполнена полностью лапароскопическим способом.
Из 6 пациентов, которым в раннем послеоперационном периоде понадобилось выполнить дренирующие под контролем УЗИ и РТВ вмешательства, у 5 удалось избежать лапаротомии.
Таблица 13
Осложнения послеоперационного периода развившиеся вследствие
несостоятельности ПЕА
| ВИДЫ ОСЛОЖНЕНИЙ ПРИ НЕСОСТОЯТЕЛЬНОСТИ ПЕА | ГРУППЫ | |
| Основная n (%) | Контрольная n (%) | |
| Аррозионные кровотечения | 1 (3,4%) | 2 (5,8%) |
| Стеноз дуоденоеюноанастомоза | 1 (3,4%) | 0 (0%) |
| Ферментативный перитонит | 2 (6,8%) | 1 (2,9%) |
| Панкреатический свищ | 1 (3,4%) | 3 (8,8%) |
| ВСЕГО | 5 (17,2%) | 6 (17,4%) |
Гнойно-воспалительные изменения в послеоперационной ране полностью отсутствовали среди пациентов, которым радикальное хирургическое лечение было выполнено лапароскопическим способом. В контрольной группе эти осложнения развились в 4-х случаях (11,7%), при этом у 1 (2,94%) из больных этой группы – на фоне гнойного процесса в ране диагностирована подкожная эвентрация петель тонкой кишки, потребовавшая активной хирургической тактики.
Продолжительность раннего послеоперационного периода не имела различий и составила 23,1±2,94 к/дня в основной группе и 22,4±2,6 к/д – в контрольной.
В 4 случаях из 69 наступил летальный исход. Общая летальность составила 5,7%. В основной группе от послеоперационных осложнений умерло 2 (6,8%) пациентов. В контрольной группе также умерло 2 (5,9%) больных.
Прослеженные результаты
Повторная госпитализация больных в разные сроки после ЛПДР из-за осложнений на фоне прогрессирования основного заболевания или связанная с характером выполненного вмешательства потребовалась 5 (17,24%) пациентам, у которых операция закончена полностью эндовидеохирургическим способом и у 6 (14,28%) больных, которым операция выполнена в радикальном объеме, но из лапаротомного доступа (табл. 14).
Таблица 14
Характер осложнений и виды чрескожных вмешательств, выполненных под контролем УЗИ и РТВ при повторной госпитализации
| ХАРАКТЕР ОСЛОЖНЕНИЙ | ХАРАКТЕР ВМЕШАТЕЛЬСТВА | ЧИСЛО ОСЛОЖНЕНИЙ | |
| Основная группа (n) | Контрольная группа (n) | ||
| метастазы в воротах печени |
| 2 --- --- | 1 1 1 |
| стеноз гастроэнтероанастомоза | стентирование зоны ГЭА | 1 | --- |
| псевдокиста ПЖ | дренирование кисты | 1 | --- |
| острый панкреатит | консервативная терапия | 1 | 3 |
| Всего | 5 | 6 | |
Полноценно оценить отдаленные результаты радикального лечения не представлялось возможным из-за короткого и неравномерного по времени периода наблюдения за пациентами. Более показательными были результаты наблюдения за больными раком головки ПЖ (рис. 11).
В основной группе от прогрессирования заболевания умерло 6 пациентов с раком головки поджелудочной железы, в среднем, через 12,42±2,7 месяца. В контрольной группе через 12,23±1,92 мес. скончалось 17 больных. При сравнении кривых выживаемости этих групп с помощью логрангового критерия различия приближались к статистически значимым (р=0,077). Максимальный срок наблюдения за одной пациенткой основной группы – 49 месяцев.
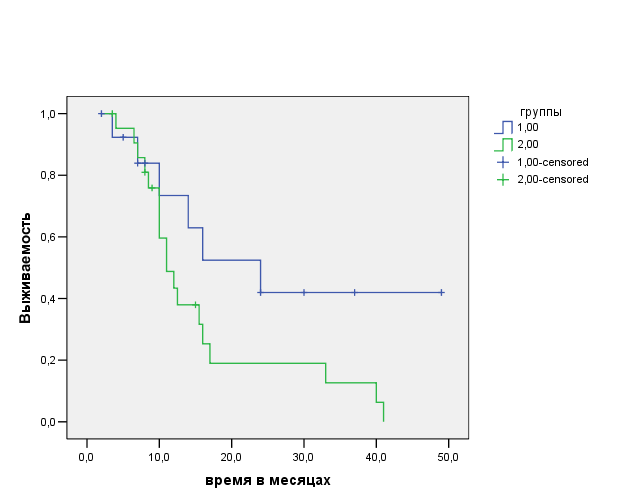
Рис. 11. Функция выживаемости для больных раком ПЖ
Основная группа (1,0), контрольная группа (2,0)
Оценить результаты лечения пациентов с заболеванием ТОХ и ДПК к настоящему моменту не представляется возможным из-за незначительного их числа в подгруппах.
Раки БСДПК как в основной, так и в контрольной группе давали самые благоприятные показатели выживаемости. Из 8 больных основной группы отдаленное метастазирование выявлено у одного. Среднее время наблюдения за этими пациентами составляет 26,6±6 мес. Среди 6 пациентов контрольной группы через 32,2±5 мес. от прогрессирования заболевания умерло 4.
В целом, проведенное исследование позволило разработать следующий алгоритм лечебно-диагностической тактики ведения больных с опухолями БПДЗ, осложненных механической желтухой (рис. 12).
Таким образом, учитывая изложенное, можно сделать вывод, что применяемый нами комплекс лечебных миниинвазивных мероприятий (интервенционно-радиологических и эндовидеохирургических) благоприятно сказывается на ближайших и отдаленных результатах не только при проведении паллиативного, но и радикального хирургического лечения у больных раком органов БПДЗ. Только преемственность малотравматичных методов на различных этапах хирургического лечения позволяет обеспечить мининвазивный, т.е. щадящий подход в лечении этой тяжелой категории больных. Продолжение работы в заданном направлении, накопление опыта и развитие новых технологий позволяет надеяться на лучшие результаты хирургического лечения в дальнейшем.
О
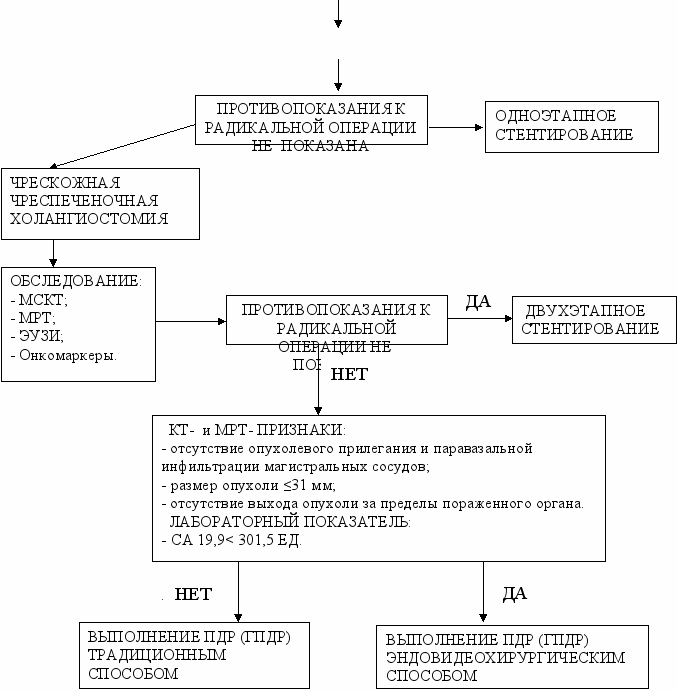 ПУХОЛЬ БПДЗ
ПУХОЛЬ БПДЗСКРИНИНГОВОЕ ОБСЛЕДОВАНИЕ
НЕТ ДА
