Молекулярно-генетический анализ генофондов редких и исчезающих видов растений пермского края
| Вид материала | Автореферат диссертации |
- Красная книга, 61.32kb.
- Венции должны содействовать восстановлению исчезающих видов, в частности, путем разработки, 98.37kb.
- Молекулярно-генетический анализ тапеторетинальной абиотрофии в республике башкортостан, 292.82kb.
- «Путешествие по регионам Большого Алтая, 177.44kb.
- Международного Союза Охраны Природы Питеру Скотту. По его инициативе в мсоп в 1949, 1423.12kb.
- Темы Вашего учебного проекта, 61.28kb.
- Правительство Республики Казахстан постановляет : Утвердить прилагаемую сохранения, 754.5kb.
- Правительство Республики Казахстан постановляет: Утвердить прилагаемую программу сохранения, 712.05kb.
- Секция: Стратегия сохранения редких и исчезающих видов наземной фауны, 135.39kb.
- Об охране окружающей среды, 2522.13kb.
5. Анализ генетического разнообразия редких видов растений с использованием оценки полиморфизма инвертированных повторов ретротранспозонов (IRAP-PCR маркеры) 5.1. Использование ДНК-маркеров на основе ретротранспозонов для анализа полиморфизма ДНК редких видов растений Для изучения генофондов редких реликтовых видов растений нами избран IRAP- (Inter-Retrotransposon Amplified Polymorphism) метод анализа полиморфизма ДНК как дающий стабильные, высоко полиморфные и четко воспроизводимые маркеры. Клонирование последовательностей ретротранспозонов осуществляли с помощью нового универсального метода (Kalendar et al., 2008), основанного на использовании ПЦР с праймерами из консервативного участка связывания tRNA (PBS, Primer Binding Site), Таблица 1 Эффективность праймеров из LTR последовательностей ретротранспозонов
непосредственно прилегающего к левому прямому повтору LTR (Long Terminal Repeats) в центральной части ретротранспозона. Для секвенирования были отобраны 96 клонов, со вставками разной длины. Для подбора праймеров с использованием программы «FastPCR» (ссылка скрыта.helsinki.fi/bi/ Programs/fastpcr.htm), секвенированные последовательности клонов были отсортированы по общей последовательности. Выявлены уникальные последовательности концевых прямых повторов LTR-ретротранспозонов. С помощью выравнивания была определена консенсус последовательность для каждого кластера LTR-последовательностей. Праймеры были подобраны на консервативных участках последовательностей LTR в обоих направлениях. Для молекулярно-генетического анализа 5 редких видов растений Пермского края (табл. 1) разработаны 70 IRAP-праймеров (Календарь и др., 2007). Нами установлено, что наиболее эффективно выявляют полиморфизм инвертированных повторов ретротранспозонов в геномах A. vernalis, A. sibirica, Ad. lilipholia, D. grandiflora, P. anomala IRAP-праймеры, обозначенные номерами 2155, 2156, 2175, 2197, 2198, 2201, 2202, 2204 (табл. 1). Установлена видовая специфичность исследованных IRAP-праймеров (Календарь и др., 2007; Боронникова, 2008). С целью апробации IRAP-метода дана оценка полиморфизма структурных элементов геномов, фланкированных инвертированными повторами ретротранспозонов, широко распространенных травянистых видов растений рода Hypericum и древесного ресурсного вида растений Populus tremula L. (Боронникова и др., 2009а). 5.2. Анализ полиморфизма IRAP-маркеров A. vernalis У A. vernalis выявлено 127 амплифицированных IRAP-методом фрагментов ДНК, из которых 118 были полиморфными ( 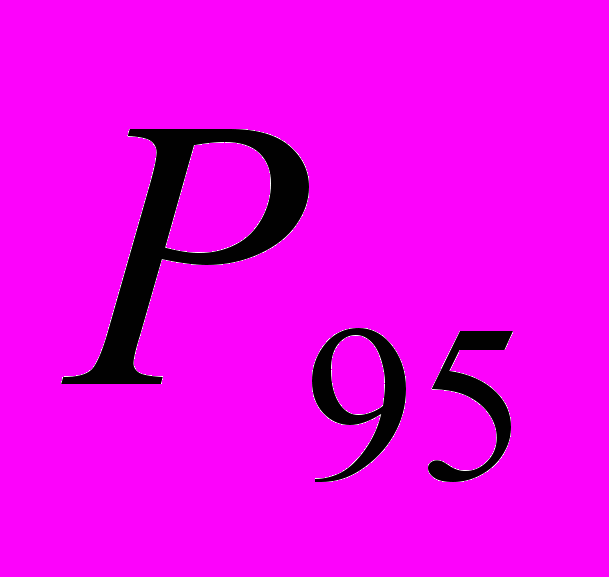 =92.91%). Число выявленных IRAP-маркеров в общей выборке растений варьировало в зависимости от праймера от 19 (праймер 2202) до 31 (праймер 2197). В среднем при IRAP-анализе один праймер инициировал у A. vernalis синтез 25 фрагментов ДНК (рис. 4). =92.91%). Число выявленных IRAP-маркеров в общей выборке растений варьировало в зависимости от праймера от 19 (праймер 2202) до 31 (праймер 2197). В среднем при IRAP-анализе один праймер инициировал у A. vernalis синтез 25 фрагментов ДНК (рис. 4). 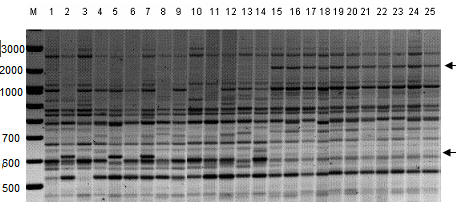 Рис. 4. IRAP-спектр популяции A. vernalis (Аv1) c праймером 2095: цифрами обозначены номера проб, М - молекулярный маркер, стрелками указаны некоторые полиморфные фрагменты ДНК Число полиморфных фрагментов A. vernalis варьировало от 17 до 30, а их размеры – от 190 до 2900 пн. Ожидаемая гетерозиготность по локусам ( 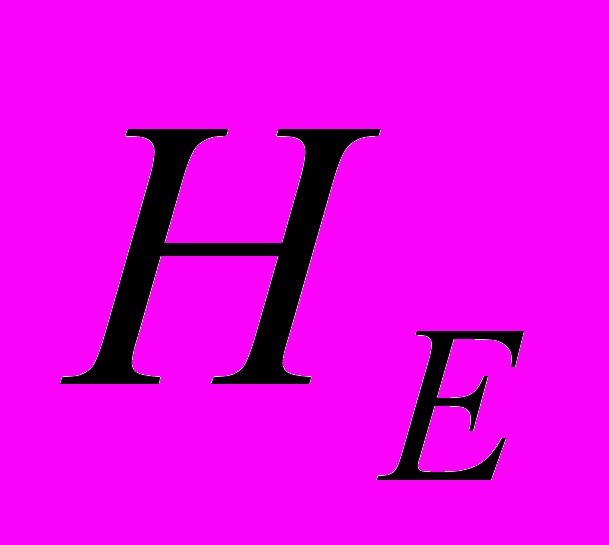 ) составила 0.291. Эти показатели наиболее высоки в Av5, а минимальны – в Av1. Абсолютное число аллелей на локус ( ) составила 0.291. Эти показатели наиболее высоки в Av5, а минимальны – в Av1. Абсолютное число аллелей на локус (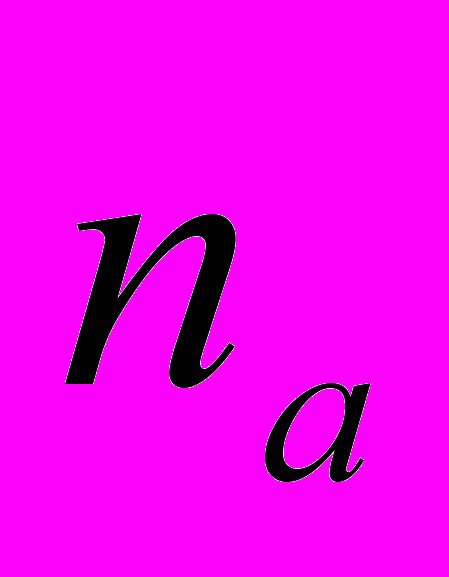 ) на общую выборку A. vernalis составило 1.992, эффективное число аллелей на локус ( ) на общую выборку A. vernalis составило 1.992, эффективное число аллелей на локус (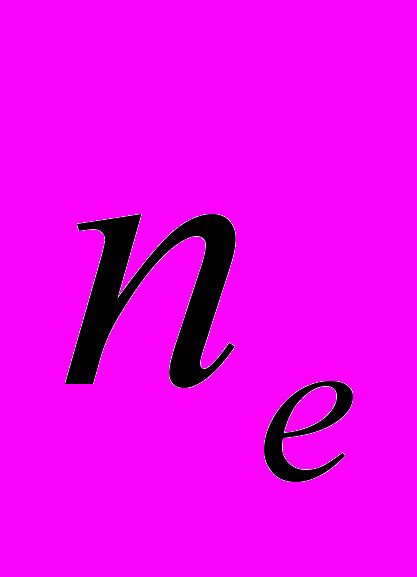 ) – 1.497. Число редких аллелей варьировало по популяциям от 2 (Av2) до 13 (Av4), а на общую выборку равно 8 (6.29%). Отмечены уникальные фрагменты ДНК, например, в Av2 – Avu1500IR75. ) – 1.497. Число редких аллелей варьировало по популяциям от 2 (Av2) до 13 (Av4), а на общую выборку равно 8 (6.29%). Отмечены уникальные фрагменты ДНК, например, в Av2 – Avu1500IR75.Ожидаемая доля гетерозиготных генотипов на всю подразделенную популяцию A. vernalis ( 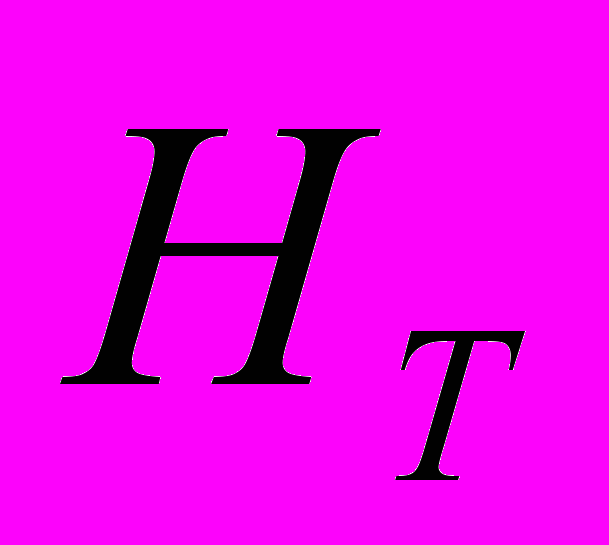 ), определенная на основании полиморфизма IRAP-маркеров, равна 0.305, а в субпопуляциях ( ), определенная на основании полиморфизма IRAP-маркеров, равна 0.305, а в субпопуляциях ( ) – 0.225. Коэффициент подразделенности популяций ( ) – 0.225. Коэффициент подразделенности популяций ( ) продемонстрировал, что на межпопуляционную компоненту генетического разнообразия A. vernalis приходится 26.13% разнообразия. Среднее значение индексов разнообразия Шеннона в изученных популяциях A. vernalis, рассчитанное по IRAP-праймерам, составило 33.83%. Выше этот показатель в Av5. На долю внутрипопуляционного генетического разнообразия A. vernalis приходится 72.15%, а на долю межпопуляционного – 27.85%. Итак, при IRAP-анализе оба подхода к определению генетического разнообразия (коэффициент подразделенности популяций ( ) продемонстрировал, что на межпопуляционную компоненту генетического разнообразия A. vernalis приходится 26.13% разнообразия. Среднее значение индексов разнообразия Шеннона в изученных популяциях A. vernalis, рассчитанное по IRAP-праймерам, составило 33.83%. Выше этот показатель в Av5. На долю внутрипопуляционного генетического разнообразия A. vernalis приходится 72.15%, а на долю межпопуляционного – 27.85%. Итак, при IRAP-анализе оба подхода к определению генетического разнообразия (коэффициент подразделенности популяций ( ) и индекс разнообразия Шеннона ( ) и индекс разнообразия Шеннона (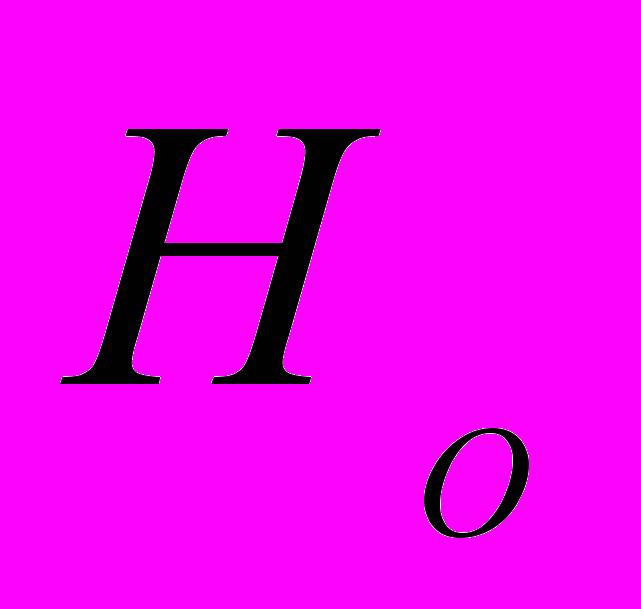 )) у изученного вида дали близкие результаты. )) у изученного вида дали близкие результаты. Таким образом, самые низкие показатели генетического разнообразия, определенные на основании полиморфизма IRAP-маркеров, отмечены в первой популяции A. vernalis (Av1) ( 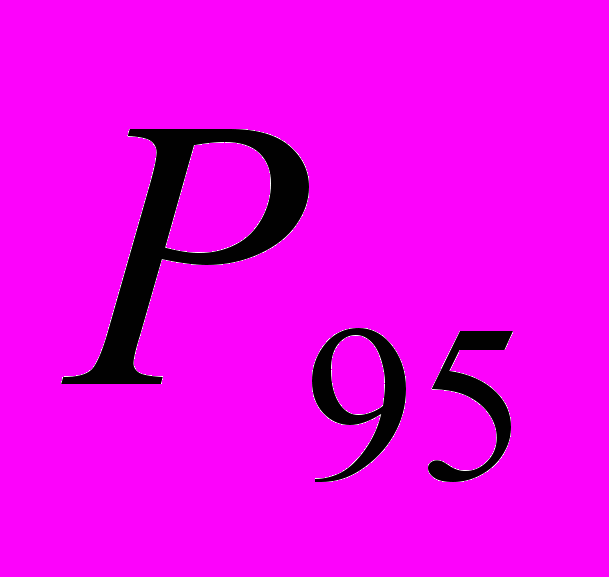 =58.26%; =58.26%; 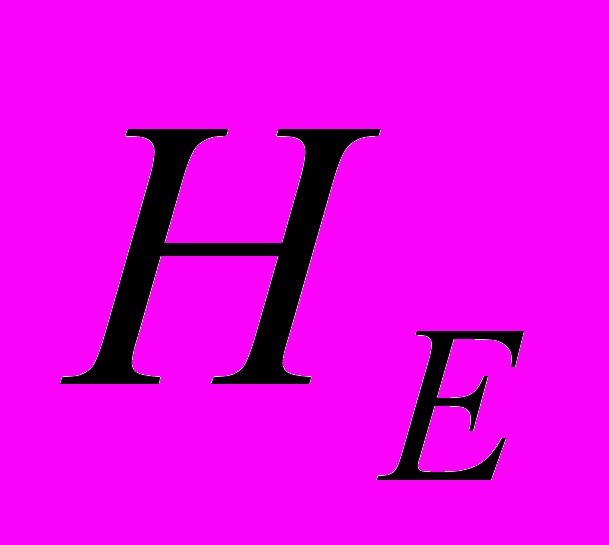 =0.177; =0.177; 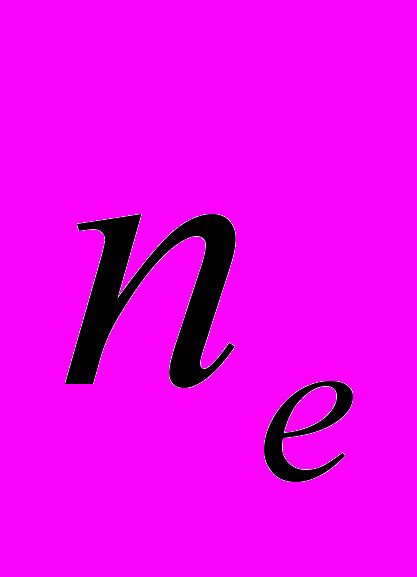 =1.281), а самые высокие показатели –в Av5 ( =1.281), а самые высокие показатели –в Av5 (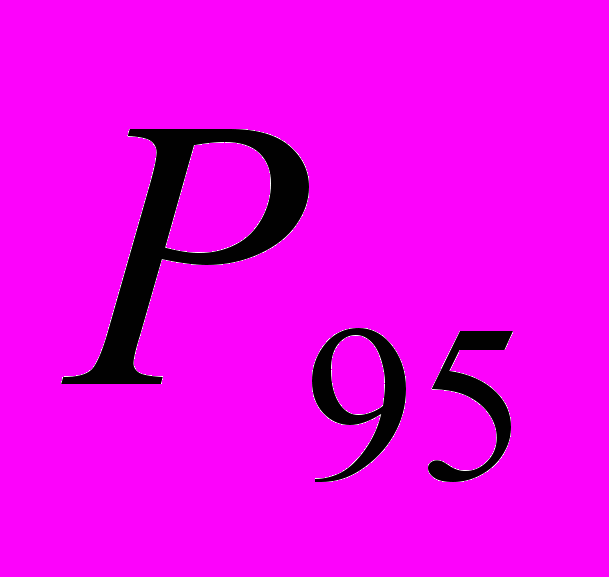 =77.16%; =77.16%; 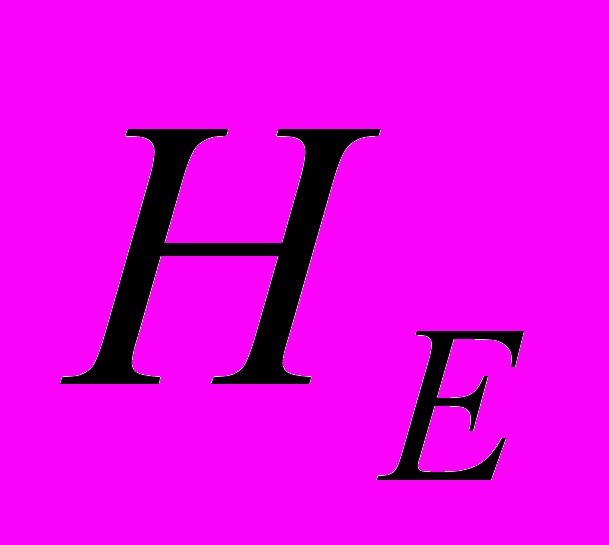 =0.270; =0.270; 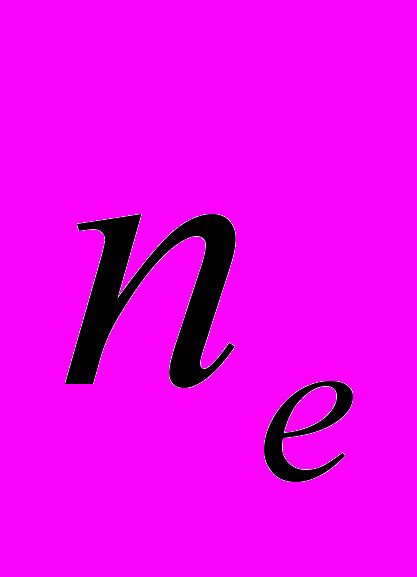 =1.445). =1.445).5.3. Анализ полиморфизма IRAP-маркеров A. sibirica При анализе фрагментов ДНК, амплифицированных в результате ПЦР с IRAP-праймерами, у A. sibirica выявлено 92 амплифицированный фрагмент ДНК, из которых 74 были полиморфными. Доля полиморфных локусов у A. sibirica составила (при 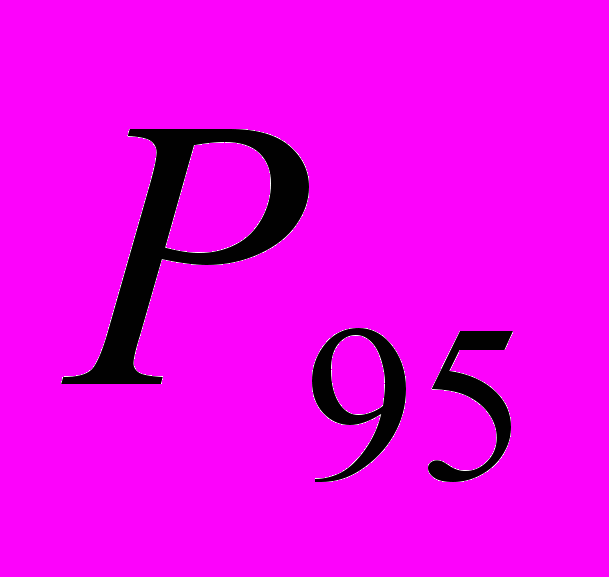 ) 80.43%. Число амплифицированных фрагментов ДНК варьировало в зависимости от праймера от 21 (праймер 2175) до 12 (праймер 2202), а их размеры – от 270 до 2980 пн. В среднем при IRAP-анализе у A. sibirica один праймер инициировал синтез 18.4 фрагментов ДНК. Наибольшую долю полиморфных локусов выявил праймер 2204 (93.33%), а наименьшую – праймер 2202 (66.66%). Высокий полиморфизм IRAP-маркеров характерен для As3 (61.96%). Резкое снижение данного показателя (34.78%) отмечено в As1 также как и при анализе полиморфизма ISSR-маркеров. Ожидаемая гетерозиготность ( ) 80.43%. Число амплифицированных фрагментов ДНК варьировало в зависимости от праймера от 21 (праймер 2175) до 12 (праймер 2202), а их размеры – от 270 до 2980 пн. В среднем при IRAP-анализе у A. sibirica один праймер инициировал синтез 18.4 фрагментов ДНК. Наибольшую долю полиморфных локусов выявил праймер 2204 (93.33%), а наименьшую – праймер 2202 (66.66%). Высокий полиморфизм IRAP-маркеров характерен для As3 (61.96%). Резкое снижение данного показателя (34.78%) отмечено в As1 также как и при анализе полиморфизма ISSR-маркеров. Ожидаемая гетерозиготность ( ) в общей выборке равна 0.360, выше данный показатель в As3 (0.235). Самое низкое значение ) в общей выборке равна 0.360, выше данный показатель в As3 (0.235). Самое низкое значение  отмечено в As1 (0.143). Абсолютное ( отмечено в As1 (0.143). Абсолютное (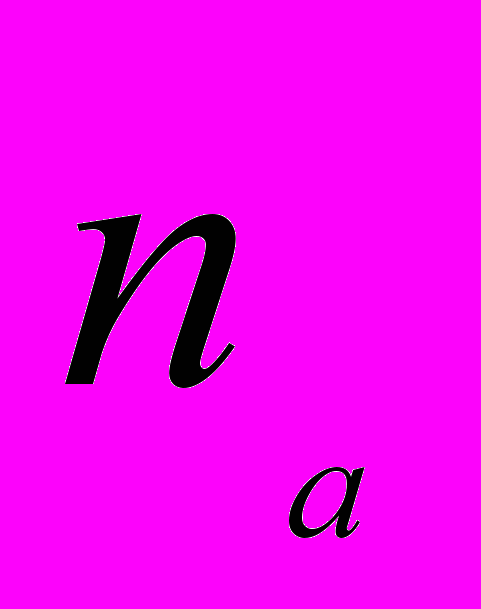 ) и эффективное ( ) и эффективное (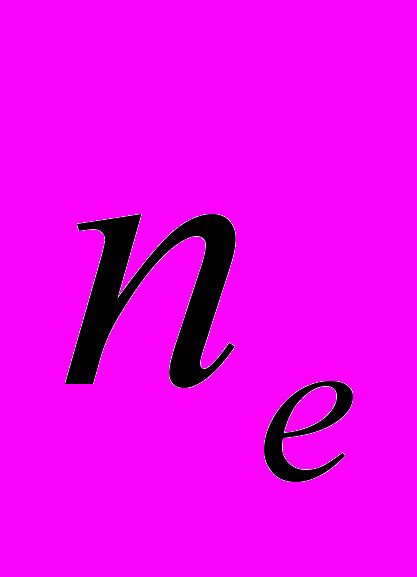 ) число аллелей на локус выше также в As2 и As3, а самые низкие значения данного показателя отмечены (также как и при ISSR-анализе) в As1. Наибольшее число редких аллелей ( ) число аллелей на локус выше также в As2 и As3, а самые низкие значения данного показателя отмечены (также как и при ISSR-анализе) в As1. Наибольшее число редких аллелей (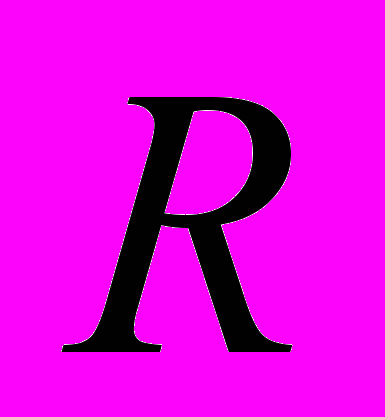 =5) отмечено в As3. =5) отмечено в As3. Ожидаемая доля гетерозиготных генотипов на всю подразделенную популяцию A. sibirica (общее генное разнообразие ( 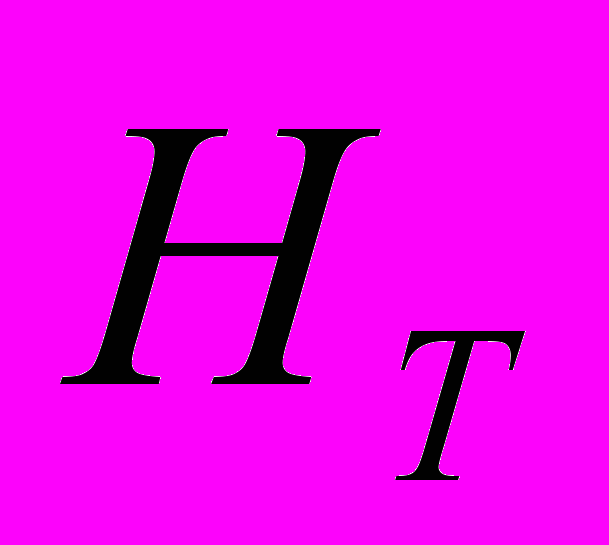 )) равна 0.336, а ожидаемая доля гетерозиготных генотипов в субпопуляциях (среднее выборочное генное разнообразия по всем локусам ( )) равна 0.336, а ожидаемая доля гетерозиготных генотипов в субпопуляциях (среднее выборочное генное разнообразия по всем локусам ( )) – 0.207. Коэффициент подразделенности популяций ( )) – 0.207. Коэффициент подразделенности популяций ( ) высок и составил 0.385. Изученные популяции сильно дифференцированы, так как 38.47% разнообразия приходится на межпопуляционную и 61.53% – на внутрипопуляционную изменчивость. Оценка генетического разнообразия посредством индекса Шеннона ( ) высок и составил 0.385. Изученные популяции сильно дифференцированы, так как 38.47% разнообразия приходится на межпопуляционную и 61.53% – на внутрипопуляционную изменчивость. Оценка генетического разнообразия посредством индекса Шеннона (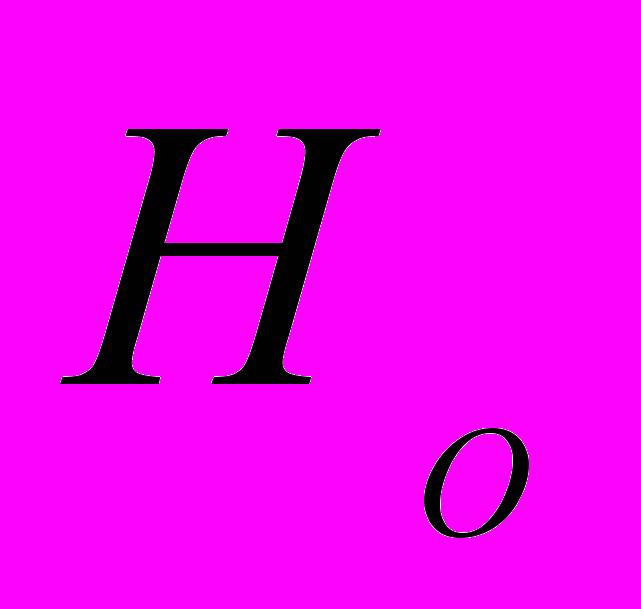 ) дала сходные результаты – на долю внутрипопуляционного генетического разнообразия A. sibirica приходится 58.30%, а на долю межпопуляционного – 41.70%. Наименьшее генетическое расстояние между исследуемыми популяциями A. sibirica, рассчитанное на основе IRAP-анализа, отмечено между As1 и As2 (0.165), наиболее генетически удаленными являются As1 и As3 (0.345). Итак, генетико-популяционные исследования с использованием IRAP-метода анализа полиморфизма ДНК выявили неоднородность генофондов редкого реликтового вида A. sibirica. Самые высокие показатели генетического разнообразия характерны для As3 ( ) дала сходные результаты – на долю внутрипопуляционного генетического разнообразия A. sibirica приходится 58.30%, а на долю межпопуляционного – 41.70%. Наименьшее генетическое расстояние между исследуемыми популяциями A. sibirica, рассчитанное на основе IRAP-анализа, отмечено между As1 и As2 (0.165), наиболее генетически удаленными являются As1 и As3 (0.345). Итак, генетико-популяционные исследования с использованием IRAP-метода анализа полиморфизма ДНК выявили неоднородность генофондов редкого реликтового вида A. sibirica. Самые высокие показатели генетического разнообразия характерны для As3 (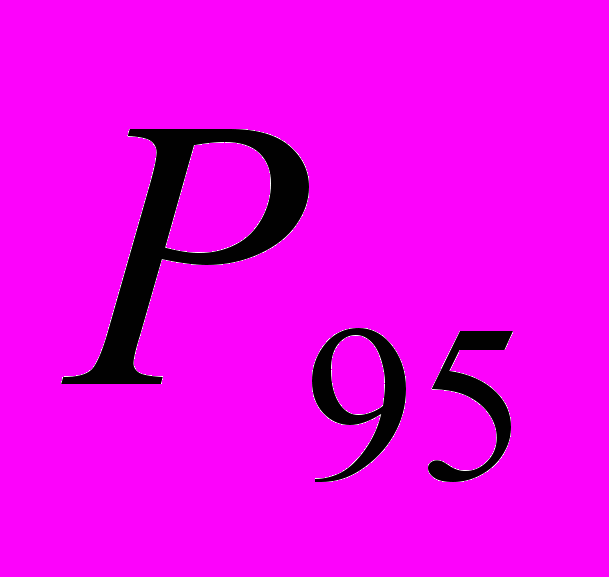 =62.50%; =62.50%; 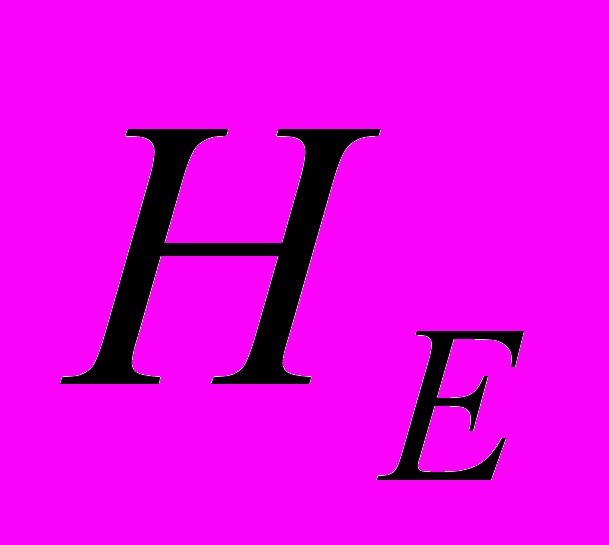 =0.350; =0.350; 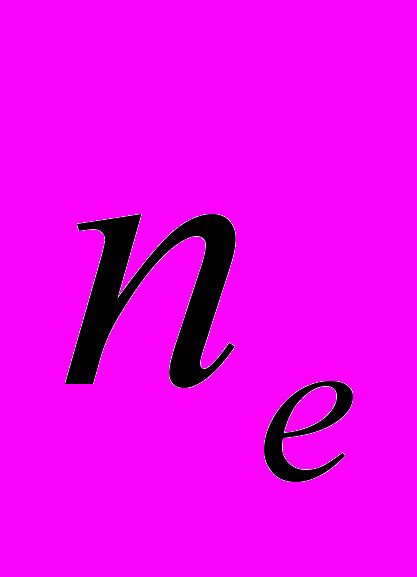 =1,409). Деградация генофонда при снижении численности популяции и сильном антропогенном воздействии отмечена у As1 ( =1,409). Деградация генофонда при снижении численности популяции и сильном антропогенном воздействии отмечена у As1 (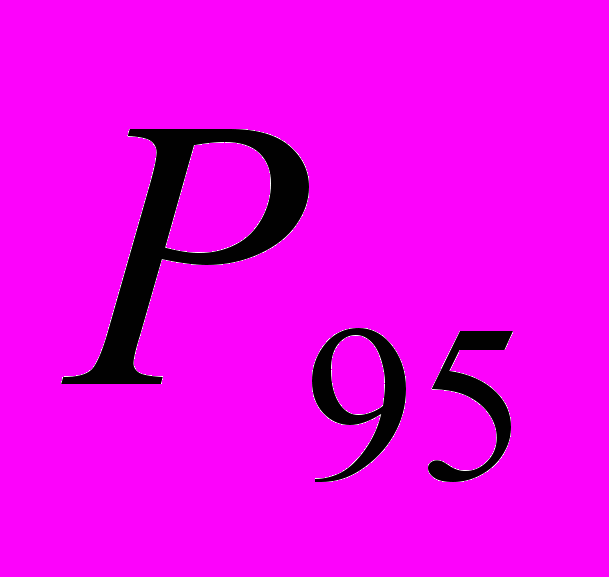 =33.65%; =33.65%; 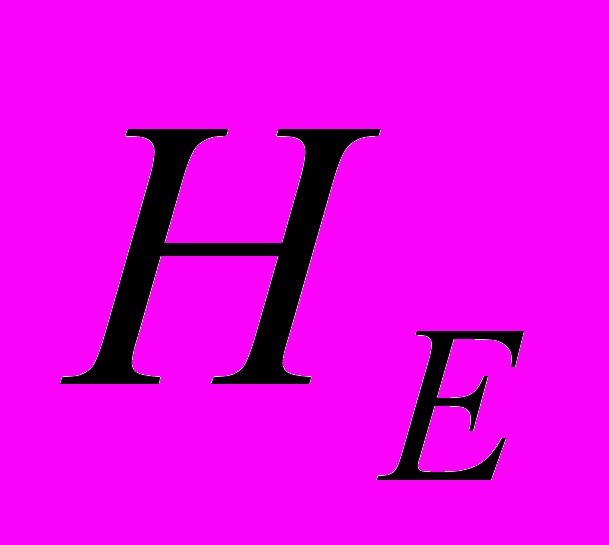 =0.143; =0.143; 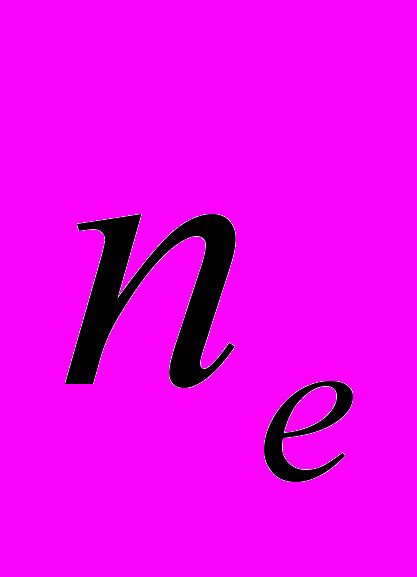 =1.253). Необходимо осуществление экстренных мер охраны данной популяции. =1.253). Необходимо осуществление экстренных мер охраны данной популяции. Таким образом, использование ДНК-фингерпринтинга на основе ретротранспозонов оказалось весьма эффективным для оценки внутри- и межпопуляционного генетического разнообразия популяций редких и исчезающих видов растений и определения характеристик их генофондов. 6. Молекулярно-генетическая паспортизация редких видов растений 6.1. Методика молекулярно-генетической паспортизации Методика молекулярно-генетической паспортизации редких и исчезающих видов растений разработана нами на примере природных популяций двух видов растений A. vernalis и A. sibirica (Боронникова, 2008, 2009а). Она включает в себя 7 этапов: выбор эффективных методов анализа полиморфизма ДНК, сбор материала, подбор эффективных праймеров, молекулярно-генетический анализ с использованием ПЦР, выявление идентификационных (мономорфных и полиморфных) маркеров ДНК, составление молекулярно-генетической формулы, штрих-кода и генетического паспорта. На первом этапе разработки методики была решена задача выбора эффективных стабильных молекулярных маркеров, позволяющих выявить высокий уровень полиморфизма ДНК, анализировать большую часть генома растений, получить четко воспроизводимые результаты. Всем этим требованиям отвечают ISSR- и IRAP-маркеры. На втором этапе паспортизации в природных популяциях двух видов рода Adonis собраны фрагменты листьев и из них выделена ДНК. На третьем этапе были отобраны наиболее информативные 4 ISSR- и 5 IRAP-праймеров, с помощью которых выявлены ISSR- и IRAP-маркеры у двух видов рода Adonis. Проведен ПЦР анализ выделенных проб ДНК. На четвертом этапе для двух видов рода Adonis выявлены 17 мономорфных и 20 полиморфных фрагментов ДНК. Четко воспроизводимые при амплификации у особей одного рода фрагменты ДНК названы нами «родовыми», а у особей одного вида – «видовыми». Как родовые, так и видовые фрагменты ДНК являются мономорфными и, в основном, установлены с использованием ISSR-метода. Полиморфные фрагменты ДНК (при их различных сочетаниях) позволили составить уникальную генетическую формулу популяции. На пятом этапе маркеры ДНК, избранные для паспортизации, представили в виде молекулярно-генетической формулы. Нами предложена новая оригинальная запись фрагмента ДНК с указанием типа фрагмента (родовой, видовой, полиморфный), длины фрагмента и указания праймера нижним индексом, например, Asv1510IR75 (табл. 2). Таблица 2 Молекулярно-генетическая паспортизация популяций A. vernalis и A. sibirica
Первыми буквами названия рода (AD) мы обозначили. родовые идентификационные фрагменты ДНК с указателем «r» от «rod» нижним индексом, например, ADr550Х11. Видовые идентификационные фрагменты обозначены как Av и As с указанием «v» от «vid», например, Avv830M12. Полиморфные фрагменты ДНК предлагается обозначить индексом «p» от «polimorph», например, Avp650IR75.. Для паспортизации популяций видов рода Adonis было отобрано по 4 родовых и видовых фрагментов ДНК, а также от 1 до 4 полиморфных фрагментов ДНК, сочетания которых специфичны для исследуемых популяций (табл. 2). Это минимальное число фрагментов ДНК, с помощью которых нам удалось провести паспортизацию. Гетерогенные природные популяции можно охарактеризовать разными сочетаниями полиморфных фрагментов ДНК, причем главную роль будут играть полиморфные фрагменты, амплифицированные IRAP-методом. Сочетания полиморфных фрагментов ДНК не совпадают ни у одной из изученных популяций.
Рис. 5. Молекулярно-генетический штрих-код популяции A. vernalis (Av1) Ординского района: AD r – фрагменты ДНК, общие для видов A.vernalis и A. sibirica; Avv – фрагменты ДНК, характерные для A. vernalis;Avp – полиморфные фрагменты ДНК Родовые фрагменты предлагается обозначить толстой линией, видовые – линией средней толщины, а полиморфные фрагменты – тонкой линией. Для штрих-кода предлагается использовать от 10 до 12 штрихов, из которых четыре характерны для рода, четыре – для вида, а от 1 до 4 – для популяции. Фрагменты ДНК в штрих-коде располагаются в зависимости от их длины от большего к меньшему. Как молекулярно-генетическая формула (табл. 2), так и штрих-код (рис. 5), позволят идентифицировать принадлежность как растительного сырья, так и отдельных особей не только к роду и виду, но и к определенной популяции изученных видов редких реликтовых растений. Генофонд популяции документируется в виде формул и штрих-кода, отражающих состав аллелей в отдельных локусах генома. На седьмом этапе молекулярно-генетической паспортизации рекомендуется составление генетического паспорта популяции. Нами разработана форма генетического паспорта популяции редкого вида растений, избраны общепринятые показатели состояния популяций и генетического разнообразия (Боронникова, 2009е). 6.2. Молекулярно-генетическая паспортизация видов рода Digitalis Для молекулярно-генетической паспортизации видов рода Digitalis выявлены четко воспроизводимые 11 мономорфных и 12 полиморфных маркеров ДНК (Боронникова, 2009е), которые обозначены первыми тремя буквами латинского названия рода, например – DIGr460M1. Мономорфные фрагменты ДНК, характерные для вида, обозначены как Dgv520X9, а полиморфные – Dgp650IR55. Основная характеристика молекулярного маркера – его длина указана большими буквами после указания типа фрагмента – Dpv750M12. В молекулярно-генетической формуле приведены тип и номер праймера нижним индексом. Например, Dgp810IR58 амплифицирован IRAP-методом посредством праймера под номером 2158. При ISSR-анализе праймер можно записать в виде короткой формулы, например, Dgр1210(АGС)6C. Для составления молекулярно-генетической формулы популяций видов рода Digitalis в соответствии с методикой отобрано традиционно по 4 родовых и видовых маркеров (табл. 3); а также от 1 до 4 маркеров, сочетания которых специфичны для исследуемых популяций. Таблица 3 Молекулярно-генетическая паспортизация видов рода Digitalis
Для генетической паспортизации исследованных популяций использованы от 10 до 12 молекулярных маркеров. Молекулярно-генетическая формула популяции Dg2, к примеру, записывается следующим образом: DIGr1260X9; DIGr640IR97; DIGr550X10; DIGr460M1; Dgv1020X9; Dgv1000IR01; Dgv950X10; Dgv520X9; Dgp1110М9; Dgp810IR58; Dgp650IR55; Dgp260IR59. Результаты молекулярно-генетической паспортизации популяций D. grandiflora представленные в виде молекулярно-генетической формулы и штрих-кода, внесены наряду с общепринятыми показателями состояния популяций и характеристиками их генофондов в генетические паспорта (Боронникова, 2009е). 6.3. Молекулярно-генетическая паспортизация видов рода Adenophora Для паспортизации двух видов рода Adenophora (Ad. lilifolia и Ad. triphylla) были выделены четко воспроизводимые 11 мономорфных и 11 полиморфных маркеров ДНК. В соответствии с разработанной методикой были отобраны по 4 фрагмента ДНК, общих и специфических для двух видов этого рода. Составлены молекулярно-генетические формулы и штрих-коды 4-х изученных популяций Ad. lilifolia. Например, запись молекулярно-генетической формулы первой популяции (Ad.lil.1) такова: Adr1610IR59; Adr840X10; Adr400M8; Adr370IR96; Ad.lilv1220IR96; Ad.lilv1050M8; Ad.lilv920X11; Ad.lilv440IR56; Ad.lilp1100IR57; Ad.lilp920M1; Ad.lilp760IR59; Ad.lilp670IR56. Данные об изученных популяциях Ad. lilifolia и характеристики их генофондов внесены в генетические паспорта. С использованием разработанной методики молекулярно-генетической паспортизации составлены молекулярно-генетические формулы и штрих-коды 22 популяций 12 видов растений (Боронникова, 2009в, 2009д). 7. Концепция идентификации и оценки состояния генофондов редких и исчезающих видов растений 7.1. Характеристика генофондов на основании анализа полиморфизма ISSR- и IRAP-маркеров Изучение генофондов редких видов растений с использованием молекулярных маркеров ДНК опирается на оценки количественных характеристик генетического разнообразия популяций. Одной из основных количественных характеристик является процент (или доля) полиморфных локусов. Избранные для анализа состояния генофондов ISSR- и IRAP-маркеры являются высоко полиморфными, так как в зависимости от вида выявляют от 56 до 111 ISSR-маркеров и от 92 до 127 IRAP маркеров. В среднем 1 праймер выявляет 17.6 при ISSR-анализе и 22.5 фрагментов ДНК при IRAP- анализе. Общее число выявленных у 4-х редких видов растений ISSR-маркеров составило 350, а IRAP-маркеров – 450. Для проведения молекулярно-генетического анализа 4-х редких видов растений проанализированы 88 978 ампликонов. Как следует из приведенных данных, IRAP-метод позволяет выявить большее число молекулярных маркеров. Стабильность избранных для изучения маркеров подтверждается их воспроизводимостью при повторных ПЦР. В совокупности избранные нами для изучения ISSR- и IRAP-маркеры позволяют характеризовать полиморфизм большей части геномов как широко распространенных так и избранных для изучения редких реликтовых видов растений и установить основные показатели генетического разнообразия популяций, таких как процент полиморфных локусов ( 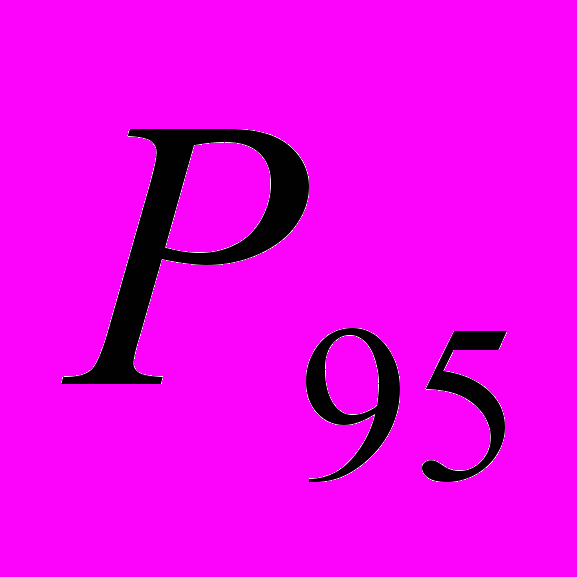 ), ожидаемая гетерозиготность ( ), ожидаемая гетерозиготность (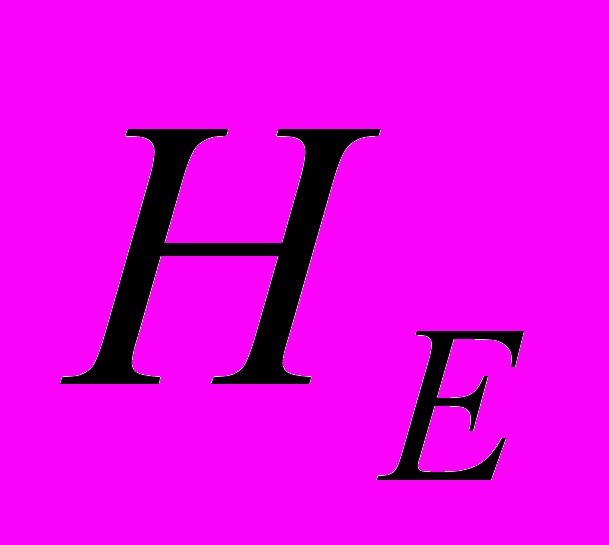 ), абсолютное ( ), абсолютное (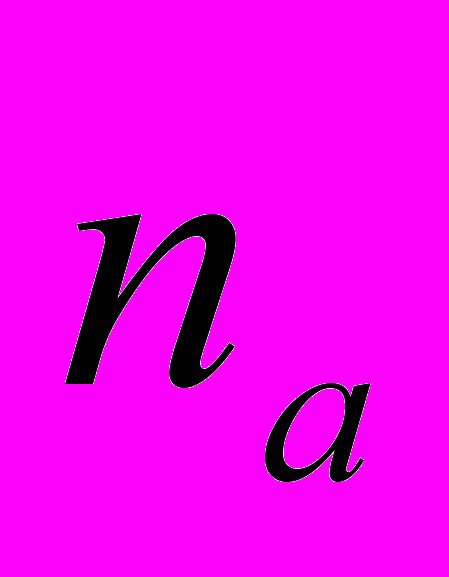 ) и эффективное ( ) и эффективное (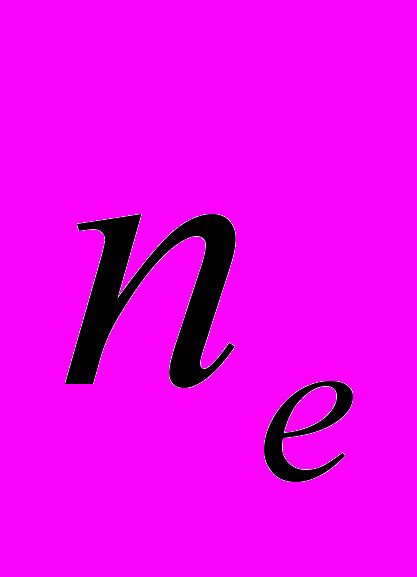 ) число аллелей, коэффициент внутрипопуляционного разнообразия (μ), число ( ) число аллелей, коэффициент внутрипопуляционного разнообразия (μ), число (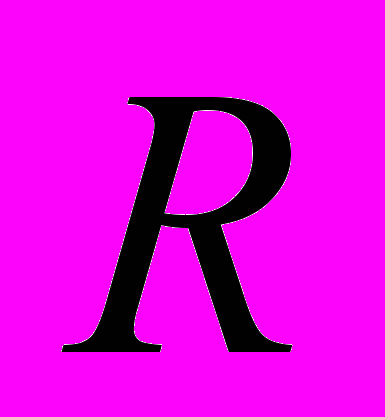 ) и долю ( ) и долю (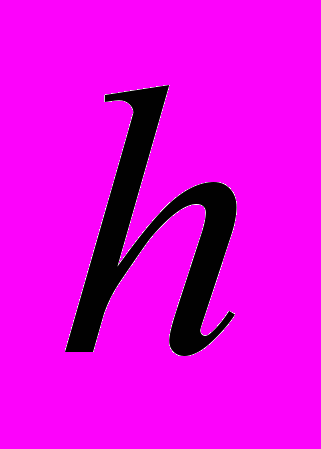 ) редких аллелей. ) редких аллелей. Таким образом, нами на большом фактическом материале убедительно доказано, что для оценки генетического разнообразия популяций редких и исчезающих видов растений эффективным является использование ДНК- фингерпринтинга (полилокусных спектров) высоко полиморфных и стабильных ISSR- и IRAP-маркеров. 7.2. Принципы множественного молекулярно-генетического геномного маркирования Изученные редкие реликтовые виды растений послужили моделью для разработки и создания концепции идентификации генофондов на основании оценок полилокусного сочетания моно- и полиморфных участков ДНК. Тандемно организованные повторяющиеся последовательности ДНК различных типов широко представлены в эукариотических геномах. Они варьируют по длине кластера и размеру повторяющегося звена. Среди них наиболее полиморфными являются минисателлитные и микросателлитные ДНК, а также ретротранспозоны. Основные принципы множественного молекулярно-генетического маркирования таковы: - использование высоко полиморфных молекулярных маркеров, основанных на широко представленных в геномах тандемных повторах; - использование не менее двух типов молекулярных маркеров ДНК, основанных на различных структурных повторяющихся элементах генома; - один из используемых молекулярных маркеров должен быть основан на вариабельных элементах генома, например, мобильных генетических элементах – ретротранспозонах; - оценка полилокусного сочетания моно- и полиморфных участков ДНК; - выявление общих (идентификационных) для рода и вида мономорфных фрагментов ДНК и характеристика популяционных генофондов посредством сочетание полиморфных фрагментов ДНК; - обобщение характеристик генофондов в виде молекулярно-генетической формулы, штрих-кода и генетического паспорта. 3. Оптимизация сохранения генофондов редких видов растений посредством их молекулярно-генетической паспортизации и идентификации Методика молекулярно-генетической паспортизации на основе ISSR- и IRAP-маркеров имеет высокую разрешающую способность, дает стабильно воспроизводимые результаты, характеризуется высоким уровнем стандартизации, как набора маркеров, так и техники выполнения анализа. Именно использование IRAP- вместе с ISSR-маркерами позволило нам провести паспортизацию гетерогенных природных популяций редких реликтовых видов растений. Разработанная методика молекулярно-генетической паспортизации популяций редких реликтовых видов растений предлагается в качестве ключевого звена технологии идентификации генофондов редких и исчезающих видов растений, которая позволит установить уровень и состав генетического разнообразия на популяционном уровне, выявить популяции с типичными и специфическими характеристиками генофондов, рекомендовать научно обоснованные меры их сохранения, то есть оптимизировать процедуру сохранения генофондов наиболее уязвимых в растительных сообществах редких и исчезающих видов растений. Эта технология является одним из подходов оптимизации сохранения генетической компоненты биоразнообразия растительных сообществ. 7.4. Показатели генетической дифференциации популяций Специфической особенностью редких реликтовых видов растений являются низкие показатели численности их популяций. Влияние общей, репродуктивной и эффективной численности популяций на показатели генетического разнообразия изучено на примере 10 популяций A. vernalis, которые распределены по показателю общей численности в две группы: популяции с низкой (Av3, Av6, Av7, Av8, Av10) и высокой (Av1,Av2, Av4, Av5, Av9) общей численностью. Нами установлено, что эффективную численность или эффективный размер популяций данного вида составляют, в основном, средневозрастные генеративные особи ( 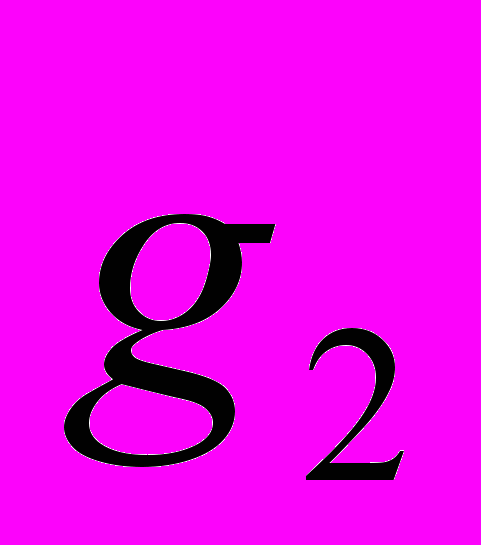 ). ). Высокая линейная корреляция достоверно установлена между долей средневозрастных генеративных особей ( 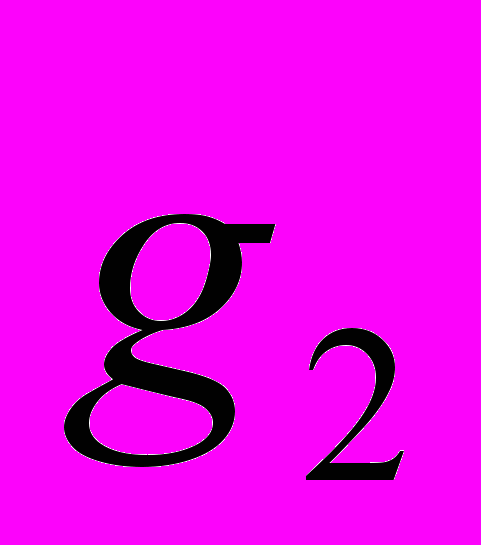 ) и индексом разнообразия Шеннона ( ) и индексом разнообразия Шеннона (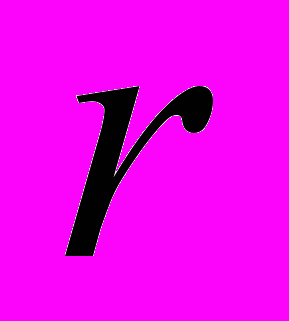 =0.958; =0.958; 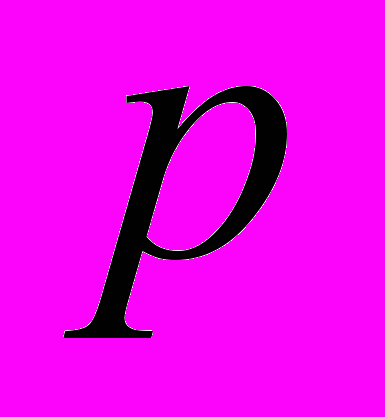 =0.0001), ожидаемой гетерозиготностью ( =0.0001), ожидаемой гетерозиготностью (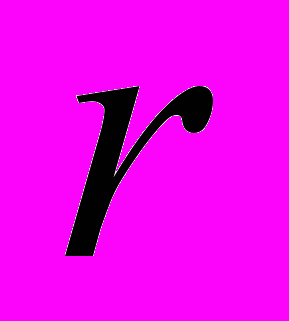 =0.963 и =0.963 и 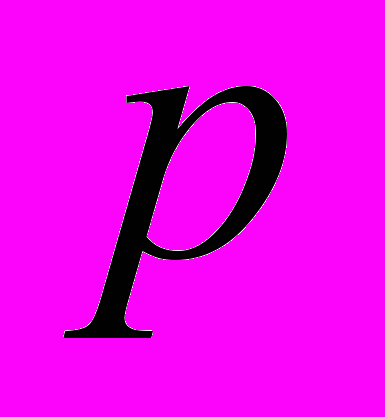 =0.002) и числом эффективных аллелей ( =0.002) и числом эффективных аллелей (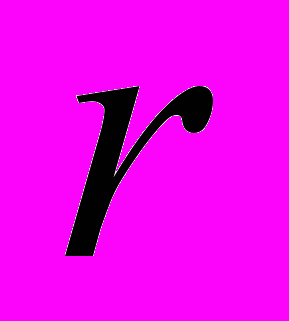 =0.970, и =0.970, и 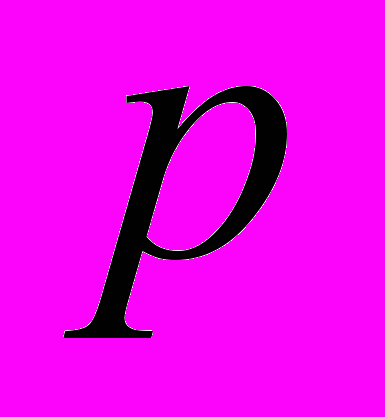 =0.001). Аналогичная картина наблюдается, если сравнить данные показатели отдельно в популяциях с низкой и высокой общей численностью. =0.001). Аналогичная картина наблюдается, если сравнить данные показатели отдельно в популяциях с низкой и высокой общей численностью. При изучении генетической структуры подразделенной популяции установлено, что в популяциях с высокой общей численностью коэффициент подразделеной популяции ( 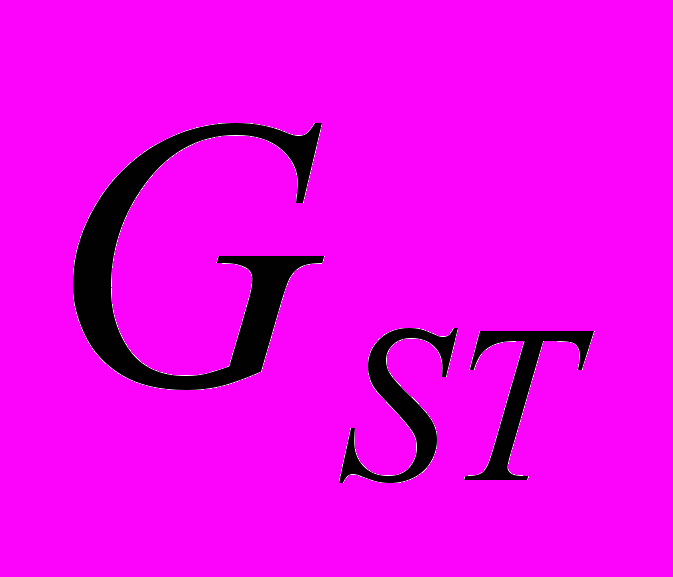 ) составил 0.169, а в популяциях с низкой общей численностью – 0.371. Нами достоверно ( ) составил 0.169, а в популяциях с низкой общей численностью – 0.371. Нами достоверно ( (1.77) > (1.77) > 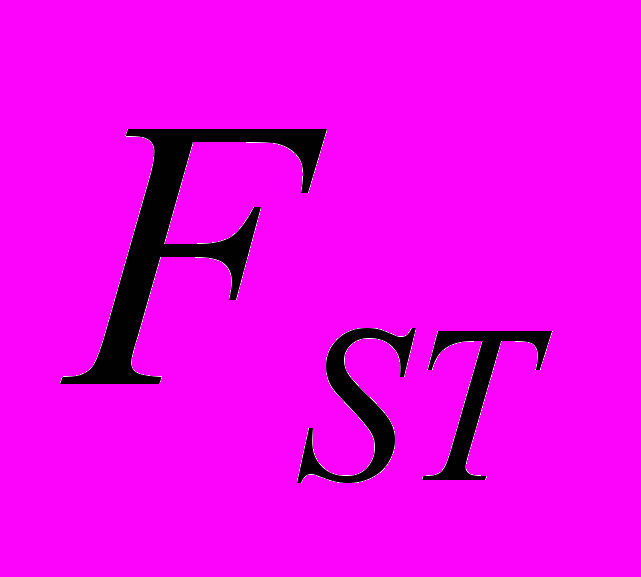 (1.39)) установлено, что популяции A. vernalis с низкой общей численностью дифференцированы в большей степени. (1.39)) установлено, что популяции A. vernalis с низкой общей численностью дифференцированы в большей степени. Таким образом, с учетом специфики редких реликтовых видов растений рекомендуемые нами генетико-статистические параметры позволяют установить характеристики их генофондов и дают адекватные и стабильные оценки генетической дифференциации популяций. 7.5. Отбор объектов для сохранения и меры охраны генофондов редких реликтовых видов растений Для отбора в качестве объектов сохранения генофондов рекомендуются локальные группы популяций с наиболее типичными характеристиками генофондов, такие как популяции A. vernalis, расположенных в центральной части островной Кунгурской лесостепи: Av4 ( 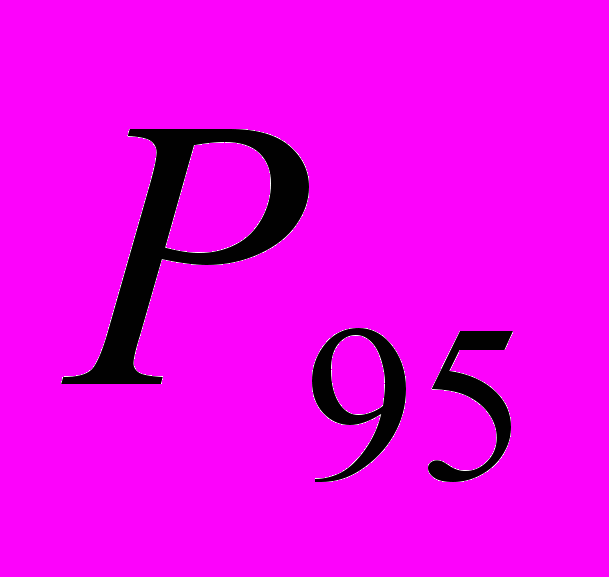 =61.47%; =61.47%; 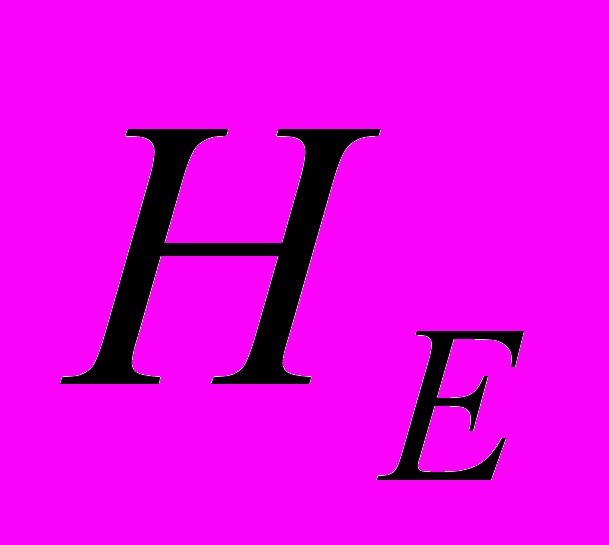 =0.243; =0.243; 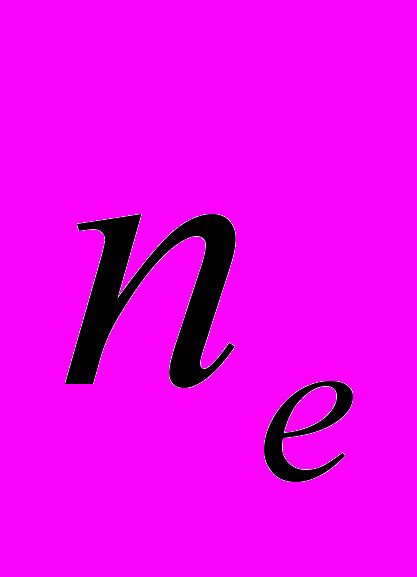 =1.423; μ=1.539; =1.423; μ=1.539; 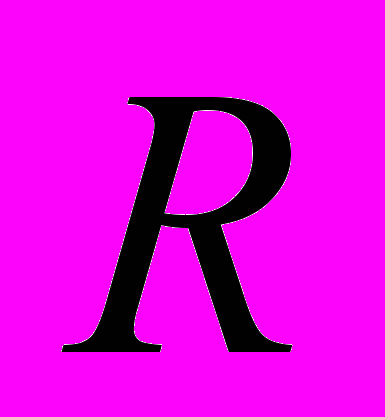 =0); Av5 ( =0); Av5 (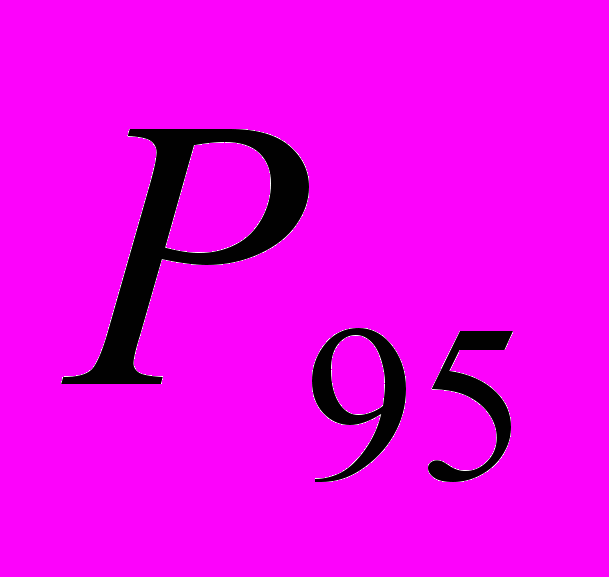 =57.80%; =57.80%; 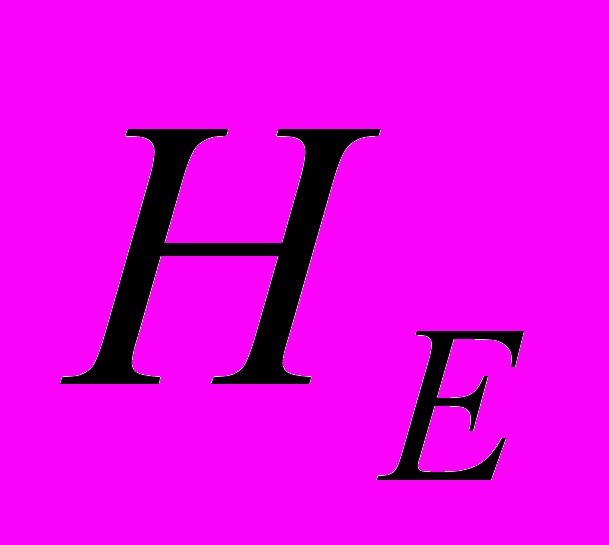 =0.222; =0.222; 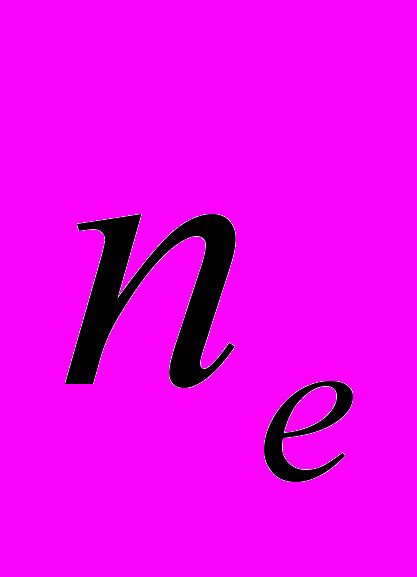 =1.380; μ=1.527; =1.380; μ=1.527; 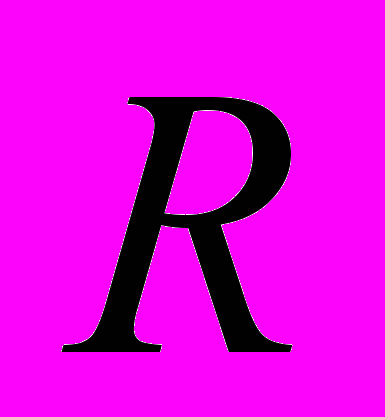 =4); Av6 ( =4); Av6 (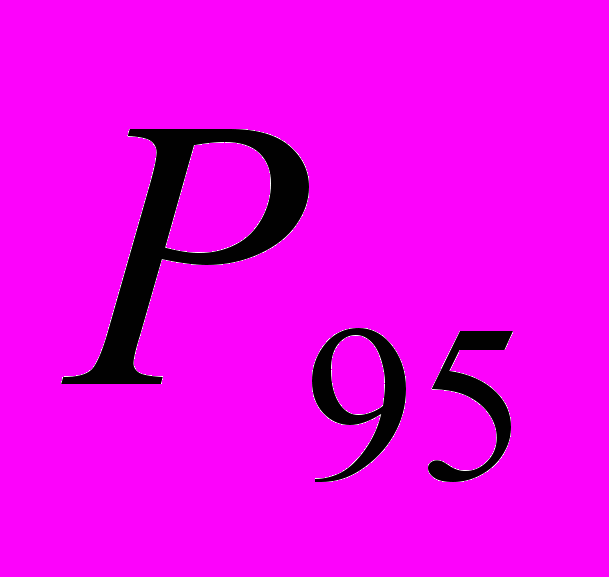 =62.39%; =62.39%; 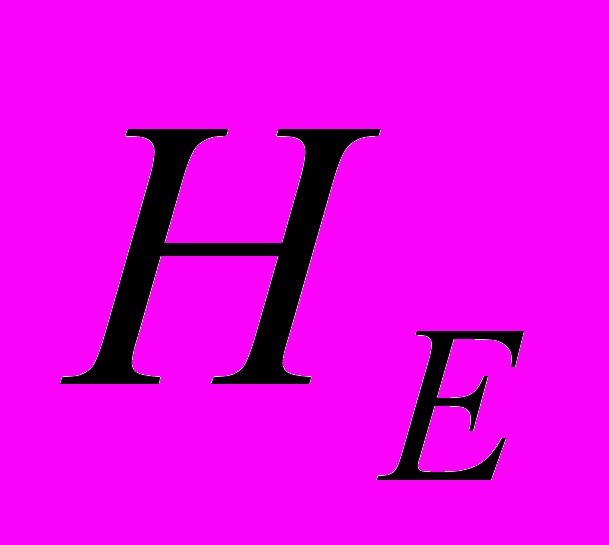 =0.232; =0.232; 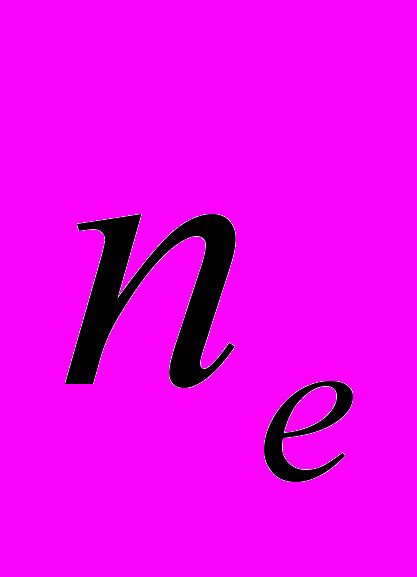 = 1.389; = 1.389; μ=1.580; μ=1.580; 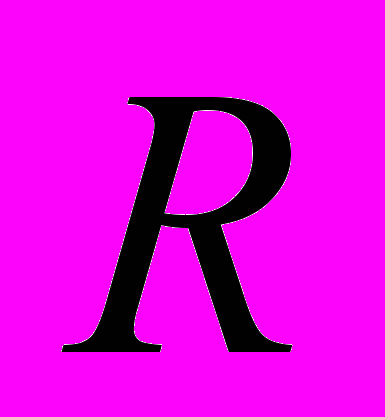 =8). Кроме этого для сохранения генофондов в качестве генетически более гетерогенных рекомендуются отдельные популяции: A. sibirica – As3 Ильинского района ( =8). Кроме этого для сохранения генофондов в качестве генетически более гетерогенных рекомендуются отдельные популяции: A. sibirica – As3 Ильинского района (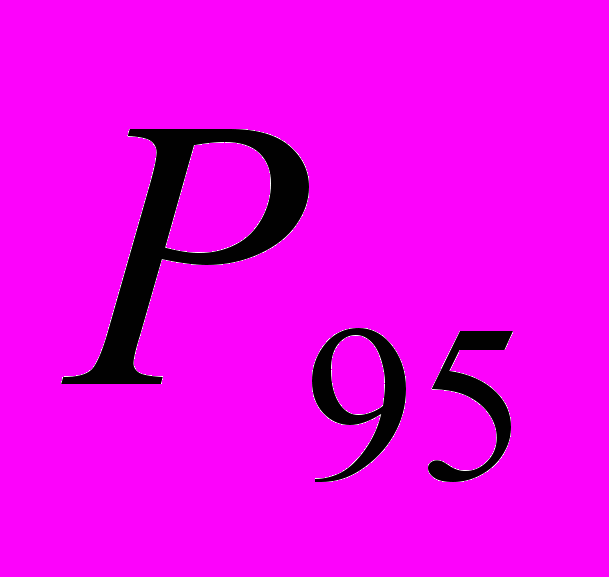 =81,08%; =81,08%; 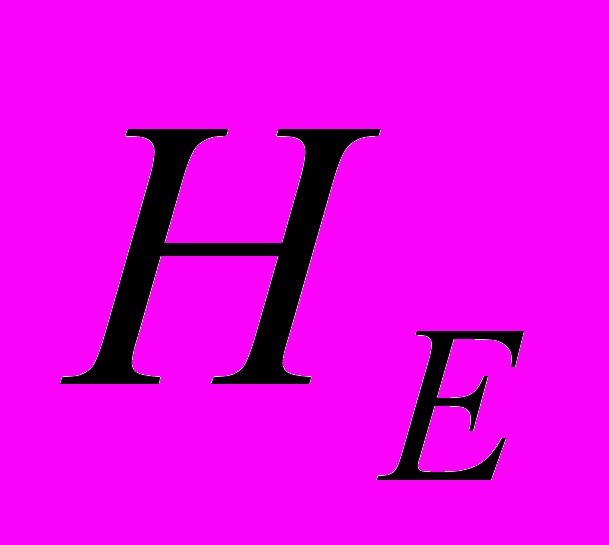 =0,235; =0,235; 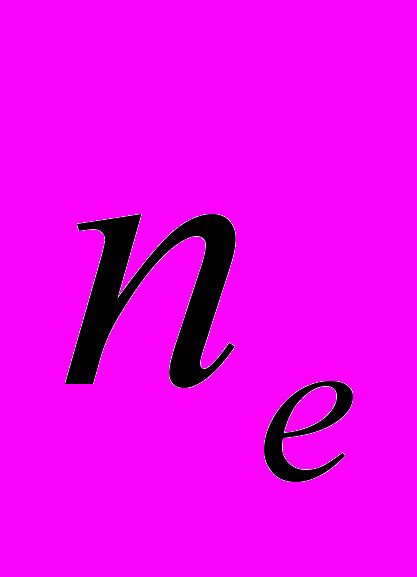 =1,409; =1,409; 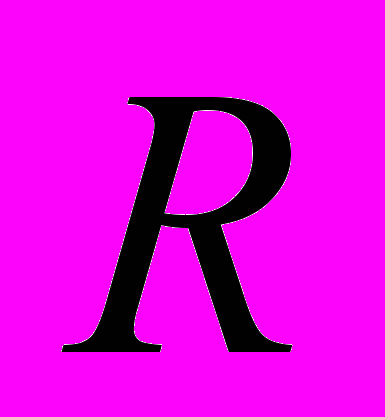 =11), Ad. lilifolia – Ad.lil.3 Ординского района ( =11), Ad. lilifolia – Ad.lil.3 Ординского района (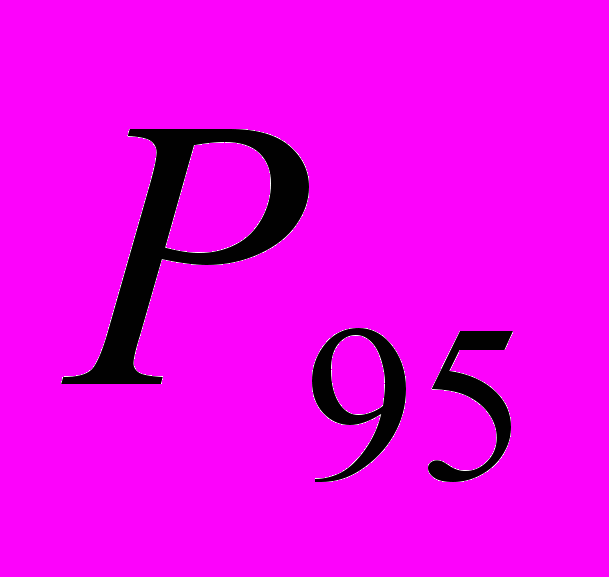 =75.00%; =75.00%; 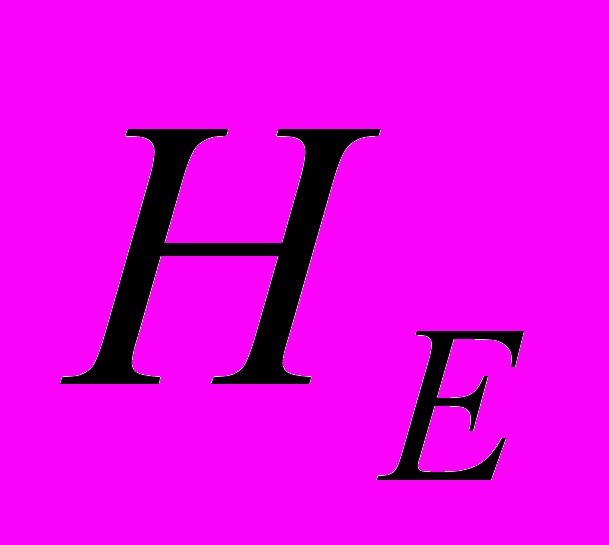 =0,275; =0,275; 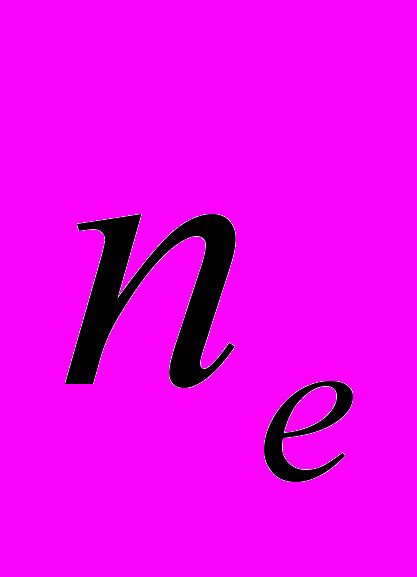 =1,462; μ=1.685; =1,462; μ=1.685; 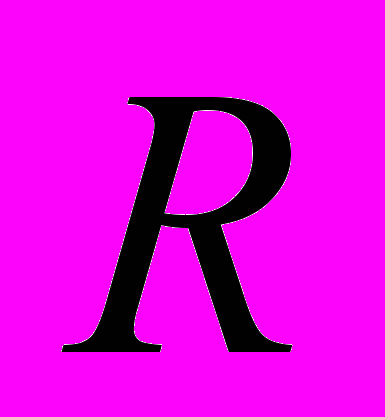 =0), D. grandiflora – Dg2 Кунгурского района ( =0), D. grandiflora – Dg2 Кунгурского района (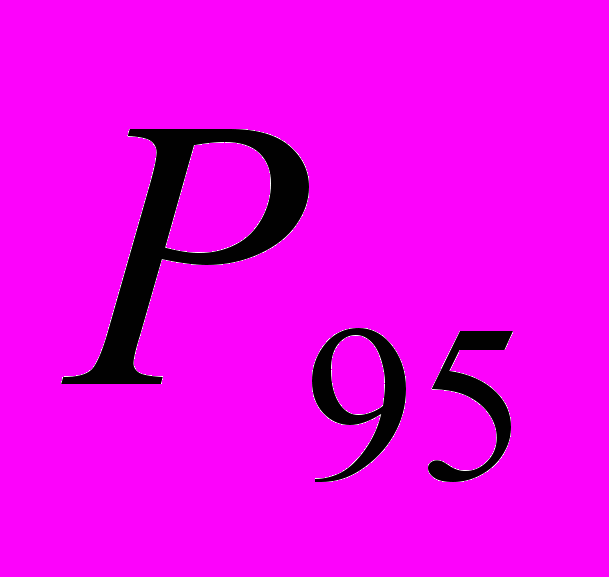 =66.36%; =66.36%; 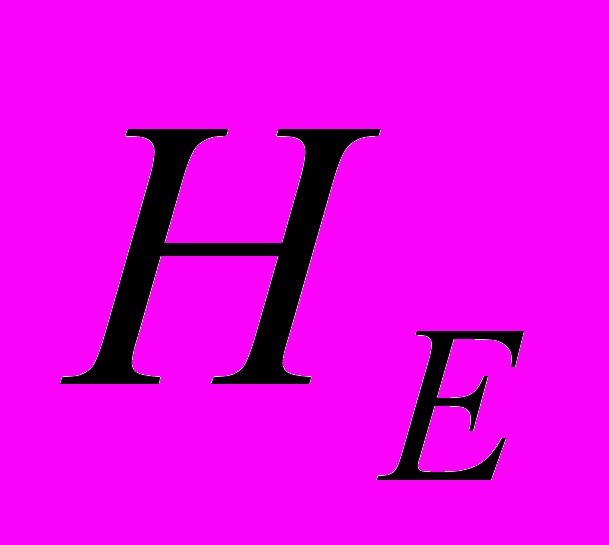 =0,182; =0,182; 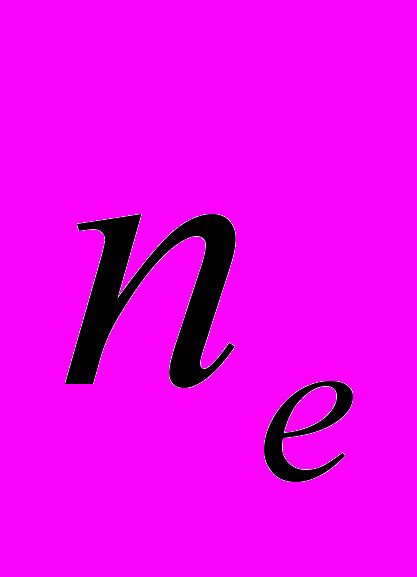 =1,784; μ=1.760; =1,784; μ=1.760; 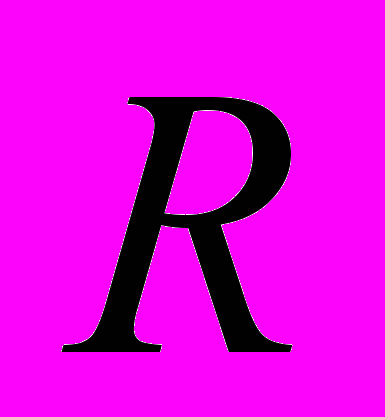 =14). К объектам сохранения со специфичными характеристиками генофондов, то есть со специфическими сочетаниями полиморфных локусов, относятся: самая северная (Av2) популяция A. vernalis на Спасской горе ( =14). К объектам сохранения со специфичными характеристиками генофондов, то есть со специфическими сочетаниями полиморфных локусов, относятся: самая северная (Av2) популяция A. vernalis на Спасской горе (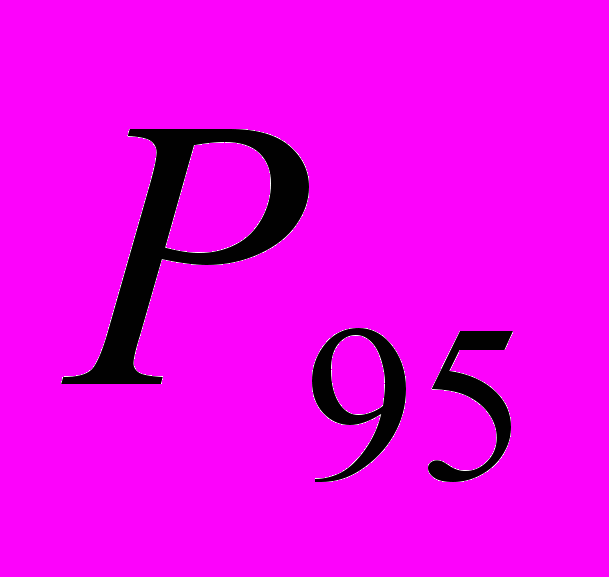 =34.86%; =34.86%; 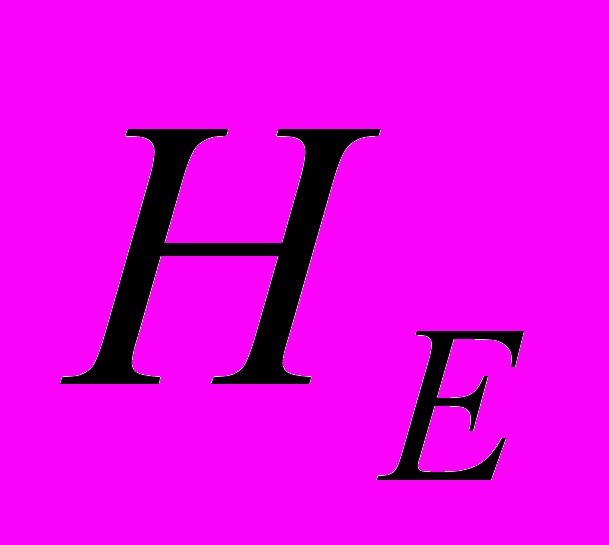 =0.122; =0.122; 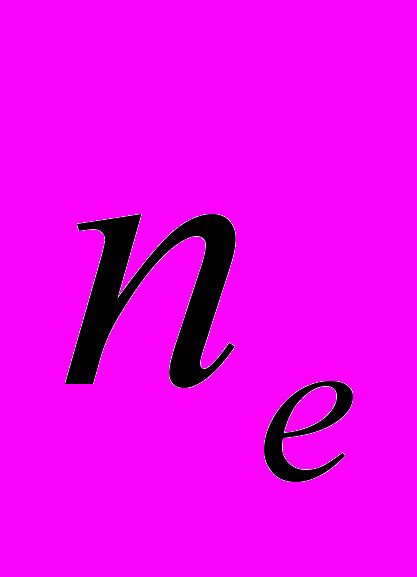 =1.199; =1.199; 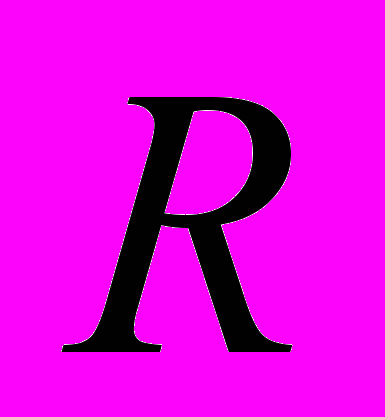 =7), Av1 ( =7), Av1 (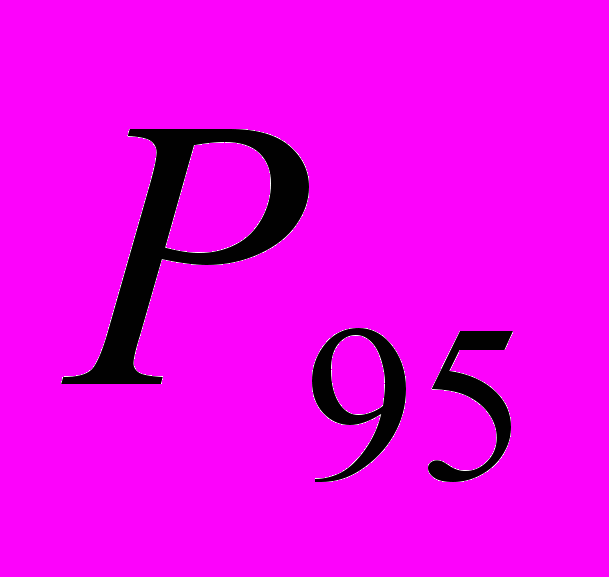 =58.26%; =58.26%; 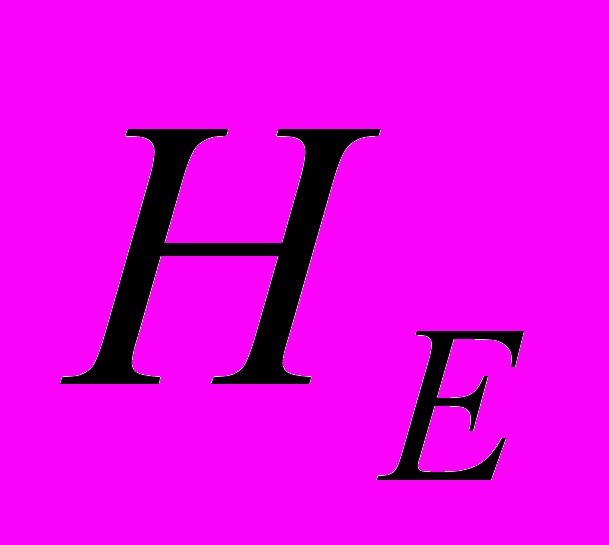 =0.177; =0.177; 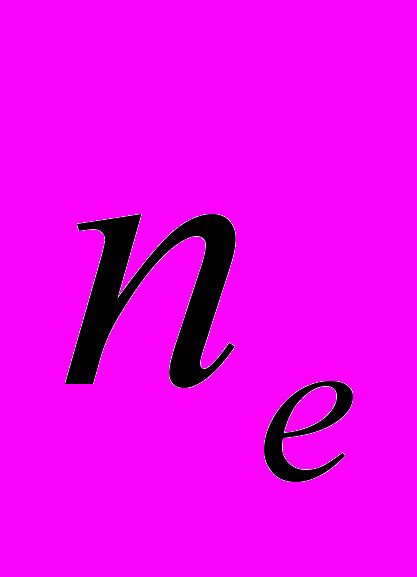 =1.281; =1.281; 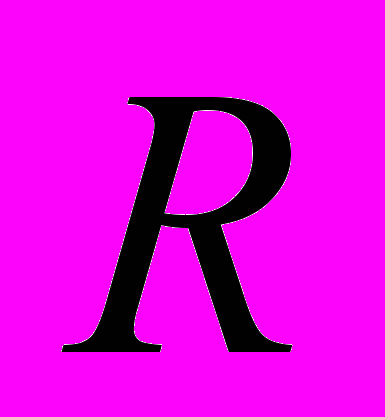 =4) Dg3 ( =4) Dg3 (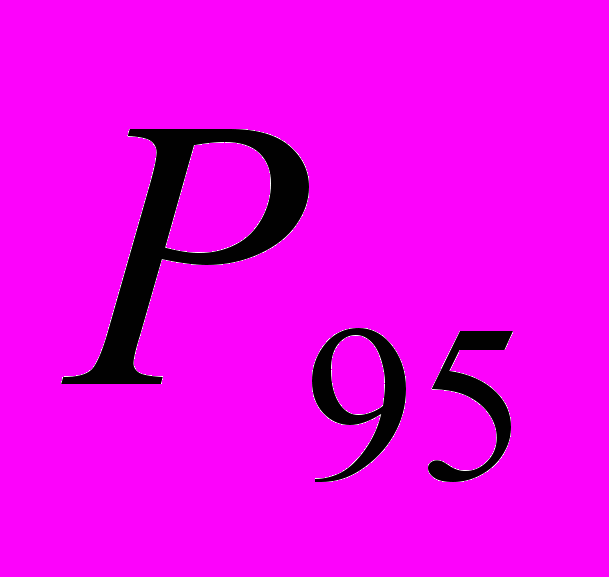 =50.45%; =50.45%; 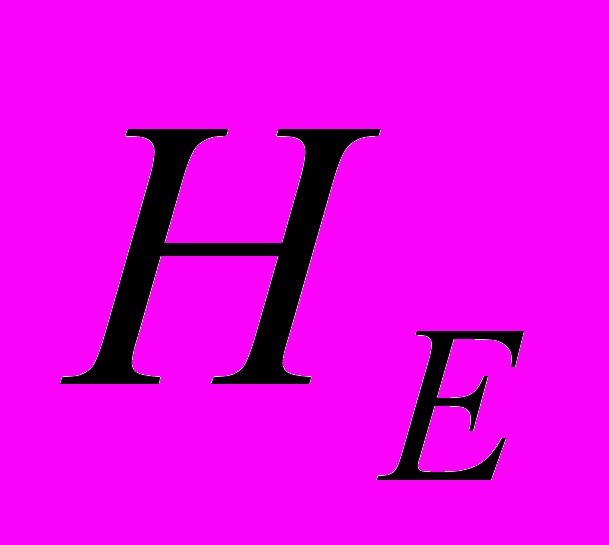 =0,1810; =0,1810; 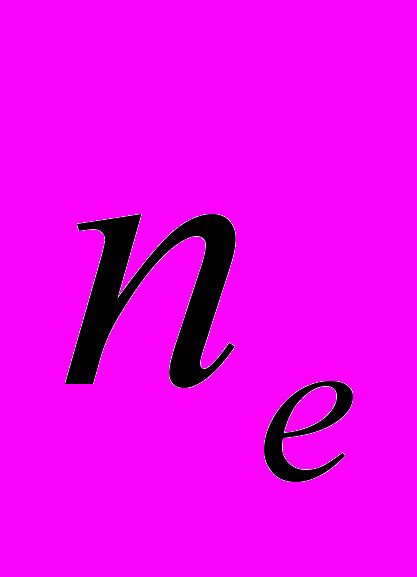 =1,2807; =1,2807; 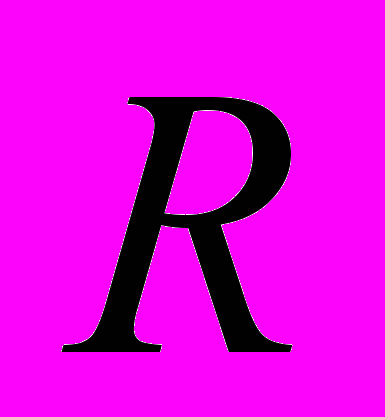 =17), расположенные в островной Кунгурской лесостепи, а также Ad.lil.1 ( =17), расположенные в островной Кунгурской лесостепи, а также Ad.lil.1 (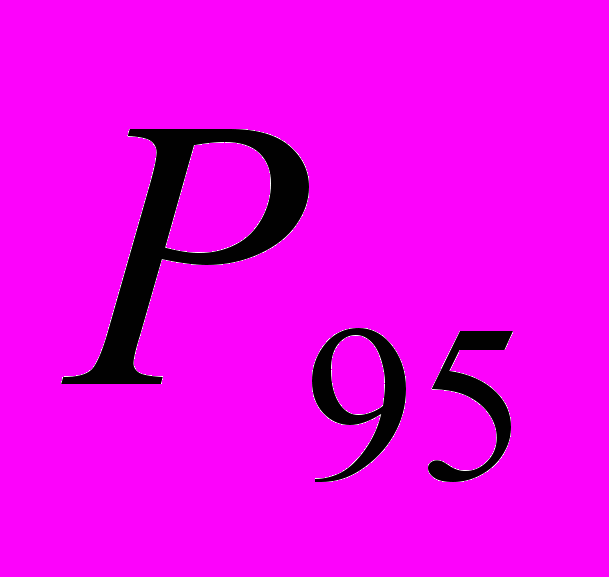 =80.36%; =80.36%; 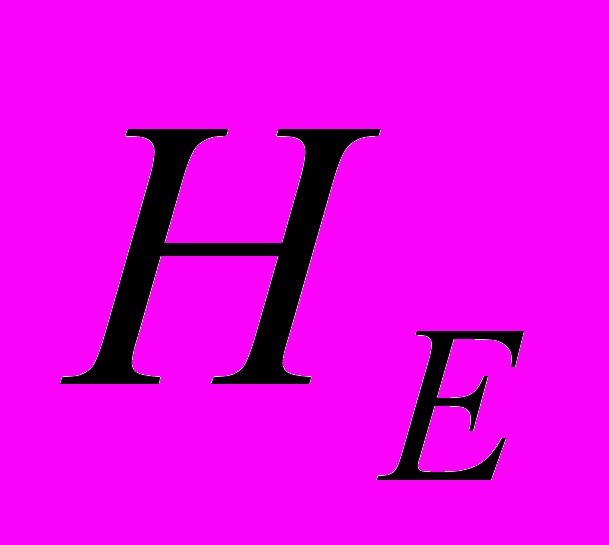 =0.250; =0.250; 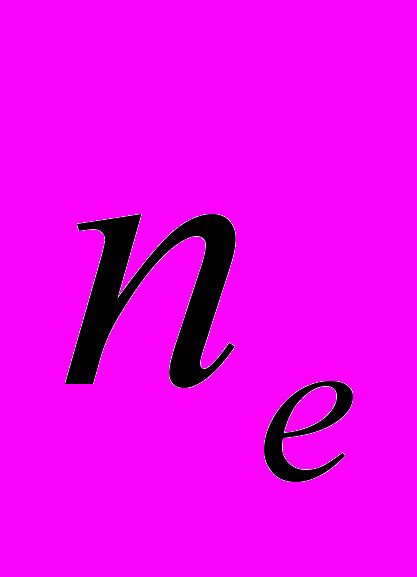 =1.402; =1.402; 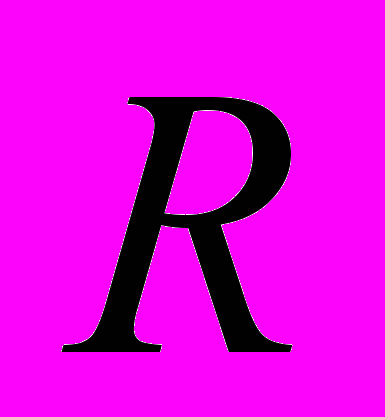 =0), и As1 ( =0), и As1 (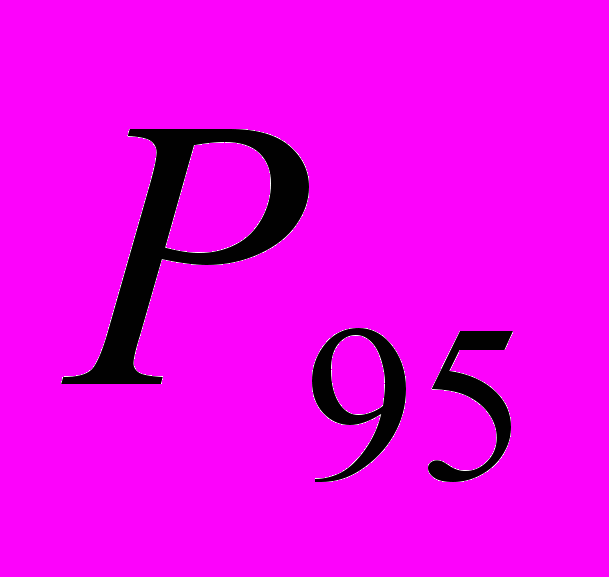 =35.13%; =35.13%; 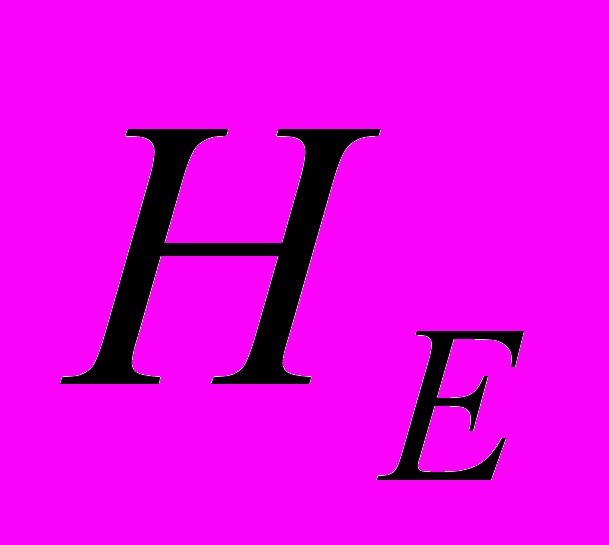 =0.141; =0.141; 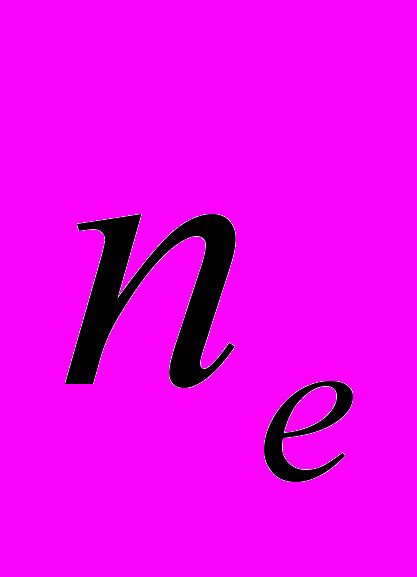 =1,257 =1,257 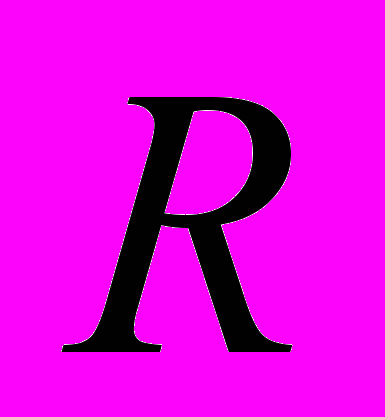 =0) из центральной части Пермского края. =0) из центральной части Пермского края. На основании обобщения данных, представленных в данной диссертационной работе, рекомендуются следующие меры по сохранению генофондов изученных редких реликтовых видов растений: 1. Поддержание генетического разнообразия популяций изученных видов путем сохранения на уровне не ниже исторически сложившегося эффективного размера популяций за счет устранения или снижения антропогенного воздействия: прекращение строительства объектов туризма и зон отдыха на склонах, где обитает вид; изъятия щебня, снижение рекреационной нагрузки, сбора цветущих растений, пожаров. 2. Картирование избранных для сохранения генофондов популяций и строгое их сохранение и учет их уникальности при планировании и проведении строительных, нефтедобывающих, хозяйственных и иных работ. 3. Мониторинг популяционных характеристик и генетического разнообразия избранных для сохранения популяций редких реликтовых видов растений. 4. Для сохранения генофонда природных популяций редких и исчезающих видов растений необходима их молекулярно-генетическая идентификация и паспортизация на популяционном уровне и выявление на ее основе объектов для сохранения генетического разнообразия. 5. Для третьей и шестой популяций A. vernalis, второй популяции A. sibirica, для третьей популяции D. grandiflora необходимы экстренные меры охраны, а именно снижение общей антропогенной нагрузки (запрет на разрушение склонов, на которых расположены популяции, ограничение выпаса скота и посещения людей путем создания ОППТ). 6. Для сохранения генофондов D. grandiflora и Ad. lilifolia помимо сохранения in situ рекомендуется отбор особей из популяций как с наибольшим типичными (Dg1) и (Ad.lil.1), так и со специфичными характеристиками генофондов (Dg2; Ad.lil.3) для введения в культуру в ботанические сады с последующей реинтродукцией. 7. В связи с ограниченной возможностью разведения в культуре двух изученных видов рода Adonis необходимо охранять природные популяции этих видов. Кроме этого рекомендуется консервация в генетических банках полноценных семян, отобранных в связи с сильной генетической дифференциацией популяций на основе максимальной представленности генетического разнообразия каждой из немногочисленных природных популяций этих видов. 8. При сильной дифференциации популяций рекомендуется создание промежуточных популяций с целью поддержания генетического разнообразия. Выводы 1. Для оценки генетической изменчивости редких и исчезающих видов растений рекомендуется метод ДНК-фингерпринтинга с использованием высоко полиморфных стабильных ISSR- и IRAP-маркеров, позволяющий эффективно оценить полиморфизм локусов в геноме и выявить основные показатели генетического разнообразия популяций. 2. С целью оптимизации сохранения генетической компоненты биологического разнообразия разработаны принципы множественного молекулярно-генетического геномного маркирования, создана концепция идентификации генофондов редких и исчезающих видов растений на основании оценок полилокусного сочетания моно- и полиморфных участков ДНК модельных редких реликтовых видов растений Пермского края рода Adonis, Ad. lilifolia и D. grandiflora. 3. Показано, что изученные редкие реликтовые виды растений характеризуются высоким уровнем генетической изменчивости: на основании полиморфизма IRAP-маркеров установлены доля полиморфных локусов ( 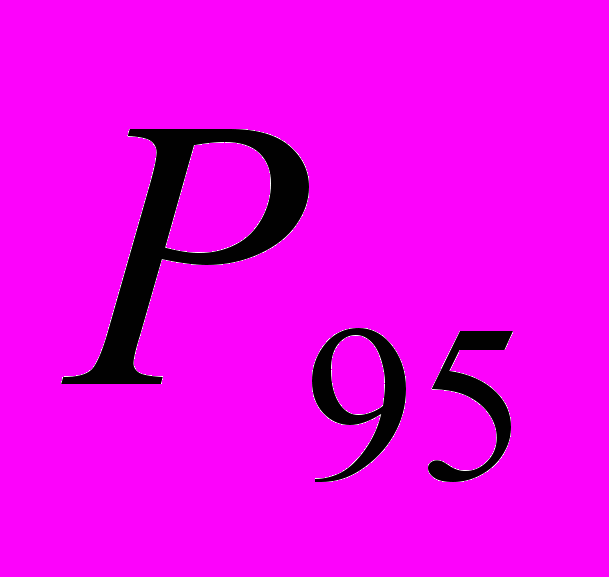 ) в пределах от 81.08% до 91.74%, ожидаемая гетерозиготность ( ) в пределах от 81.08% до 91.74%, ожидаемая гетерозиготность (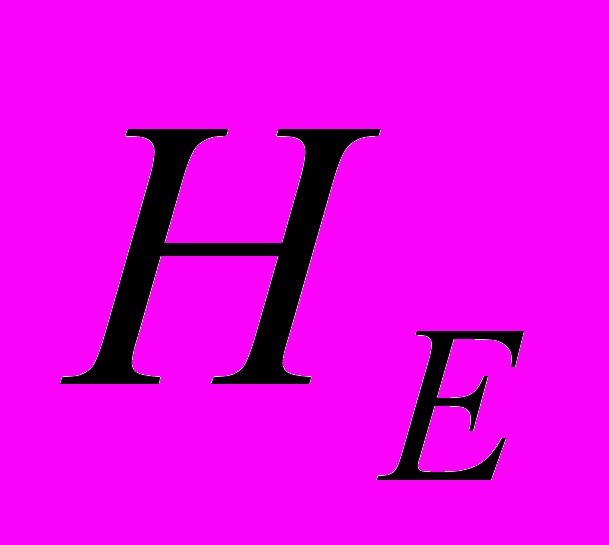 ) – от 0.228 до 0.356, а эффективное число аллелей ( ) – от 0.228 до 0.356, а эффективное число аллелей (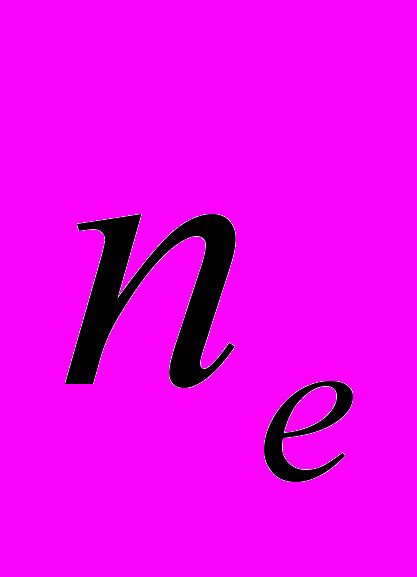 ) – от 1.394 до 1.608; на основании полиморфизма IRAP-маркеров – доля полиморфных локусов в пределах от 80.43% до 92.91%, ожидаемая гетерозиготность – от 0.291 до 0.432, а эффективное число аллелей – от 1.496 до 1.759. ) – от 1.394 до 1.608; на основании полиморфизма IRAP-маркеров – доля полиморфных локусов в пределах от 80.43% до 92.91%, ожидаемая гетерозиготность – от 0.291 до 0.432, а эффективное число аллелей – от 1.496 до 1.759.4. Выявлено, что генетическая изменчивость у исследованных редких реликтовых видов растений варьирует в узких пределах (уровень полиморфизма ISSR-маркеров – от 81.08 % у D. grandiflora до 91.74 % у A. vernalis; уровень полиморфизма IRAP-маркеров – от 80.43% у A. sibirica до 92.91% A. vernalis), не смотря на небольшую эффективную численность популяций, а также их дифференциацию и изолированность. 5. Установлено, что основные показатели генетического разнообразия изученных популяций A. vernalis достоверно ( 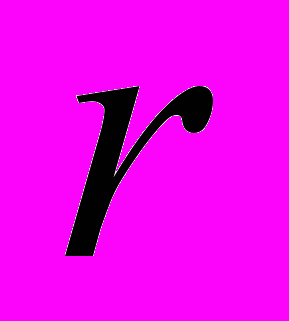 =0.963 и =0.963 и 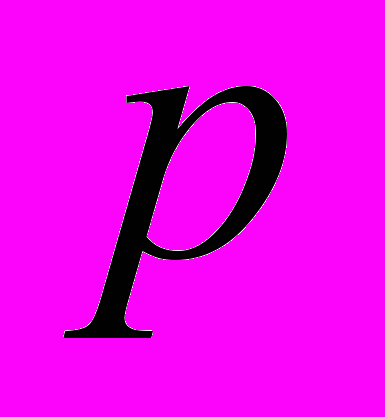 =0.002 для ожидаемой гетерозиготности; =0.002 для ожидаемой гетерозиготности; 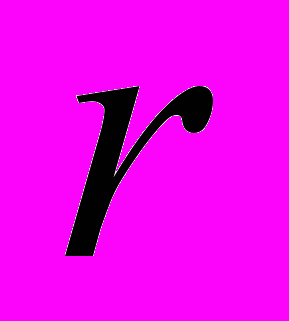 =0.970, и =0.970, и 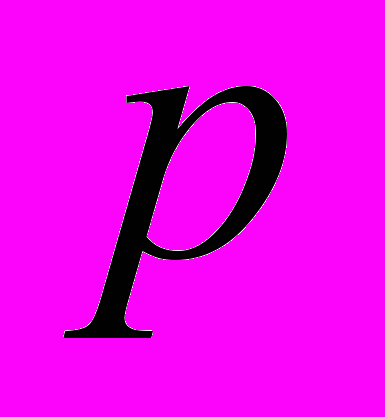 =0.001 для числа эффективных аллелей; =0.001 для числа эффективных аллелей; 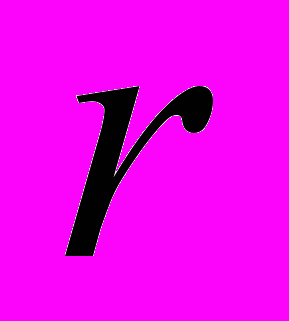 =0.958 и =0.958 и 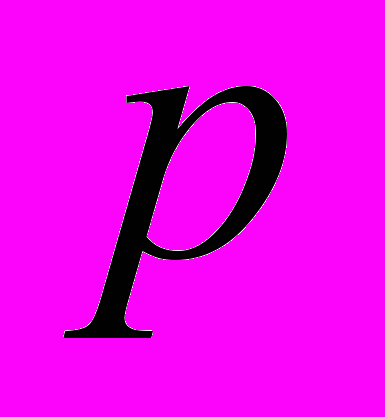 =0.001 для индекса разнообразия Шеннона) и линейно коррелируют с долей средневозрастных генеративных особей ( =0.001 для индекса разнообразия Шеннона) и линейно коррелируют с долей средневозрастных генеративных особей (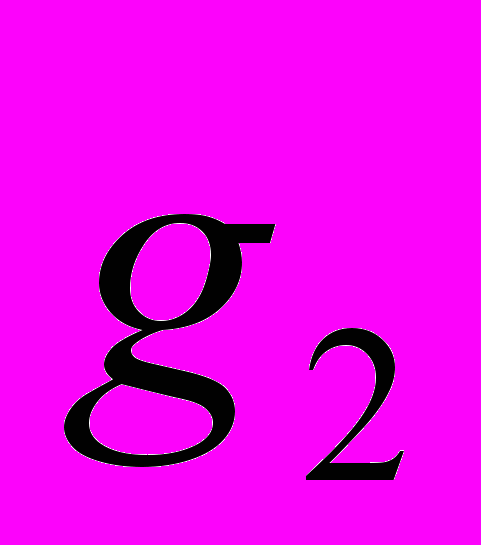 ), составляющих эффективную численность изученных популяций. ), составляющих эффективную численность изученных популяций.6. Виды рода Adonis характеризуются высоким уровнем межпопуляционной дифференциации ( 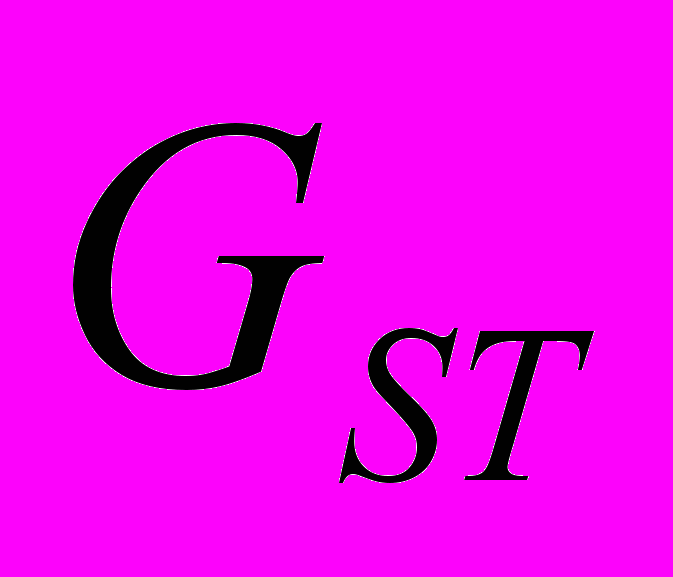 равен 41.22% у A. vernalis и 35.77% у A. sibirica). Величина параметра ниже у D. grandiflora (27.22 %) и Ad. lilifolia (15.51%). равен 41.22% у A. vernalis и 35.77% у A. sibirica). Величина параметра ниже у D. grandiflora (27.22 %) и Ad. lilifolia (15.51%).7. Генофонд исследованных популяций D. grandiflora способен самовоспроизводиться без вмешательства извне при условии сохранения существующих популяций, их эффективной численности (как определено в работе, изменяющийся в популяциях от 40 до 304 особей) и существующего уровня семенной продуктивности (в среднем около 2350 полноценных семян на особь в год). Генофонд Ad. lilifolia обеднен из-за отсутствия редких аллелей, но также способен к самовоспроизводству при сохранении существующей эффективной численности популяций (от 36 до 239 особей) и при формировании на каждой особи около 570 полноценных семян в год. 8. Выявлено, что у A. vernalis и A. sibirica часть популяций находится на пороге деградации генофонда из-за антропогенных факторов, среди которых преобладает разрушение местонахождений из-за строительства горнолыжной трассы (As1), нефтепровода (Av7), дорог (Av10), а также вытаптывание вследствие выпаса скота и посещения людьми. 9. Для отбора в качестве объектов сохранения рекомендуются локальные группы популяций с наиболее типичными характеристиками генофондов, такие как популяции A. vernalis, расположенных в центральной части островной Кунгурской лесостепи (Av4, Av5, Av6), а также отдельные популяции, такие как третья (As3) популяция A. sibirica из Ильинского района, третья (Ad.lil.3) популяция Ad. lilifolia из Ординского района и вторая (Dg2) популяция D. grandiflora из Кунгурского района Пермского края. 10. Установлены специфические характеристики генофондов, то есть специфические сочетания аллелей многих локусов, для ряда популяций: самой северной популяции A. vernalis на Спасской горе (Av2); для первой популяции A. vernalis (Av1) и для третьей (Dg3) популяция D.grandiflora, расположенных в островной Кунгурской лесостепи; а также для первой (Ad.lil.1) популяции Ad. lilifolia, расположенной на горе Подкаменной, и первой (As1) популяции A. sibirica из центральной части Пермского края. 11. С помощью разработанной нами технологии идентификации генофондов редких видов растений и ее ключевой части (методики молекулярно-генетической паспортизации) на основании молекулярно-генетического анализа установлены уровень и состав генетического разнообразия популяций, выявлены популяции с типичными и специфическими характеристиками генофондов, даны научно обоснованные рекомендации по сохранению генофондов с учетом уровней внутри- и межпопуляционного генетического разнообразия, то есть разработана модельная система оптимизации сохранения генофондов редких и исчезающих видов растений. Список основных работ, опубликованных по теме диссертации Статьи в научных журналах, рекомендованных ВАК РФ
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



