Обоснование применению телбивудина в клинической практике
| Вид материала | Документы |
- Реферат: Использование небулайзеров в клинической практике Использование небулайзеров, 208.91kb.
- Календарно-тематический план лекций по лучевой диагностике и лучевой терапии для студентов, 165.91kb.
- Первоеинформационноесообщени е III региональная конференция «достижения современной, 73.6kb.
- Перечень медицинских технологий, разрешенных к применению в медицинской практике, 1846.6kb.
- Международная китайская конференция по научным исследованиям и разработкам в области, 2320.87kb.
- Проблема использования внутривенных препаратов железа в клинической практике. Обзор, 593.92kb.
- Роль эндоскопии в диагностике и лечении кровотечении из острых гастродуоденальных язв, 435.85kb.
- Р. О. Моисеенко 2007, 927.55kb.
- Конференция 09. 00-11., 702.82kb.
- Глюкокортикостероидов в клинической практике, 1086.14kb.
В исследование включено 1367 пациентов (921 HBeAg-позитивных и 446 HBeAg-негативных), которые были рандомизированы в соотношении 1:1 и получали телбивудин в дозе 600 мг в день (n=680) и ламивудин по 100 мг в день (n=687) в течение двух лет. Спустя год был проведен предварительный анализ эффективности лечения, а через 2 года – окончательный (Таблица 9).
Таблица 9. Эффективность телбивудина у 921 HBeAg-позитивного пациента ХВГВ
| | Телбивудин (n=458) | Ламивудин (n=463) |
| Терапевтический ответ | 64% | 48% |
| Вирусная нагрузка | -5,7 Log10 | -4,4 Log10 |
| Супрессия вируса | 56% | 39% |
| Нормализация АЛТ | 70% | 62% |
| Исчезновение HBeAg | 35% | 29% |
| Сероконверсия HBeAg | 30% | 25% |
К концу 2-го года лечения эффективность телбивудина по таким важнейшим параметрам, как нормализация АЛТ, исчезновение и сероконверсия HBeAg, была на 5-8% выше, чем у ламивудина, а по терапевтической эффективности (сочетание снижения ДНК по сравнению с исходной более 5 log10 и нормальной АЛТ) – на 16%. У 31 из 38 больных (80%), прекративших терапию по истечению 2-лет, наблюдалась устойчивая сероконверсия.
Немаловажным обстоятельством является то, что к концу 2-го года лечения резистентность к телбивудину отмечалась почти в 2 раза реже, чем к ламивудину (17,8% и 30,1%, соответственно). Это является результатом ранней и выраженной супрессии вируса при приеме телбивудина, что минимизирует риск развития мутаций и, соответственно, повышает эффективность терапии (Рисунок 7): только у 4% больных с вирусологическим ответом на телбивудин к концу 24-й недели лечения развилась резистентность к препарату спустя 2 года терапии.
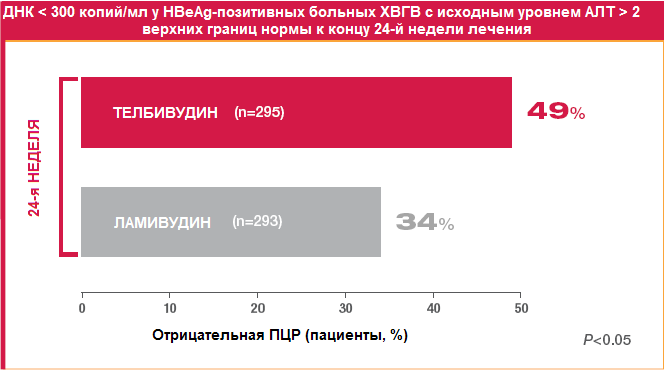
Рисунок 7. Ранний вирусологический ответ на лечение телбивудином и ламивудином у HBeAg-позитивных больных ХВГВ
У пациентов с HBeAg-негативным гепатитом, традиционно хуже поддающихся противовирусной терапии, результаты лечения телбивудином выглядят обнадеживающе: нормализация АЛТ развивается у 78% больных, вирусная супрессия (в среднем на 5 Log10 по сравнению с исходной) – у 82% (Error: Reference source not found). У всех пациентов с нормализовавшейся АЛТ происходило исчезновение вируса (терапевтический ответ развивался у 78% больных и был на 12% выше, чем у получавших ламивудин) (Таблица 10).
Таблица 10. Эффективность телбивудина у 446 HBeAg-негативного пациента ХВГВ
| | Телбивудин (n=222) | Ламивудин (n=224) |
| Терапевтический ответ | 78% | 66% |
| Вирусная нагрузка | -5,0 Log10 | -4,2 Log10 |
| Супрессия вируса | 82% | 57% |
| Нормализация АЛТ | 78% | 70% |
Немаловажным обстоятельством является то, что к концу 2-го года лечения резистентность к телбивудину отмечалась почти в 2 раза реже, чем к ламивудину (7,3% и 16,6%, соответственно). Это является результатом ранней и выраженной супрессии вируса при приеме телбивудина, что минимизирует риск развития мутаций и, соответственно, повышает эффективность терапии (Рисунок 8). Только у 2% больных с вирусологическим ответом на телбивудин к концу 24-й недели лечения развилась резистентность к препарату спустя 2 года терапии.
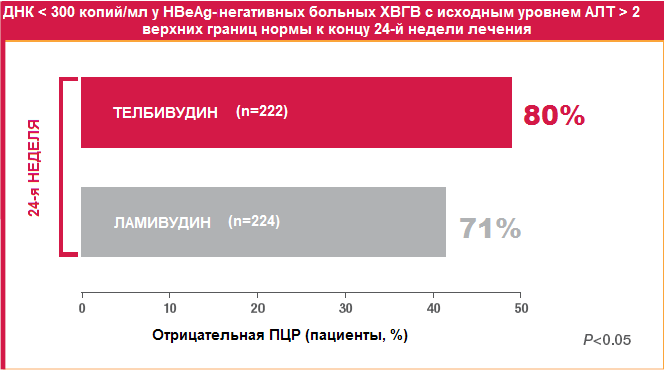
Рисунок 8. Ранний вирусологический ответ на лечение телбивудином и ламивудином у HBeAg-негативных больных ХВГВ
Важным показателем, характеризующим эффективность препаратов, использующихся для сдерживающей терапии, в том числе и телбивудина, является способность предупреждать прогрессию заболевания. При лечении телбивудином гепатит не прогрессирует у большинства больных (80% HBeAg-позитивных и 82% HBeAg-негативных) (Рисунок 9). Причем у большей части этих пациентов (соответственно 41% и 48%) наступает обратное развитие фиброза.
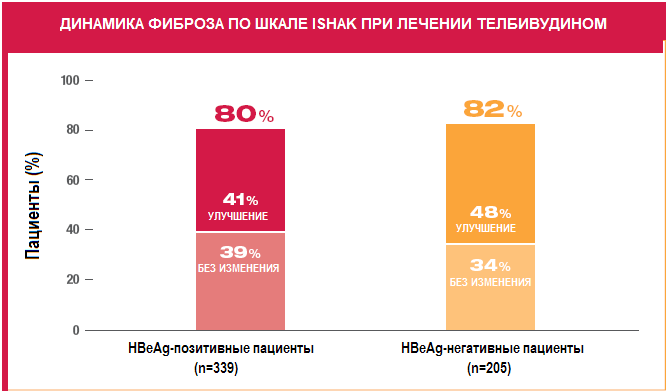
Рисунок 9. Влияние телбивудина на динамику фиброза у больных ХВГВ
Телбивудин достаточно хорошо переносится. Частота встречаемости основных побочных эффектов не превышает 1%, т.е. сопоставима с ламивудином – эталонным препаратом среди нуклеозидных аналогов в плане безопасности лечения пациентов с хроническим гепатитом В. Т.е. телбивудин может считаться препаратом, практически не вызывающим каких-либо серьезных побочных эффектов.
| НЕКОТОРЫЕ ПОБОЧНЫЕ ЭФФЕКТЫ ПРИ ЛЕЧЕНИИ ТЕЛБИВУДИНОМ | ||
| Побочный эффект | Телбивудин (n=680) | Ламивудин (n=687) |
| Всего | 22% | 22% |
| Миопатия | 2% | 2% |
| Слабость | 1% | 1% |
| Головная боль | 1% | 2% |
| Пирексия | 1% | <1% |
| Боль в животе | <1% | <1% |
| Артралгия | <1% | 1% |
| Кашель | <1% | <1% |
| Диарея | <1% | <1% |
| Гастрит | <1% | 0% |
Таким образом, телбивудин является современным, наиболее мощным из доступных в настоящее время в Украине, и, одновременно, безопасным лекарственным средством для лечения хронического вирусного гепатита В.
ЧТО ВЫБРАТЬ: ПРЕПАРАТЫ С ИММУНОМОДУЛИРУЮЩИМ ДЕЙСТВИЕМ ИЛИ ПРОТИВОВИРУСНЫЕ СРЕДСТВА?
Для лечения ХВГВ используются иммуномодулирующие средства (интерферон-α) и противовирусные препараты (нуклеоз(т)идные аналоги). Они отличаются не только по механизму действия, но и по типу ответа на них, а также по эффективности. Последняя оценивается по частоте нормализации трансаминаз, исчезновению или сероконверсии HBeAg, снижению вирусной нагрузки ниже определенного фиксированного уровня, а также по тому, как долго после прекращения терапии удерживается достигнутый ответ на лечение (так называемый, устойчивый ответ на лечение).
Ответ на лечение нуклеоз(т)идными аналогами развивается гораздо быстрее и значительно более выражен, чем при лечении интерфероном. Однако, прекращение лечения у большинства больных вызывает рецидив болезни, в то время как интерферон приводит к устойчивому ответу на лечение не менее чем у трети пациентов. Вероятность устойчивого ответа на лечение нуклеоз(т)идными аналогами зависит от продолжительности лечения, однако препятствием для многолетней терапии является развивающаяся к ним устойчивость вируса.
С первого взгляда кажется, что лечение интерфероном имеет абсолютное преимущество перед терапией нуклеоз(т)идными аналогами. Однако, это не так. Хотя интерферон и индуцирует устойчивый ответ на лечение примерно у трети пациентов, его эффективность в процессе лечения не превышает 40%, т.е. большая часть больных, нуждающихся в терапии вообще не отвечает на лечение интерфероном. В то время как на лечение нуклеоз(т)идными аналогами отвечает до 80% больных. К новым препаратам, к которым относится телбивудин, резистентность развивается медленно, что позволяет рассчитывать на возможность многолетней супрессии вируса, пусть даже поддерживаемой непрерывной терапией.
Кроме того, лечение интерферонами сопряжено с развитием большого числа побочных эффектов и противопоказано у целого ряда больных ().
Таблица 11. противопоказания к назначению интерферона при хвгв
| Общие противопоказания |
|
| Связанные с HBV-инфекцией |
|
| Назначение возможно, но с предосторожностью |
|
Наконец интерфероны крайне дорогостоящи. Курс противовирусной терапии пегилированным интерфероном в течение 52 недель стоит около 100000 гривен. Этой суммы достаточно для проведения непрерывной терапии ламивудином в течение 800 недель или 15 лет! И это при условии отсутствия серьезных побочных эффектов при лечении ламивудином, а также фактически противопоказаний к лечению этим препаратом. Телбивудин, хотя и дороже ламивудина, однако лучшее соотношение эффективность/стоимость делает его использование экономически более выгодным, нежели ламивудина.
Таким образом, современная схема выбора препаратов для терапии ХВГВ выглядит следующим образом (Рисунок 10). Если пациент является идеальным кандидатом для лечения интерфероном (молодой возраст, отсутствие выраженного фиброза, умеренная или низкая гистологическая активность гепатита, высокий уровень сывороточных трансаминаз в сочетании с низкой вирусной нагрузкой, отсутствие противопоказаний к лечению), должен назначаться интерферон. Остальным больным (абсолютному большинству) лечение необходимо проводить нуклеоз(т)идными аналогами. Несмотря на привлекательность ламивудина вследствие его дешевизны, предпочтительным все же является назначение телбивудина. Это связано с тем, что ламивудин индуцирует устойчивые к лечению этим препаратом мутации вируса уже с 6 месяца терапии. У таких пациентов резко возрастает риск тяжелого обострения гепатита, связанного с мутировавшим вирусом. Замена ламивудина на телбивудин будет неэффективной, поскольку индуцированные ламивудином мутации вируса устойчивы и к телбивудину. Преимущества первоочередного назначения телбивудина состоят в том, что последний, обладая высокой противовирусной активностью, рано подавляет репликацию вируса и, следовательно, снижает риск возникновения устойчивой к лечению мутации вируса. Это позволяет рассчитывать на многолетнюю устойчивую супрессию вируса, поддерживаемую непрерывным приемом телбивудина.
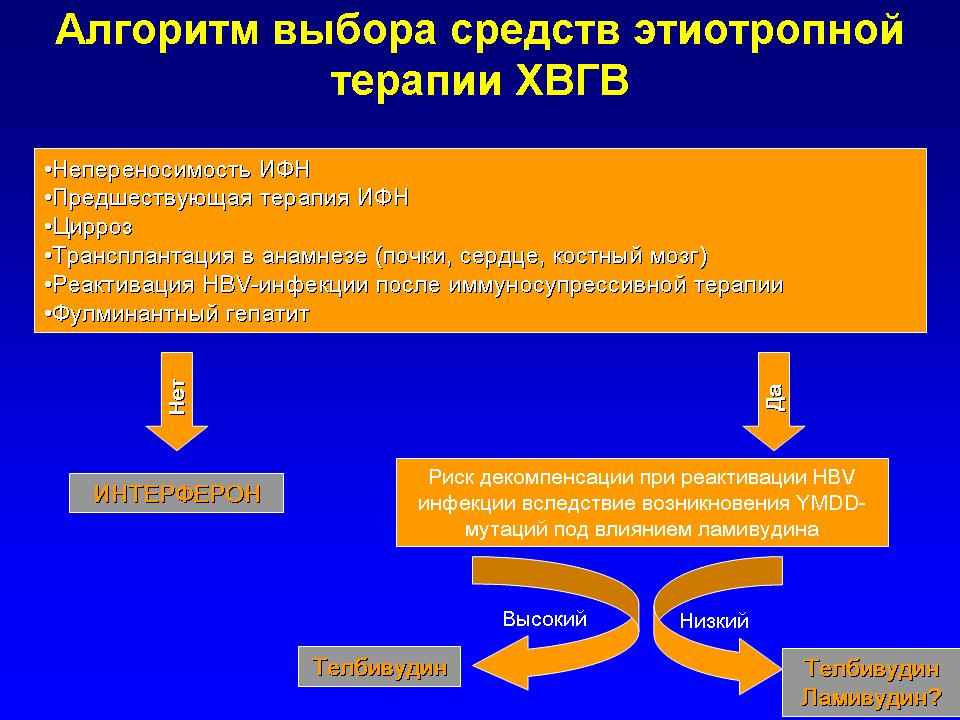
Рисунок 10. алгоритм выбора средств этиотропной терапии хвгв
ЛИТЕРАТУРА
1 Vail BA Managemant of chronic viral hepatitis. Am Fam Physician; 1997; 55: 2749-56.
2 Kane M. Global programme for control of hepatitis B infection. Vaccine 1995;13:S47–S49.
3 Gay N, Edmunds W, Bah E, Nelson C. Estimating the global burden of hepatitis B. Geneva: World Health Organization, Department of Vaccines and Biologicals; 2001.
4 FitzSimons D, Van Damme P, Emiroglu N, Godal T, Kane M, Malyavin A, et al. Strengthening immunization systems and introduction of hepatitis B vaccine in central and eastern Europe and the newly independent states. Vaccine 2002;20:1475–1479.
5 Parkin DM, Bray F, Ferlay J, Pisani P. Estimating the world cancer burden: Globocan 2000. Int J Cancer 2001;94:153–156.
6 Margolis HS, Alter MJ, Hadler S. Viral hepatitis. In: Evans A, Kaslow R, editors. Viral infections of humans, 4th ed. New York: Plenum; 1997. p. 363–418.
7 ov/ncidod/diseases/hepatitis/slideset/index.php
8 Metcalf M, Brown N, Peterson S, Feld A, Gale F, Kirk J, Mabry G. Health care costs associated with chronic hepatitis B. Am J Health Syst Pharm 1999;56:232–236.
9 McMahon BJ, Alward WL, Hall DB, Heyward WL, Bender TR, Francis DP, Maynard JE. Acute hepatitis B virus infection: relation of age to the clinical expression of disease and subsequent development of the carrier state. J Infect Dis 1985;151:599–603.
10 EASL International Consensus Conference On Hepatitis B. Consensus statement (Long version). Journal of Hepatology 39 (2003) S3–S25.
11 Tassopoulos NC, Papaevangelou GJ, Sjogren MH, Roumeliotou-Karayannis A, Gerin JL, Purcell RH. Natural history of acute hepatitis B surface antigen-positive hepatitis in Greek adults. Gastroenterology 1987;92:1844–1850.
12 Lok AS, Heathcote EJ, Hoofnagle JH. Management of hepatitis B: 2000-Summary of aworkshop. Gastroenterology 2001;120:1828-1853.
13 Lok ASF, McMahon BJ. Chronic hepatitis B. Hepatology 2001;34:1225-1241.
14 Ikeda K, Saitoh S, Suzuki Y, Kobayashi M, Tsubota A, Koida I, et al. Disease progression and hepatocellular carcinogenesis in patients with chronic viral hepatitis: a prospective observation of 2215 patients. J Hepatol 1998;28:930–938.
15 Fattovich G, Brollo L, Giustina G, Noventa F, Pontisso P, Alberti A, et al. Natural history and prognostic factors for chronic hepatitis type B. Gut 1991;32:294–298.
16 Realdi G, Fattovich G, Hadziyannis S, Schalm SW, Almasio P, Sanchez-Tapias J, Christensen E, Giustina G, Noventa F. Survival and prognostic factors in 366 patients with compensated cirrhosis type B: a multicenter study. J Hepatol 1994;21:656-666.
17 Yu MW, Hsu FC, Sheen IS, Chu CM, Lin DY, Chen CJ, Liaw YF. Prospective study of hepatocellular carcinoma and liver cirrhosis in asymptomatic chronic hepatitis B virus carriers. Am J Epidemiol 1997;145:1039–1047.
18 Fattovich G, Giustina G, Schalm SW, Hadziyannis S, Sanchez-Tapias J, Almasio P, et al. Occurrence of hepatocellular carcinoma and decompensation in western European patients with cirrhosis type B. The EUROHEP Study Group on Hepatitis B Virus and Cirrhosis. Hepatology 1995;21:77–82.
19 Fattovich G, Pantalena M, Zagni I, Realdi G, Schalm SW, Christensen E. Effect of hepatitis B and C virus infections on the natural history of compensated cirrhosis: a cohort study of 297 patients. Am J Gastroenterol 2002;97:2886-2895.
20 Chung HT, Lai CL, Lok AS. Pathogenic role of hepatitis B virus in hepatitis B surface antigen-negative decompensated cirrhosis. Hepatology 1995;22:25-29.
21 De Jongh FE, Janssen HLA, De Man RA, Hop WCJ, Schalm SW, Van Blankestein M. Survival and prognostic indicators in hepatitis B surface antigen-positive cirrhosis ofthe liver. Gastroenterology 1992;103:1630-1635.
22 Hui AY, Chan HL, Leung NW, Hung LC, Chan FK, Sung JJ. Survival and prognostic indicators in patients with hepatitis B virusrelated cirrhosis after onset of hepatic decompensation. J Clin Gastroenterol 2002;34:569–572.
23 Buster E, Janssen H. Antiviral treatment for chronic hepatitis B virus infection – immune modulation or viral suppression? The Netherlands Journal of Medicine. 2006; 64(6):175-185
24 Severini, A, Lin, XY, Wilson, JS, Tyrrell, DL. Mechanism of inhibition of duck hepatitis B virus polymerase by (-)-b-L-2',3'-dideoxy-3'-thiacytidine. Antimicrob Agents Chemother 1995; 39:1430.
25 Chang, C.-N., Doong, S.-L., Zhou, J. H., Beach, J. W., Jeong, L. S., Chu, C. K. et al. (1992). Deoxycytidine deaminase-resistant stereoisomer is the active form of (±)-2′,3′-dideoxy-3′-thiacytidine in the inhibition of hepatitis B
26 Veenstra D, Sullivan SD, Lewis G, Green J, Patel K. Cost-effectiveness of peginterferon alfa-2a (40KD) compared to lamivudine for the treatment of HBeAg-negative chronic hepatitis B in the UK. Presented at the ISPOR meeting, May 15-18 2005, Washington DC.
27 Jonas MM, Kelly DA, Mizerski J, Badia IB, Areias JA, Schwarz KB, et al. Clinical trial of lamivudine in children with chronic hepatitis B. N Engl J Med 2002;346:1706–1713.
28 Wai CT, Chu CJ, Hussain M, Lok AS. HBV genotype B is associated with better response to interferon therapy in HBeAg(ю) chronic hepatitis than genotype C. Hepatology 2002;36:1425–1430.
29 Flink HJ, van Zonneveld M, Hansen BE, de Man RA, Schalm SW, Janssen HL. Treatment with Peg-Interferon alpha-2b for HBeAg-Positive Chronic Hepatitis B: HBsAg Loss Is Associated with HBV Genotype. Am J Gastroenterol 2006;101(2):297-303.
30 Lau GK, Piratvisuth T, Luo KX, et al. Peginterferon Alfa-2a, lamivudine, and the combination for HBeAg-positive chronic hepatitis B. N Engl J Med 2005;352(26):2682-95.
31 Erhardt A, Blondin D, Hauck K, et al. Response to interferon alfa is hepatitis B virus genotype dependent: genotype A is more sensitive to interferon than genotype D. Gut 2005;54(7):1009-13.
32 Janssen HL, van Zonneveld M, Senturk H, et al. Pegylated interferon alfa-2b alone or in combination with lamivudine for HBeAg-positive chronic hepatitis B: a randomised trial. Lancet 2005;365(9454):123-9.
33 Di Martino V, Thevenot T, Colin JF, et al. Influence of HIV infection on the response to interferon therapy and the long-term outcome of chronic hepatitis B. Gastroenterology 2002;123(6):1812-22.
34 Lai, CL, Chien, RN, Leung, NW, et al. A one-year trial of lamivudine for chronic hepatitis B. N Engl J Med 1998; 339:61.
35 Schiff, E, Karayalcin, S, Grimm, I, et al. A placebo controlled study of lamivudine and interferon alpha 2b in patients with chronic hepatitis B who previously failed interferon therapy (abstract). Hepatology 1998; 28:388A.
36 Schalm SW, Heathcote J, Cianciara J, Farrell G, Sherman M, Willems B, et al. Lamivudine and alpha interferon combination treatment of patients with chronic hepatitis B infection: a randomised trial. Gut 2000;46:562-8.
37 Niederau C, Heintges T, Lange S, Goldmann G, Niederau CM, Mohr L, Haussinger D. Long-term follow-up of HBeAg-positive patients treated with interferon a-for chronic hepatitis B. N Engl J Med 1996; 334:1422–1427.
38 Lau DT, Everhart J, Kleiner DE, Park Y, Vergalla J, Schmid P, Hoofnagle JH. Long-term follow-up of patients with chronic hepatitis B treated with interferon alpha. Gastroenterology 1997; 113:1660–1667.
39 Lin SM, Sheen IS, Chien RN, Chu CM, Liaw YF. Long-term beneficial effect of interferon therapy in patients with chronic hepatitis B virus infection. Hepatology 1999;29:971–975.
40 Lok AS, Chung HT, Liu VW, Ma OC. Long-term follow-up of chronic hepatitis B patients treated with interferon alpha. Gastroenterology 1993;105:1833–1838.
41 Dienstag JL, Schiff ER, Wright TL, Perrillo RP, Hann HW, Goodman Z, et al. Lamivudine as initial treatment for chronic hepatitis B in the United States. N Engl J Med 1999;341: 1256–1263.
42 Song BC, Suh DJ, Lee HC, Chung YH, Lee YS. Hepatitis Be antigen seroconversion after lamivudine therapy is not durable in patients with chronic hepatitis B in Korea. Hepatology 2000;32: 803–806.
43 Allen MI, Deslauriers M, Andrews CW, Tipples GA, Walters KA, Tyrrell DL, et al. Identification and characterization of mutations in hepatitis B virus resistant to lamivudine. Lamivudine Clinical Investigation Group. Hepatology 1998;27:1670–1677.
44 Fu L, Cheng YC. Role of additional mutations outside the YMDD motif of hepatitis B virus polymerase in L(-)SddC (3TC) resistance. Biochem Pharmacol. 1998; 55: 1567-72.
45 Hadziyannis SJ, Vassilopoulos D. Hepatitis B e antigen-negative chronic hepatitis B. Hepatology 2001;34:617–624.
46 Hadziyannis S, Tassopolous N, Heathcote EJ, Chang TT, Kitis G, Rizzetto T, et al. Adefovir Dipivoxil for the treatment of hepatitis B e antigen-negative chronic hepatitis. N Engl J Med 2003;348: 800–807.
47 Papatheodoridis GV, Dimou E, Laras A, Papadimitropoulos V, Hadziyannis SJ. Course of virologic breakthroughs under long-term lamivudine in HBeAg- negative precore mutant HBV liver disease. Hepatology 2002;36:219–226.
48 Lok AS, Hussain M, Cursano C, Margotti M, Gramenzi A, Grazi GL, et al. Evolution of hepatitis B virus polymerase gene mutations in hepatitis B e antigen-negative patients receiving lamivudine therapy. Hepatology 2000;32:1145–1153.
