Эпидемиологическая и клиническая характеристика врожденных аномалий развития мочевой системы у детей в крупном административно-хозяйственном центре Западной Сибири 14. 02. 02 эпидемиология 14. 01. 08 педиатрия
| Вид материала | Автореферат диссертации |
| Содержание работы |
- Эпидемиологическая характеристика и лабораторная диагностика урогенитальных инфекций,, 298.26kb.
- Эпидемиологическая характеристика и профилактика вич-инфекции среди городской молодежи, 451.32kb.
- А. А. Порошин [и др.] // Медико-биологические и социально-психологические Пробл безопасности, 27.59kb.
- Эпидемиологическая и микробиологическая характеристика шигеллезов при спорадических, 327.58kb.
- Перспективы развития рынка кредитования физических лиц Западной Сибири, 75.44kb.
- Методические рекомендации n 11-8/240-09, 306.83kb.
- «педиатрия», 760.1kb.
- В. А. Кельцев общая характеристика работы, 342.39kb.
- Механизм развития стоматологической патологии, принципы ее профилактики и лечения, 563.09kb.
- «Пепдиатрия», 101.82kb.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования. Базой для изучения ВПР у детей и плодов явился город Омск, входящий в число 13 крупнейших городов Российской Федерации. При выполнении работы использованы эпидемиологические методы исследования (описательно-оценочные, аналитические – типа «случай-контроль»); клинический и клинико-генеалогический методы; методы лабораторной диагностики (РИФ, ИФА); статистический анализ. На первом этапе проведено сплошное наблюдательное описательно-оценочное эпидемиологическое изучение врожденных аномалий развития у детей, родившихся живыми (n=4955), мертвыми (n=60) и у плодов, элиминированных после пренатальной диагностики (n=291) за период с 1998 по 2008 г. Общее количество детей, родившихся живыми, мертвыми и элиминированных плодов за исследованный период – 105023. Определены частота, структура и динамика всех врожденных пороков, в том числе аномалий развития мочевой системы, согласно международной классификации болезней 10-го пересмотра. Для регистрации ВПР была разработана собственная форма учетной документации. В качестве первичных материалов использованы: журналы регистрации и учета новорожденных и истории развития детей (форма №112/у) с ВПР из всех детских поликлиник города; медицинские карты детей с пороками развития из перинатального центра МУЗ «Клинический родильный дом № 1» (форма № 003/у); протоколы патологоанатомических вскрытий и журналы аутопсий из патоморфологического отделения БУЗ Омской области «Областная детская клиническая больница». Детальное изучение показателей частоты пороков развития проводилось в административных округах (АО) города и в микроучастках, соответствующих детским городским поликлиникам и их филиалам. Для анализа загрязнения атмосферного воздуха в г. Омске использованы данные ежегодных сборников «О состоянии и об охране окружающей среды Омской области». Также был проведен анализ эпидемиологической ситуации, связанный с летальностью детей от врожденных пороков с рождения до 17 лет на территории г. Омска.
Проведено наблюдательное аналитическое исследование типа «случай – контроль». В работе обобщены результаты клинико-анамнестического обследования 152 семей, в том числе, имеющих детей с врожденными стойкими пиелоэктазиями (76 детей – основная группа). Сбор клинического материала проводился на базе перинатального центра МУЗ «Клинический родильный дом № 1» г. Омска. Контрольную группу составили 76 детей первого года жизни I и II групп здоровья. Критерием включения детей в основную группу являлось стойкое и прогрессирующее увеличение диаметра лоханки почки более 6 мм. (Гельдт В.К., Донгак Л.А., 2002) с подтверждением диагноза «Врожденная пиелоэктазия» при помощи ультразвукового исследования в возрасте от 1 до 3-х мес. и повторно в 12 мес. жизни в условиях детских поликлиник города. Дополнительным критерием включения являлось наличие вакцинации матерей этих детей против вируса краснухи до беременности. Критерием исключения являлось наличие у детей функциональной пиелоэктазии, исчезающей к 1 году, сопутствующих аномалий развития других органов и систем, гемолитической болезни новорожденных и отсутствие информации об обследовании их матерей на цитомегаловирус.
Обследование всех детей основной и контрольной группы на антигены ЦМВ проводилось методом РИФ (материал исследования – моча), на антитела к ЦМВ в сыворотке крови – методом ИФА в Центральной научно-исследовательской лаборатории ГОУ ВПО ОмГМА Росздрава. При обследовании новорожденных определяли также антигены вируса простого герпеса (ВПГ) I и II типов и вируса Эпштейна-Барр в реакции иммунофлюоресценции с использованием тест-систем «Vircell» (Испания), а в сыворотке крови детей методом ИФА – индекс авидности с использованием диагностических систем «ДС» (г. Нижний Новгород).
Материалы исследования были подвергнуты статистической обработке с использованием методов параметрического и непараметрического анализа (Реброва О.Ю., 2003; Петров В.И., Недогода С.В., 2009). Накопление, корректировка, систематизация, статистический анализ исходной информации и визуализация полученных результатов проводилась в системе управления базами данных «Access», электронных таблицах «Excel». Биометрический анализ осуществлялся с использованием пакетов «STATISTICA-6», «БИОСТАТИСТИКА», возможностей Microsoft Excel. Для построения прогностической таблицы и определения вероятности возникновения заболевания использован метод неоднородной последовательной процедуры Вальда и формула Байеса (Гублер Е.В., 1978).
Результаты и их обсуждение.
На этапе эпидемиологического изучения ВПР определены частота, структура и динамика всех врожденных пороков для выявления групп аномалий развития, имеющих наибольший темп прироста показателя, следовательно, в первую очередь требующих поиска активных факторов риска. Показатели частоты пороков развития у детей, родившихся живыми (47,7±0,66‰; Тпр=+5,8%, p<0,05), мертвыми (67,1±8,37‰; Тпр=+13,3%; p<0,05) и общий среднемноголетний показатель частоты ВПР у детей и плодов за 11 лет наблюдения имели выраженную тенденцию к росту (рис. 1), а общая частота патологии составила в среднем 50,5±0,68 на 1000 родов (Тпр=+5,8%; p<0,05).
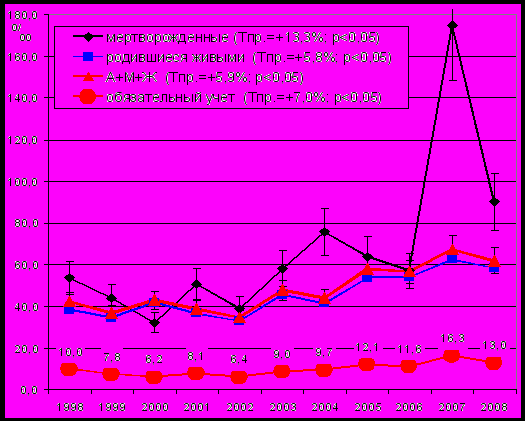
Рис. 1 Показатели частоты ВПР у мертворожденных (М), родившихся живыми (Ж) и у элиминированных плодов (А) и по ВПР обязательного учета в г. Омске (‰, 1998-2008 гг.)
Увеличение показателя рождаемости детей с пороками развития в г. Омске является не только результатом патогенных воздействий факторов окружающей среды на плод (истинный рост), но и следствием целенаправленной работы медицинских учреждений по выявлению пороков развития в антенатальном и неонатальном периоде, т.е. имеет место и регистрационный прирост. У детей и плодов в структуре всех ВПР наибольший удельный вес занимали пороки развития костно-мышечной системы (48,1±0,69%) и системы кровообращения (17,2±0,52%); пороки развития мочевой системы составили 4,4±0,28% (рис. 2).

Рис. 2 Структура ВПР у живорожденных, мертворожденных детей и элиминированных плодов (%, г. Омск, 1998-2008 гг.)
Наибольшие значения темпов прироста среднемноголетнего показателя рождаемости детей с ВПР были определены в группе пороков развития мочевой системы (табл. 1), что послужило основанием для дальнейших углубленных эпидемиологических и клинических исследований аномалий развития данной группы.
Таблица 1
Частота и оценка динамики ВПР по группам пороков развития у детей, родившихся живыми, мертвыми и у элиминированных плодов в результате пренатальной диагностики в г. Омске в 1998-2008 гг., ‰
| Группы ВПР | 1998-2008 гг. | Тпр.(сн.) | p | |
| Абс. | M±m, ‰ | |||
| Пороки нервной системы | 334 | 3,2±0,17 | 2,4 | <0,05 |
| Пороки «глаза, уха, лица, шеи» | 118 | 1,1±0,10 | 2,3 | <0,05 |
| Пороки развития системы кровообращения | 995 | 9,5±0,30 | 6,2 | <0,05 |
| Пороки органов дыхания | 65 | 0,6±0,08 | 13,0 | <0,05 |
| Расщелина губы, неба | 105 | 1,0±0,1 | 4,7 | <0,05 |
| Пороки органов пищеварения | 117 | 1,1±0,1 | -7,2 | <0,05 |
| Пороки половых органов | 253 | 2,41±0,15 | 6,1 | <0,05 |
| Пороки мочевой системы | 256 | 2,44±0,15 | 18,5 | <0,05 |
| Пороки костно-мышечной системы | 2790 | 26,6±0,50 | 5,4 | <0,05 |
| Другие ВПР | 389 | 3,7±0,19 | 7,3 | <0,05 |
| Хромосомные нарушения | 71 | 0,7 ±0,08 | 12,3 | <0,05 |
| ВПР не уточненные | 49 | 0,5±0,07 | 12,7 | <0,05 |
| Множественные ВПР | 262 | 2,5±0,15 | 10,6 | <0,05 |
| Всего: | 5306 | 50,5±0,68 | 5,8 | <0,05 |
Количество детей и плодов с ВПР обязательного учета за период 1998-2008 гг. составило 1107 (10,54±0,32‰; Тпр=+6,95%; рис. 1), а их удельный вес – 20,8% от числа всех пороков развития у детей и плодов, зарегистрированных за исследованный период, т.е. 1/5 часть от всех случаев рождения детей с ВПР (табл. 2).
Таблица 2
Частота ВПР, подлежащих обязательному учету, у детей (живорожденных и мертворожденных) и плодов, ‰, г. Омск, 1998-2008 гг.
| Вариант ВПР | Частота ВПР, М±m | Тпр.(сн.) | Данные международного регистра International Clearinghouse of Birth Defects, ‰, (по Минайчевой Л.И. с соавт., 2007) |
| Анэнцефалия | 0,31±0,05 | -9,68 | 0,08-1,60 |
| Спинномозговая грыжа | 0,41±0,06 | 0,82 | 0,10-0,70 |
| Энцефалоцеле | 0,05±0,02 | 12,93 | 0,03-0,30 |
| Гидроцефалия врожденная | 1,59±0,12 | 1,47 | 0,20-0,80 |
| Микрофтальм, анофтальм | 0,09±0,03 | -0,58 | |
| Микротия, анотия | 0,05±0,02 | -7,62 | 0,01-0,08 |
| Транспозиция магистральных сосудов | 0,16±0,04 | 6,63 | 0,10-0,61 |
| Гипоплазия левого сердца | 0,15±0,04 | 7,34 | 0,00-0,35 |
| Расщелина неба, незаращение губы | 1,00±0,10 | 4,72 | 0,60-1,70 |
| Атрезия пищевода | 0,18±0,04 | 3,02 | 0,10-0,5 |
| Атрезия ануса | 0,15±0,04 | -2,70 | 0,10-0,50 |
| Гипоспадия | 0,88±0,09 | 9,20 | 0,10-0,26 |
| Редукционные пороки конечностей | 0,34±0,06 | 3,6 | 0,20-0,70 |
| Диафрагмальная грыжа | 0,25±0,05 | 13,94 | 0,03-0,40 |
| Агенезия и дисгенезия почек | 1,02±0,10 | 11,40 | 0,02-0,40 |
| Омфалоцеле | 0,46±0,07 | 19,72 | 0,10-0,30 |
| Гастрошизис | 0,29±0,05 | 8,34 | 0,10-0,30 |
| Синдром Дауна | 0,67±0,08 | 11,64 | 0,70-1,40 |
| Множественные ВПР | 2,50±0,15 | 10,36 | 0,90-2,40 |
| Всего: | 10,54±0,32 | 6,95 | 8,8-21,24 |
Частота пороков, подлежащих обязательному учету, имела тенденцию к истинному росту показателя, поскольку диагностика большинства из этих пороков основана на клиническом описании фенотипа. В первую очередь это пороки развития, которые диагностируются при осмотре новорожденного ребенка, а они за период наблюдения имели существенное увеличение показателей. В структуре пороков развития обязательного учета у детей и плодов с наибольшей частотой регистрировались множественные пороки – 2,50±0,15‰ (удельный вес в структуре ВПР – 23,76±0,13%), врожденная гидроцефалия – 1,59±0,12‰ (15,09±0,11% соответственно) и группа пороков «Агенезия и дисгенезия почек» – 1,02±0,10‰ (9,67±0,09%).
Анализ летальности детей с врожденными пороками от рождения до 17 лет показал, что в 83,2±1,64% случаев их гибель происходила преимущественно на первом и значительно реже на втором (8,5±1,22%) и третьем году жизни (2,7±0,71%). Кроме того, были отмечены единичные случаи смерти детей от 3 до 15 лет (рис. 3).
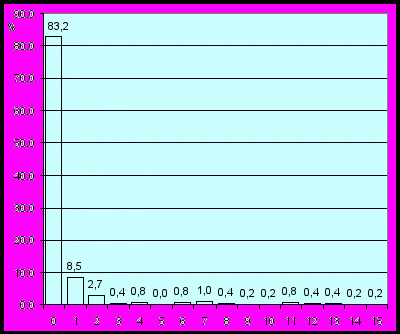
Рис. 3 Распределение случаев смерти детей с ВПР от рождения до 15 лет (%, г. Омск, 1998-2008 гг.)
Среди детей до 1 года, 64,7±2,30% случаев гибели было отмечено на первом месяце жизни, преимущественно в первые 10 суток. Наибольший удельный вес среди детей, умерших в первые 10 суток жизни, занимали аномалии сердечно-сосудистой системы (29,3±1,48%), множественные пороки развития (18,9±1,27%) и аномалии желудочно-кишечного тракта (10,1±0,98%), а доля пороков мочевой системы составила 7,4±0,85% (рис. 4).
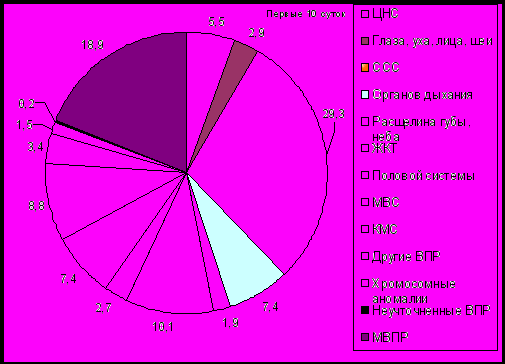

Рис. 4 Структура ВПР – причин летальности детей в первые 10 суток жизни (%, г. Омск, 1998-2008 гг.)
Проведено эпидемиологическое изучение ВПР органов мочевой системы у детей и плодов за период с 1998 по 2008 г. (табл. 3). Общая частота аномалий развития органов мочевой системы составила 2,68±0,16‰. Среднемноголетний показатель частоты рождения мальчиков с данной патологией – 2,45±0,21‰, девочек – 1,33±0,16‰; соотношение – 1,96 (p<0,001).
Таблица 3
Частота пороков мочевой системы у детей, родившихся живыми, мертвыми и плодов с пороками, элиминированных после пренатальной диагностики (‰,
г. Омск, 1998-2008 гг.)*
| Фенотипические варианты ВПР | Живорож-денные | Мертворожден- ные | Живорожден-ные+мертво-рожденные+ плоды |
| Дисплазия почки | - | 4,47±0,21 | 0,13±0,03 |
| Поликистоз почек | 0,12±0,03 | 1,12±0,10 | 0,16±0,04 |
| Врожденная одиночная киста почки | 0,01 | - | 0,02 |
| Гипоплазия почки | - | 2,24±0,15 | 0,03 |
| Эктопическая почка | 0,03 | - | 0,03 |
| Врожденная пиелоэктазия | 1,35±0,11 | 3,36±0,18 | 0,40±0,12 |
| Удвоение мочеточника | - | 1,12±0,10 | 0,01 |
| Врожденное расширение мочеточника | - | 1,12±0,10 | 0,20±0,01 |
| Врожденное отсутствие мочевого пузыря и мочеиспускательного канала | - | - | 0,20±0,01 |
| Подковообразная почка | - | - | 0,10±0,01 |
| Агенезия почки | 0,05 | 2,24±0,15 | 0,13±0,01 |
| Другие уточненные врожденные аномалии мочевыделительной системы | - | - | 0,10±0,04 |
| Агенезия мочеточника | - | - | 0,20±0,01 |
| Атрезия и стеноз мочеточника | - | - | 0,01 |
| Врожденный гидронефроз | 0,25±0,05 | 3,36±0,18 | 0,35±0,06 |
| Другие врожденные аномалии мочевого пузыря и мочеиспускательного канала | - | - | 0,01 |
| Врожденная аномалия мочевыделительной системы неуточненная | 0,10±0,03 | - | 0,11±0,03 |
| Врожденная аномалия почки неуточненная | 0,23±0,05 | - | 0,23±0,05 |
| Аномалия мочевого протока | 0,01 | - | 0,01 |
| Всего: | 2,14±0,14 | 19,02 | 2,68±0,16 |
*Примечание. Комбинированные пороки мочевой системы учитывались раздельно для наиболее точной оценки структуры.
В общей структуре аномалий развития мочевой системы у детей и плодов с наибольшей частотой регистрировались врожденные пиелоэктазии и гидронефрозы (рис. 5). В структуре пороков развития у плодов, преобладали врожденная дисплазия почек (22,50±4,18%), агенезия почки и врожденный гидронефроз (по 17,50±3,80%), у мертворожденных детей – врожденная дисплазия почек (23,50±0,13%) и врожденный гидронефроз (17,6±0,11%), а у живорожденных детей – врожденная пиелоэктазия (63,10±0,15%) и врожденный гидронефроз (11,70±0,10%).
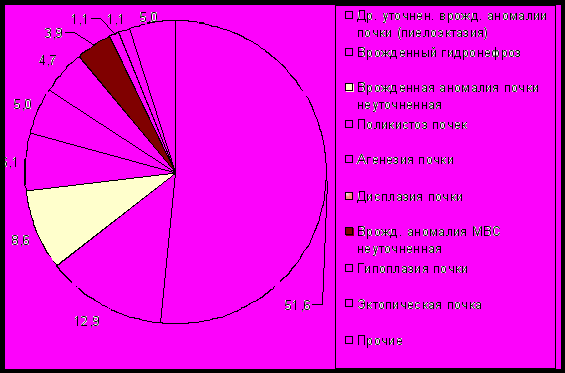
Рис. 5 Структура детей с аномалиями развития мочевой системы, родившихся живыми, мертвыми и плодов с пороками, элиминированных после пренатальной диагностики (%, г. Омск, 1998-2008 гг.)
Наибольшая частота патологии зарегистрирована в Кировском (3,43±0,38‰), Центральном (1,78±0,28‰) и Советском (1,70±0,27‰) округах. Установлено, что большинство матерей детей основной группы, проживающих в Кировском АО, работали (стаж работы от 3 до 10 лет) на предприятиях Советского (36,8±5,53% женщин, против 6,6±2,84% в группе контроля; p0,05) и Центрального округа (27,6±5,13%, против 14,5±4,04% соответственно; p0,05). В этих округах в периоде исследования регистрировались наибольшие уровни загрязнения атмосферного воздуха формальдегидом и бенз(а)пиреном.
Максимальные значения среднемноголетних показателей отмечены на территории второго педиатрического отделения детской городской поликлиники № 4 (микроучасток № 25 – 4,8‰) и филиала № 2 ДГП №2 (микроучасток № 21 – 4,4‰; рис. 6).
Темпы прироста показателей на протяжении периода наблюдения свидетельствовали о существенном увеличении частоты врожденных пороков развития органов мочевой системы во всех округах города, что было связано с улучшением диагностики в антенатальном и неонатальном периодах (рис. 7).
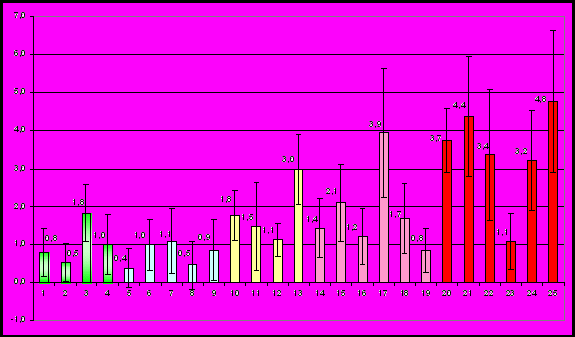
Рис. 6 Среднемноголетние показатели рождения детей с пороками развития органов мочевой системы в микроучастках г. Омска (‰, 1998-2008 гг.; 1-4 – Ленинский округ, 5-9 – Октябрьский, 10-13 – Центральный, 14-19 – Советский, 20-25 – Кировский округ)
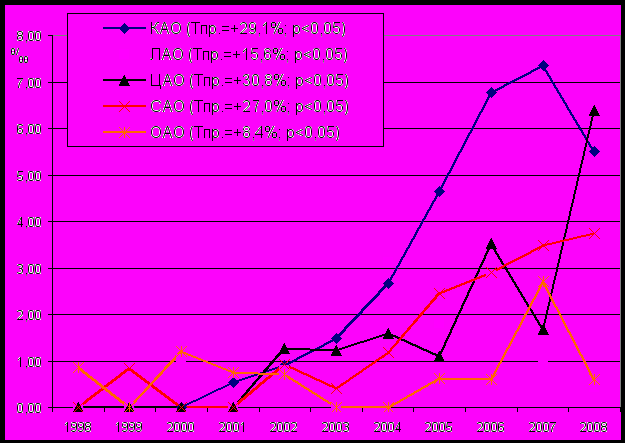
Рис. 7 Динамика частоты пороков развития мочевой системы у детей, родившихся живыми, в административных округах г. Омска, (‰, 1998-2008 гг.)
Изучена связь фактора сезонности и распределения частоты аномалий развития мочевой системы в зависимости от месяца года. Результаты исследований свидетельствовали о преобладании количества случаев рождений детей с пороками развития мочевой системы в июне, августе и сентябре, следовательно, зачатий детей в осенне-зимний период (рис. 8). Формирование аномалий развития в этот период могло быть обусловлено ролью инфекционных факторов с реализацией аэрозольного механизма передачи и возможным дефицитом микронутриентов в этот период года.
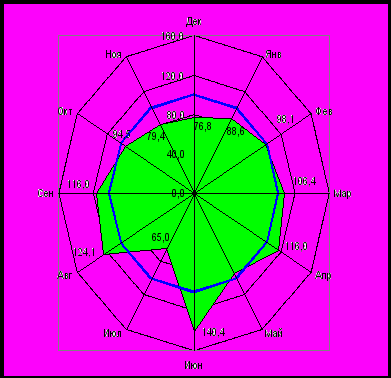
Рис. 8 Типовая кривая внутригодовой динамики рождений детей с аномалиями развития мочевой системы в г. Омске в 1998-2008 гг. (по индексам сезонных колебаний, %)
При определении параметров физического развития детей с ВПР мочевой системы установлено, что показатели массы (M±σ – 3449,5±456,6 г) и длины тела (M±σ – 52,5±2,4 см) при рождении существенно не отличались от соответствующих долженствующих показателей. Установлено, что матерям детей с ВПР мочевой системы в течение беременности были проведены курсы сохраняющей терапии, которая, возможно, способствовала рождению детей со средними показателями массы и длины тела.
Значительное преобладание врожденных пиелоэктазий в структуре аномалий мочевой системы у детей, родившихся живыми, определило вариант патологии для изучения активных факторов риска. Собственные клинические наблюдения за детьми с врожденной пиелоэктазией, сохраняющейся в 1 год жизни, потребовали изучения причин и условий возникновения и сохранения размеров дилатации чашечно-лоханочной системы почек. В связи с этим был проведен анализ клинического, лабораторного и инструментального обследования этих детей в периоде новорожденности и анализ динамики размеров лоханки у этих детей на протяжении первого года жизни.
В 67,1±5,39% врожденные стойкие пиелоэктазии регистрировались у мальчиков и в 81,6±4,45% имели одностороннюю локализацию. 86,8±3,88% детей основной группы были доношенные, 13,2±3,88% – недоношенные, из них недоношенных детей II степени было 3,9±2,23%. В группе контроля 96,1±2,23% детей родились в срок, а 3,9±2,23% новорожденных имели I степень недоношенности. В течение первых трех суток жизни в родильном доме состояние новорожденных основной группы ухудшалось, что потребовало их перевода в Городской клинический перинатальный центр. При поступлении в отделение патологии новорожденных состояние детей было обусловлено преимущественно неврологической симптоматикой, нарастающей желтушностью кожного покрова и конъюгационной гипербилирубинемией (табл. 4).
Таблица 4
Основные клинические проявления поражения органов и систем организма
у детей основной и контрольной групп, %
| Симптомы и синдромы | Основная группа | Контрольная группа |
| Клинические Иктеричность кожи Мышечная гипотония Гипорефлексия Синдром угнетения Пастозность подкожно-жировой клетчатки Акроцианоз Мраморность кожного покрова Гепатомегалия Синдром вегето-висцеральных дисфункций Повышение температуры до фебрильных цифр Спленомегалия | 93,4±2,84 68,4±5,33 68,4±5,33 63,2±5,53 32,9±5,39 31,6±5,33 23,7±4,88 15,8±4,18 10,5±3,52 7,9±3,09 5,3±2,56 | 0,0±0,93* 23,7±4,88* 22,4±4,78* 10,5±3,52* 3,9±2,23* 6,6±2,84* 3,9±2,23* 2,6±1,84** 2,6±1,84*** 0,0±0,93*** 0,0±0,93*** |
| Лабораторные Коньюгационная гипербилирубинемия Наличие антигена цитомегаловируса в моче Анемия Гипопротеинемия Увеличение аланинаминотрансферазы в крови Лейкоцитоз Моноцитоз | 94,7±2,56 90,8±3,32 19,7±4,57 19,7±4,57 11,8±3,71 6,6±2,84 2,6±1,84 | 10,5±3,52* 5,9±2,70* 5,3±2,56* 5,3±2,56* 0,0±0,93* 0,0±0,93*** 0,0±0,93 |
| Инструментальные Отек перивентрикулярных тканей (по данным нейросонографии) | 80,3±4,57 | 2,6±1,84* |
*– pφ0,001; ** – pφ0,01; *** – pφ0,05
При анализе проб мочи методом РИФ у 90,8±3,32% детей с врожденными пиелоэктазиями были выделены антигены цитомегаловируса, при этом высокоавидные антитела имели 89,9±4,45% новорожденных (ИФА). Антитела средней авидности обнаружены у 4,3±2,23% детей, а низкоавидные антитела у 5,8±2,56% детей (рис. 9). При обследовании детей контрольной группы антиген к ЦМВ был обнаружен в 5,9±2,70% (pφ0,001).
Дополнительные исследования (РИФ) показали наличие микст-инфекции у 5,3±2,56% детей основной группы (ЦМВ и вирус Эпштейна-Барр), у 6,6±2,84% детей выявлено сочетание ЦМВ и ВПГ I типа.
В I год жизни у 94,7±2,56% детей основной группы размеры почечной лоханки не уменьшались и составили в среднем 8,5±0,37 мм., что практически соответствовало количеству детей, выделявших в периоде новорожденности антиген цитомегаловируса (90,8±3,32%), а у 5,3±2,56% детей была диагностирована гидронефротическая трансформация. Можно предположить, что наличие инфекционного процесса способствовало сохранению расширенных размеров лоханки, и рассматривать пиелоэктазию у таких детей как вторичную аномалию развития на фоне внутриутробной инфекции.
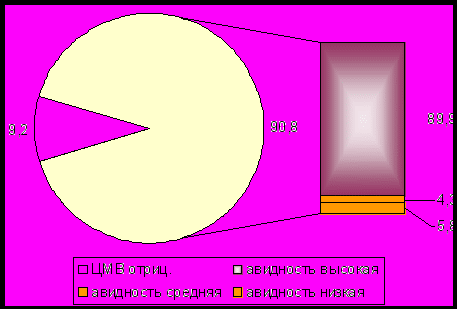
Рис. 9 Распределение индекса авидности у новорожденных детей до 10 дней жизни с врожденной пиелоэктазией, %
Все матери детей основной и контрольной группы были обследованы на ЦМВ. 12,0±3,88% женщин основной группы из числа обследованных имели латентную форму ЦМВИ, 60,0±5,53% имели персистирующую форму ЦМВИ, у 28,0±3,32% женщин был отрицательный результат обследования.
30,0±5,39% беременных контрольной группы имели латентную форму ЦМВИ, у 52,0±5,72% женщин был отрицательный результат обследования, а 18,0±4,57% женщин имели персистирующую форму ЦМВИ.
На основании клинико-анамнестических данных среди многих вероятных факторов определены следующие информативные факторы риска врожденной стойкой пиелоэктазии: рабочие профессии, самопроизвольные аборты неустановленного генеза в анамнезе, пассивное курение во время беременности, отягощенный наследственный анамнез матери по наличию хронических заболеваний органов мочевой системы, ОРЗ у женщины во втором триместре, наличие антигена цитомегаловируса у женщины во время беременности (табл. 5).
Для каждого информативного фактора в основной и контрольной группах рассчитаны диагностические коэффициенты (ДК) в битах и построена таблица прогноза. Сложение ДК при анализе информативных факторов риска в семье позволяет получить определенную сумму битов информации. Если она при сравнении двух гипотез «риск» и «отсутствие риска» превышает предел «+13», то вероятность отклонить гипотезу «отсутствие риска» и принять альтернативную гипотезу о наличии в семье риска рождения ребенка с врожденной пиелоэктазией равна 95,0%. Если сумма ДК превышает предел «+19», то этот выбор будет сделан с вероятностью в 99,0%
