Н. Н. Каншин Хирургическое лечение послеоперационного перитонита, вызванного несостоятельностью кишечных швов Лекция
| Вид материала | Лекция |
- Диагностика и хирургическое лечение заболеваний гепатопанкреатодуоденальной зоны. Целями, 71.79kb.
- Тема Абсцесс, гангрена легкого и бронхоэктатическая болезнь, 394.58kb.
- План реферата Определение перитонита Классификация перитонита Этиология и патогенез, 750.09kb.
- 1. Параректальные свищи. Этиология. Патогенез. Классификация. Клиника. Диагностика., 80.83kb.
- А. Г. Краснояружский Хирургическое лечение компрессионного синдрома средостения, обусловленного, 162.81kb.
- Методические рекомендации для практического занятия №11, 107.83kb.
- Тема : Хирургическое лечение осложнённого неспецифического язвенного колита. Болезнь, 118.83kb.
- Ангелы в белых халатах, 23.11kb.
- Эндост Мотор Апекс доклад, 94.79kb.
- «Санкт-Петербургский государственный медицинский университет им акад. И. П. Павлова», 252.91kb.
Проф. Н.Н.Каншин
Хирургическое лечение послеоперационного перитонита,
вызванного несостоятельностью кишечных швов
(Лекция для молодых хирургов)
Хирургическое лечение послеоперационного перитонита, вызванного несостоятельностью кишечных швов — М.: ПРОФИЛЬ, 2004 - 64 с.
Лекция посвящена актуальной проблеме брюшной хирургии - послеоперационному перитониту.
Предлагая способы решения хирургических проблем этой нестандартной клинической патологии, автор опирается как на свой большой опыт в данной области, так и на достижения всего коллектива НИИ скорой помощи им. Н.В.Склифосовского.
Доступность изложения, четкость формулировок, иллюстративный материал, представленный в книге, помогут хирургам расширить арсенал средств эффективной помощи пациентам, попавшим в тяжелую и опасную ситуацию. В центре внимания автора находятся конкретные вопросы хирургической тактики и необходимые средства, которые могут спасти больного.
Издание адресовано молодым хирургам, начинающим оперировать на органах брюшной полости.
Введение
Послеоперационный перитонит по определению Н.А.Ефименко (1995) является осложнением, развивающимся «после плановых оперативных вмешательств на передней брюшной стенке и органах брюшной полости, а также после экстренных абдоминальных операций, которым не предшествовал перитонит». Послеоперационный перитонит не следует смешивать с продолжающимся перитонитом.
В хирургических отделениях крупных клинических больниц, являющихся базами хирургических кафедр, послеоперационный перитонит наблюдается относительно редко, что не дает возможности хирургам приобрести достаточный практический опыт в диагностике и лечении этой «многоликой» патологии. В «рядовых» стационарах, где работают хирурги различного, в том числе и недостаточно высокого, уровня квалификации послеоперационный перитонит наблюдается чаще, но и в этих учреждениях он все-таки является раритетной патологией.
Помимо наблюдений в своей клинике нам достаточно часто приходилось консультировать больных с послеоперационным перитонитом в различных лечебных учреждениях Москвы и других городов. Нередко это были пациенты, уже оперированные по поводу послеоперационного перитонита и затем перенесшие в связи с новыми осложнениями неоднократные релапаротомии с безуспешными попытками ушить дефект кишечной стенки или выполнить ререзекцию несостоятельного анастомоза в условиях тяжелого нагноения. У этих пациентов теперь уже приходилось заниматься лечением «продолжающегося перитонита» и несформированных кишечных свищей.
Ряд больных с послеоперационным перитонитом в 80-х годах прошлого столетия мы имели возможность переводить в свою клинику и нередко принимали участие в лечении (как периодически и в настоящее время) в других лечебных учреждениях.
В процессе лечения при ликвидации источника послеоперационного перитонита или уже имеющихся кишечных свищей нередко возникала необходимость находить неординарный выход из сложного положения, позволявший получать успех в нестандартных условиях тяжелого гнойного процесса с наличием сквозного дефекта кишечной стенки.
Об основных наших принципах лечения рассматриваемой патологии мы сообщали в целом ряде печатных работ, в частности (достаточно подробно) в монографии «Несформированные кишечные свищи и гнойный перитонит» (1999). Малый тираж книги сделал ее фактически неизвестной широкой массе практических хирургов.
Лучшие результаты лечения послеоперационного перитонита в крупных городах, безусловно, могут быть получены в специализированном хирургическом стационаре, концентрирующем этих пациентов и имеющем выездную бригаду консультантов. Специалисты этой бригады могли бы в особо острых ситуациях производить экстренные операции по месту вызова, переводя затем этих пациентов для наблюдения и долечивания в свой специализированный стационар. Переводу бы также подлежали больные с менее настоятельными показаниями к неотложной операции, с неясным диагнозом в момент консультации и осложненным течением послеоперационного периода.
На протяжении многих и многих лет мы безуспешно пытались добиться создания в Москве подобного городского хирургического отделения абдоминальной гнойной патологи, находя при этом понимание большой значимости данной проблемы у руководителей московского здравоохранения. Вопрос всегда упирался в сложности финансирования. Перспектив создания такого отделения мы не видим и в настоящее время.
Московский городской НИИ скорой помощи им. Н.В.Склифосовского периодически организует семинары для практических хирургов Москвы по наиболее острым проблемам экстренной хирургии, в том числе и по вопросам диагностики и лечения послеоперационного перитонита. В дополнение к этим мероприятиям мы написали данное иллюстрированное схематичными рисунками краткое руководство («лекцию»), адресованное в основном новому поколению хирургов.
В «лекции» мы рассматриваем чисто хирургическую часть проблемы, не освещая достижения современной комплексной общей терапии, проводимой при перитоните.
Некоторые возможности снижения частоты послеоперационного перитонита
Наиболее частой причиной развития послеоперационного перитонита является несостоятельность кишечных швов, причем частота этого осложнения наиболее высока при операциях на толстой кишке, как на «загрязненном» органе. Однако в литературе эта частота указывается в очень широком диапазоне: от 3% до 50% и выше. Причиной этого является как неоднородность клинического материала, так и неодинаковая квалификация оперировавших хирургов.
Разницу в результатах операций на полых органах брюшной полости, выполняемых рядовыми и более опытными хирургами, в известной степени может сгладить использование современных скобочных сшивающих аппаратов, тем более в труднодоступных для наложения ручных нитяных швов анатомических областях.
Кроме того, современное механическое аппаратное анастомозирование протекает значительно более асептично, чем наложение ручных швов, выполняемое на «открытой» кишке, и почти не приводит к инфицированию операционного поля.
Вместе с тем, пользуясь в конце 60-х годов наложением механических скобочных швов при гастрэктомии и передней резекции прямой кишки (отечественными сшивающими аппаратами ПКС-25 и КЦ-28), мы в последующем при эндоскопических исследованиях (с помощью жесткого эзофагоскопа Брюнингса и металлического ректоскопа) обнаруживали в зоне анастомоза тканевые разрастания, подозрительные на местный рецидив опухоли. По данным биопсии разрастания оказывались небольшими воспалительными гранулемами, содержавшими в своей толще металлическую скобку. Так же ведут себя и длительно отторгающиеся в просвет органа нитяные швы при заживлении анастомоза без развития несостоятельности. В более отдаленном периоде воспалительная реакция вокруг этих «инородных тел» приводит к частичному рубцовому сужению даже полностью состоятельного анастомоза.
Однако послеоперационный перитонит может развиваться и при физической герметичности кишечных швов (как ручных нитяных, так и механических скобочных). Так, при изучении послеоперационного перитонита на клиническом материале ряда лечебных учреждений Н.А.Ефименко (1995) отметил, что, хотя наиболее частой причиной перитонита явилась несостоятельность швов анастомозировнных или ушитых полых органов, но в целом ряде наблюдений причиной перитонита оказалось проникновение в брюшную полость кишечной микрофлоры при физической герметичности швов. С.А.Шалимов с соавт. (1989) при анализе причин развития перитонита на секционном материале в 12 наблюдениях установили перитонит при наличии физически герметичных швов.
« Биологическая негерметичность» кишечных швов, была подробно изучена в свое время А.А.Запорожцем (1968). Микроорганизмы проникают в брюшную полость из просвета кишки по ходу шовного материала, вызывая (при наличии физической герметичности швов!) локальный отграничивающий спаечный процесс, препятствующий развитию перитонита. Перитонит развивается при нарушении этой защитной реакции организма.
Вместе с тем «биологическая негерметичность» анастомозов, в отличие от нитяного и скобочного швов, отсутствует при компрессионном методе анастомозирования, который известен в медицине с 1826 года и в свое время получил клиническое воплощение в «пуговке» Мерфи.
В конце XIX и в начале XX столетий «пуговка» Мерфи достаточно широко использовалась хирургами многих стран, включая и Россию. Однако в связи с тем, что устанавливать ее вручную было весьма сложно и, будучи металлической, тяжелая «пуговка» создавала опасность образования пролежней кишечной стенки, увлечение это постепенно прошло.
Проведенные в нашей клинике в 70-х годах прошлого столетия эксперименты на животных (с использованием ряда специально созданных оригинальных сдавливающих устройств) показали, что компрессионные анастомозы напоминают скорее врожденное межкишечное соустье, чем созданный хирургическим путем анастомоз. Со стороны слизистой такой анастомоз можно различить лишь по несовпадению рисунка складок слизистой оболочки.
Экспериментальные компрессионные анастомозы не имели тенденции к рубцовому сужению и не были окружены в брюшной полости спаечным процессом, что свидетельствовало об их биологической герметичности.
Морфологические исследования толсто кишечных анастомозов, проведенные патоморфологом академиком Н.К.Пермяковым, подтвердили, что заживление соустья происходит к периферии от зоны компрессии по типу первичного натяжения с минимальной воспалительной реакцией и без образования грубого рубца. Кроме того, компрессионное соединение создает абсолютный гемостаз.
В содружестве с инженерами-конструкторами И.А.Гуськовым и А.Е.Сачковым нами был создан аппарат компрессионного действия АКА-2 (многоразового использования), в котором принцип, присущий компрессионной «пуговке» Мерфи, был объединен с принципом конструкции механической части отечественного скобочного сшивающего аппарата ПКС-25. Аппарат АКА-2 получил достаточную распространенность в СССР и в ряде зарубежных стран. В ответ на просьбу японской фирмы Ишео-Иваи был создан пластикатный аппарат одноразового использования АКА-4. Его большими партиями закупала Япония вплоть до периода известных негативных «перемен», произошедших в отечественной промышленности в 90-х годах.
К настоящему моменту сшивающие аппараты АКА-2 и АКА-4 в значительной степени морально устарели. В связи с этим совместно с инженером В.А.Липатовым нами сконструированы более совершенные сшивающие компрессионные аппараты следующего поколения, обозначенные как аппараты АСК. Их в настоящее время небольшими сериями выпускает в Москве отечественная фирма «Инжемед». О приобретении сшивающих аппаратов АСК можно получить справку по телефонам: (095) 318-98-28, 334-89-04, 420-91-18, 137-55-79 или моб. 8-910-435-72-59.
Прямой аппарат АСК-22 (рис. 1) с соединительными кольцами диаметром 22 мм используется нами для наложения компрессионных анастомозов на пищеводе (при гаст-
г» _
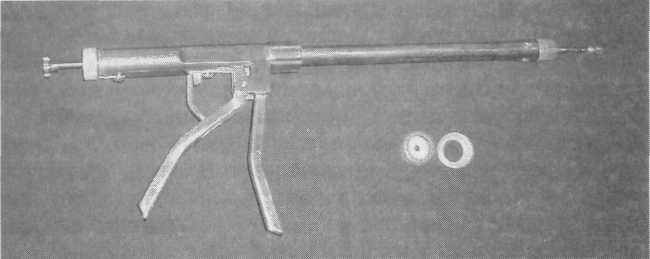
Рис. 1. Сшивающий хирургический аппарат АСК-22
рэктомии) и тонкой кишке (в том числе при формировании энтероколоанастомозов). К аппарату прилагается металлический стержень, временно соединяемый с короткой частью центрального штока для удобства удерживания последнего в период затягивания кисетного шва на пищеводе.
Аппарат АСК-29 (с соединительными кольцами диаметром 29 мм), имеющий изогнутый корпус (рис. 2) предназначается для формирования компрессионных анастомозов на толстой кишке, включая прямую кишку.
Принципиальные изменения при создании аппаратов АСК внесены в конструкцию сдавливающих элементов. Так, вместо жестких подпружиненных металлическими пружинами сдавливающих элементов, использовавшихся в аппаратах АКА, в аппаратах АСК применены амортизирующие резиновые кольца, имеющие форму покрышки автомобильного колеса. Такое кольцо фиксируется прокалываюшими иглами на легко отделяемой от аппарата короткой части центрального штока.
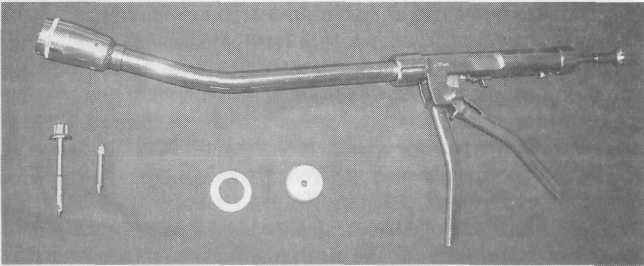
Рис. 2. Сшивающий хирургический аппарат АСК-29.
На переднем конце находящейся в аппарате АСК-29 длиной части штока помещен заостренный «наконечник», удлиняющий шток и облегчающий его проведение через кишечную стенку (например, при восстановительном вмешательстве после операции Гартмана или при наложении анастомоза «бок в конец»).
«Наконечник» в ходе наложения анастомоза можно легко отделить от штока. Столь же легко производится стыковка с длинным штоком короткой части штока, на которой помещено игольчатое кольцо с резиновым «амортизатором».
Эластичный резиновый «амортизатор» обеспечивает мягкую компрессию соединяемых тканей по всей окружности анастомоза даже и в случаях неравномерного (создающего утолщенные складки) сборивания кишечных стенок кисетным швом при его затягивании. Вследствие этого (в отличие от жестких колец аппаратов АКА) при «прошивании» аппаратом АСК отсутствует опасность перекоса по отношению друг к другу сдавливающих элементов с возможным нарушением герметичности анастомоза.
Центральнее прокалывающих игл у резинового кольца имеется полость, в которую при операции достаточно легко удается погрузить избыток стянутых кисетным швом тканей. Такое погружение избытка тканей устраняет опасность их выхождения за пределы зоны прокалывания и компрессии и дает также возможность накладывать анастомоз кольцами диаметром 29 мм даже на достаточно широкие кишечные отрезки.
Методика формирования анастомозов аппаратом АСК близка к методике выполнения аналогичных операций с использованием современных циркулярных скобочных сшивающих аппаратов. Существенное отличие заключается в том, что сближение соединяемых кишечных отрезков До нужной «отметки» осуществляется не вращением специальной «гайки», а простым вытягиванием рукой из аппарата центрального штока до момента автоматической фиксации его в исходном для прошивания тканей положении.
Вслед за этим посредством нажатия подвижной рукоятки аппарата последовательно в одну, затем в другую сторону происходит вначале прокалывание иглами (при первом нажатии), а затем (при втором нажатии) — прорезывание тканей цилиндрическим ножом. После осуществленного таким путем формирования компрессионного анастомоза аппарат беспрепятственно извлекается из просвета кишечника.
Как и при использовании аппаратов АКА, отсутствует необходимость в наложении серо-серозных ручных швов.
В многочисленных клинических наблюдениях было установлено, что, в отличие от жестких сдавливающих элементов аппаратов АКА, сдавливающий резиновый амортизатор аппарата АСК, создавая мягкую, не раздавливающую соединяемые ткани, компрессию, приводят к несколько более позднему (через 9-12 дней) отторжению сдавливающих колец в просвет кишки, т.е. в период уже абсолютно надежного срастания анастомоза.
Нашими сотрудниками проведено сравнительное изучение результатов формирования анастомозов на толстой кишке тремя различными методами. На двух клинических базах (городская больница № 3 в городе Зеленограде и Клинический госпиталь ГУВД г. Москвы) за 13-летний
Осложнения при формировании толстокишечных анастомозов
| Осложнения | Ручные швы (162) | Аппарат АКА (51) | Аппарат АСК (104) |
| Нагноение лапаротомной раны | 27(16, 6%) | 6(11,8 %) | 4 (3,8 %) |
| Абсцесс брюшной полости | 8 (4,9 %) | 2 (3,9 %) | 0 |
| Несостоятельность швов анастомоза | 11 (6,8 %) | 2 (3,9%) | 2 (1,9%) |
| Летальность | 18 (11,1%) | 2 (3,9%) | 2(1,9%) |
период (1990 — 2003 годы) при операциях на толстой кишке 162 раза для наложения анастомозов были использованы ручные нитяные швы, 51 раз аппараты АКА-2 или АКА-4, 104 раза аппараты АСК. В этой статистике не рассматриваются многочисленные операции с наложением анастомозов бок в бок аппаратами НЖКА-60, снабженными силиконовыми «фиксаторами компрессии».
В таблице отражены осложнения, возникшие при трех наиболее доступных отечественным хирургам типах формирования анастомозов.
Конструкция аппаратов АКА из-за отсутствия разборного штока не позволяет осуществлять формирование анастомоза столь же асептично, как аппаратом АСК, приближая этот этап работы на «открытой кишке» к условиям наложения ручного анастомоза. Это, видимо, и явилось причиной значительного числа нагноений лапаротомной раны (11,8%) при использовании аппаратов АКА.
Приведенные в таблице результаты операций на толстой кишке четко свидетельствуют о несомненных преимуществах формирования анастомозов аппаратом АСК, особенно по сравнению с ручными нитяными швами.
Современные циркулярные скобочные одноразовые сшивающие аппараты использованы нами лишь в небольшом числе наблюдений (были отмечены как единичные случаи несостоятельности, так и выраженное кровотечение из линии шва).
Использованный при операции металлический аппарат АСК после механической очистки (с промыванием его деталей) и последующей сухожаровой стерилизации может быть повторно применен с новыми (недорогими по цене) сдавливающими кольцами почти неограниченное число раз. Это дает существенный экономический эффект по сравнению с использованием одноразовых скобочных сшивающих аппаратов. В случае необходимости затупившийся при многочисленных операциях цилиндрический нож может быть легко заменен новым.
Роль кишечной интубации как метода лечения тонкокишечной непроходимости в уменьшении частоты послеоперационного перитонита
Одной из нередких причин возникновения послеоперационного перитонита, как мы на протяжении многих лет убеждаемся при консультациях в различных стационарах, является экстренное хирургическое вмешательство по поводу острой спаечной тонкокишечной непроходимости. При выделении из обширных прочных плоскостных сращений тонкокишечных петель, растянутых «застойным» содержимым, хирург либо десерозирует кишку на отдельных участках, либо даже наносит сквозное ранение. Зашивание дефекта на петлях с нарушенной микроциркуляцией даже несмотря на длительную назоеюнальную декомпрессию может привести к несостоятельности, вызывающей развитие послеоперационного перитонита (смотри раздел, посвященный несостоятельности швов тонкой кишки).
Вместе с тем в институте им. Н.В.Склифосовского при большой серии операций по поводу спаечной тонкокишечной непроходимости послеоперационный перитонит не возник ни разу. Это напрямую можно связать с применением в институте кишечной интубации, выполняемой у всех больных с кишечной непроходимостью сразу же после подтверждения диагноза с использованием рентгеновского и ультразвукового исследований.
Методика выполнения и лечебная роль кишечной интубации при данной патологии достаточно подробно освещены А.С.Ермоловым, А.Г.Лебедевым и Н.С.Утешевым в изданном сборнике «Назоеюнальная интубация в неотложной хирургии» (2003). Для интубации используется двухканальный силиконовый зонд ЖКС-25 с наружным диаметром 8,2 мм.
В аспирационный канал зонда после заполнения его вазелиновым маслом вводят «до упора» гибкую металлическую струну (мандрен). На конце зонда имеется небольшая нитяная петля для захвата ее биопсионными цапками. После предварительного опорожнения желудка (по достаточно широкому желудочному зонду) трансназально в желудок вводят зонд ЖКС-25. После этого выполняют фиброгастроскопию. Биопсионными цапками захватывают конец зонда и под визуальным контролем проводят его в двенадцатиперстную кишку и начальный отдел тощей кишки. Раскрывают цапку, освобождая зонд от фиксации, и извлекают гастродуоденоскоп. Металлический мандрен, придающий зонду ригидность, препятствует скольжению относительно мягкого зонда вслед за удаляемым эндоскопом. Последующее извлечение из канала зонда струны-мандрена облегчается наличием в просвете зонда вазелинового масла.
Расположение зонда в пищеварительном тракте контролируют введением по зонду под рентгенологическим контролем водорастворимого контрастного вещества.
В дальнейшем наряду с общей инфузионной терапией проводят постоянную аспирацию по аспирационному каналу зонда (с помощью отсасывателя ОП-01) при одновременном вливании по второму каналу солевого раствора.
Кишечная интубация позволяет в большинстве случаев добиваться разрешения непроходимости и выписывать больных без хирургического вмешательства.
На городской научно-практической конференции (2001 г.), было сообщено о 890 больных, поступивших в институт с тонкокишечной непроходимостью, из них, в результате применения кишечной интубации операция оказалась необходимой лишь у 273. При этом ни разу не развился послеоперационный перитонит (как и при аналогичных наблюдениях в последующие 2 года). У 124 из 273 оперированных больных имелась странгуляционная спаечная непроходимость, достаточно легко ликвидируемая хирургическим путем (либо посредством простого пересечения спаечного тяжа, либо посредством резекции участка тонкой кишки при отсутствии резко выраженного ее переполнения содержимым).
При обширном спаечном процессе кишечная интубация оказалась эффективным методом консервативного лечения кишечной непроходимости, избавившим многих больных от, казалось бы, необходимого хирургического вмешательства. Но именно при этой форме непроходимости в учреждениях, не применяющих кишечную интубацию и выполняющих экстренную операцию у всех больных с кишечной непроходимостью в соответствии с общепринятыми показаниями, особенно часто возникает послеоперационный перитонит.
Таким образом, лечебную кишечную интубацию можно отнести к одному из путей, ведущих к «профилактике» (существенному снижению числа) послеоперационного перитонита.
Диагностика послеоперационного перитонита
Диагностика послеоперационного перитонита не вызывает затруднений в тех случаях, когда это осложнение развивается по типу внезапной внутрибрюшной катастрофы, а также при появлении по «страховочным» дренажам отделяемого с примесью кишечного содержимого.
При появлении по дренажу лишь «подозрительного» по цвету отделяемого дальнейшая тактика обусловливается результатами оценки общих симптомов возможного осложнения в сочетании с данными экстренно проводимого обследования. Иногда больному предлагают выпить (или вводят по зонду) интенсивно окрашенный индифферентный раствор.
Хирург, наблюдающий больного в послеоперационном периоде, должен четко представлять, что при постепенном развитии послеоперационного перитонита может отсутствовать выраженная боль в животе, могут отсутствовать такие классические симптомы перитонита как напряжение мышц брюшной стенки и симптом Щеткина-Блюмберга.
Чаще всего при развитии послеоперационного перитонита на третий-пятый дни послеоперационного периода появляются учащение пульса, медленно нарастающее вздутие живота с ослаблением и затем исчезновением перистальтических шумов (хотя в самом начале перистальтика может быть даже усиленной), прекращение отхождения газов. Появляются признаки эйфории, может повыситься температура тела, начинает нарастать лейкоцитоз.
От ранней спаечной кишечной непроходимости послеоперационный перитонит отличает наличие на обзорных рентгенограммах газа в толстой кишке и нередкое появление в зоне катастрофы «дежурной» петли тонкой кишки, заполненной небольшим количеством газа. Большую помощь в диагностике способна оказать компьютерная томография.
Ультразвуковая диагностика, являясь весьма ценным методом исследования, нередко (например, при отсутствии в брюшной полости скоплений жидкости) оказывается, в лучшем случае, неубедительной. Выполнять это исследование должен опытный специалист, повторяя его в динамике при недостаточно убедительных данных.
Большую помощь в диагностике послеоперационного перитонита способна оказать лапароскопия.
Лечение
При появлении даже части перечисленных выше клинических признаков, указывающих на послеоперационный перитонит, очень опасна чрезмерно продолжительная выжидательная тактика.
«Напрасная» релапаротомия, выполненная при появлении тревожной клинической картины, менее опасна, чем длительное промедление с операцией в ожидании абсолютной уверенности в правильности грозного диагноза. Опыт показывает, что при возникновении подозрения на послеоперационный перитонит напрасными такие релапа-ротомии оказываются достаточно редко.
Для получения успеха от применявшихся нами при лечении послеоперационного перитонита не всегда стандартных методик необходимо иметь в хирургическом отделении некоторый запас двухканальных дренажных трубок и устройства для длительной аспирации по ним. Разработка моделей таких силиконовых дренажей и зондов, получивших достаточно широкое распространение, проводилась нами в институте им. Склифосовского совместно с рядом сотрудников.
Двухканальные дренажи
Эти трубки предназначены для аспирационно-промывного лечения как перитонита, так и нагноительных процессов самой различной локализации. К сожалению, нередко хирурги нового поколения, устанавливая при операциях имеющиеся в их распоряжении такие дренажи, не в полной мере используют их функциональные возможности.
На протяжении уже почти 30 лет отечественная промышленность в подмосковном городе Мытищи выпускает разработанные нами совместно с инженером Л.З. Хазеном и нашим сотрудником Ю.М.Максимовым двухканальные силиконовые трубки ТММК, на которые было получено авторское свидетельство на изобретение.
Канал малого диаметра расположен в сегментарном утолщении стенки трубки, вследствие чего более широкий канал имеет в поперечном сечении форму усеченного круга. Из-за эластичности силикона жесткий трубчатый штуцер, введенный в этот канал, обеспечивает хорошую герметичность при соединении данного канала с трубкой, по которой осуществляется аспирация.
По нашей инициативе серийно выпускаются также силиконовые трубки, разделенные внутренней перегородкой на два равновеликих канала.
Кратко осветим способы подготовки к использованию двухканальных дренажных трубок. Подготовка обычно осуществляется непосредственно перед дренированием.
На конце дренажных трубок ТММК (имеющих узкий и широкий каналы) на протяжении около 8 мм тонкими остроконечными ножницами или кончиком скальпеля иссекают перегородку между обоими каналами (Рис. 3). Подготовленный таким образом конец трубки помещается в дренируемую полость. Созданное сообщение между каналами позволяет при аспирации по широкому каналу с одновременным вливанием жидкости по узкому каналу промывать широкий канал (Рис. 4). Это предупреждает его закупорку фибрином и экссудатом.
При использовании одноканальных дренажных трубок, устанавливаемых для спонтанного оттока по ним (или для постоянной аспирации по принципу Редона) легко происходит их
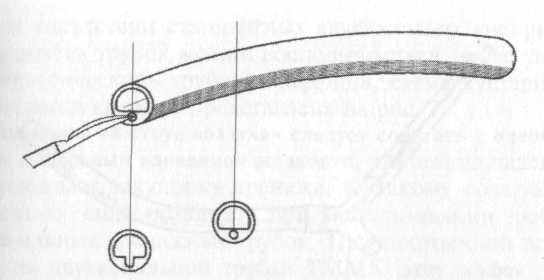
Рис. 3. Иссечение перегородки между двумя каналами на конце дренажной трубки
ТММК
закупорка, превращающая трубчатый дренаж в «монолитное» инородное тело, содержащее инфицированные фибринные сгустки.
В широком канале трубки ТММК на участке, который должен быть помещен в дренируемую полость, просекают боковые отверстия, размеры которых должны быть меньше (!) ширины канала. Это предупреждает внедрение через отверстия в период аспирации (даже при малой степени разрежения) окружающих тканей, нарушающих проходимость канала.
Формировать боковые отверстия удобно кончиками костных кусачек Люера.
При отсутствии стандартных двухканальных
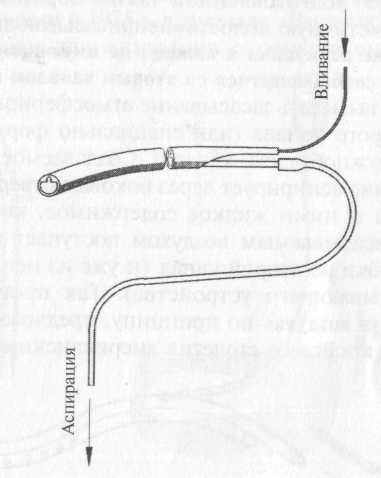
Рис. 4. Дренажная трубка ТММК, подготовленная к использованию
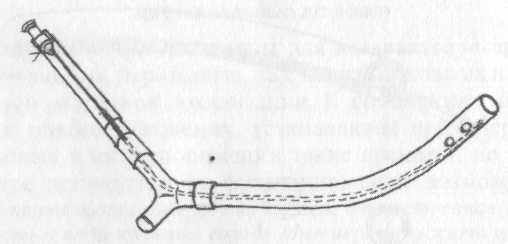
Рис 5. Кустарно изготовленное «подобие» трубки ТММК
трубок ТММК их «подобие» можно изготовить кустарно (рис. 5).
У двухканальных трубок, имеющих два равновеликих канала, на конце дренажа на протяжении 12-15 мм иссекают перегородку, разделяющую оба канала. Относительно небольшие боковые отверстия высекают на одном из каналов на участке, погружаемом в полость (рис. 6).
У подготовленной таким образом и установленной в герметичную полость «неприсасывающейся» трубки подключение аспирации к каналу, не имеющему боковых перфораций (но сообщающегося со вторым каналом на конце дренажа) будет вызывать засасывание атмосферного воздуха через торец второго канала (или специально формируемое отверстие в наружной части канала). Создаваемое в этом канале разрежение аспирирует через боковые отверстия находящееся рядом с ними жидкое содержимое, которое затем вместе с присасываемым воздухом поступает на дистальном конце трубки во второй канал (и уже из него в банку-сборник отсасывающего устройства). Так происходит аспирация «в струе воздуха» по принципу, предложенному еще в 40-х годах прошлого столетия американским хирургом Чаффином.
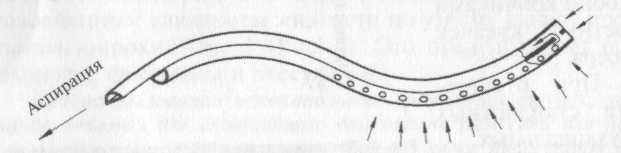
Рис. 6. Двухпросветная «неприсасывающаяся» дренажная трубка
При отсутствии стандартных двухканальных «неприса-сываюшихся» трубок можно воспользоваться менее удобной «классической» трубкой Чаффина, схема кустарного изготовления которой представлена на рис. 7.
Аспирацию «в струе воздуха» следует сочетать с одновременным капельным вливанием жидкости, что весьма надежно предупреждает закупорку дренажа. К такому сочетанию желательно чаще прибегать при использовании любых двухканальных дренажных трубок. При постоянной аспирации по двухканальной трубке ТММК этот эффект достигается подключением к системе капельного вливания жидкостей подсоса воздуха по инъекционной игле, соединенной с отрезком тонкой трубки, свободный конец которой должен находиться несколько выше сосуда с вливаемой жидкостью (рис. 8).
Первоначально аспирацию по дренажным трубкам мы осуществляли с помощью аквариумных виброкомпрессоров, переоборудованных в микровиброотсасыватели (о способе такого переоборудования аквариумного виброкомпрессора ВК-1 было сообщено нами в 1975 г. в журнале «Вестник хирургии»). В дальнейшем для аспирации с регулируемым
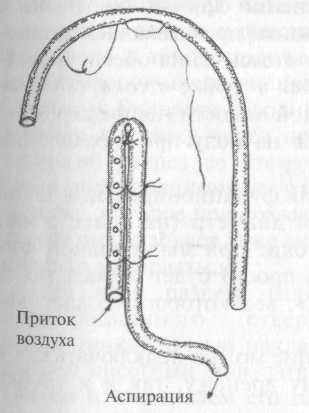
рис. 7. Схема кустарного изготовления «неприсасывающейся» дренажной трубки Чаффина
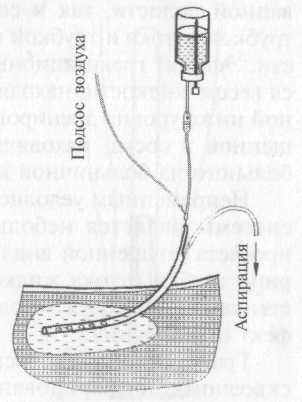
Рис. 8. Подключение подсоса воздуха к аспирационно-промывной дренажной трубке ТММК.

Рис. 9. Отсасыватель послеоперационный ОП-О1
уровнем разрежения стали пользоваться созданными инженером Л.Л.Лавриновичем (при частичном нашем участии) послеоперационными отсасывателями ОП-01 (рис. 9), создающими разрежение в пределах от 10 до 50 см водяного столба. В самое последнее время то же предприятие приступило к выпуску боле компактных модернизированных отсасывателей ОП-2.
При отсутствии отсасывающих устройств с успехом может быть применено многократное на протяжении суток отсасывание шприцем Жане, сочетающееся с промыванием, а также подключение гравитационной («пассивной») аспирации.
Для успешного использования гравитационной аспирации необходима надежная герметичность как дренированной полости, так и соединений дренажной трубки с трубкой оттока и трубкой вливания промывающей жидкости. Эффект гравитационного отсасывания обеспечивается весом жидкости, находящейся в трубке оттока, опущенной ниже уровня дренированной полости (например, опущенной в сосуд, находящийся на полу при нахождении больного на больничной койке).
Непременным условием для функционирования такой системы является небольшой диаметр (не более 5 мм) просвета опущенной вниз трубки. При значительной ширине трубки оттока жидкость просто будет стекать по ее стенкам, не образуя «столбик», вес которого создает эффект отсасывания.
Гравитационное отсасывание можно подключать как к сквозному перфорированному дренажу, так и к трубке ТММК.
Хорошо зарекомендовали себя при лечении послеоперационного перитонита латексные катетеры Пеццера, с помощью которых мы, в частности, формируем разработанную нами подвесную компрессионную энтеростому, имеющую принципиальные отличия от подвесной энтеростомии С.С.Юдина.
Подвесная компрессионная энтеростомия
Хирургам хорошо известно, если при гнойном перитоните между плотно прилежащими друг к другу воспаленными кишечными петлями отсутствует прослойка экссудата, петли достаточно быстро прочно слипаются и срастаются друг с другом. Это свойство воспаленной брюшины мы учли при разработке способа формирования подвесной компрессионной энтеростомы.
У неширокого (!) (№24) катетера Пеццера иссекаем центральную часть «донышка» его раструба, имеющего круглые отверстия. После этого тремя длинными нитями прошиваем оба «лепестка» раструба катетера, осуществляя проколы рядом с трубчатой частью катетера (как это показано на рис. 10). Концы каждой длинной нити объединяем прочным узлом (чтобы в дальнейшем было ясно, что именно эти нити являются «парой»).
Свернув раструб катетера в виде «улитки» и фиксировав его в таком положении кровоостанавливающим зажимом Бильрота, вводим катетер в кишку через небольшой разрез ее стенки (или перфорационное отверстие, которое при его малых размерах может даже несколько надорваться).
На края разреза (или перфорационного отверстия) тонкой нитью накладываем кисетный шов, затягиваем и завязываем его на катетере. Избыток этих нитей отсекаем.
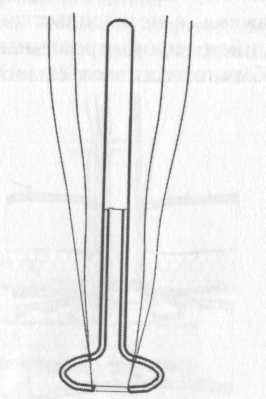
Рис. 10. Специальная подготовка катетера Пеццера для наложения подвесной компрессионной энтеростомы
Катетер вместе с длинными нитями, которыми были прошиты «лепестки» раструба, выводим через «разрез-прокол» предлежащей части передней брюшной стенки наружу. Прошиваем каждой парой нитей кожные края «разреза-прокола» и при умеренном, но явном (!), натяжении (прижимающим кишечную стенку в зоне раструба катетера к париетальной брюшине) завязываем надежными узлами (рис. 11).
Созданная таким образом мягкая компрессия (постепенно ослабевающая по направлению к периферии раструба катетера), не приводя к некрозу тканей кишечной стенки, герметично изолирует от брюшной полости зону ушитого вокруг катетера кисетным швом сквозного дефекта кишки.
Подчеркиваем, что натяжение нитей должно создавать лишь достаточно плотное прижатие кишечной стенки раструбом катетера к париетальной брюшине, не приводя при этом к значительной ишемии тканей кишки. Кожные края прошитого нитями разреза-прокола должны быть умеренно втянутыми в сторону брюшной полости.
В дальнейшем после удаления катетера Пеццера (путем его «вывинчивания» с помощью кровоостанавливающего зажима, а не насильственного выдергивания!) образовавшийся сформированный трубчатый кишечный свищ обычно заживает самостоятельно (чем более выражена толщина брюшной стенки, тем быстрее происходит заживление).
Но если у истощенного пациента такое самостоятельное заживление задерживается, то нежелательное истечение кишечного содержимого можно ликвидировать посредством временной установки резинового лепесткового обтуратора. В последующем после пересечения фиксирующей нити
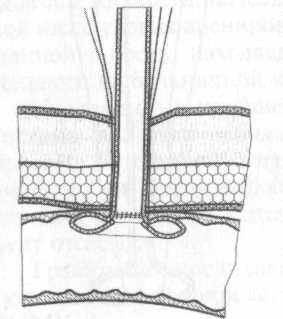
Рис. 11. Схема формирования подвесной компрессионной энтеростомы по Каншину
лепесток обтуратора мигрирует по кишечнику и выводится из организма естественным путем (резко сузившийся к этому времени трубчатый кишечный свищ быстро полностью закрывается). В самом крайнем случае, после ликвидации перитонита медленно заживающий свищ легко ликвидировать хирургическим путем из небольшого местного разреза.
Лепестковые обтураторы мы изготавливаем из стенки медицинской резиновой грелки, вырезая острыми ножницами округлую пластину необходимых размеров. Центральную часть такого лепесткового обтуратора прошиваем прочной нитью, которой привязываем к обтуратору тонкий резиновый жгутик (например, отрезанный от хирургической перчатки закругленный латексный рант).
Свернутый в виде «сигары» лепестковый обтуратор захватываем кровоостанавливающим зажимом Бильрота и в таком виде вводим в свищевое отверстие. В просвете кишки обтуратор расправляется.
Снаружи помещаем достаточно широкую «шайбу», изготовленную из двух слоев таких же резиновых пластин, с отверстием в центре диаметром около 5-8 мм. Это «окно» обеспечивает свободный отток наружу возможного серозно-гнойного отделяемого из свищевого канала в брюшной стенке.
Резиновый жгутик проводим через небольшой отрезок силиконовой дренажной трубки, упирающейся при натяжении жгутика в края «окна» в центре шайбы. Жгутик слегка натягиваем и фиксируем созданное натяжение одетой на наружную часть жгутика канцелярской скрепкой (рис. 12). Такая фиксация позволяет по желанию увеличивать или уменьшать степень натяжения латексного жгутика, создавая мягкое прижатие лепесткового обтуратора к кишечной стенке в области свища.
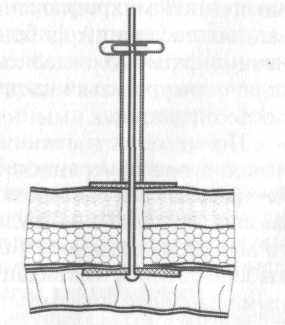
Рис. 12. Подпружиненный латексным жгутиком лепестковый обтуратор
Хирургическое вмешательство
Наша клиника при лечении послеоперационного перитонита придерживается двух следующих правил.
1. Хирургический доступ и при послеоперационном перитоните, как правило, должен быть срединным.
2. Применение при лечении перитонита марлевых тампонов (кроме использования их с гемостатической целью) при наличии силиконовых дренажей и современных «послеоперационных» отсасывателей с регулируемой степенью разрежения (в крайнем случае, аквариумных виброкомпрессоров, переоборудованных в виброотсасыватели), следует признать почти анахронизмом.
При всех операциях по поводу перитонита сразу же после вскрытия брюшной полости и затем многократно по ходу вмешательства тщательно аспирируют жидкое содержимое из брюшной полости (не травмируя кишечные петли грубым осушением марлевыми салфетками!) и промывают индифферентными стерильными растворами. Применение относительно дорогостоящих антисептических растворов целесообразно в виде последних порций в конце каждого промывания и перед закрытием лапаротомной раны.
При промываниях удаляют все легко отделяемые от кишечных петель, от брыжеек и от париетальной брюшины напластования фибрина, содержащие большое количество патогенной микрофлоры. Что касается прочно фиксированных наслоений фибрина, то при релапаротомиях мы неоднократно убеждались, что они способны самостоятельно лизироваться на протяжении первых двух-трех дней после операции.
По методам и техническим приемам хирургического лечения послеоперационного перитонита невозможно дать исчерпывающие однозначные рекомендации «на все случаи жизни». Наибольшие трудности, требующие нестандартного выхода из сложного положения, обычно возникают при выборе способа ликвидации источника перитонита, которым чаще всего оказывается дефект стенки полых органов брюшной полости (несостоятельность швов, незамеченное при предшествовавшей операции повреждение, перфорация острой язвы). Рассмотрим возможные способы устранения источника послеоперационного перитонита, вызванного несостоятельностью швов на различных уровнях пишевариельного тракта (начиная с пищеводно-тонко-кишечного анастомоза).
