«Визначення ступеню дисоціації електроліту методом кріоскопії» Виконав манжос о. В зміст
| Вид материала | Документы |
- «сучасні методи експрес аналізу органічних речовин» Виконав манжос о. В зміст, 1177.91kb.
- План Визначення політики. Політика як соціальне явище. Структура, мета, завдання, засоби, 208.45kb.
- Питання для підготовки до іспиту (заліку), 19.17kb.
- Реферат Визначення висотного розподілу іоносферних параметрів методом некогерентного, 326.07kb.
- Зміст Вступ 3, 489.58kb.
- Контрольная работа по курсу «Линейной алгебры и математического программирования», 99.84kb.
- Представник давньогрецької школи, математик, астроном Ератосфен Кіренський (276-195, 39.29kb.
- Зміст, 27.25kb.
- План курсу «Інформатика, 9 клас» (35 год.) № Зміст навчального матеріалу Вид практичних, 152kb.
- Питань для підсумкового контролю, 167.18kb.
КУРСОВА РОБОТА
ПО КУРСУ «Фізична хімія»
НА ТЕМУ: «Визначення ступеню дисоціації електроліту методом кріоскопії»
Виконав МАНЖОС О.В
ЗМІСТ
| ВСТУП | 3 |
| РОЗДІЛ1 РОЗЧИНИ ЕЛЕКТРОЛІТІВ | 6 |
| 1.1 СЛАБКІ ЕЛЕКТРОЛІТИ. КОНСТАНТА ДИСОЦІАЦІЇ | 7 |
| 1.2 СИЛЬНІ ЕЛЕКТРОЛІТИ | 9 |
| РОЗДІЛ 2 СУТНІСТЬ КРІОСКОПІЧНОГО МЕТОДУ | 10 |
| 2.1 ДІАГРАМА СТАНУ ВОДИ | 12 |
| РОЗДІЛ 3 ПРОВЕДЕННЯ ЕКСПЕРИМЕНТУ | 15 |
| 3.1 ТЕРМОМЕТР БЕКМАНА | 16 |
| 3.2 ВИЗНАЧЕННЯ ПОНИЖЕННЯ ТЕМПЕРАТУРИ КРИСТАЛІЗАЦІЇ РОЗЧИНУ | 19 |
| ВИСНОВКИ | 23 |
| СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ | 24 |
ВСТУП
Розчин – однофазна, гомогенна, багатокомпонентна система змінного хімічного складу. Практично усі рідини, що є в природі, являють собою розчини. Крім рідких розчинів, існують газові (газуваті) – їх прийнято називати газовими сумішами (напр., повітря) і тверді (напр., деякі сплави). Як правило, під розчином розуміють рідку молекулярно-дисперсну систему (т. зв. істинні розчини, англ. true solution). Кожний розчин складається з розчинника і розчиненої речовини або речовин. Розчинником називають компонент, концентрація якого суттєво більша концентрації інших компонентів. Розчинник у чистому вигляді має той самий аґреґатний стан, що й розчин. Процес утворення розчинів полягає у руйнуванні зв’язків між молекулами (йонами) вихідної речовини і утворенні нових зв’язків між молекулами (йонами) розчиненої речовини і розчинника. За концентрацією розчиненої речовини поділяють на насичені, ненасичені й пересичені. За наявністю чи відсутністю електролітичної дисоціації розчиненої речовини на йони розрізняють розчини електролітів і розчини неелектролітів. Крім того, виділяють розчини полімерів, головна особливість яких – дуже велика різниця у розмірах молекул розчинника і розчиненої речовини. У розчинах протікає багато природних і промислових процесів. З ними пов’язане формування покладів ряду корисних копалин, їх видобування і переробка, розділення речовин, глибоке очищення тощо.
За своїми властивостями розчини займають проміжне місце між механічними сумішами і хімічними сполуками. Від механічних сумішей вони відрізняються головним чином своєю однорідністю і виділенням або поглинанням тепла при утворенні, а від хімічних сполук тим, що склад їх не сталий і може змінюватись у досить широких межах. Водні розчини відіграють величезну роль у природі і практичній діяльності людини. Досить сказати, що рослини беруть з ґрунту всі потрібні для їх росту поживні речовини лише у вигляді водних розчинів. Процеси травлення і засвоєння їжі людиною і всіма тваринами теж зв'язані з переведенням поживних речовин у розчин.
Розчини відіграють величезну роль у техніці. Більшість хімічних процесів у промисловості проводять у розчинах. Такі галузі техніки, як шкіряне і паперове виробництво, виробництво цукру, мінеральних добрив, лікувальних речовин і багато інших, нерозривно пов'язані з широким застосуванням водних розчинів.
Розчини характеризуються рядом колігативних властивостей, відмінних від властивостей їх складових частин і які пропорційні кількості часток усіх речовин, розчинених в даному об’ємі розчину, та не залежать від природи розчинених речовин. Колігативними властивостями є осмотичний тиск, відносне зниження тиску пари розчинника, зниження температури кристалізації, збільшення температури кипіння та інші. Величини колігативних властивостей прямо пропорційні один до одного. Будь яка з цих властивостей може бути використана для визначення молекулярної маси розчиненої речовини, або кількості часток розчиненої речовини. Деякі колігативні властивості надто важливі для існування як людства так і інших живих істот. Так, завдяки осмосу підтримується постійна концентрація води в клітинах людини і рослин. Завдяки зниженню температури кристалізації не вкриваються кригою моря, океани й інші солоні водоймища, що дає змогу водним істотам взимку виходити на поверхню й на суходіл й отримувати додатковий кисень і таке інше.
Знання цих властивостей й факторів від яких вони залежать, вміння їх визначати надто важливе для існування життя.
Під час повені на заході України більшість частини країни вкрили розчини, які є розчинами електролітів. Знання властивостей цих розчинів, дозволить прогнозувати їй руйнівну силу – це найважливіший показник актуальності теми, адже повені останнім часом повторюються надто часто.
Незабаром настане зима, что призведе до явищ зв’язаних з поведінкою залишкових явищ повені тому метою роботи є кріоскопічний метод визначення ступеня диссоціації, що надасть можливість спостерігати поведінку розчинів електролітів при морозах.
Завданнями дослідження є:
- визначити температуру кристаллізації розчину солей (який є розчином електроліту.
- Визначити порядок кристаллізації розчину. Тобто температуру початку та закінчення кристаллізації.
- Розрахувати ізотонічний коеффіцієнт
- Розрахувати ступень диссоціації
Предметом дослідження є ступінь диссоціації низки концентрацій одно й того електроліту, який є об’єктом дослідження. Це може бути розчин отриманий взбовтуванням грунту з великою кількістю води, або розчин отриманий після довгого контакту води наприклад з бетоном, деревиною.
Значимість теми визначається залежністю колігативних властивостей розчинів від ступеня диссоціації, й можливості прогнозування цих властивостей на підставі розрахунку одного показника при вивченні лише одного явища – кристалізації розчину.
РОЗДІЛ 1. РОЗЧИНИ ЕЛЕКТРОЛІТІВ
Закони встановлені для колігативних властивостей розчинів неелектролітів не виконуються для розчинів (навіть нескінченно розбавлених), які проводять електричний струм – розчинів електролітів.
Узагальнюючи експериментальні дані, Вант-Гофф прийшов до висновку, що розчини електролітів завжди поводяться так, ніби вони містять більше частинок розчиненої речовини, чим виходить з аналітичної концентрації: підвищення температури кипіння, пониження температури замерзання, осмотичний тиск та інші колігативні властивості для них завжди більше, ніж обчислені за законами для коллігативних властивостей розчинів неелектролітів. Для обліку цих відхилень Вант-Гофф вніс до рівнянь для розчинів електролітів поправку – ізотонічний коефіцієнт i. [3,c.228-233]
Ізотонічний коефіцієнт для розчинів електролітів завжди більше одиниці причому з разбавленням розчину i зростає до деякого цілочисельного значення.
Ізотонічний коефіцієнт показує у скільки разів загальне число молекул і іонів в розчині більше числа молекул внесених у розчин.
Для пояснення особливостей властивостей розчинів електролітів С.Арреніус запропонував теорію електролітичної дисоціації, що грунтується на наступних постулатах:
1. Електроліти в розчинах розпадаються на іони – диссоціюють;
2. Дисоціація є оборотним рівноважним процесом;
3. Сили взаємодії іонів з молекулами розчинника і один з одним малі (тобто розчини є ідеальними).
Дисоціація електролітів в розчині відбувається під дією полярних молекул розчинника; наявність іонів в розчині зумовлює його електропровідність.
Для оцінки повноти дисоціації в теорії електролітичної дисоціації вводиться поняття ступінь дисоціації α, яка дорівнює відношенню числа молекул n що розпалися на іони, до загального числа молекул N:
 . (1)
. (1) Величина ступеня дисоціації залежить від природи розчинника і розчиненого речовини, концентрації розчину і температури. По величині ступеня дисоціації електроліти підрозділяються на три групи: [6,c. 23]
сильні ( α ≥ 0, 7),
середньої сили (0,3 < α < 0,7),
слабкі (α ≤ 0,3).
До сильних електролітів відносяться майже всі солі (окрім Рb(СН3СОО)2, НgСl2, СdСl2), більшість неорганічних кислот і лугів; до слабких – всі органічні кислоти, вода, NН4ОН, Н2S і так далі. Електролітами середньої сили є деякі неорганічні кислоти: НF, НСN, Н3PO4.
1.1 СЛАБКІ ЕЛЕКТРОЛІТИ. КОНСТАНТА ДИСОЦІАЦІЇ
Процес дисоціації слабких електролітів є оборотним і в системі існує динамічна рівновага, яка може бути описана константою рівноваги, вираженою через концентрації іонів, що утворюються, і непродіссоційованих молекул, названою константою дисоціації. Для деякого електроліту, що розпадається в розчині на іони відповідно до рівняння:
АaВb <–> aАx- + bВy+
к
 онстанта діссоциації буде наступним співвідношенням:
онстанта діссоциації буде наступним співвідношенням:, (2)
Д
 ля бінарного (що розпадається на два іони) електроліту вираз (2) можна переписати у вигляді (3): , , (3)
ля бінарного (що розпадається на два іони) електроліту вираз (2) можна переписати у вигляді (3): , , (3)Оскільки концентрація кожного іона для бінарного електроліту дорівнює добутку ступеня дисоціації α на загальну концентрацію електроліту С, вираз (3) в цьому випадку можна переписати таким чином [4,c.120]:

, (4)
Для розбавлених розчинів можна вважати, що (1 – α) = 1. Тоді отримуємо:
 , (5)
, (5)  , (6)
, (6)Таким чином, ступінь дисоціації слабкого електроліту оборотнопропорційний концентрації і прямо пропорційний розбавленню розчину; вираз (6) називають законом розбавлення Оствальда. Ступінь дисоціації слабкого електроліту можна пов'язати з ізотонічним коефіцієнтом. Вважатимемо, що з N молекул електроліту продіссоціювало n молекул, утворивши νn іонів (ν – число іонів, на яке диссоціює молекула). Оскільки ізотонічний коефіцієнт показує у скільки разів загальне число молекул і іонів в розчині більше числа молекул до дисоціації, отримуємо [2,c.228-221]:
 , (7)
, (7) , (8)
, (8)Співвідношення (8) дає можливість, експериментально визначивши ізотонічний коефіцієнт розчину, розрахувати ступінь дисоціації слабкого електроліту.
1.2 СИЛЬНІ ЕЛЕКТРОЛІТИ
Припущення Ареніуса про те, що в розчині сильного електроліту також
існує динамічна рівновага між молекулами і іонами, як і у слабких електролітів, виявилося помилковим. Експериментальні дослідження показали, що
по-перше, величина константи дисоціації сильного електроліту залежить від концентрації (тобто до розчинів сильних електролітів непридатний закон діючих мас)
і, по-друге, ніякими методами не вдалося виявити в розчинах сильних
електролітів непродіссоційовані молекули.
Це дозволило зробити висновок, що сильні електроліти в розчинах будь-яких концентрацій повністю диссоціюють на іони і, отже, закономірності, отримані для слабких електролітів, не можуть застосовуватися до сильних електролітів без відповідних поправок.
Якісна теорія сильних електролітів була розроблена П.Дебаєм і Г.Хюккелем (1923) [1, c.302]. Для сильних електролітів, повністю диссоціюючих на іони, навіть при малих концентраціях розчинів енергія електростатичної взаємодії між іонами достатньо велика, і нехтувати цією взаємодією не можна.
Взаємодія протилежно і однойменно заряджених іонів (відповідно тяжіння і відштовхування) приводить до того, що поблизу кожного іона знаходяться переважно іони з протилежним зарядом, створюючі так звану іонну атмосферу. Радіус іонної атмосфери порівняно великий, тому іонні атмосфери сусідніх іонів перетинаються; крім того, кожен іон оточений дипольними молекулами розчинника – сольватною оболонкою. Таким чином, в розчині сильного електроліту виникає подібність просторової структури, що обмежує свободу переміщення іонів і приводить до зміни властивостей розчину в тому ж напрямі, як діяло б зменшення ступеня дисоціації. Тому визначаючи ступінь дисоціації розчину сильного електроліту, отримують так званий уявний ступінь дисоціації, тобто величину α з поправкою на міжіонну взаємодію. Чим вище концентрація розчину, тим сильніше взаємодія іонів, тим менше і уявний ступінь дисоціації сильного електроліту.
Уявний ступінь дисоціації сильного електроліту не можна пов'язати з ізотонічним коефіцієнтом.
Теорія Дебая – Хюккеля застосовується тільки при концентраціях, що не перевищують 0,05 моль/л. Для більш концентрованих розчинів сильних електролітів кількісної теорії не існує.
РОЗДІЛ 2 СУТНІСТЬ КРІОСКОПІЧНОГО МЕТОДУ
Кріоскопічним називається метод визначення молекулярної маси по пониженню точки замерзання розчинника. Для дослідження цього методу нам необхідно пригадати закон Рауля стосовно розбавлених розчинів неелектролітів. Ми знаємо, що тиск насиченої пари кожної рідини є величина постійна для даної температури. При розчиненні в рідині якої-небудь твердої речовини тиск пари рідини знижується. Таким чином, тиск пари розчину завжди нижче за тиск пари чистого розчинника при тій же температурі. Різниця між числовими значеннями тиску пари чистого розчинника і тиску пари розчину називається зазвичай пониженням тиску пари розчинника над розчином. Це можна виразити формулою:
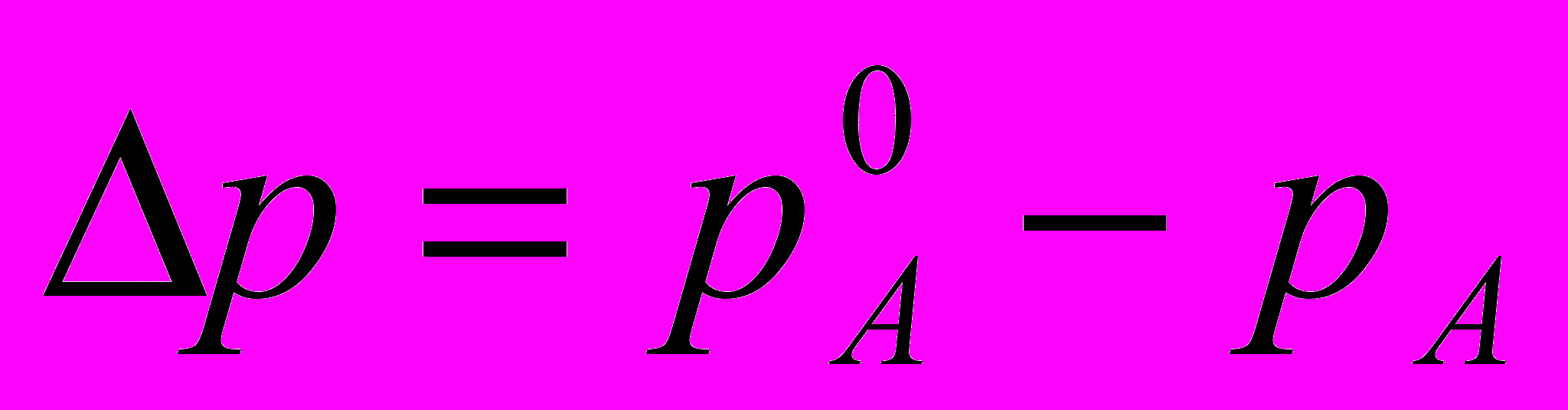 [3,c.221].
[3,c.221].У 1887 році французький фізик Рауль на підставі численних дослідів з розчинами різних твердих речовин і нелетких рідин встановив наступний закон: у розбавлених розчинах неелектролітів при постійній температурі пониження тиску пари пропорційне кількості речовини, розчиненої в даній кількості розчинника. Пояснення цьому закону дає молекулярно-кінетична теорія. Тиск насиченої пари, що знаходиться над рідиною, залежить від числа молекул, що випаровуються з поверхні рідини в одиницю часу. Але в розчині частина його вільної поверхні зайнята молекулами нелеткої розчиненої речовини. Тому число молекул, що покидають поверхню розчину в одиницю часу, стає менше, ніж у разі чистого розчинника при тій же температурі, і тиск пари знижується. Наприклад, тиск пари розчину, в якому число молекул розчиненої речовини складає 1/20 всього числа молекул, на 1/20 менше тиску пари чистого розчинника.
Залежність між пониженням тиску пари і кількістю розчиненої речовини може бути виражена в математичній формі. Позначимо тиск чистого розчинника через p, пониження тиску пари через
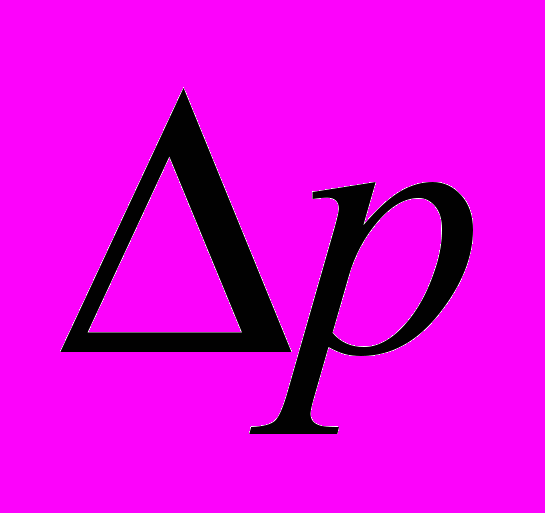 , число молів розчиненої речовини через n і число молів розчинника через N. Тоді закон Рауля для розбавлених розчинів виразиться рівнянням:
, число молів розчиненої речовини через n і число молів розчинника через N. Тоді закон Рауля для розбавлених розчинів виразиться рівнянням: 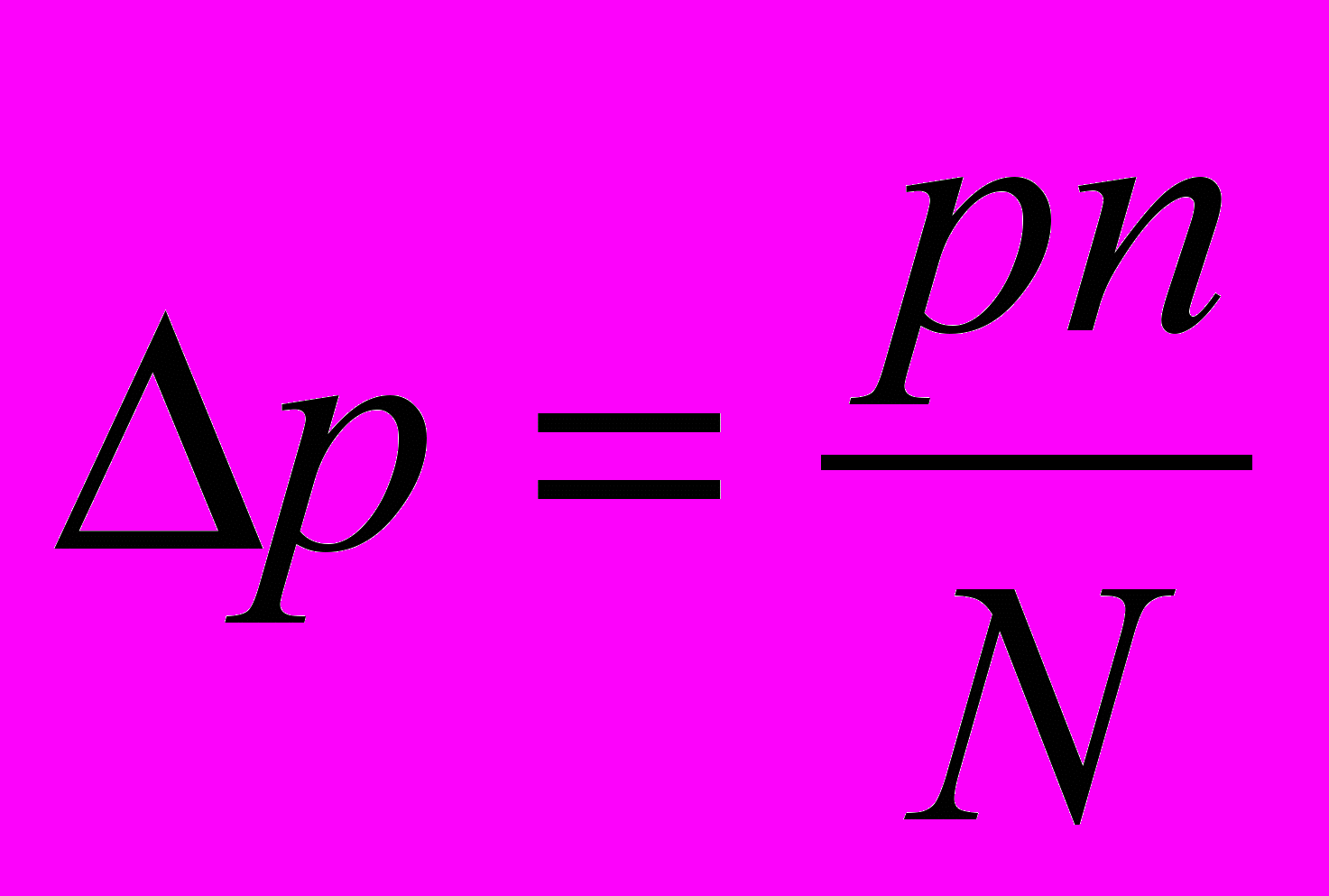 [10,c. 215]
[10,c. 215]Вимірюванням пониження тиску пари розчину можна користуватися для визначення молекулярної маси розчинених речовин. Проте на практиці зазвичай застосовується інший, зручніший метод, заснований на вимірюванні пониження температури кристалізації розчину.
Всі чисті речовини характеризуються певною температурою кристалізації. Так, чиста вода при нормальному атмосферному тиску замерзає при 00С; бензол при +5,50С. Ці температури зберігаються незмінними до тих пір, поки вся рідина не закристалізується.
Інакше йде справа з розчинами. Присутність розчиненої речовини знижує точку (або температуру) кристалізації розчинника, і тим сильніше, чим більш концентрований розчин. Тому розчини кристалізуються при нижчих температурах, ніж чисті розчинники. Неважко довести, що це є прямим наслідком пониження тиску пари розчинів. Нижча температура замерзання розчину, в порівнянні з чистим розчинником, пояснюється тим, що температура замерзання є та температура, при якій одночасно можуть існувати тверда і рідка фази даної речовини.
2.1 ДІАГРАМА СТАНУ ВОДИ
Залежність між тиском водяної пари і температурою, а також умови одночасного існування води в різних фазах можуть бути наочно представлені за допомогою діаграми стану води. (малюнок 1). [9,c.46]
p
 малюнок 1
малюнок 1 A
C
760


вода
лід
4,6
O
пара
B
100
0,01
t, ºC

На цій діаграмі лінія ОА представляє криву тиску пари води, а лінія ОВ – криву тиску пари льоду. Точки кривої ОА показують, при яких температурах і тиску можуть одночасно існувати в рівновазі вода і пара; точки кривої ОВ визначають умови рівноваги між льодом і парою. Обидві криві перетинаються в точці О, вказуючи температуру і тиск, при яких можуть знаходитися в рівновазі всі три фази.
Тому точка О називається потрійною точкою; їй відповідає тиск 4,6 мм.рт.ст. і температура +0,010 С. Крива ОС показує вплив тиску на точку плавлення льоду. Кожній її точці відповідає певний тиск і певна температура, при яких лід і вода знаходяться в рівновазі. Проте для цього необхідно, щоб тиск пари твердої і рідкої фаз був однаковим, інакше пара переходитиме від однієї фази до іншої до повного зникнення тої з них, над якою тиск пари більший. Одночасне існування льоду і розчину буде можливе тільки при температурі нижче 00С, і саме при такій, при якій тиск їх пари стане однаковим. Іншими словами, розчин замерзатиме при нижчій температурі, ніж чистий розчинник. Всі ці співвідношення стають особливо ясними, якщо зобразити їх графічно, (малюнок 2) накресливши криві зміни тиску пари з температурою. [2,c.219]
малюнок 2
a
p

b
вода
A
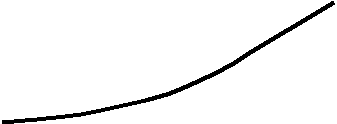
розчин

пара
B
C
T1
T
t, ºC

На малюнку 2 лінія Аа зображає криву тиску пари чистої води, а лінія Bb – криву тиску пари над розчином. Оскільки при будь-якій температурі тиск пари розчину менше тиску пари чистої води, то лінія Bb лежить нижче за лінію Аа. Лінія АС зображає криву тиску пари льоду. Ми вже говорили, що при температурі замерзання тиски пари твердої і рідкої фаз розчинника або твердого розчинника і розчину повинно бути однаковим. Цій умові відповідають точки А і В перетину кривих Аа і Bb з кривою АС. Температури замерзання води і розчину визначаються як проекції точок А і В на вісь абсцис. В цьому випадку, як видно з графіка, температури Т і Т1, розташовані в зворотному порядку, тобто температура замерзання розчину нижча за температуру замерзання води.
При замерзанні розбавлених розчинів спочатку виділяється в твердому вигляді чистий розчинник, наприклад у разі водного розчину – чистий лід. Оскільки по мірі виділення льоду концентрація розчину збільшується, то температура замерзання не залишається постійною, а поступово знижується Проте виділення льоду і пониження температури замерзання відбуваються лише до тих пір, поки концентрація розчину не досягне деякої визначеної для даної речовини величини, при якій весь розчин застигає в суцільну масу. Така маса отримала назву евтектики. Температура, при якій відбувається її кристалізація, називається кріогідратною точкою, а відповідна концентрація розчину – кріогідратною концентрацією.
З кількісного боку явище замерзання розчину було вивчене Раулем, який експериментальним шляхом встановив наступні положення, відомі під назвою законів Рауля: 1) пониження точки замерзання пропорційне кількості речовини, розчиненої в даній кількості розчинника; 2) еквімолекулярні кількості різних речовин, будучи розчинені в одній і тій же кількості даного розчинника, знижують його точку замерзання на одне і те ж число градусів. Пониження температури замерзання, відповідне розчиненню 1 молю речовини в 1000 грамах розчинника, є величина постійна для даного розчинника. Вона називається кріоскопічною (від греч. «кріос» - холод, «скопео» - дивлюся) константою розчинника.
Математично закони Рауля для неелектролітів можуть бути виражені наступним рівнянням: [3,c.228-230]
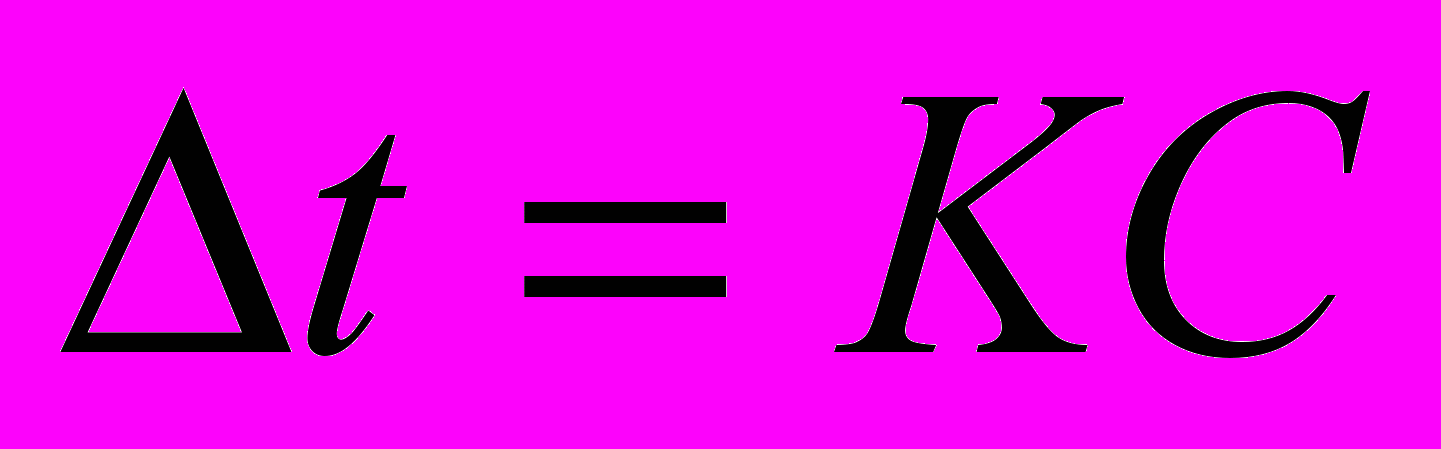 , (9)
, (9)де
 - пониження точки замерзання розчинника;
- пониження точки замерзання розчинника;С – число молів розчиненої речовини, що доводиться на 1000 грамів розчинника;
К – коефіцієнт пропорційності, рівний відповідно кріоскопічній константі розчинника (при С=1 величина
 =К). Ця константа залежить лише від властивостей розчинника й визначається за формулою (9а): [2,c.221]
=К). Ця константа залежить лише від властивостей розчинника й визначається за формулою (9а): [2,c.221]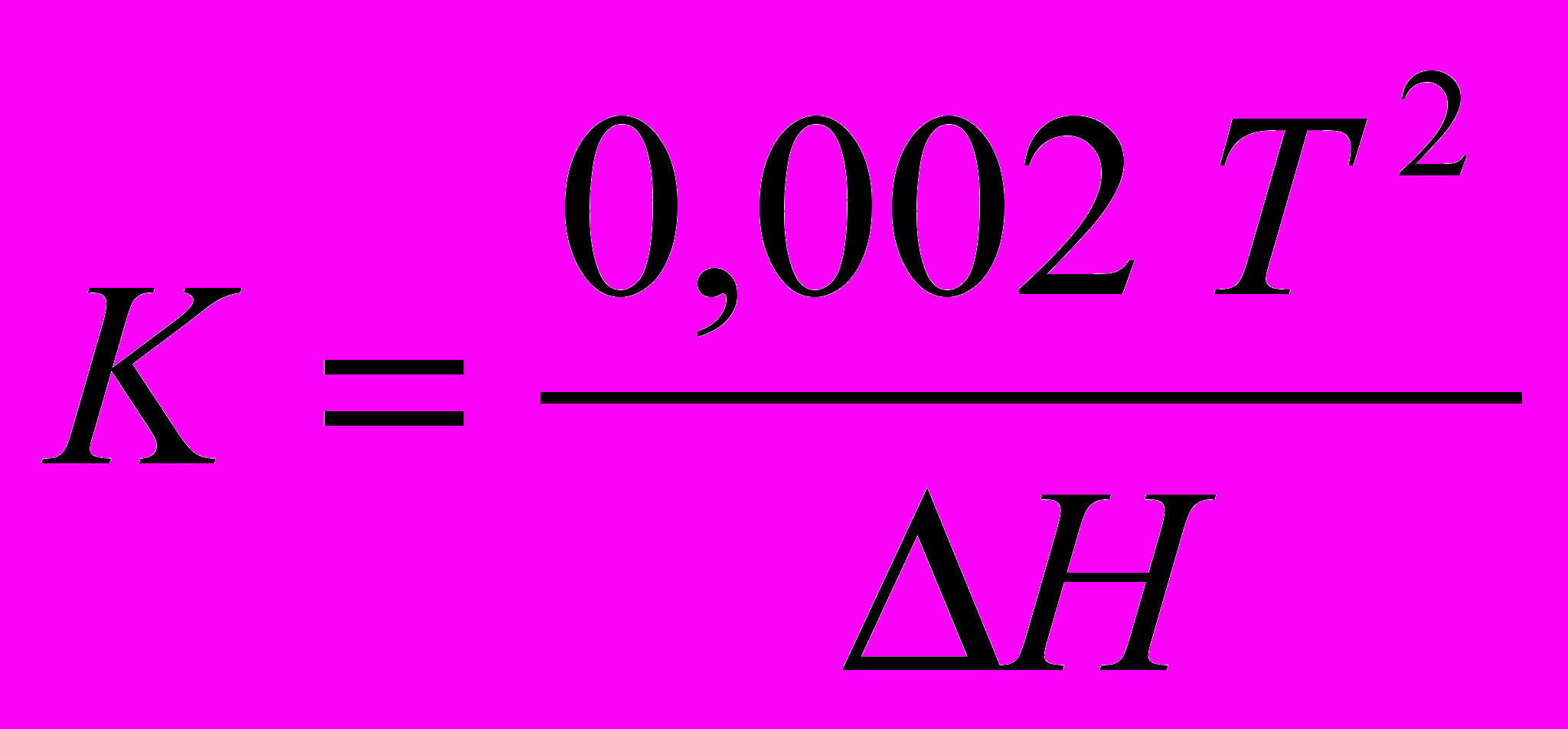 , (9а)
, (9а)T – температура кристаллізації розчинника
ΔН – питома ентальпія плавлення розчинника.
Замінивши в попередньому рівнянні (9) С за допомогою g – маси розчиненої речовини, G – маси розчинника, M – молекулярної маси розчиненої речовини, отримаємо:
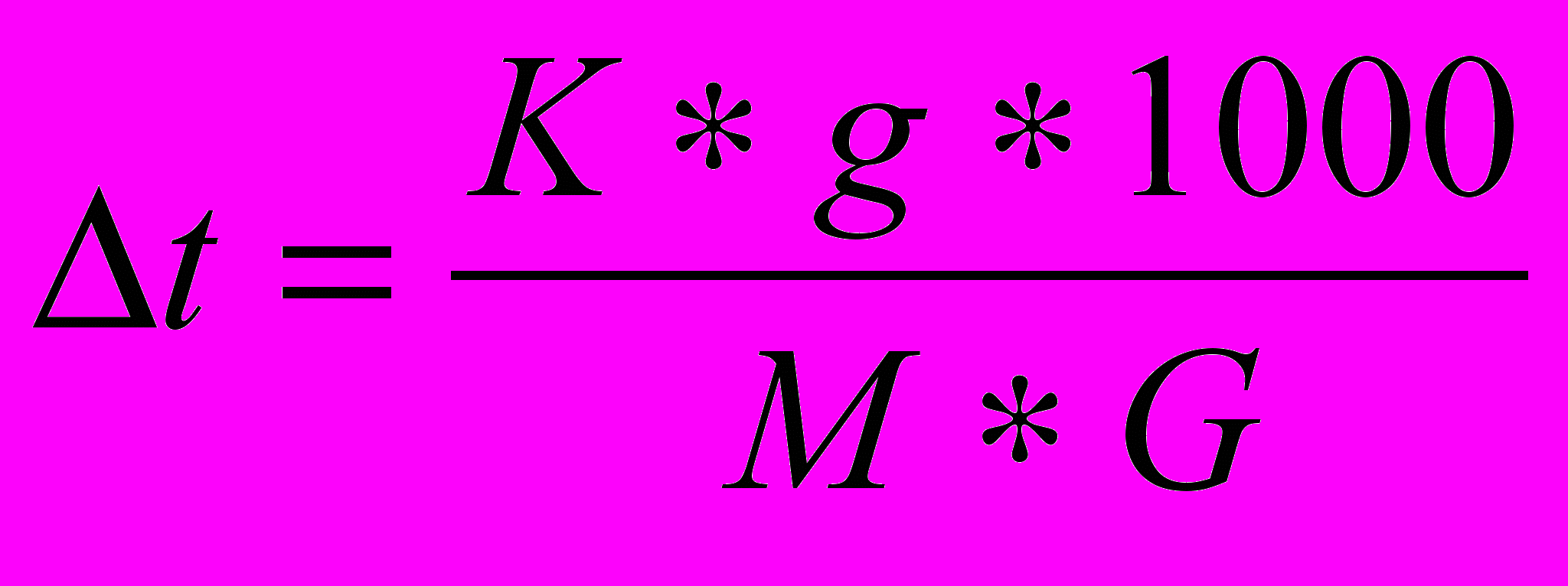 (10)
(10) Розраховане за рівнянням (10)
 для розчинів електролітів не збігається з отриманим експериментально. Тому, як згадано вище, Вант-Гофф вніс до рівнянь для розчинів електролітів поправку – ізотонічний коефіцієнт i. Й для розчинів електролітів воно має вигляд:
для розчинів електролітів не збігається з отриманим експериментально. Тому, як згадано вище, Вант-Гофф вніс до рівнянь для розчинів електролітів поправку – ізотонічний коефіцієнт i. Й для розчинів електролітів воно має вигляд: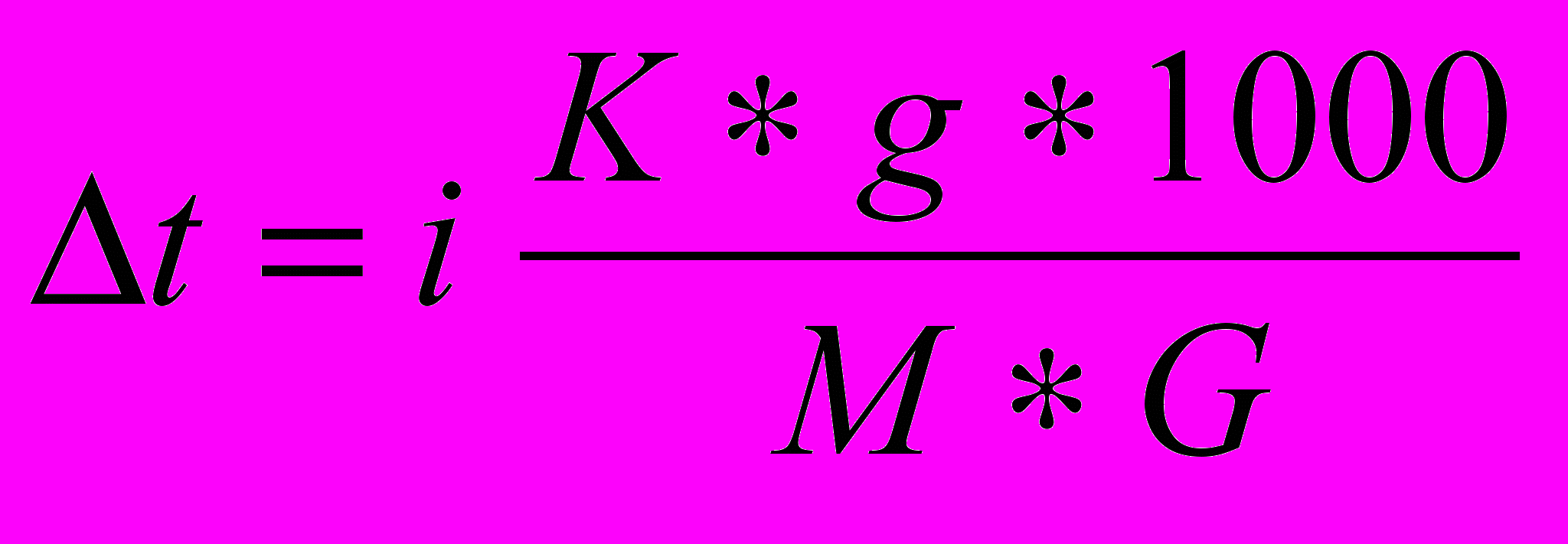 (11)
(11)Розрахувавши за рівнянням (10)
 для будь якого електроліту та порівнявши його з експериментальним можна визначити ізотонічний коефіцієнт i за рівнянням (12):
для будь якого електроліту та порівнявши його з експериментальним можна визначити ізотонічний коефіцієнт i за рівнянням (12):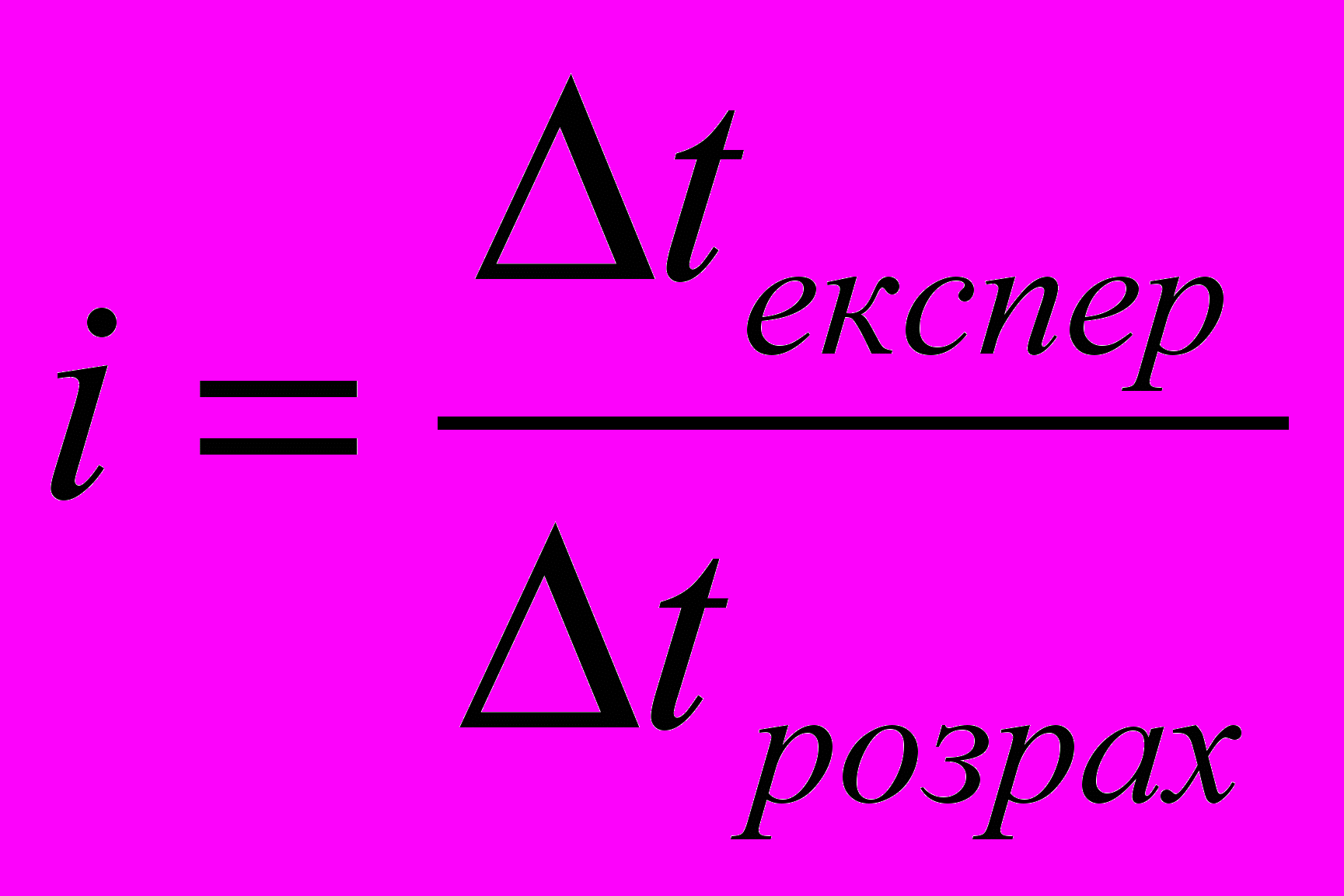 (12)
(12)РОЗДІЛ 3 ПРОВЕДЕННЯ ЕКСПЕРИМЕНТУ
Схема приладу, яка використовується для кріоскопічних вимірювань, наведена на малюнку 3. [5,c.13]
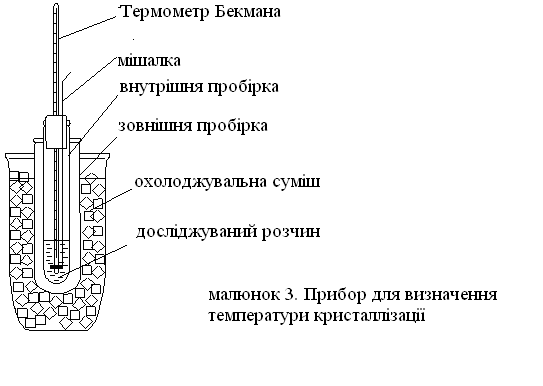
У досліді використовується диференційний термометр Бекмана, який заздалегідь повинен бути налаштований на використовуваний інтервал температур.
3.1 ТЕРМОМЕТР БЕКМАНА
Як показує практика, зміна температури в подібних дослідах невелика. Отже, ця зміна повинна визначатися з великою точністю, принаймні не менше 0,01 градуса. Природно, що для таких точних визначень змін температури звичайні термометри не придатні. Для цих цілей використовують термометри Бекмана (малюнок 4). [5,c.15]
малюнок 4
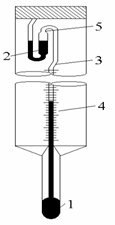
Термометр Бекмана: 1 - нижній резервуар; 2 - верхній резервуар; 3 - капіляр; 4 - шкала; 5 - місце з'єднання капіляра з верхнім резервуаром.
Термометри Бекмана відрізняються від звичайних термометрів тим, що мають не один, а два ртутні резервуари: нижний, занурюваний в досліджувану рідину, і верхній - запасний. Резервуари з'єднуються один з одним тонким капіляром. Наявність двох резервуарів дозволяє змінювати кількість ртуті в нижньому резервуарі і використовувати термометр Бекмана для досліджень в широкому діапазоні температур. Термометри Бекмана служать для вимірювання не дійсних значень температури, а зміни температури.
Оскільки кількість ртуті в нижньому резервуарі термометру непостійна, її треба підібрати так, щоб при температурі досліду рівень ртуті в капілярі встановлювався в межах шкали термометра. Оскільки в ході досліду температура повинна знижуватися, термометр треба встановлювати так, щоб рівень ртуті в капілярі відповідав верхній частині шкали термометру.
Нагріваючи ртуть нижнього резервуару рукою або теплою водою так, щоб вона заповнила весь капіляр доверху, швидко перевертають термометр верхнім резервуаром вниз, добиваючись того, щоб ртуть нижнього і верхнього резервуарів з'єдналася.
Після цього обережно, щоб не розірвати ртуть, термометр перевертають в звичайне вертикальне положення і занурюють нижній резервуар в підготовлену охолоджену воду, де він повинен поволі охолоджуватися близько 5 хвилин (підтримувати температуру охолоджувального середовища, додаючи у воду лід!). Після закінчення 5 хвилин ртуть обривають - для цього термометр Бекмана беруть правою рукою за верхню частину, різко, але не дуже ударяють нею по великому пальцю лівої руки. Ртуть розривається в місці з'єднання капіляра з верхнім резервуаром. Після налаштування термометр не можна класти горизонтально, струшувати. Його треба укріпити у вертикальному положенні.
Слід враховувати, що при необережному поводженні з термометром Бекмана може відбутися падіння крапельки ртуті у верхній резервуар термометра, і його налаштування доведеться проводити наново. Для точних вимірювань необхідно, щоб охолоджування досліджуваної рідини відбувалося якомога повільніше. Для цього служить повітряний прошарок між зовнішньою і внутрішньою пробірками. При проведенні досліду досліджувану рідину необхідно постійно перемішувати для її рівномірного охолоджування.
Для визначення пониження температури кристалізації розчину термометр Бекмана необхідно відкалібрувати. Для цього в першому досліді заморожують дистильовану воду.
У ретельно промиту водою, і висушену внутрішню пробірку наливають 50 мл води. Термометр Бекмана поміщають в пробірку так, щоб нижній резервуар термометра був повністю занурений у воду. Внутрішню пробірку з термометром і мішалкою поміщають в зовнішню і занурюють останню в суміш, що охолоджує. Безперервно перемішуючи воду, спостерігають за переміщенням стовпчика ртуті в капілярі термометра. При проведенні досліду зазвичай має місце переохолодження води (приблизно на 1 °С). В цьому випадку услід за повільним пониженням рівня ртуті в капілярі спостерігається його швидке підвищення і стабілізація на значенні, яке відповідає температурі кристалізації води. Набутого значення tо на шкалі термометра Бекмана, що відповідає 0°С, записується.
Внутрішню пробірку виймають із зовнішньої і обережно нагрівають рукою для розплавлення кристалів льоду, що утворилися (при правильному проведенні досвіду кристали повинні утворюватися в об'ємі рідини, а не на стінках пробірки). Після того, як всі кристали розплавилися і температура води підвищилася на 1-2°С вище tо, дослід повторюють. Якщо різниця між першим і другим значенням tо перевищує 0,01°С, дослід проводять ще раз.
За наслідками проведених дослідів розраховують середнє значення
 на шкалі термометра Бекмана, що відповідає 0 °С, яке використовується надалі для розрахунку пониження температури кристалізації розчину.
на шкалі термометра Бекмана, що відповідає 0 °С, яке використовується надалі для розрахунку пониження температури кристалізації розчину.3.2 ВИЗНАЧЕННЯ ПОНИЖЕННЯ ТЕМПЕРАТУРИ КРИСТАЛІЗАЦІЇ РОЗЧИНУ
На аналітичних вагах відважують певну кількість розчинної речовини - електроліту. Вийнявши з внутрішньої пробірки термометр і мішалку, наважку повністю переносять в пробірку і перемішують мішалкою до повного розчинення речовини у розчиннику, який теж зважують на аналітичних вагах . Слід звернути увагу на те, щоб на стінках пробірки не залишалося розчинної речовини.
Внутрішню пробірку поміщають в зовнішню і аналогічним описаному вище чином проводять охолоджування розчину, фіксуючи температуру початку кристалізації розчину tкр. Охолодження розчину проводять спеціально підібраною сумішшю, температура якої нижче прогнозованої температури кристалізації. Склад та температура таких сумішей наведена в таблиці 1.
Таблиця 1. Охолоджувальні суміші
Якщо А г солі змішати з 100 г води при 10-15 °С, то температура знизиться на Δt °С. При змішуванні В г солі з 100 г льоду або снігу температура знижується до кріогідратної точки.
У таблиці приводяться необхідні кількості безводих речовин. [8,c.379]
| Сіль | А, г | Δt °C | В, г | Кріогідратна точка °С |
| СаС12 | 126,9 | 23,2 | 42,2 | -55 |
| FeCl2 | | | 49,7 | -55 |
| MgCl2 | | | 27,5 | -33,6 |
| NaCl | 36 | 2,5 | 30,4 | -21,2 |
| (NH4)2S04 | 75 | 6,4 | 62 | -19 |
| NaN03 | 75 | 18,5 | 59 | -18,5 |
| NH4NO3 | 60 | 27,2 | 45 | -17,3 |
| NH4C1 | 30 | 18,4 | 25 | -15,8 |
| MgS04 | 41,5 | 8,0 | 23,4 | -3,9 |
| KNO3 | 16 | 9,8 | 13 | -2,9 |
| K2S04 | 12 | 3 | 6,5 | -1,6 |
| CH3COONa | 51,1 | 15,4 | | |
| NH4CI | 133 | 31,2 | | |
Оскільки у міру випадання кристалів розчинника концентрація розчину збільшується, за температуру початку кристалізації розчину tкр приймають найбільше значення температури, досягнуте після переохолодження. Дослід повторюють тричі і за температуру початку кристалізації розчину приймають середнє значення
Розраховують пониження температури кристалізації розчину:
 (13)
(13)Розрахувавши за рівнянням (10)
 можна розрахувати за рівнянням (12) ізотонічний коефіцієнт, при цьому результат рівняння (10) буде в знаменнику, результат рівняння (13) в чисельнику. Знаючи цей результат можна за рівнянням (14), яке можна отримати з рівняння (8), розрахувати ступінь дисоціації:
можна розрахувати за рівнянням (12) ізотонічний коефіцієнт, при цьому результат рівняння (10) буде в знаменнику, результат рівняння (13) в чисельнику. Знаючи цей результат можна за рівнянням (14), яке можна отримати з рівняння (8), розрахувати ступінь дисоціації: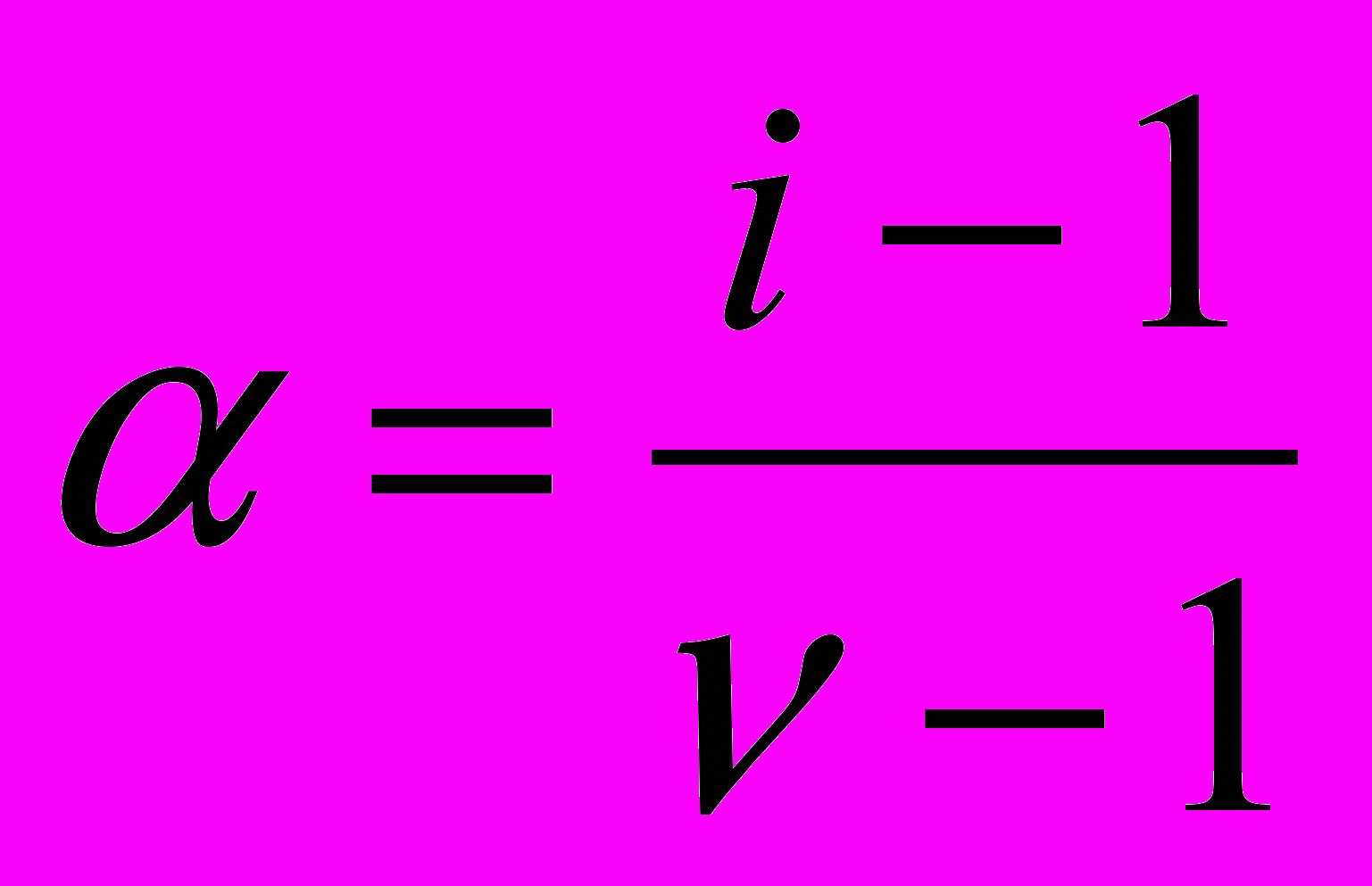 (14)
(14)Значення коефіцієнта i, знайдені Вант-Гоффом для 0,2 н, розчинів деяких солей по пониженню їх температур кристалізації, наведені в табл. 2.
Таблиця 2. Значення коефіцієнта i для 0,2 н. розчинів деяких солей
| Сіль | Формула | Пониження температури замерзання | i | |
| експеримент | розрахунок | |||
| Хлорид калія Нітрат калія Хлорид магнію Нітрат кальцію | КС1 KN03 MgCl2 Ca(N03)2 | 0,673 0,664 0,519 0,461 | 0,372 0,372 0,186 0,186 | 1,81 1,78 2,79 2,48 |
Дані табл. 2 показують, що коефіцієнт i для різних солей різний. З розбавленням розчину він росте, наближаючись до цілих чисел 2, 3, 4. Для солей аналогічного складу ці числа однакові. Наприклад, для всіх солей, утворених одновалентними металами і одноосновними кислотами, при достатньому розбавленні їх розчинів коефіцієнт i наближається до 2; для солей, утворених двовалентними металами і одноосновними кислотами, — до 3.
Наведене в таблиці 3 вказує, що і ізотонічний коеффіціент і ступінь дисоціації залежать від концентрації розчину, тому її треба вказувати разом з цими показниками.
Таблиця 3. Коеффіциент Вант-Гоффа i і ступінь дисоціації α
у водних розчинах La(N03)3 [7,c. 749-751]
| C*10З, М | —ΔТ*103 | i | α | |
| за даними спостережень | обчислені значення | |||
| 0 | - | 0 3,71 | (4,00) | (1,00) |
| 2 | 14 | | 3,78 | 0,93 |
| 5 | 33 | 9,27 | 3,56 | 0,85 |
| 10 | 62 | 18,54 | 3,35 | 0,78 |
| 20 | 117 | 37,08 | 3,15 | 0,72 |
| 40 | 222 | 74,16 | 2,99 | 0,66 |
ВИСНОВКИ
Електролітична дисоціація приводить до, в - перше, збільшення кількості частинок в розчинах, і , по – друге, до появи в розчинах заряджених частинок. Ступінь дисоціації тому може бути зміряна двома групами методів.
До першої групи відносяться методи вимірювання колігативних властивостей розчинів: осмотичний тиск, пониження тиску пари розчинника, підвищення температури кипіння і пониження температури замерзання.
До другої групи методів, що дозволяють визначати α, відносяться такі, які безпосередньо використовують наявність заряду у продуктів дисоціації, наприклад, вимірювання електропровідності.
Обидві групи методів дають практично однакові результати, при цьому перша група методів з погляду апаратурного забезпечення доступніша. З цієї групи методів кріоскопія найбільш простий у виконанні.
Ступінь дисоціації залежить від виду розчинника, температури, концетрации електроліту, присутності і концентрації в розчині інших розчинених речовин.
Знання ступеня дисоціації електроліту дозволяє визначити велику частку властивостей розчинів і розрахувати або спрогнозувати решту властивостей.
Це дуже важливо оскільки, велика частина природи складається з найрізноманітніших розчинів, знання властивостей яких дозволяє прогнозувати їх поведінку і визначити можливі області застосування. У той же час знання ступеня дисоціації дає можливість змінювати її в потрібному напрямі для набуття потрібних властивостей, а простій спосіб визначення дозволить перевірити змінений ступінь дисоціації. Наявність найрізноманітніших розчинників для методу кріоскопії, дозволяє зміряти цей показник в різних інтервалах температур і з різним ступенем точності.
Ступінь диссоціації можна визначити лише для слабких електолітів і це суттєве обмеження застосування цього показника. Для сильних електролітів цей показник не вимірюють, а вимірюють костанту диссоціації. Константу диссоціації наближено можна розрахувати для слабких електролітів знаючи ступінь дисоціації. (за формулами (4) та (5)).
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
| 1 | Білий О.В. Фізична хімія: Навч. посіб./ О.В.Білий.- К.: ЦУЛ, Фітосоціоцентр, 2002.- 364 с |
| 2 | Герасимов Я.И. и др. - Курс физической химии т.1, М.-Л. Химия, 1973-500с. |
| 3 | Н.Л. Глинка Общая химия Издательство: Интеграл-пресс 2006 – 728с |
| 4 | Лебідь В. І. Фізична хімія. 2005 Фолио 478с. |
5 | Манжос О.В. Методичні вказівки до виконання лабораторних робіт за курсом "органічна і колоїдна хімія" для студентів спеціальності 7070801 «екологія» денної форми навчання ОДАХ, Одеса, 2005, 24с. |
| 6 | Манк В.В. Фізична хімія. 2007. Центр учбової літератури. 170с. |
| 7 | Мелвин-Хьюз Э.А. Физическая химия Книга 2. Издательство иностранной литературы. Москва 1973 – 1000с |
| 8 | В.А.Рабинович, З.Я.Хавин "Краткий химический справочник" М., 1986- 392 с |
| 9 | Физическая химия. Химическая термодинамика: Сборник задач / И.И.Иванов, П.Н.Девяткин. Санкт-Петербургский государственный горный институт (технический университет). СПб, 2004.- 66 с. |
| 10 | Яцимирський В. Фізична хімія. 2007. Перун Стр 512 |
