Отдаленные результаты применения моноклональных анти-ige антител в комплексной терапии тяжелой неконтролируемой атопической бронхиальной астмы 14. 01. 25 пульмонология
| Вид материала | Автореферат |
- Лабораторные методы исследования в диагностике аллергий, 15.05kb.
- Обоснование целесообразности применения метода компьютерной электроакупунктуры в комплексной, 353.98kb.
- На правах рукописи, 611.91kb.
- Эффективность галотерапии в комплексе реабилитации при атопическом дерматите у детей, 61.6kb.
- Клинико-иммунологическая характеристика обострений бронхиальной астмы 14. 00. 43 пульмонология, 423.16kb.
- Взрослых, 178.64kb.
- А. Г. Логвиненко, С. И. Логвиненко, И. А. Логвиненко, 58.39kb.
- Морфофункциональные аспекты сопряженности бронхиальной астмы и гастроэзофагеального, 146.61kb.
- Принципы терапии аллергических заболеваний, 781.38kb.
- Применение нутрицевтиков при комплексном санаторном лечении бронхиальной астмы и атопического, 248.85kb.
Таблица 6. Исходные клинико-функциональные показатели и показатели КЖ у исследуемых групп больных (III этап исследования)
| Показатели | Группы больных | |
| Моноклональные анти-IgE антитела (n=23) | Группа сравнения (n=23) | |
| Частота дневных симптомов в неделю | 6,56±1,07; 7 (7-7) | 6,65±0,71; 7 (7-7) |
| Частота ночных симптомов в неделю | 2,04±1,55; 2 (1-3) | 2,04±1,55; 2 (1-3) |
| Частота ингаляций сальбутамола в сутки | 5,9±2,71; 6(4-8) | 6,0±1,31; 6(5-7) |
| ОФВ1, % от должного | 59,1±17,06; 58(46,3-72,6) | 63,47±12,19; 67,9(56,4-73,8) |
| Тест АСТтм, баллы | 11,4±2,67; 11(9-13) | 11,56±2,17; 11(10-13) |
| Опросник AQLQ,баллы: | | |
| - Общее КЖ | 3,43±0,8; 3,15(2,9-3,9) | 3,37±0,45; 3,43(3,0-3,73) |
| - Симптомы | 3,3±0,8; 3,27(2,75-3,75) | 3,25±0,55; 3,41(2,83-3,75) |
| - Ограничение активности | 3,6±0,92; 3,36(2,81-4,27) | 3,57±0,5; 3,45(3,1-4,0) |
| - Эмоциональная сфера, | 3,52±1,15; 3,2(2,8-4,0) | 3,35±0,67; 3,6(2,8-3,8) |
| - Влияние окружающей среды | 3,3±1,03; 3(2,75-3,75) | 3,23±0,65; 3,25(2,75-3,5) |
| Частота внеплановых визитов к врачу в год | 3,95±1,77; 4(3-5) | 4,3±1,96; 4(3-5) |
| Частота обострений в год | 4,39±2,36; 4(3-6) | 3,95±1,18; 4(3-4) |
| Частота госпитализаций в год | 1,47±0,84; 1(1-2) | 3,95±1,18; 4(3-4) |
| Суточная доза ИГКС, мкг/сут | 1552,1±534,1; 2000(1000-2000) | 1456,52±520,33; 1500(1000-2000) |
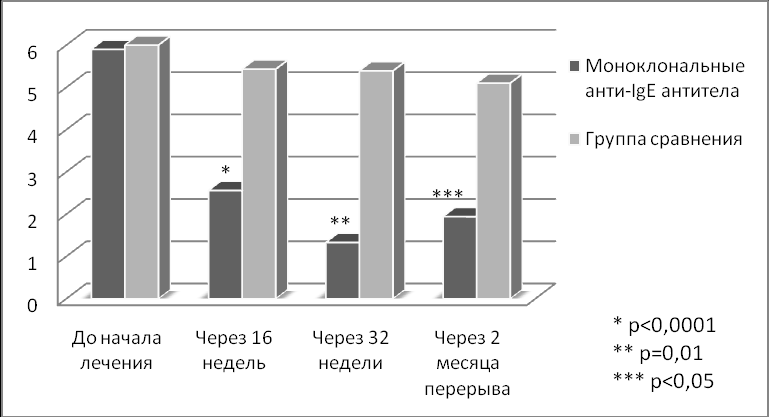
Рисунок 3. Динамика частоты ингаляций β2-агонистов короткого действия в сутки.
У больных, получавших моноклональные анти-IgE АТ, отмечено снижение суточных доз ИГКС. Их среднее значение в пересчете на БД составило на 16 неделе 1128,2±411,4; 1000(1000-1500) (р<0,001) мкг/сут и 750±577,3; 500(500-750) (р=0,043) мкг/сут на 32 неделе лечения (рис. 4).
На фоне проводимой анти-IgE терапии частота внеплановых визитов к врачу сократилась до 0,47±0,73; 0(0-1) (р<0,001) в год, статистически высоко значимыми были также снижение частоты госпитализаций по поводу ухудшения течения БА 0,13±0,34; 0 в год (р<0,001) и количества обострений - 0,56±0,72; 0(0-1) в год (р<0,001). В группе сравнения указанные показатели оставались высокими.
У больных по данным спирометрии на 16 неделе лечения отмечалось значительное улучшение бронхиальной проходимости, среднее значение показателя ОФВ1 (% от должного) составило 84,2±18,1; 88,3(72-98) (р<0,001) и на 32 неделе показатель ОФВ1 был равным 99,6±24,3; 103(85,9-117) % от должного. В группе сравнения статистических изменений ФВД выявлено не было.
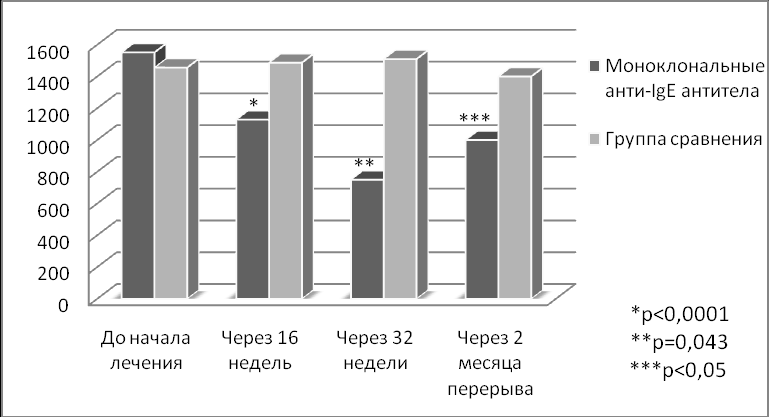
Рисунок 4. Динамика суточной дозы ИГКС, мкг/сут (III этап исследования).
Согласно критериям, рекомендованным GINA пересмотра 2006 г, в группе больных, получавших моноклональные анти-IgE АТ, на 16 неделе лечения полный контроль над симптомами БА был достигнут у 7 больных (30,4%), частично контролируемое течение заболевания было у 9 больных (39,1%). К 32 неделе контролируемое течение БА отмечено у 11 больных (47,8%), частичный контроль был достигнут у 6 больных (26%). Неконтролируемое течение БА на 16 неделе наблюдения сохранялось у 7 (30,4%) больных, на 32 неделе наблюдения у 6 больных (26%) (рис. 5). Следует отметить, что у всех больных с неконтролируемым течением заболевания за время наблюдения отмечено улучшение клинико-функциональных показателей и КЖ, однако, согласно критериям GINA, течение их заболевания не могло все же быть расценено как частично или полностью контролируемое.
В группе сравнения к 16 неделе частично контролируемое течение заболевания наблюдалось у 2 больных (8,6%), к 32 неделе – у 3 (13,0%). Достигнуть полного контроля над симптомами БА во второй группе не удалось в течение всего периода наблюдения.
На фоне проводимой терапии отмечено статистически значимое улучшение результатов теста АСТтм. Среднее количество баллов на 16 неделе терапии было равным 17,6±3,9; 19(15-21) (р<0,001), на 32 неделе – 21,1±2,92; 22(20-23) (р<0,001). В группе сравнения значимых изменений результатов АСТтм выявлено не было.
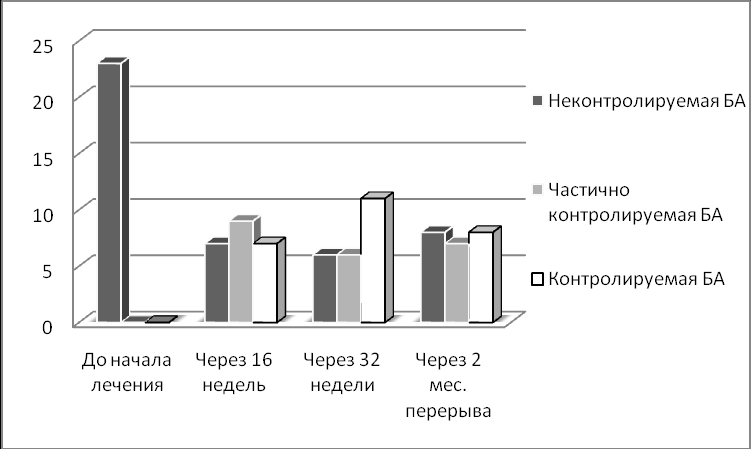
Рисунок 5. Изменение уровня контроля БА у больных, получавших лечение моноклональными анти-IgE АТ на III этапе исследования (согласно критериям GINA, 2006).
Проведенное кожное аллергологическое тестирование показало наличие положительных кожных тестов с бытовыми и эпидермальными аллергенами как в первой группе больных, так и в группе сравнения, причем в группе больных, получавших анти-IgE терапию, средние значения результатов prick-test были положительными для аллергенов D.pteronyssinus и D.farinae (таблица 7).
На фоне проводимой терапии моноклональными анти-IgE АТ на 16 неделе лечения отмечено статистически значимое снижение кожной гиперчувствительности к аллергенам D.pteronyssinus в 2,5 раза (р<0,0001), D.farinae в 5,3 раза (р<0,0001) и к эпидермальному аллергену кошки в 6 раз (р<0,05), на 32 неделе лечения отмечалась тенденция к дальнейшему снижению кожной гиперчувствительности к бытовым аллергенам. Изменения гиперчувствительности к аллергену эпидермиса собаки не имели статистически значимых различий на протяжении всего изучаемого периода, однако прослеживалась тенденция к ее снижению на 16 неделе терапии. В группе сравнения статистически значимых различий между изучаемыми показателями в течение всего периода наблюдения выявлено не было.
Таблица 7. Динамика показателей кожной чувствительности по данным Prick-test к бытовым и эпидермальным аллергенам у больных, получавших лечение моноклональными анти-IgE АТ на III этапе исследования
| Аллергены | Периоды наблюдения | |||
| До начала лечения | 16 недель | 32 недели | После 2 мес. перерыва в лечении | |
| Диаметр волдырной реакции, мм | ||||
| D.pteronyssinus | 5,6±2,85; 7(4-7) | 2,21±2,13; 3(0-4) *(р<0,0001) | 1,91±2,04; 2(0-4) | 3,26±2,0; 4(2-5) **(р<0,0001) |
| D.farinae | 5,3±2,77; 6(4-8) | 1±1,8; 0(0-1,5) *(р<0,0001) | 0,9±1,68; 0(0-1) | 2,15±2,08; 2(0-3) **(р<0,05) |
| Эпидермис кошки | 1,82±2,96; 0(0-4) | 0,3±1,45; 0(0-0) *(р<0,05) | 0,39±1,07; 0(0-0) | 1,26±1,81; 0(0-3) **(р<0,05) |
| Эпидермис собаки | 1±2,08; 0(0-0) | 0,13±0,62; 0(0-0) | 0,13±0,62; 0(0-0) | 0,47±1,12; 0(0-0) |
* - статистически значимые различия по сравнению с исходными данными;
** - статистически значимые различия по сравнению с результатами, полученными через 32 недели терапии.
Проведенное исследование содержания IgE-специфических АТ в сыворотке крови показало наличие сенсибилизации бытовыми аллергенами в обеих группах больных, средние значения результатов были положительными для аллергенов D.pteronyssinus и D.farinae. На фоне проводимой терапии моноклональными анти-IgE АТ на 16 неделе лечения у больных первой группы отмечено статистически значимое снижение содержания IgE-специфических АТ к бытовым аллергенам (р<0,05). На 32 неделе лечения прослеживалась тенденция к их дальнейшему снижению (таблица 8). В группе сравнения статистически значимых различий между изучаемыми показателями в течение всего периода наблюдения выявлено не было.
Таблица 8. Динамика уровня специфических IgE-АТ к бытовым и эпидермальным аллергенам у больных, получавших лечение моноклональными анти-IgE АТ на III этапе исследования.
| Аллергены | Периоды наблюдения | ||
| До начала лечения | 16 недель | 32 недели | |
| Содержание специфических IgE АТ | |||
| D.pteronyssinus | 2±1,04; 2(1-3) | 0,91±0,73; 1(0-1) *(р<0,0001) | 0,73±0,75; 1(0-1) |
| D.farinae | 1,95±1,06; 2(1-3) | 1±0,85; 1(0-2) *(р<0,05) | 1,13±0,96; 0(0-2) |
| Эпидермис кошки | 0,52±0,89; 0(0-1) | 0,21±0,6; 0(0-0) | 0,65±1,11; 0(0-2) |
| Эпидермис собаки | 0,30±0,76; 0(0-0) | 0,34±0,64; 0(0-1) | 0,26±0,75; 0(0-0) |
* - статистически значимые различия по сравнению с исходными данными.
Анализ результатов иммунологического обследования, проведенный до назначения моноклональных анти-IgE АТ, показал, что количество CD8-лимфоцитов было ниже возрастной нормы в обеих группах больных, что согласуется полученными научными данными о снижении количества и функциональной активности супрессоров при атопической БА. В тоже время среднестатистические показатели в исследуемых группах находились в пределах нормативных интервалов с той лишь разницей, что в группе сравнения показатели были ближе к нижней границе нормы, а в группе, получавшей терапию моноклональными анти-IgE антителами, – к верхней. Для относительных показателей количества В-лимфоцитов данная зависимость имела обратный характер (таблица 9).
Исходно между I и II группами были выявлены следующие статистически значимые различия показателей иммунного статуса: содержание лимфоцитов в периферической крови (относительный показатель, %) (р<0,01), общие Т-лимфоциты (относительный и абсолютный показатель) (р<0,05), а также процентное содержание В-лимфоцитов (р<0,05) и В-лимфоцитов с маркером CD23 (р<0,01). Несмотря на статистически значимое повышенное процентное содержание лимфоцитов в крови у больных, получавших лечение моноклональными анти-IgE АТ, абсолютные значения указанного показателя сопоставимы в обеих группах (р>0,05).
Полученные результаты свидетельствуют о том, что базисная терапия не влияла на показатели клеточного иммунитета у больных группы сравнения. В группе больных, получавших лечение моноклональными анти-IgE АТ, было выявлено статистически значимое (р<0,001) снижение относительного показателя содержания лимфоцитов в периферической крови, относительного и абсолютного показателя общих Т-лимфоцитов (р>0,05), абсолютного числа Т-хелперов с антигенным маркером CD4 (р>0,05), а также В-лимфоцитов с маркером CD23 (р<0,001), что указывает на подавление синтеза IgE В-клетками.
Таблица 9. Динамика показателей иммунного статуса у пациентов, получавших лечение моноклональными анти-IgE АТ и больных группы сравнения (III этап исследования)
| Исследуемые показатели | Группа сравнения | Анти-IgE АТ | р | ||
| исходно | через 16 недель | исходно | через 16 недель | ||
| Лейкоциты, 109/л | 9,3±1,01 | 10,24±0,72 | 7,93±0,71 | 8,66±0,73 | >0,05 |
| Лимфоциты, % | 27,8±2,4 | 28,6±2,02 | 36,53±1,11* | 27,14±1,44** | *<0,01 **<0,01 |
| Лимфоциты, абс | 2,46±0,26 | 2,51±0,22 | 2,89±0,27 | 2,32±0,23 | >0,05 |
| Антигенные маркеры лимфоцитов: | | | | | |
| CD3, % | 58,22±3 | 61,4±4 | 72,87±1,85* | 66,0±1,62** | *<0,001 **<0,05 |
| CD3, абс | 1493,88±244,5 | 1569,2±288,44 | 2110,0±210 | 1520,0±140** | **<0,05 |
| CD4, % | 34,55±3,16 | 36,2±4,8 | 46,8±2,61* | 41,5±1,95 | *<0,05 |
| CD4, абс | 913,34±179 | 1060,2±246 | 1380,0±170 | 960±110** | **<0,05 |
| CD8, % | 23,33±2,73 | 20,6±1,14 | 23,7±2,31 | 25,86±1,9 | >0,05 |
| CD8, абс | 559,6±65,32 | 569,8±76,4 | 680,0±90 | 590±60 | >0,05 |
| CD 16,% | 12,22±1,05 | 12,2±1,47 | 10,13±1,4 | 11,64±1,27 | >0,05 |
| CD 16, абс | 277±14,8 | 279±30,07 | 310±50 | 250±25 | >0,05 |
| CD72, % | 17,44±1,71 | 16,8±2,6 | 11,1±1,35* | 12,79±1,69 | *<0,01 |
| CD72, абс | 431±63,75 | 439±71,4 | 290±34* | 330±78 | *<0,001 |
| CD23, % | 3,31±0,78 | 3,15±0,4 | 7,96±1,24* | 5,46±0,84** | *<0,05 **<0,05 |
| CD25 | 3,77±0,98 | 3,06±0,4 | 4,81±0,51 | 3,98±0,45 | >0,05 |
| Иммуно-регуляторный индекс | 1,66±0,2 | 1,72±0,2 | 2,45±0,45 | 1,77±0,18 | >0,05 |
* - статистически значимые различия по сравнению с исходными данными в группе, получающей моноклональные анти-IgE АТ;
** - статистически значимые различия по сравнению с группой сравнения.
При оценке динамики КЖ больных по данным опросника AQLQ на фоне лечения моноклональными анти-IgE АТ нами было получено статистически значимое улучшение по всем пяти изучаемым критериям на 16 и 32 неделях терапии (таблица 10). В группе сравнения статистически значимых изменений КЖ выявлено не было.
