А. Н. Радченко Санкт-Петербургский институт информатики и автоматизации ран
| Вид материала | Документы |
- Теоретические основы управления структурной динамикой сложных технических систем, 87kb.
- В. Б. Наумов Санкт-Петербургский институт информатики и автоматизации ран, 168.59kb.
- Информационно-измерительная и Управляющая система оптимизации температурного режима, 294.7kb.
- Общая характеристика работы, 204.9kb.
- Российская академия наук санкт-петербургский научный центр ран институт лингвистических, 13.04kb.
- А. В. Тимофеев Санкт-Петербургский институт информатики и автоматизации Российской, 110.4kb.
- Которая пройдет в Санкт-Петербурге в период с 28 по 31 марта 2012 года, 18.5kb.
- Доклад на Всероссийской научной конференции «От СССР к рф: 20 лет итоги и уроки», 140.15kb.
- Дмитрий иванович менделеев и санкт-петербургский технологический институт, 95.43kb.
- Российская академия наук санкт-Петербургский Институт истории, 2831.96kb.
СЕКЦИЯ 2
А.Н. Радченко
Санкт-Петербургский институт информатики и автоматизации РАН
radch@spiiras.nw.ru
молекулярные механизмы памяти:
1. Двухканальное управление конформациями
метаботропных рецепторов
Аннотация
С целью изучения механизмов памяти анализируется модель кластера метаботропных рецепторов. Его конформационные переходы подобны переключениям молекулярного триггера, управляемого химическими и электрическими стимулами. Один из конформационных переходов внутриклеточно усиливается: синтезируется второй посредник и инициируется метаболический процесс генерации эндогенного («спонтанного») спайка. Метаботропные рецепторы, локализованные за границами синапсов, воспринимают оба типа стимулов: электрические – продуцируются субсинаптически (ПСП) окрестными синапсами, а химические – распространением медиаторов за границы синапсов, т.е. в нейроно-глиальных щелях.
Введение. Наш анализ механизмов памяти основан на исследовании обычных, в основном стабильных синаптических структур. Они великолепно адресуют энграммы, но не являются носителем информации. Эту функцию выполняют метаботропные рецепторы. За пределами синаптической щели они образуют кластеры. Их конформационные состояния управляются различными сочетаниями химических и электрических (ПСП) стимулов, которые продуцируются окрестными синапсами. Изменяя конформационные состояния, рецептивные кластеры управляют метаболизмом клетки и ее «спонтанной» активностью, а конформационный гистерезис позволяет кластерам выполнять функции памяти [1, 2, 3].
В работе внимание акцентируется на происхождении, механизмах и роли эндогенной активности нейронов, которая инициируется конформационными переходами рецепторов. Показано, например, что в гиппокампе эта активность зависит от входных сигналов и в свою очередь детерминирует выходные реакции [4] Доминирование «спонтанной» активности в форме обыкновенных спайков демонстрируют клетки Пуркинье мозжечка. Более полувека назад Экклз отмечал, что «… существует много примеров химической передачи возбуждения, при которой постсинаптические импульсы не генерируются» [5]. Детерминизм плохо заметен в электрических реакциях, поэтому такую активность обычно называют «спонтанной» или «фоновой», подразумевая недетерминированность. Мы вынуждены использовать эти неточные термины, но в детерминистском смысле. Концепция детерминированности такой активности поддерживается ведущими учеными и базируется на многочисленных экспериментах.
Возбуждающие и тормозные медиаторы, нейропептиды, нейромодуляторы, их комбинации и дериваты транспортируются за границами синапсов в межклеточные щели [6, 7]. В клеточные мембраны, образующие нейроно-глиальные щели, встроены каналы и рецепторы. Свободная латеральная диффузия в БЛМ таких интегральных белков оценивается величинами 410–9–310–12 см2/с [8]. Но в данном случае на дрейф рецепторов и каналов влияет движение медиаторов. Они оттесняет интегральные белки от возбуждающих и тормозных синапсов. Вокруг каждого синапса образуется область, свободная от рецепторов [9]. Рецепторы дрейфуют к квазистационарным точкам, где сумма гидромеханических градиентов в среднем за многодневный период нервной активности нулевая. Такие локусы, называемые эффективными центрами синаптических ловушек [3], благоприятны для кластеризации рецепторов. Свободные рецепторы вокруг кластеров отсутствуют [10]. Квазистационарная позиция кластера смещена от геометрического центра синаптической «ловушки» в сторону более слабых синапсов. Это выравнивает влияние синапсов разного веса на химическую реактивность кластера. Если вес синапсов по каким-либо причинам меняется, то кластер медленно смещается в синаптической ловушке так, что эти изменения компенсируются. Здесь кластер реагирует на изменения концентрации медиаторов и текущие значения ПСП, переключая конформационные состояния и инициируя запуск эндогенных спайков, причем только на определенных (адресных) афферентных паттернах [11].
Конформационные переходы рецептивных кластеров подобны переключениям триггеров. На мембране нейрона они образуют запоминающую среду из многих тысяч трехпозиционных молекулярных триггеров. Они способны фиксировать и прочно удерживать информацию при записи (W) и эндогенно активировать нейроны – при чтении (R).
От вялой и преходящей модификации синапсов конформации рецепторов отличаются:
1) ярко выраженной синаптически управляемой гетерогенностью свойств;
2) устойчивым, сильным и относительно быстрым изменением параметров под действием медиаторов и электрического поля окрестных синапсов;
3) гистерезисными свойствами, благодаря которым одно из конформационных состояний может длительно удерживаться и трансформироваться в необратимую форму;
4) возможностью неразрушающего тестирования конформаций и воспроизведением записанных сигналов в форме инверсии;
5) индивидуальной настройкой конформационных локусов на пространственно-временные конфигурации (паттерны) нервных импульсов [2, 3, 11, 12];
6) способностью под влиянием малых вариаций мембранного потенциала оперативно переключать бистабильные и моностабильные конформационные режимы, заставляя рецепторы попеременно выполнять функции записи или считывания информации [12].
Современные данные о распространении медиаторов в нейроно-глиальных щелях и о кластеризации рецепторов на мембране клетки [13, 14, 15] позволяет исследовать свойства нейронной памяти, где важны оба канала управления – электрический (ПСП) и химический, индуцирующий эндогенную деполяризацию и «спонтанную» активность.
Модель рецептивного кластера. Действие рецептора определяется локализацией и функциями его частей – внеклеточных, внутриклеточных и соединяющих их трансмембранных. Трансмембранные a-спиральные участки рецептора пересекают билипидный матрикс (БЛМ), соединяя вне- и внутриклеточные среды. Концевые и промежуточные части рецептора стелятся по обеим сторонам БЛМ, образуя b-петли. Их амфифильные и гидрофобные остатки частично погружены в БЛМ с обеих сторон. Гидрофильные остатки препятствуют полному погружению цепей. Поэтому они многократно пересекают границы БЛМ, растягивая полипептидные связи и расщепляясь на два подслоя: гидрофильные участки остаются в водных фазах снаружи и внутри клетки, а гидрофобные – погружаются в БЛМ с обеих его сторон навстречу друг другу. Ломаные линии на рис. 1 схематизируют это расщепление.
Подвижность боковых цепей белка не зависит от его вторичной структуры. Сближаясь в центре бислоя с обеих сторон БЛМ, погруженные подслои взаимодействуют внутри БЛМ также с противолежащими подслоями смежных рецепторов. Ионизируясь вследствие переноса электронов [16], группы образуют трансмембранные диполи. Их заряды и подвижность такие же, как и у воротных зарядов (ВЗ) [1]. Трансмембранное притяжение ВЗ не ограничено цепями одного рецептора. В результате смежные рецепторы объединяются в кластеры, а удерживающие их димерные связи формируют оппозитные решетки зарядов. Похоже, что ионизация частично опосредуется ионами кальция: встраиваясь между оппозитными отрицательными зарядами, они заменяют отталкивание притяжением, делая элементы решетки пригодными для формирования трансмембранных диполей.
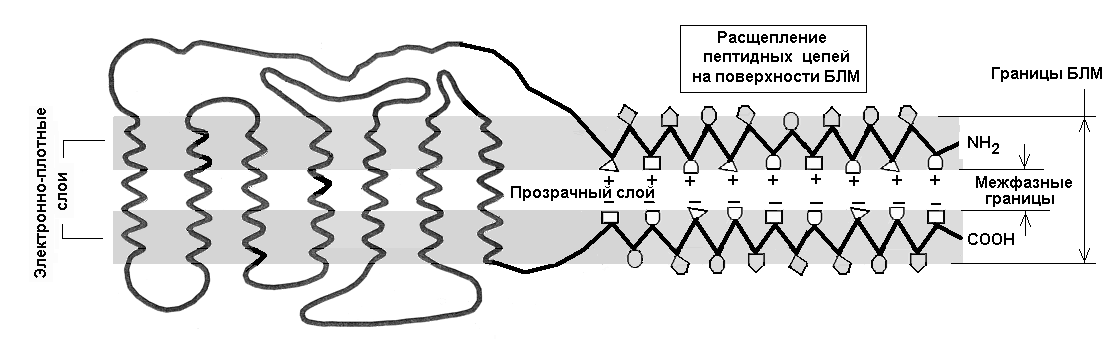
Рис. 1. Схема рецептора. Темные слои толщиной 2.5 нм образованы головками фосфолипидов и растянутыми белковыми цепями. Наибольший размер светлого слоя равен расстоянию между головками фосфолипидов (6.5 – 7.5 нм), наименьший – определяется переменной глубиной погружения заряженных белковых групп (+) и (–) в липидный слой с обеих его сторон. Ионизированные пары цепей образуются также между несколькими рецепторами (кластеризация)
Электростатическое притяжение решеток ВЗ погружает расщепленные цепи в БЛМ, и гидрофильно-гидрофобные границы смещаются внутрь бислоя. Следовательно, межфазные границы проходят не по границам БЛМ, а внутри его – по зарядам противолежащих подслоев. Поликар [17] отмечал, что средняя "липидная" зона клеточной мембраны имеет толщину 2.5 – 5.0 нм и варьирует в зависимости от условий. По другим данным [18] расстояние между осмиофильными (т. е., вероятно, и гидрофильными) слоями меняется от 1.4 до 2.2 нм при изменении pH среды от 7 до 9. Рис. 1 показывает, что рецептивный кластер функционирует как заряженный конденсатор с упругим диэлектриком. Сотни тысяч таких кластеров в виде малоподвижных островков оккупируют перисинаптическую мембрану нейрона.
На каждой из сторон БЛМ полипептидный каркас жестко связывает расщепленные компоненты рецепторов, заставляя их внемембранные части повторять вариации липидной зоны рецептивного кластера. Эти части выталкиваются из БЛМ или частично погружаются в него соответственно при деполяризации или гиперполяризации мембраны. Похоже, что эти трансмембранные перемещения обусловлены конформационными переходами рецептивных кластеров, причем известно, что имеется три конформационных состояния.
Считают, что взаимодействие внеклеточных подслоев рецептора с медиаторами подчиняется принципу «ключ-замок». Известно также, что после удаления агонистов эти конформации могут устойчиво удерживаться [19]. Имеются некоторые представления о внутриклеточных реакциях, порождающих синтез второго посредника. Однако передача сигналов через рецептор между вне- и внутриклеточными процессами изучена слабо. Поэтому наиболее интересны трансмембранные конформационные переходы внутри БЛМ [13, 20, 21]. С тремя состояниями рецепторов связаны закрытие, открытие и инактивация ионных каналов (Радченко, 1996). Модель рецептивного кластера на рис. 1 интересна также в связи с тем, что управлять ионными каналами способны только димеризованные рецепторы [22].
Вопрос, как рецептор передает внешний сигнал внутрь клетки, обычно связывают со спираль-спиральным взаимодействием цепей рецептора внутри БЛМ. Наша модель расширяет обычный подход, допуская, что перемещение внутримембранных спиралей – не причина, а следствие конформационной подвижности околомембранных цепей рецептора и взаимодействия его ионизированных групп (ВЗ). Это единственное допущение позволяет исследовать конформации рецептивного кластера как запоминающего элемента и проследить функции обширного множества этих кластеров на разных уровнях механизма памяти.
Рис. 2 схематизирует передачу внешнего сигнала внутрь клетки с помощью электрического (А) или химического стимулов (Б). Деполяризация мембраны (ВПСП) ослабляет внутримембранную электростатическую «пружину», сжимающую подслои рецепторов, и, как следствие, вызывает скачкообразный деполяризационный конформационный переход (ДКП"a ® b") рецептивного кластера. Происходит разобщение половин рецептивного кластера и их выталкивание из БЛМ в обе стороны и освобождение энергии. Оба фактора способны катализировать синтез второго посредника, например, цАМФ, и активацию внутриклеточного усилительного механизма.
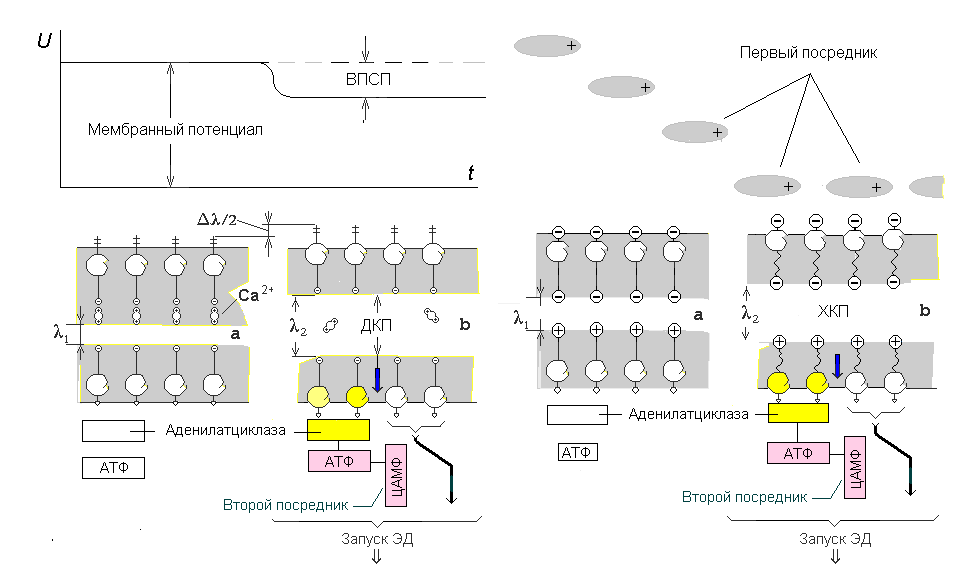
Рис. 2. Два канала управления конформациями рецепторов. Трансмембранные конформационные переходы, вызванные электрическими (ДКП) и химическими (ХКП) стимулами выталкивают части рецепта из БЛМ. Внутриклеточная часть запускает катализ синтез второго посредника и эндогенно деполяризует мембрану. Возможность взаимодействия внеклеточной части с нейроглиальной средой расширяется
Аналогичные процессы происходят при химической активации рецептивного кластера. Молекулы медиатора «садятся» на внеклеточную часть кластера, конформируя ее и частично вытягивая из БЛМ. Такое противодействие электростатическому трансмембранному притяжению зарядов индуцирует химический конформационный переход (ХКП) и «выстреливание» сопряженных частей кластера вне и внутрь клетки. В результате действие первичного (внешнего) медиатора транслируется внутрь клетки. Активные центры внутриклеточной части активируют аденилатциклазу и синтез второго посредника – цАМФ. Для этого процесса известен коэффициент усиления: в результате реакции средняя концентрация цАМФ оказывается в 10000 раз больше концентрации первичного медиатора. Похоже, что такое усиление достаточно для преобразования конформационного перехода в спайк, но эффект может быть ограничен синтезом цАМФ. Он может быть важен для потенциации клетки и запуска других клеточных механизмов.
Выбор реакции клетки после синтеза цАМФ может направляться различием в химическом сродстве внутриклеточных частей рецептивного кластера, которые в результате ДКП или ХКП выталкиваются внутрь клетки из БЛМ. Некоторое сигнальное значение для этого процесса могут иметь сопутствующие химические группы внутримембранной части кластера (показаны на рис. 2 жирной стрелкой справа). Они селектируют одну из многих возможных внутриклеточных реакций, а АТФ снабжает эти реакции энергией. Похоже, это различие определяет долговременные формы потенциации и депрессии [23]. Известно, что большинство ферментов функционирует, будучи связанными с мембранами. Для многих ферментов доказано, что они располагаются на мембране в определенном порядке, который определяет последовательное протекание реакций метаболического цикла. Этот порядок включает конформацию и ориентацию активных центров белков относительно БЛМ.
Электростатические силы, сжимая половины кластера, действуют изнутри. Химические стимулы действуют снаружи. Метаботропные медиаторы, вытягивая из БЛМ часть рецептивного кластера, противопоставляют действию электростатической «пружины» силы другой природы и направления. Химическое управление влияет на конформационные переходы прямо, в то время как электрические стимулы возникают опосредованно – через механизм субсинаптической активации ионных каналов и результирующие ПСП. Ионотропные медиаторы действуют на конформационный механизм косвенно и двухступенчато, ослабляя или натягивая его внутреннюю «электростатическую пружину». Те же медиаторы, распространяясь в щелевой микроструктуре нервной ткани, порождают встречные силы, растягивающие эту пружину. Это двойное – прямое (химическое) и косвенное (электрическое) – управление рецептивными кластерами лежит в основе взаимодействия ионотропных и метаботропных влияний.
Противоборство сжимающих и растягивающих сил внутри кластера дополняет молекулярную модель «рецептора растяжения» [15] и показывает, как в масштабе межатомных связей можно реализовать конформационное управление открытием и закрытием конкретного ионного канала. Важная для механизмов памяти фиксация одного их конформационных состояний достигается благодаря агрегации рецепторов и включению в этот механизм сил адгезии и полимеризации. Существенную ясность в эти процессы вносит математическое исследование модели [24].
Список литературы
- Радченко А.Н. Гистерезисные свойства возбудимых мембран – основа нейронной памяти // Биофизика. 1993. Т.38. Вып. 2. С. 288-293.
- Радченко А.Н. Ассоциативная память. Нейронные сети. Оптимизация нейропроцессоров. СПб.: Наука, 1998. 261 с.
- Радченко А.Н. Межуровневые отношения в нейронной памяти: внесинаптическая рецепция медиаторов, потенциация, спонтанная активность // Успехи физиологических наук. 2002. Т. 33. № 1. С.58-76.
- Habliz J.J. аnd Jonston D. Endogenous nature of spontaneous bursting in hippocampal pyramidal neurons. Cell. Mol. Neurobiol. 1981. V.1. P. 325-334.
- Экклз Дж. Тормозные пути центральной нервной системы. М.: Мир, 1971. 168 с.
- Agnati, L.F., Zoli, M., Stromberg, I., Fuxe, K. Intercellular communication in the brain: Wiring versus volume transmission. // Neurosci. 1995. V. 69. P. 711-726.
- Agnati L.F., K. Fuxe, C. Nicolson E. Sykova (ed's), Volume transmission revisited. Progress in Brain Research, v.125. 200, 28 articles.
- Бергельсон Л.Д. Мембраны, молекулы, клетки. М.: Наука, 1975.
- Hanson J. E. & Smith Y. Group I Metabotropic Glutamate Receptors at GABAergic Synapses in Monkeys. Journal of Neuroscience, 1999. 19(15), 6488-6496.
- Kruk PJ, Korn H, and Faber D. S.. The effects of geometrical parameters on synaptic transmission: a Monte Carlo simulation study. Biophysical Journal, 1997, 73, 2874-2890.
- Радченко А.Н. Оптимизация распределенной ассоциативной памяти со случайной организацией // Биофизика. 1993. Т.38. Вып. 2. 294-299.
- Радченко А. Н. Информационные механизмы нейронной памяти и модели амнезий. СПб: Анатолия, 2002. 297 с.
- Zoli M., Agnati L. F., Hedlund P., Li X. M., Ferre S. and Fuxe K. Receptor-receptor interactions as an integrative mechanism in nerve cells. // Mol. Neurobiol. 1993 V. 7. P. 293-334.
- Rusakov D.A., Kullmann D.M.. Extrasynaptic Glutamate Diffusion in the Hippocampus: Ultrastructural Constraints, Uptake, and Receptor Activation. Neuroscience, 1998, 18(9):3158-3170.
- Sukharev S., Durell S. R. and Guy H. R. Structural Models of the MscL Gating Mechanism. Biophysical J. 2001.V. 81. P.917-936.
- Лахно В. Д., Сковорода А.Р. Роль полярной среды в процессах переноса электрона на большое расстояние. Пущино. 1991 (препринт).
- Поликар А. Молекулярная цитология мембранных систем животной клетки. М.: Мир, 1982. 158 с.
- Coster H.G.L. Electromechanical stresses and the effect of pH on membrane structure. BBA. V.382. 1975. 142-146.
- Avissar S., Amitai G. and Sokolovsky M. // Oligomeric structure of muscarinic receptors is shown by photoaffinity labeling: Subunit assembly may explain high- and low-affinity agonist states," Proc. Natl. Acad. Sci. USA. 1983. V. 80. Р.156-159.
- Smith S. O., Kawakami T., Liu W., Ziliox M., and Aimoto S. Helical Structure of Phospholamban in Membrane Bilayers, Journal of Molecular Biology. 2001. 13(5). 1139-1148.
- Zoli M., Guidolin D.,, Fuxe K., Agnati L. F. The receptor mosaic hypothesis of the engram possible relevance of Boolean network modeling. // Int. J. Neural Syst. 1996. V. 7. № 4. P.363-368.
- Maggio R., Barbier P., Colelli A., Salvadori F., Demontis G and Corsini G. U. G Protein-Linked Receptors: Pharmacological Evidence for the Formation of Heterodimers. Molecular Pharmacology, 1999, Vol. 291, Issue 1 (October), 251-257.
- Rodriguez-Ithurralde D., Henley J. M., Bravo S. O. Molecular mechanisms in the regulation of neurotransmitter receptors. Physiological and pathological implications. 6th Internet World Congress for Biomedical Sciences. Symposium: Protein regulation of neurotransmitter receptors. Presentation 44, 2000.
- Радченко А.Н. Молекулярные механизмы памяти: 2. Управление консолидацией рецептивных кластеров // Нейроинформатика-2005. Сб. научн. тр. Ч. 1. С. 100.
УДК 004.032.26(06) Нейронные сети
