Актуальность работы
| Вид материала | Документы |
- Общая характеристика работы актуальность работы, 227.87kb.
- Общая характеристика работы актуальность работы, 227.87kb.
- Актуальность разработки данной программы основывается на данных статистических показателей, 99.21kb.
- Общая характеристика работы актуальность, 242.28kb.
- I. общая характеристика работы актуальность темы исследования, 263.23kb.
- Конституция Российской Федерации Гражданский кодекс, 198.07kb.
- Общая характеристика работы актуальность темы исследования, 305.28kb.
- Общая характеристика работы актуальность работы, 336.09kb.
- Общая характеристика работы актуальность работы, 236.99kb.
- Общая характеристика работы актуальность темы диссертационного исследования, 329.52kb.
АКТУАЛЬНОСТЬ РАБОТЫ. Профессиональная патология кожи до настоящего времени остается одной из важных медицинских и социальных проблем [Г.Д. Селисский, Е.В. Орлов, С.М. Федоров, Н.И. Измерова, И.Г. Шакурова, 2003]. В настоящее время насчитывается более 90 000 химических веществ и около 2 000 аллергенов, которые широко применяются в современном производстве. Ведущими из них являются металлы, обладающие сенсибилизирующими свойствами (хром, никель, кобальт). Повышенное поступление ионов никеля и его соединений в организм приводит к токсическому эффекту, который сопровождается снижением активности ряда ферментов, активацией процессов липидной пероксидации, нарушением синтеза белка, ДНК, РНК [Н.Ф. Измеров, 1983,1990; Г.П. Артюнина, 1998; Л.И. Антошина, 2001; Р.В. Борисенкова, 2001; О.И. Румянцева, 2005; S.Antilla,1986]. Широкое распространение на производстве имеют вещества раздражающего действия - цементные растворы, органические растворители, полимерные соединения, аминосоединения, медикаменты и др. Многообразие производственных химических соединений с раздражающими и сенсибилизирующими свойствами, их комплексное воздействие на организм и кожу, в частности, в сочетании с многочисленными факторами экзо- и эндогенного характера, включая генетически обусловленные особенности метаболизма, приводят к разнообразию клинических проявлений профессиональных дерматозов.
Комплексный и комбинированный характер воздействия химических веществ на организм, особенности токсикокинетики, популяционная и индивидуальная чувствительность к химических веществам обусловливают особенности изменения биологической реактивности и неспецифической резистентности организма, влияющих на развитие и течение профессиональных аллергических заболеваний кожи.
Нарушение физиологического состояния свободнорадикального окисления приводит к нарушению структуры плазматических мембран, в конечном итоге к избыточной продукции медиаторов воспаления (фактора активации тромбоцитов, тромбоксанов, простагландинов, лейкотриенов). В научной литературе имеются работы, доказывающие значительную роль нарушений деятельности систем «перекисное окисление липидов (ПОЛ) – антиоксидантная защита (АОЗ)» в развитии различных патологических состояний [А.Х. Коган, 1999; Л.А. Белова, О.Г. Оглоблина, Н.М. Чихладзе, 1998; В.З. Ланкин, А.К Тихазе, Ю.Н. Беленков, 2000; О.Н. Ушатикова, 2005]. Однако, исследования процессов свободнорадикального окисления и антиоксидантной защиты при патологии кожи носят крайне ограниченный характер.
В настоящее время возрос интерес исследователей к изучению процессов повреждения ДНК при различных патологических состояниях [А.К. Получкин, 2006]. Обсуждается возможность влияния экологических факторов на процессы, приводящие к усиленному образованию антител к ДНК, свидетельствующему о повреждении нативной (двуцепочечной), денатурированной (одноцепочечной) ДНК и белковой составляющей нуклеосомы. Широкое распространение в последние годы получили геномные и протеомные исследования по изучению генетико-биохимических полиморфных систем и взаимосвязи отдельных аллельных вариантов генов с различными патологическими процессами [А.И Арчаков, 2002; А.М. Егоров, 2003; В.М. Говорун, 2003; Л.П. Кузьмина, 2005; В.А. Спицын, 2006].
Все вышесказанное определяет актуальность изучения состояния системы «оксиданты-антиоксиданты», процессов повреждения ДНК и генетического биохимического полиморфизма у больных профаллергодематозами для расширения представлении о патогенетических механизмах формирования данной патологии с целью разработки системы профилактических, лечебно-диагностических и реабилитационных мероприятий.
Диссертационная работа выполнена в рамках госбюджетной темы ГУ НИИ медицины труда РАМН №0203 «Новые технологии ДНК диагностики генетического биохимического полиморфизма» и темы №0602 «Разработка дифференцированных систем комплексной профилактики профессиональной и производственно-обусловленной патологии и реабилитации работников современных производств с учетом ведущих факторов риска нарушения здоровья».
ЦЕЛЬ РАБОТЫ – изучение состояния системы «оксиданты-антиоксиданты», процессов повреждения ДНК и показателей генетического биохимического полиморфизма для расширения представлений о патогенезе профессиональных аллергических дерматозов и обоснования биохимических критериев оценки риска развития, прогноза клинического течения и мониторинга эффективности лечебных мероприятий.
Для достижения цели предстояло решить следующие задачи:
- Изучить состояние системы «оксиданты-антиоксиданты» у больных профессиональными аллергическими дерматозами.
- Изучить состояние процессов повреждения ДНК у больных профессиональными аллергическими дерматозами.
- Исследовать участие полиморфных генов цитохрома Р-450, глутатионтрансферазы, эндотелиальной синтазы окиси азота, фактора некроза опухолей альфа в патогенезе профаллергодерматозов для оценки индивидуального риска их развития и прогноза клинического течения.
- Проанализировать выявленные биохимические и молекулярно-генетические изменения в зависимости от тяжести клинического течения различных форм профессиональных аллергических дерматозов для оценки индивидуального прогноза заболевания.
- Обосновать клинико-лабораторный комплекс биохимических и молекулярно-генетических показателей для прогноза индивидуального риска развития профессиональных аллергодерматозов, научно обоснованного проведения профилактических и лечебных мероприятий.
НАУЧНАЯ НОВИЗНА. В результате проведенных исследований получены новые данные, расширяющие представление о патогенетических механизмах развития профессиональных аллергических дерматозов.
Впервые проведена комплексная оценка системы «оксиданты-антиоксиданты», процессов повреждения ДНК, генетического биохимического полиморфизма систем цитохрома Р-450, глутатион-S-трансферазы (GSTM1), фактора некроза опухолей альфа (TNF-α), эндотелиальной синтазы окиси азота (eNOS) у больных профессиональными аллергическими дерматозами.
Изучена особенность сроков развития, клинического течения профаллергодерматозов в зависимости от наличия дефицитных вариантов полиморфных генов цитохрома Р-450, GSTM1, TNF-α, синтазы окиси азота.
Определены биохимические и молекулярно-генетические критерии оценки риска развития, тяжести и прогноза клинического течения профаллергодерматозов.
ПРАКТИЧЕСКАЯ ЗНАЧИМОСТЬ РАБОТЫ. Полученные результаты изучения биохимических и молекулярно-генетических особенностей течения профаллергодерматозов могут служить критериями индивидуального риска развития профессиональной патологии кожи и являться основой для разработки системы профилактических, лечебно-диагностических и реабилитационных мероприятий. Представленные в работе методы являются информативными, доступными и могут быть внедрены в практику обследования больных профаллергодерматозами в условиях профпатологических центров для оценки тяжести, индивидуального прогноза заболевания и выбора патогенетической терапии.
Материалы исследований легли в основу проекта методического пособия «Определение полиморфизма генетико-биохимических систем для оценки индивидуальной чувствительности организма к воздействию неблагоприятных факторов производственной среды».
АПРОБАЦИЯ РАБОТЫ проведена на заседании специалистов клинического отдела медицинской экспертизы, профилактики и реабилитации профессиональных и производственно-обусловленных заболеваний ГУ НИИ медицины труда РАМН (14.06.2006).
Материалы диссертации доложены и обсуждены на Всероссийской научно-практической конференции молодых ученых и специалистов «Окружающая среда и здоровье» (Суздаль, 2005 г.), XII Российском национальном конгрессе «Человек и лекарство» (Москва, 2005 г.), III и IV Всероссийском Конгрессе «Профессия и здоровье» (Москва, 2004 и 2005гг.). В рамках конгресса проводился конкурс молодых учёных, по результатам которого данная работа удостоена диплома (II место).
ПУБЛИКАЦИИ. По теме диссертации опубликовано 8 работ.
ОБЪЁМ И СТРУКТУРА ДИССЕРТАЦИИ. Работа изложена на _____ страницах машинописного текста, состоит из введения, глав, обсуждения, выводов, списка литературы, содержащего _____ отечественных и _____ иностранных источников. Иллюстрации представлены таблицами и рисунками.
ОСНОВНЫЕ ПОЛОЖЕНИЯ, ВЫНОСИМЫЕ НА ЗАЩИТУ:
- В патогенетических механизмах развития профаллергодерматозов важную роль играет нарушение биологического баланса в системе «оксиданты-антиоксиданты», в основе которого лежит гиперактивация процессов свободнорадикального окисления и снижение антиоксидантной активности, а также процессы повреждения двуцепочечной нативной ДНК.
- Сочетание неблагоприятных гетеро- и гомозиготных аллелей систем цитохрома Р-450, GSTM1, TNF-α, синтазы окиси азота характеризуется более ранним развитием (до 5 лет), тяжелым течением и неблагоприятным прогнозом профессиональной патологии кожи.
- Для оценки риска развития, тяжести клинического течения и прогноза профессиональной аллергической патологии кожи целесообразно определение биохимических и молекулярно-генетических показателей систем «оксиданты-антиоксиданты», генетического биохимического полиморфизма и процессов повреждения двуцепочечной нативной ДНК.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Для решения поставленных в работе задач в условиях клиники ГУ НИИ Медицины труда РАМН было обследовано 144 больных профессиональными аллергодерматозами (экзема и аллергический дерматит). Результаты биохимических исследований сопоставлялись с контрольной группой из 40 практически здоровых лиц, не имевших заболеваний кожи и контакта с веществами раздражающего и сенсибилизирующего действия. При исследовании генетических биохимических маркеров в качестве контроля использовались результаты анализов крови 250 практически здоровых лиц Московской популяции (данные В.А. Спицына).
Общее клиническое обследование больных проводилось в дерматологическом отделении клиники ГУ НИИ Медицины труда РАМН. Профессиональное заболевание кожи диагностировалось на основании профессионального маршрута больного, санитарно-гигиенической характеристики условий труда, данных анамнеза, клинической картины, течения заболевания и выявленной повышенной чувствительности к промышленным аллергенам при кожном тестировании, цитохимическом исследовании периферической крови.
Для решения поставленных в работе задач с учетом известных патогенетических механизмов развития аллергических заболеваний кожи и характера действующих производственных факторов был разработан комплекс биохимических и молекулярно-генетических показателей, характеризующий активность свободнорадикальных процессов, основные звенья антиоксидантной защиты, степень повреждения ДНК и состояние генетико-биохимических полиморфных систем.
Для оценки состояния системы «оксиданты-антиоксиданты» у обследованных больных и лиц контрольной группы проводилось определение уровней продуктов перекисного окисления липидов (ПОЛ), оксида азота, общей антиокислительной активности и отдельных антиоксидантов: каталазы, супероксиддисмутазы (СОД), трансферрина, α-токоферола, ретинола. Количественное содержание продуктов ПОЛ определялось в сыворотке крови в реакции с 2-тиобарбитуровой кислотой (ТБК) спектрофотометрическим методом [О.Г. Архипова, 1988]. Исследование количественного содержания оксида азота в сыворотке крови проводили с помощью тест-систем фирмы «R&D Systems» (США) с оценкой результатов на вертикальном фотометре «Multiscan» с последующей обработкой результатов компьютерной программой «Genesis». Общую атиокислительную активность плазмы крови определяли спектрофотометрическим методом [Б.Т. Величковский, 2003], в основе которого лежит реакция восстанавления антиоксидантами свободного радикала - дифенилпикрилгидразила (ДФПГ). Измерение оптической плотности проводили на спектрофотометре «Cary-50». Количественное содержание Cu-Zn-зависимой супероксиддисмутазы (СОД) в сыворотке крови определяли методом иммуноферментного анализа (ИФА) с помощью тест-систем фирмы «Bender MedSystems» (Австрия). Уровень каталазы в сыворотке крови обследованных лиц определяли спектрофотометрическим методом [Королюк М.А., 1988], основанным на способности перекиси водорода образовывать с солями молибдата аммония стойкое соединение желтого цвета. Содержание трансферрина определяли спектрофотометрическим методом на автоматическом биохимическом анализаторе «Keysys» с использованием тест-систем фирмы «Roche». Содержание основных липидных антиоксидантов – α-токоферола и ретинола определяли по высокочувствительному флуориметрическому методу при максимуме эмиссии 324 нм и максимуме возбуждения 292 нм для α-токоферола и при максимуме эмиссии 490 нм и максимуме возбуждения 324 нм дла ретинола на спектрофлуориметре «Флюорат-02» [Черняускене Р.Ч., 1984].
Процессы повреждения ДНК оценивали по образованию антител к одноцепочечной, двухцепочечной ДНК и нуклеосоме методом ИФА с использованием тест-систем фирмы «ORGENTEC Diagnostika GmbH» (Германия).
Анализ полиморфных систем генов цитохрома Р-450, GSTM1, TNF-α, eNOS проводили методом полимеразной цепной реакции (ПЦР) на амплификаторе “Терцик” фирмы “ДНК-технология” с использованием локусспецифических олигонуклеотидных праймеров (разработка ООО “Центр Молекулярной Генетики”) и анализом продуктов реакции в 7%-ном полиакриламидном геле с последующей окраской этидиумбромидом и визуализацией в проходящем УФ-свете.
Результаты исследований обрабатывались параметрическими (дисперсионный анализ, критерий Стьюдента, Ньюмена-Кейлса, Даннета) и непараметрическими (критерий Крускала-Уоллиса, Манна-Уитни, Данна) методами математической статистики с использованием пакета компьютерных программ «Биостат».
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Характеристика обследованного контингента больных и условий их труда. Условия труда оценивались нами по результатам научных разработок сотрудников гигиенических подразделений института, а также по данным характеристик условий труда, представленных территориальными ЦГСЭН с мест работы заболевших.
Обследованные в условиях стационара 144 человека работали на различных предприятиях, в основном г. Москвы и Московской области. Все они контактировали с веществами сенсибилизирующего и раздражающего действия. У всех больных была выявлена повышенная чувствительность к тому или иному химическому веществу по результатам кожного тестирования (зав. отделением дерматологии д.м.н., профессор Н.И. Измерова), НСТ-теста и цитохимического исследования (зав. лаб. клинической диагностики д.м.н., профессор Л.А. Иванова): цементу и бетону – у 37 человек, органическим растворителям – у 17, соединениям хрома – у 23, солям никеля – у 15, соединениям кобальта – у 4, синтетическим смолам, клеям, краскам – у 21, антибиотикам и фармацевтическим средствам – у 9, минеральным удобрениям и ядохимикатам – у 3. Большая часть больных были заняты в строительстве, производстве строительных материалов или работали на домостроительных комбинатах – 76 человек (52,8%) и имели профессии отделочницы, плиточника, штукатура, маляра, слесаря, формовщика, монтажника, машиниста.
Основная масса обследованных больных (79% женщин и 21% мужчин) представлена средней и старшей возрастными группами. Развитие профессионального заболевания кожи в 86% случаев наблюдалось у лиц со стажем работы во вредных условиях труда от 10 лет и более.
Все обследованные лица (144 чел.) в зависимости от формы профессионального аллергического заболевания кожи были разделены на три группы. Первую группу обследованных составили 97 больных профессиональной экземой. Во вторую группу (32 чел.) вошли больные профессиональным аллергическим дерматитом. Третью группу составили лица (15 чел.), имеющие профессиональные аллергодерматозы (экзема или аллергический дерматит) в сочетании с профессиональной бронхиальной астмой.
Биохимические и молекулярно-генетические исследования. При изучении состояния системы «оксиданты-антиоксиданты» у больных различными формами профессиональных аллергодерматозов выявлены однонаправленные биохимические изменения: увеличение содержания продуктов ПОЛ и снижение уровня антиокислительной активности. Следует отметить, что дисбаланс в системе «оксиданты-антиоксиданты» в группе больных с сочетанной патологией (профессиональные заболевания кожи и бронхиальная астма) был более выражен, и показатели данной системы статистически достоверно отличались от показателей в группах больных профессиональной экземой и профессиональным аллергическим дерматитом (табл.1).
Таблица 1
Уровень оксидантов и антиоксидантов в плазме крови у обследованных больных
| Биохимический показатель | Группа | |||
| I Профессио-нальная экзема | II Профессио-нальный аллергический дерматит | III Профаллерго-дерматозы и профессионал-ная бронхиальная астма | IV Контроль | |
| | 97 | 32 | 15 | 40 |
| ПОЛ, мкмоль/л | 3,24±0,09 *** | 3,27±0,15 *** | 3,9±0,2*** | 2,4±0,1 |
| Оксид азота, мкмоль/л | 16,8±0,63 | 19,2±1,2* | 16,3±0,8 | 14,5±1,72 |
| Общая антиокис-лительная активность, мэкв. | 35,2±0,8*** | 36±1,5*** | 26,8±1,9*** | 44,5±0,2 |
| Каталаза, мКат/л | 25,6±1,3 | 23,5±2,3 | 20,9±0,7** | 22,0±0,2 |
| СОД, нг/мл | 136±8,6*** | 131±12,4** | 147±13,2*** | 56,5±20 |
| Трансферрин, г/л | 2,67±0,08** | 2,7±0,09** | 2,4±0,05** | 2,93±0,05 |
| Ретинол, мкг/дл | 44,4±1,43** | 45,8±2,1 | 40,3±1,2** | 54,4±6,0 |
| α-токоферол, мкг/дл | 633±30*** | 703±41,7*** | 616±36*** | 1012±39,2 |
Примечание. Достоверность различий с контрольной группой *** р<0,001; ** р<0,05
Достоверность различий с I и II группами р<0,05
С увеличением трудового стажа (более 30 лет) у обследованных лиц выявлено достоверное нарастание продуктов ПОЛ (табл. 2).
Таблица 2
Уровни продуктов ПОЛ у больных профаллергодерматозами в зависимости от стажа работы
| группа Стаж работы | I 1-9 лет n=17 | I I 10-19 лет n=42 | I I I 20-29 лет n=39 | IV более 30 лет n=31 | Контроль n=40 |
| ПОЛ, мкмол/л | 2,64±0,2 | 3,36±0,14*** | 3,43±0,15*** | 3,59±0,1*** | 2,4±0,1 |
Достоверность различий с контрольной группой ***р<0,001
Достоверность различий со стажевой группой до 10 лет р<0,05
В последние годы становится все более очевидным участие в патогенезе многих заболеваний оксида азота. Оксид азота, простой свободнорадикальный газ, обладает уникальными свойствами, сочетая функции первичного и вторичного мессенджера, т.е. передатчика внутриклеточной информации. Биологический эффект оксида азота зависит от его концентрации. При низких концентрациях преобладают прямые эффекты, направленные на поддержание гомеостаза сердечно-сосудистой и нервных систем, а при высоких – непрямые, обусловленные действием оксида азота как свободного радикала.
Проведенные исследования выявили достоверное по сравнению с контролем повышение количественного содержания оксида азота в группе больных профессиональным аллергическим дерматитом, в то время как в группах больных профессиональной экземой и сочетанной кожной и бронхолегочной патологией достоверных различий с контролем не обнаружено (табл. 1). Кроме того, уровень оксида азота коррелировал с содержанием продуктов ПОЛ (r=0,87; p<0,001) (рис 1), что может свидетельствовать об избыточном образовании пероксинитрита, обладающим цитотоксическим действием.
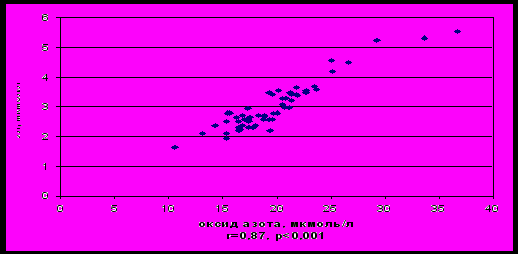

Рис. 1. Анализ зависимости уровней оксида азота и продуктов перекисного окисления липидов (ПОЛ) в сыворотке крови у обследованных больных.
Анализ отдельных антиоксидантов выявил свои специфические особенности: достоверное снижение концентрации α-токоферола – главного жирорастворимого антиоксиданта сыворотки крови – на 37% у больных профессиональной экземой и на 31% у больных профессиональным аллергическим дерматитом, а также дефицитом другого жирорастворимого антиоксиданта – ретинола (табл.1). Оценка функционирования ферментативного звена антиоксидантной системы выявила достоверное снижение содержания трансферрина и достоверное повышение активности сепероксиддисмутазы более чем в 2 раза у обследованных больных в сравнении с контрольной группой (табл.1). По уровню активности каталазы обнаружили достоверное снижение активности данного фермента в группе больных с сочетанной патологией в сравнении с контрольной группой, а в группах больных профессиональной экземой и профессиональным аллергическим дерматитом по уровню активности каталазы достоверных различий по сравнению с контролем не выявлено (табл.1). Однако при индивидуальном анализе было установлено, что в группе больных профессиональной экземой 39% лиц имели повышенную активность каталазы, 35% - имели снижение активности данного фермента, а в группе лиц с профессиональным аллергическим дерматитом у 44% наблюдалось повышение, а у 40% понижение активности каталазы.
Таким образом, у больных профаллергодерматозами выявлена гиперактивация процессов свободнорадикального окисления, характеризующаяся достоверным повышением уровня продуктов ПОЛ и повышением в группе больных профессиональным аллергическим дерматитом концентрации оксида азота. Снижение общей антиокислительной активности сыворотки крови у всех обследованных лиц свидетельствует об угнетении антиокислительной системы. Также угнетено неферментативное звено данной системы, что является основанием для включения в комплекс лечебно-профилактических мероприятий препаратов токоферола и ретинола. Анализ ферментативного звена выявил угнетение каталазы при прогрессировании патологического процесса (распространенные формы экземы и дерматитов), или у высокостажированных (>20 лет) больных. Противовоспалительные свойства СОД и ее антирадикальная активность рассматривается в литературе как важный фактор неспецифической резистентности [J.D. Laskin, 2001]. В связи с этим усиление активности этого антиоксиданта можно рассматривать как компенсаторную реакцию в ответ на усиление окислительных процессов в организме больных. С другой стороны, повышение активности СОД может усугублять патологический процесс, так как активность каталазы у 50-60% больных или снижена, или в пределах физиологической нормы, и таким образом, дефицит каталазы у больных профаллергодерматозами приводит к избыточному образованию перекиси водорода в реакции дисмутации, катализируемой СОД. Снижение содержания трансферрина у больных профаллергодерматозами свидетельствует о хронизации воспалительного процесса и является неблагоприятным прогностическим признаком. Следует также отметить, что у больных профессиональными аллергодерматозами при прогрессировании патологического процесса усиливается степень угнетения антиоксидантной защиты, увеличивается вариабельность активности ферментов и нарушается взаимодействие (характер корреляции) между ними как взаимосвязанной системы.
Выявленный дисбаланс в системах свободнорадикального окисления и антиоксидантной защиты (увеличение продуктов ПОЛ, концентрации оксида азота, снижение общей антиокислительной активности, уровней α-токоферола, ретинола, трансферрина, увеличение активности СОД, снижение активности каталазы) у больных профаллергодерматозами, нарастающий при прогрессировании патологического процесса, свидетельствует о роли системы «оксиданты-антиоксиданты» в патогенетических механизмах формирования и развития профессиональных аллергических дерматозов.
Учитывая выраженные изменения в системе «оксиданты-антиоксиданты» и обсуждаемый в литературе радикальный механизм повреждения ДНК, в основе которого лежит способность свободных радикалов вызывать разрывы сахарофосфатных и гликозидных связей в ДНК, представляло интерес исследовать активность повреждения ДНК, включая одно-нитевые и дву-нитевые разрывы.
У больных профаллергодерматозами наблюдался высокий процент антител к нативной двуспиральной ДНК (н-ДНК). Встречаемость антител к н-ДНК в группе больных профессиональной экземой превышала средние популяционные значения в 5 раз (25,8%; χ2=10,4; р=0,001), в группе больных профессиональным аллергическим дерматитом – в 6,6 раз (33,3%; χ2=13,0; р<0,001), у больных профаллергодерматозами в сочетании с бронхиальной астмой – в 11 раз (56,2%; χ2=15,4; р<0,001) (рис.2).
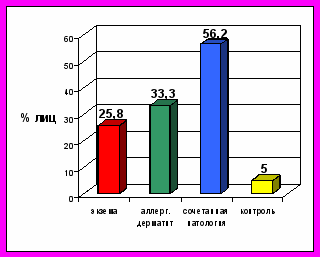
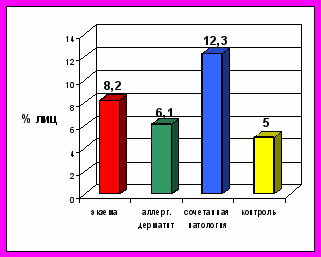
Рис.2. Доля лиц с повышенным Рис.3. Доля лиц с повышенным
содержанием антител к н-ДНК содержанием антител к д-ДНК
в обследованных группах. в обследованных группах.
Содержание антител к одноцепочечной денатурированной ДНК (д-ДНК) в группе профессиональной экземы превышало средние популяционные значения в 1,6 раза (8,2%; χ2=0,687; р=0,4), у больных профессиональным аллергическим дерматитом – 1,2 раза (6,11%; χ2=0,001; р=0,97), у больных профаллергодерматозами в сочетании с бронхиальной астмой – в 2,5 раза (12,3%; χ2=0,6; р=0,4) (рис. 3). Содержание антител к нуклеосоме у всех обследованных больных не отличалось от средних популяционных значений.
Анализ степени повреждения ДНК в зависимости от стажа работы показал последовательное нарастание уровня антител к одноцепочечной, двуцепочечной ДНК и нуклеосоме с увеличением стажевой нагрузки (рис.4), причем антитела к нативной ДНК в группах высокостажированных больных (более 20 лет) достоверно выше контрольных величин и групп больных, представленных малостажированными рабочими (до 20 лет).

Рис. 4. Уровень антител к одноцепочечной, двуцепочечной ДНК и нуклеосоме у обследованных больных в зависимости от стажа работы.
Таким образом, изучение процессов повреждения ДНК у больных профаллергодерматозами выявило статистически значимое повышение частоты встречаемости лиц с высокими антителами к нативной двуспиральной ДНК. По литературным данным [Т.Г. Сьяксте, 1991] двунитевые разрывы относятся к наиболее тяжелым повреждениям ДНК, которые могут являться летальными для клетки. Появление антител к нативной, денатурированной ДНК и нуклеосоме в крови больных профаллергодерматозами может быть результатом воздействия вредных факторов производственной среды, обладающих прямым токсическим действием на клетки (никель, хром и др.), либо следствием чрезмерного образования продуктов свободнорадикального и перекисного окисления, которые вызывают повреждение ДНК.
Широкий спектр химических агентов оказывает прямое токсическое, аллергическое и раздражающее действие на кожу, провоцируя развитие заболеваний. Идентифицированы также соединения, приобретающие повреждающие свойства уже in vivo после активации ферментами биотрансформации ксенобиотиков (ФБК). Биотрансформация ксенобиотиков играет ключевую роль в механизмах адаптации организма к факторам внешней среды. Наиболее важными генами детоксикации, которые заслуживают особого внимания при разработке биомаркеров восприимчивости, являются гены цитохрома Р-450, ген глутатионтрансферазы и др.
В представленной работе методом ПЦР-анализа была изучена частота гомозиготных носителей делеции гена GSTM1, сопровождающейся полным отсутствием белкового продукта и формирующей нулевой генотип GSTM1 0/0. Система глутатионтрансферазы является важной антиоксидантной системой, которая препятствует образованию и накоплению в организме активных форм кислорода. Глутатионопосредованная детоксикация играет ключевую роль в обеспечении резистентности клеток к перекисному окислению липидов, свободным радикалам, алкилированию белков и в предотвращении повреждений ДНК.
При анализе результатов распределения частоты гомозигот по нулевому аллелю гена GSTM1 в группе больных профаллергодерматозами в сравнении с контрольной группой статистически достоверных различий получено не было, выявлено достоверное повышение частотычастота достоверное повышение еированнойДНК и нуклеосоме в крови больных профаллергодерматозами может быть результатом лами к н встречаемости нулевого варианта (GSTM1 0/0) в группе больных с сочетанной патологией (профессиональные заболевания кожи и бронхиальная астма) (χ2=5,6; p<0,01). Несмотря на отсутствие статистически значимых различий в группе больных профаллергодерматозами, обращает на себя внимание высокий процент лиц (56,3%), имеющих нулевой генотип, характеризующийся полным отсутствием белкового продукта. В связи с этим был проведен анализ состояния показателей системы «окиданты-антиоксиданты» в зависимости от генотипа GSTM1.
У лиц носителей нулевого генотипа гена GSTM1 развивается более выраженный дисбаланс в системе «окиданты-антиоксиданты», чем у носителей генотипа GSTM1 +/+, что выражается в статистически достоверном повышении продуктов ПОЛ и снижении общей антиокислительной активности сыворотки крови (табл.3). Полученные данные свидетельствуют о том, что генетический полиморфизм GSTM1 влияет на степень выраженности окислительного стресса у больных профаллергодерматозами. Менее выраженные изменения в системе «оксиданты-антиоксиданты» у лиц с генотипом GSTM1 +/+ можно рассматривать как реализацию механизмов защитной компенсации при агрессивном воздействии производственных факторов.
Таблица 3
Состояние системы «оксиданты-антиоксиданты» в зависимости от генотипа GSTM1
| | Генотип GSTM1 +/+ | Генотип GSTM1 0/0 |
| ПОЛ, мкмоль/л | 2,670,1 | 3,320,1*** |
| Общая антиокислительная активность, мэкв. | 39,31,1 | 32,30,9*** |
Примечание. *** – р < 0,001.
Нами была предпринята попытка оценить состояние больных в зависимости от генотипа GSTM1. Полученные данные представлены в таблице 4.
Таблица 4
Характеристика состояния больных в зависимости от генотипа GSTM1
| Генотип Группа | Генотип GSTM1+/+ | Генотип GSTM1 0/0 | ||
| абс. | % | абс. | % | |
| Профессиональная экзема | 39 | 43,4% | 51 | 56,6% |
| Профессиональный аллергический дерматит | 18 | 60,0% | 12 | 40,0% |
| Сочетанная патология (профессиональные заболевания кожи и бронхиальная астма) | 1 | 10,0% | 9 | 90,0% |
| Распространенная форма профессиональной экземы | 4 | 33,3% | 8 | 66,7% |
| Распространенная форма профессионального аллергического дерматита | 7 | 43,8% | 9 | 56,2% |
| Стаж работы до начало заболевания 1-5 лет | 45 | 32,0% | 94 | 68,0% |
Как видно из таблицы 4, более тяжелое течение профаллергодерматозов имели лица с полным отсутствием белкового продукта гена GSTM1. Так, 90% лиц с сочетанной патологией (профессиональные заболевания кожи и бронхиальная астма) имели нулевой генотип гена GSTM1. Среди больных с распространенной формой профессиональной экземы 67% лиц имели нулевой генотип (GSTM1 0/0), а среди больных профессиональным аллергическим дерматитом – 56%. При индивидуальном анализе больных с нулевым генотипом, было выявлено, что 68% лиц имели раннее начало заболевания (стаж работы до начало заболевания 1-5 лет).
Таким образом, развитие у лиц с нулевым генотипом гена GSTM1 более тяжелых нозологических форм профаллергодерматозов (экзема) с тяжелым клиническим течением (распространенные формы), формирование сочетанной патологии (профессиональные аллергодерматозы и бронхиальная астма), развитие профессиональной патологии кожи даже при небольшом стаже работы во вредных условиях труда (1-5 лет) свидетельствуют о вовлеченности системы GSTM1 в патогенез профаллергодерматозов. Система GSTM1 может являться критерием риска развития профаллергодерматозов, оценки тяжести и прогноза клинического течения.
Синтез оксида азота осуществляется семейством цитохром Р-450-подобных гемопротеинов – NO-синтазами (eNOS). Ген эндотелиальной NO-синтазы исследовали по VNTR полиморфизму (варьирующим числом тандемных повторов размером в 27 пар нуклеотидов - variable number of tandem repeats, VNTR).
Проведенные исследования выявили у больных профаллергодерматозами достоверное увеличение частоты встречаемости гетерозиготного аллеля (АВ) гена синтазы окиси азота в сравнении с популяционным контролем. При исследовании количественного содержания оксида азота обнаружено низкое содержание NO в сыворотке крови у больных с генотипом АА гена eNOS, что может приводить к развитию прямых эффектов оксида азота с нарушением гомеостаза сердечно-сосудистой и нервных систем. Изучение данной системы требует дальнейшего научного поиска.
Фактор некроза опухолей альфа (TNF-α) - воспалительный цитокин, который вовлечен в патогенез большинства инфекционных и иммунопатологических заболеваний, где он может выполнять различные функции, главным образом, выступая в качестве медиатора развития воспаления. Для гена TNF-α определяли единичные замены гуанина на аденин, которые вызывают изменение уровня продукции белка TNF-α. Распределение частоты дефицитного аллеля А, продуцирующего повышенное количество воспалительного белка TNF-α у больных профаллергодерматозами достоверно не отличалось от контроля по гетерозиготным вариантам (GA). Гомозиготных вариантов (АА) среди больных профаллергодерматозами не обнаружено.
Анализ особенностей клинического течения профаллергодерматозов в зависимости от генотипа TNF-α, выявил у 72% лиц с наличием гетерозиготного варианта (GA) гена TNF-α формирование заболевания при небольшом (1-5 лет) стаже работы в условиях воздействия вредных производственных факторов. Эти данные свидетельствуют об участии воспалительного цитокина TNF-α в патогенезе профаллергодерматозов.
Результаты изучения генетико-биохимических полиморфных систем цитохрома Р-450, GSTM1, TNF-α, синтазы окиси азота выявили у 40% больных профаллергодерматозами сочетание 2-х и более вариантов дефицитных генов. Сочетание нескольких форм полиморфных генов характеризовалось развитием заболевания в течение первых пяти лет от начала контакта с производственным фактором. У лиц, имеющих сочетание 3-х и более редко встречающихся генотипов, наблюдали более тяжелое клиническое течение (распространенные формы экземы и дерматита, сочетанная кожная и бронхолегочная патология). Обращает на себя внимание и тот факт, что эти же больные имели высокие уровни антител к нативной, денатурированной ДНК и (или) нуклеосоме (табл.5).
Таблица 5
Характеристика больных с сочетанием редких форм полиморфных генов
| № | Полиморфизм генов | диагноз | Начало заболе- вания, лет | АТ к ДНК | |||
| GSTМ1 | CYP2Е1 | eNOS | TNF-α | ||||
| 1. | + | - | + | + | распр. экзема | 2 | есть |
| 2. | + | - | + | + | распр. экзема | 2 | есть |
| 3. | + | - | + | + | экзема в/к и БА | 2 | есть |
| 4. | + | + | + | - | распр. экзема | сразу | есть |
| 5. | + | - | + | + | распр. экзема | 2 | есть |
| 6. | + | - | + | + | экзема в/к и БА | 1 | есть |
| 7. | + | - | + | + | распр. дерматит | 2 | есть |
| 8. | + | - | + | + | распр. дерматит | 1 | есть |
Примечание: + присутствие дефицитных вариантов гена
- отсутствие дефицитных вариантов гена
в/к – верхних конечностей
БА – бронхиальная астма
Проведенные исследования по изучению состояния систем свободнорадикального окисления и антиоксидантной защиты, генетического биохимического полиморфизма и процессов повреждения ДНК свидетельствуют о патогенетической значимости данных систем в развитии профаллергодерматозов. Анализ полученных результатов позволил выявить критерии риска развития и прогноза клинического течения профессиональных аллергических заболеваний кожи (рис.5).
Полученные данные могут являться основой для разработки системы лечебно-профилактических мероприятий с применением антиоксидантной терапии у лиц аллергоопасных производств и больных профессиональными аллергодерматозами.
ПОЛ , общая антиокислительная активность;
α-токоферол, ретинол;
СОД , N каталаза, трансферрин;
АТ к нативной ДНК
Профессиональная экзема
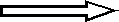
ПОЛ , оксид азота;
общая антиокислительная активность;
α-токоферол, ретинол
СОД , N каталаза, трансферрин;
АТ к нативной ДНК
Профессиональный
аллергический
дерматит
ПОЛ, общая антиокислительная активность;
α-токоферол, ретинол
СОД , каталаза, трансферрин;
АТ к нативной ДНК
Профаллергодерматозы в сочетании с бронхиальной астмой
Раннее развитие, тяжелое течение профаллергодерматозов (распространенные формы экземы и дерматитов)
GSTM1 0/0
TNF-α (GA)
eNOS (AB, АА)
CYP 1A1 (Ile/Val)
CYP 2E1 (CD, DD)
Рис. 5. Биохимические и молекулярно-генетические критерии риска развития и тяжести клинического течения профессиональных аллергических дерматозов.
ВЫВОДЫ:
- У больных профаллергодерматозами выявлена гиперактивация процессов свободнорадикального и перекисного окисления липидов на фоне снижения общей антиокислительной активности, снижения уровней α-токоферола, ретинола, каталазы, трансферрина и повышения активности супероксиддисмутазы, что свидетельствует о выраженном дисбалансе в системе «оксиданты-антиоксиданты».
- Установлено достоверное нарастание продуктов перекисного окисления липидов с увеличением стажа работы во вредных условиях труда свыше 10 лет.
- Выявлена прямая корреляция (r=0,87; p<0,001) между уровнями продуктов ПОЛ и биологически активного соединения оксида азота, что свидетельствует об избыточном образовании пероксинитрита, обладающим цитотоксическим действием.
- Достоверное повышение антител к двуцепочечной нативной ДНК, свидетельствующее об активации процессов повреждения ДНК у больных профаллергодерматозами, может являться следствием длительного воздействия производственных факторов и гиперактивации процессов свободнорадикального и перекисного окисления липидов.
- У больных с сочетанной патологией (профаллергодерматозы и профессиональная бронхиальная астма) установлены достоверно более выраженные изменения показателей системы «перекисное окисление липидов – антиоксидантная защита» и процессов повреждения ДНК.
- Сочетание дефицитных генотипов систем цитохрома Р-450, GSTM1, TNF-α, синтазы окиси азота характеризуется более ранним развитием (до 5 лет), тяжелым течением и неблагоприятным прогнозом профессиональной патологии кожи. Выявленные показатели могут быть использованы для оценки индивидуального риска развития профаллергодерматозов у здоровых лиц поступающих на аллергоопасные производства.
- Разработан комплекс биохимических и молекулярно-генетических критериев, направленных на оценку риска развития профаллергодерматозов, индивидуального прогноза заболевания и мониторинга эффективности лечебных мероприятий.
СПИСОК ОПУБЛИКОВАННЫХ НАУЧНЫХ РАБОТ
ПО ТЕМЕ ДИССЕРТАЦИИ
- Кузьмина Л.П., Измерова Н.И., Лазарашвили Н.А. Изучение процессов микросомального и свободнорадикального окисления у больных профессиональными аллергодерматозами. // III Всероссийский конгресс «Профессия и здоровье»: Сб. тезисов. – Москва, 2004. – С.236-238.
- Лазарашвили Н.А. Состояние процессов свободнорадикального окисления у больных профессиональной экземой от воздействия факультативных раздражителей и аллергенов. // XII Российский национальный конгресс «Человек и лекарство». Тезисы докладов. – Москва, 2005. - С.164.
- Лазарашвили Н.А. Изменения в системах «оксиданты-антиоксиданты» у больных профессиональными аллергодерматозами. // Материалы Всероссийской научно-практической конференции молодых ученых и специалистов «Окружающая среда и здоровье». – Суздаль, 2005. – С.79-81.
- Лазарашвили Н.А. Процессы перекисного окисления липидов и антиоксидантной защиты у больных профаллергодерматозами. IV Всероссийский конгресс «Профессия и здоровье»: Сб. тезисов. – Москва, 2005. – С.255-256.
- Лазарашвили Н.А., Кузьмина Л.П., Измерова Н.И., Безрукавникова Л.М. Состояние системы «оксиданты – антиоксиданты» и процессов повреждения ДНК у больных профаллергодерматозами. // Медицина труда и промышленная экология.- 2006. -№7.- С.5-9.
- Пай Г.И., Кузьмина Л.П, Лазарашвили Н.А., Войлокова А.Е., Спицын В.А. Роль эндотелиальной синтазы окиси азота (eNOS) в патогенезе некоторых профессиональных заболеваний. // Медицинская генетика. - 2006.- №7.- С.37-40.
- Кузьмина Л.П., Безрукавникова Л.М., Лазарашвили Н.А., Софронова Е.В. Молекулярные механизмы и индивидуальные особенности метаболизма, определяющие возникновение, клиническое течение и исход профессиональных и производственно-обусловленных заболеваний. // Актуальные проблемы «Медицины труда». Сборник трудов института. Под редакцией академика РАМН Н.Ф. Измерова. М., 2006. – С.465-478.
- Кузьмина Л.П., Безрукавникова Л.М., Лазарашвили Н.А., Софронова Е.В. Новые технологии ДНК-диагностики генетического биохимического полиморфизма. // Актуальные проблемы «Медицины труда». Сборник трудов института. Под редакцией академика РАМН Н.Ф. Измерова. М., 2006. – С.504-517.
