Структурно-функциональные свойства эритроцитарных мембран при дислипопротеинемиях 03. 00. 04 биохимия 14. 00. 16 патологическая физиология
| Вид материала | Автореферат |
- Роль молекул оксида азота в программированной гибели нейтрофилов при окислительном, 343.37kb.
- Пояснительная записка Учебно-методический комплекс по курсу «Патологическая физиология», 140.7kb.
- Гормональный статус, генетический полиморфизм и мотивационно-потребностные особенности, 450.55kb.
- Структурно-семантические и функциональные свойства идиоматичных слов английского языка, 390.28kb.
- Программа вступительных испытаний для специальности магистратуры 1-79 80 29 Патологическая, 348.44kb.
- Пояснительная записка к учебной дисциплине Эпизоотология и инфекционные болезни животных, 166.41kb.
- Николаева Мария Андреевна, доктор технических наук, профессор, заведующий кафедрой, 367.89kb.
- Вопросы к экзамену по дисциплине «спортивная физиология», 205.39kb.
- Патофизиологический анализ влияния факторов риска образовательной среды на функциональное, 816.71kb.
- Исследование механических характеристик нелинейно деформируемых сферических мембран, 43.3kb.
1 2
На правах рукописи
БУТУСОВА Валерия Николаевна
СТРУКТУРНО-ФУНКЦИОНАЛЬНЫЕ
СВОЙСТВА ЭРИТРОЦИТАРНЫХ МЕМБРАН
ПРИ ДИСЛИПОПРОТЕИНЕМИЯХ
03.00.04 – биохимия
14.00.16 – патологическая физиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Новосибирск-2007
Работа выполнена в ГОУ ВПО Сибирском государственном медицинском университете Федерального агентства по здравоохранению и социальному развитию, в ГУ Научно-исследовательском институте биохимии СО РАМН
| Научные руководители: | |
| доктор медицинских наук, профессор, академик РАМН | Панин Лев Евгеньевич |
| доктор медицинских наук, профессор | Рязанцева Наталья Владимировна |
| Официальные оппоненты: | |
| доктор медицинский наук, профессор | Колпаков Аркадий Ростиславович |
| доктор медицинских наук, профессор | Трунов Александр Николаевич |
Ведущая организация: ГОУ ВПО Красноярская государственная медицинская академия Росздрава
Защита состоится «__» _________ 2007 г. в __ часов на заседании диссертационного совета Д 001.034.01 в Государственном учреждении Научно-исследовательском институте биохимии СО РАМН по адресу: 630117, Новосибирск, ул. Академика Тимакова, 2
С диссертацией можно ознакомиться в библиотеке ГУ Научно-исследовательского института биохимии СО РАМН
Автореферат разослан «___» ___________ 2007г.
Ученый секретарь диссертационного совета,
кандидат биологических наук Русских Г.С.

ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. Многочисленные экспериментальные, клинические и эпидемиологические исследования убедительно свидетельствуют о ключевой роли дислипопротеинемий в патогенезе большого числа социально-значимых заболеваний (ишемическая болезнь сердца, сахарный диабет, ожирение, гипотериоз и др.). При сахарном диабете типа 1 и 2 дислипопротеинемии связаны прежде всего с нарушением гормональной регуляции метаболических процессов и являются одним из факторов развития сосудистых осложнений, определяя тяжесть течения заболевания [Manzato E. et al., 1989; Hanefeld M., 1994; Панин Л.Е., 2000; Деменкова А.П., 2001; Яфасов К.М., Дубянская Н.В., 2001; Потеряева О.Н. и соавт., 2003; Vergès B., 2005; Lapolla A. et al., 2006]. Важнейшим из системных изменений при патологии липидного обмена является нарушение метаболизма липидов мембранных структур [Bryszewska M. et al., 1979; Godin D.V., Herring F.G., 1981; Otsuji S. et al., 1981; Kamada T., Otsuji S., 1983; Watala C., Winocour P.D., 1992; Faloia E., 1999].
Клеточные мембраны являются одним из ключевых звеньев сложной системы обмена липидов в организме. Они не только сами содержат липиды как структурный элемент, но и участвуют в переносе последних путем пассивного транспорта и активного рецепторопосредованного эндоцитоза [Титов В.Н.,2000; Rigotti A. et al., 2003]. В самой мембране выделяют липидную фазу, состоящую главным образом из фосфолипидов и холестерина. Липидные молекулы, являясь важными структурными и функциональными компонентами клеточной мембраны, регулируют подвижность и активность мембраносвязанных белков, определяя адаптационный потенциал клетки [Крепс Е.М., 1982; Геннис Р., 1997; Титов В.Н., 2002; Болдырев А.А., 2006]. Соотношение основных липидных фракций, степень насыщенности жирных кислот, входящих в их состав, определяют такое понятие как «текучесть» липидного бислоя мембраны, влияют на упорядоченность липидных молекул, а также характер липид-липидных и белок-липидных взаимодействий [Владимиров Ю.А., Добрецов Г.Е., 1980; Новиков К.Н., 2004; Allen H.G., 2006]. Возрастание микровязкости липидной фазы плазматических мембран закономерно приводит к снижению активности мембраносвязанных ферментов, торможению связывания рецепторов с лигандами и нарушению других важнейших для клетки процессов [Shinitzky M.,1984; Сомова О.Г. и соавт., 1997; Горошинская И.А. и соавт., 1999; Corver J. et al., 2000; Decsi T. et al., 2002].
Несмотря на очевидную роль обмена мембранных липидов в реализации многочисленных функциональных свойств клеток, в настоящее время нет четких представлений о регуляции этого процесса. Выделяют внутриклеточные механизмы регуляции метаболизма липидов плазматической мембраны, которые осуществляются через биосинтетические процессы самой клетки с участием ядра и других органелл [Геннис Р.,1997]. Однако важный вклад вносят и другие механизмы регуляции, к которым относятся действие фосфолипаз, вторичных посредников (фосфатидилинозитолтрифосфат, Са2+), система свободно-радикального окисления и т.д. [Климов А.Н., Никульчева Н.Г., 1999; Daleke D.L., 2003; Новицкий В.В. и соавт., 2004].
В мембранах наряду с липидами, прочно связанными с белками цитоскелета, существуют формы липидов, которые свободно обмениваются с плазменными липопротеинами. В связи с этим изменения состава липидов мембран, в частности клеток крови, могут быть результатом взаимодействия с липопротеинами [Quarford S.H., 1970; Faergeman O., Havel R.J., 1975; Poon R., 1981; Hollan S. et al., 1995, 1996; Broncel M. et al., 2005].
Универсальной моделью плазматических мембран, вполне подходящей для изучения влияния на них внеклеточных воздействий, в том числе и воздействия липопротеинового состава крови, является мембрана эритроцитов. Поскольку мембране эритроцитов присущи общие принципы молекулярной организации, выявленные закономерности их функционирования вполне допустимо экстраполировать на плазматические мембраны иных клеток. Кроме того, видимая простота организации эритроцита позволяет изучать метаболизм, структуру и функциональные свойства плазматической мембраны без тех помех, которые существуют в клетках с развитыми внутриклеточными мембранными образованиями и органеллами [Постнов Ю.В., Орлов С.Н.,1987].
Поскольку эритроцитарные мембраны свободно обмениваются с липидным компонентом плазменных липопротеинов, использование в качестве модели дислипопротеинемии патологических состояний, в частности сахарного диабета типа 1 и 2 с выраженными нарушениями липопротеинового спектра, может помочь раскрыть механизмы регуляции липидного обмена в клеточных мембранах, а также уточнить роль дислипопротеинемий в изменении качественных и количественных характеристик мембранных липидов. Целесообразность проведения такого исследования продиктована тем фактом, что к настоящему времени остается неясной непосредственная роль липопротеинов различных классов и их белкового компонента в метаболизме липидов плазматических мембран и механизмах формирования мембранной патологии при дислипопротеинемиях.
Цель исследования: выявить особенности изменений структурно-функциональных характеристик мембран эритроцитов при дислипопротеинемиях различного типа.
Для достижения поставленной цели были сформулированы следующие задачи:
- Выявить особенности структурно-функциональных свойств мембран эритроцитов у больных с дислипопротеинемиями при сахарном диабете типа 1 и 2.
- Установить взаимосвязь между нарушениями липидного обмена и структурно-функциональными свойствами липидной фазы мембран эритроцитов у больных с сахарным диабетом типа 1 и 2.
- Исследовать в эксперименте in vitro влияние липопротеинов различных классов и их белкового компонента (аполипопротеинов А-I, Е и С) на наноструктурные переходы, ответственные за липид-липидные и белок-липидные взаимодействия в эритроцитарных мембранах.
Положения, выносимые на защиту:
- Нарушения липопротеинового обмена более выражены у пациентов с сахарным диабетом типа 2 по сравнению с таковыми у больных сахарным диабетом типа 1 и характеризуются значительным увеличением содержания в крови липопротеинов очень низкой плотности, триглицеридов и общего холестерина.
- Структурно-функциональные изменения эритроцитарных мембран при сахарном диабете развиваются как часть общих системных нарушений липидного обмена, одним из ключевых звеньев которых является развитие дислипопротеинемий.
- Изменения структурных и функциональных свойств мембран эритроцитов при дислипопротеинемиях, сопровождающих сахарный диабет типа 1 и 2, характеризуются структурной перестройкой мембранных липидов, нарушением их микровязкостных свойств и уменьшением активности мембраносвязанной Na+,K+-АТФазы.
- В механизмах действия липопротеинов на клеточные мембраны важную роль играет не только липидный, но и белковый компонент: аполипопротеин A-I снижает микровязкость липидной фазы и изменяет характер белок-липидных взаимодействий; аполипопротеины С вызывают противоположное действие – повышают микровязкость липидного бислоя и нарушают белок-липидные взаимодействия; аполипопротеин Е не оказывает мембранотропного эффекта.
Научная новизна. Впервые проведено сравнительное исследование изменений структурно-функциональных свойств мембран эритроцитов с учетом особенностей нарушений липопротеинового спектра крови у больных сахарным диабетом типа 1 и 2. Показано, что липидный состав и микровязкостные свойства мембран эритроцитов существенно нарушаются при увеличении соотношения в сыворотке атерогенных и антиатерогенных фракций липопротеинов. Установлено, что выраженность нарушений липидного обмена у пациентов влияет на степень дезорганизации плазматических мембран. Рассмотрен вопрос о прямом воздействии как липопротеинов, так и аполипопротеинов на биофизические свойства плазматических мембран. Впервые получены экспериментальные данные, свидетельствующие о различном влиянии аполипопротеинов на эритроцитарные мембраны крыс: выраженное снижение микровязкости при действии аполипопротена А-I, увеличение ее при действии аполипопротеина С и отсутствие изменений при действии аполипопротеина Е.
Теоретическая и практическая значимость. В результате проведенного исследования получены новые данные фундаментального характера о состоянии мембран эритроцитов при дислипопротеинемиях у больных сахарным диабетом типа 1 и 2. Выявленные закономерности позволяют говорить о связи структурных изменений клеточных мембран с их биофизическими характеристиками (микровязкость, липид-липидные и белок-липидные взаимодействия) и активностью мембраносвязанных ферментов (Na+,К+-АТФаза). Они также свидетельствуют о важной роли межсистемных взаимодействий: клеточные мембраны и липопротеины сыворотки крови, как функционально активная среда, в которой существуют и работают эти мембраны. Установленные нами закономерности указывают на необходимость разработки новых подходов к мембранотропной терапии для коррекции системных нарушений при дислипопротеинемиях.
Апробация и внедрение результатов работы. Результаты проведенных исследований докладывались и обсуждались на VI международном конгрессе молодых ученых и специалистов «Науки о человеке» (Томск, 2005), на научно-практической межрегиональной конференции, посвященной 70-летию ГОУ ВПО НГМА Росздрава «Актуальные проблемы современной эндокринологии» (Новосибирск, 2005), XI Всероссийской научно-практической конференции «Молодые ученые в медицине» (Казань, 2006).
Исследования поддержаны Советом по грантам при Президенте РФ для поддержки ведущих научных школ РФ по проблемам: «Молекулярные основы нарушений структуры, метаболизма и функции клеток крови при патологии» (НШ-1051.2003.4), «Молекулярные основы нарушения гомеостаза клеток при актуальных заболеваниях инфекционной и неинфекционной природы» (НШ-4153.2006.7).
Публикации. По материалам диссертации опубликовано 6 работ, из них 3 – в центральных рецензируемых журналах.
Объем и структура работы. Диссертация изложена на 153 страницах машинописного текста и состоит из введения, 4 глав (обзор литературы, материал и методы исследования, результаты собственных исследований, обсуждение результатов исследования), выводов и списка литературы, включающего 258 источников, из них - 78 отечественных и 180 зарубежных авторов. Работа иллюстрирована 34 таблицами и 7 рисунками.
ХАРАКТЕРИСТИКА ЭКСПЕРИМЕНТАЛЬНОГО И КЛИНИЧЕСКОГО МАТЕРИАЛА И МЕТОДЫ ИССЛЕДОВАНИЯ
В основу настоящей работы положены результаты комплексного клинико-лабораторного исследования структурно-функционального статуса мембран эритроцитов и особенностей нарушения липопротеинового спектра у 70 пациентов с сахарным диабетом типа 1 и 2 (табл. 1), проводившегося на базе эндокринологической клиники ГОУ ВПО «Сибирский государственный медицинский университет Росздрава» (главный врач – Заслуженный врач РФ, к.м.н. В.М. Шевелев), эндокринологического отделения ОГУЗ «Томская Областная клиническая больница» (главный врач – Заслуженный врач РФ Б.Т Серых) и городской больницы № 3 г. Томска (главный врач – М.А. Лукашов). В контрольную группу были включены 20 практически здоровых донора, не предъявлявших на момент обследования жалоб, мужчин и женщин, в возрасте от 25 до 55 лет.Следующим этапом работы явилось экспериментальное исследование in vitro, проведенное с использованием крови 27 крыс линии Вистар.
Было обследовано 27 пациентов, страдающих сахарным диабетом типа 1, мужского и женского пола в возрасте от 19 до 55 лет. Длительность заболевания у больных варьировала от 1 года до 30 лет (средние значения длительности диабета – 9,9±2,1 лет), при этом 19 человек страдали СД 1 более 5 лет, а 8 пациентов имели стаж диабета менее 5 лет. Степень компенсации сахарного диабета была определена с учетом содержания глюкозы в сыворотке крови утром натощак и концентрации гликированного гемоглобина (НbА1с). Согласно “Национальным стандартам сахарного диабета” (Федеральная целевая программа “Cахарный диабет”, 2002), компенсацию углеводного обмена у пациентов с СД 1 считали при показателе НbА1с ниже 7,0%, субкомпенсацию - от 7,0 до 7,5% включительно, декомпенсацию – выше 7,5%. В связи с этим были выделены группы пациентов с субкомпенсацией (12 человек) и декомпенсацией углеводного обмена (13 пациентов), 2 больных имели компенсированное течение СД 1. У пациентов с СД 1 верифицировали наличие диабетической ретинопатии с использованием классификации С. Mongensen et al. [1983]. Диагностику диабетической ретинопатии осуществляли с помощью критериев Е. Koner и M. Porta [1992].
Обследовано 43 больных СД 2 (10 мужчин и 33 женщины) в возрасте от 39 до 60 лет. Длительность диабета у пациентов варьировала от 1 месяца до 21 года, при этом 19 человек страдали СД 2 менее 5 лет, а 24 – более 5 лет. Показатели метаболизма глюкозы указывали на декомпенсированное течение заболевания у всех пациентов с СД 2 (декомпенсацию углеводного обмена у пациентов с СД 2 считали при показателе НbА1с выше 7,0%). Среди пациентов с СД 2 была выделена группа больных (17 человек), у которых верифицирован диагноз ишемическая болезнь сердца (ИБС). Из них только 2 больных имели нормальный индекс массы тела, 9 человек страдали ожирением 1 степени (индекс массы тела 30,0-34,9 кг/м2), 4 пациента – ожирением 2 степени (35,0-39,9 кг/ м2), 1 человек – ожирением 3 степени. 14 пациентов с СД 2 страдали только ожирением без ИБС, причем у 4 пациентов было отмечено ожирение 1 степени, у 5 больных – 2 степени и у 5 человек – 3 степени.
Таблица 1
Распределение здоровых доноров, больных сахарным
диабетом типа 1 и 2, экспериментальных животых на группы
в соответствии с использованными методами исследования
липидного спектра крови и структурно-функциональных
особенностей мембраны эритроцитов
| № | Методы исследования | Группы обследованных больных | Экспериментальные животные (крысы) | |||
| Здоровые доноры | Пациенты сахарным диабетом типа 1 | Пациенты сахарным диабетом типа 2 | Количество контрольных проб | Количество опытных проб | ||
| 1 | Исследование липидного спектра крови методом малоуглового рентгеновского рассеяния | 20 | 19 | 43 | - | - |
| 2 | Оценка липид-липидных и белок-липидных взаимодействий в мембранах эритроцитов с использованием флуоресцентного зонда пирен | 20 | 25 | 41 | - | - |
| 3 | Определение активности Na+, K+-АТФазы в мембранах эритроцитов | 18 | 25 | 40 | - | - |
| 4 | Исследование липидного состава мембран эритроцитов методом тонкослойной хроматографии | 12 | 14 | 23 | - | - |
| 5 | Определение количественного содержания общих липидов в мембранах эритроцитов | 12 | 14 | 23 | - | - |
| 6 | Исследование структуры мембран эритроцитов с использованием флуоресцентного зонда пирен при инкубации мембранной взвеси с липопротеинами высокой плотности in vitro | - | - | - | 12 | 12 |
| 7 | Исследование структуры мембран эритроцитов с использованием флуоресцентного зонда пирен при инкубации мембранной взвеси с липопротеинами низкой плотности in vitro | - | - | - | 9 | 9 |
| 8 | Исследование структуры мембран эритроцитов с использованием флуоресцентного зонда пирен при инкубации мембранной взвеси с липопротеинами очень низкой плотности in vitro | - | - | - | 9 | 9 |
| 9 | Исследование структуры мембран эритроцитов с использованием флуоресцентного зонда пирен при инкубации мембранной взвеси с аполипопротеином А-I in vitro | - | - | - | 6 | 6 |
| 10 | Исследование структуры мембран эритроцитов с использованием флуоресцентного зонда пирен при инкубации мембранной взвеси с аполипопротеином С in vitro | - | - | - | 6 | 6 |
| 11 | Исследование структуры мембран эритроцитов с использованием флуоресцентного зонда пирен при инкубации мембранной взвеси с аполипопротеином Е in vitro | - | - | - | 6 | 6 |
Все пациенты обследованы в момент диспансеризации на фоне проведения коррегирующей углеводный обмен терапии (препараты групп сульфанилмочевины и бигуанидов для больных СД 2 и инсулинотерапия для пациентов с СД 1). Материалом исследования явилась венозная кровь обследованных лиц, взятая утром натощак после шестнадцатичасового воздержания от приема жирной пищи. Для получения плазмы кровь стабилизировали гепарином (25 Ед/мл).
Определение фракционного и субфракционного составов липопротеинов сыворотки крови было проведено с помощью метода малоуглового рентгеновского рассеяния, предложенного Ф.В. Тузиковым и соавт. [1997]. Нами учитывались концентрации липопротеинов 6 основных подклассов (2 субфракции ЛПВП, 2 субфракции ЛПНП и 2 субфракции ЛПОНП) и величина таких интегральных показателей как общий холестерин и общие триацилглицериды. Также были рассчитаны отношение общих фосфолипидов к общему холестерину и индекс атерогенности. Индекс атерогенности рассчитывался как отношение (ОХС-ХС ЛПВП)/ХС ЛПВП, где ОХС – общий холестерин, а ХС ЛПВП – холестерин липопротеинов высокой плотности. При этом больные с нарушенным липидным обменом были распределены по типу ДЛП по классификации, предложенной D. Fredricson. IIa тип ДЛП регистрировали, если в сыворотке крови значения содержания ХС ЛПНП превышали 175 мг/дл при нормальных величинах концентрации ТГ, IIб тип – если было повышено содержание ХС ЛПНП и ТГ (свыше 175 мг/дл для лиц моложе 40 лет и свыше 210 мг/дл для пациентов 40 лет и старше), IV тип – если значения ХС ЛПНП были в пределах нормы, а концентрация ТГ была повышенной.
Мембраны эритроцитов выделяли путем гипоосмотического гемолиза [Dodge J.T. et al. 1963]. В полученной взвеси мембран определяли микробиуретовым методом содержание белка.
Липиды мембран эритроцитов экстрагировали хлороформ-метаноловой смесью по методу J. Folch et al. [1957]. Общее содержание липидов в мембране эритроцитов определяли методом Н.А. Тарановой [1987]. Препаративное разделение общих липидов проводили методом тонкослойной хроматографии [Финдлей Дж.Б., Эванз У.Г., 1990] в системе растворителей гептан : диэтиловый эфир : этилацетат (в соотношении 80:20:1,5) на пластинках “Sorbfil” (Россия). Разделение фракций фосфолипидов мембран эритроцитов методом тонкослойной хроматографии [Прохорова М.И., 1982] осуществляли в системе хлороформ : метанол : вода (в соотношении 32:12,5:2) на пластинках “Sorbfil”(Россия). Идентификацию фракций липидов осуществляли с использованием соответствующих стандартов (фирма “Sigma”, США). Количественную оценку хроматограмм проводили с помощью разработанной компьютерной программы.
Характеристика структурных свойств липидной фазы мембран эритроцитов проводилась с использованием измерения собственной флуоресценции теней эритроцитов и определения спектральных характеристик взаимодействия мембран с флуоресцентным зондом пирен на спектрофлуориметре “Hitachi-MPF-4” (Япония). Микровязкостные свойства мембраны в области анулярных и общих липидов оценивали по степени эксимеризации пирена, вычисляя отношение интенсивности флуоресценции эксимеров и мономеров (J470/J370) при длине волны возбуждающего света (lв) 285 и 340 нм, соответственно. Полярность окружения молекул пирена оценивали по отношению J370/J390 при lв=340 нм [Добрецов Г.Е., 1989]. Рассчитывали показатель миграции энергии с триптофановых остатков на пирен по формуле, предложенной Ю.А. Владимировым и Г.Е. Добрецовым [1980].
Определение активности Na+,K+-АТФазы в мембранах эритроцитов определяли методом, разработанным А.М. Казенновым и соавт. [1984] и основанном на накоплении неорганического фосфора (Рi) в среде, содержащей АТФ, в результате его гидролиза под действием АТФазы. Содержание Рi определяли по методу Р.S. Chen et al. [1956].
В рамках диссертационной работы был выполнен экспериментальный блок, связанный с исследованием структурной организации эритроцитарных мембран у крыс в условиях инкубации взвеси теней эритроцитов с липопротеинами основных классов (ЛПНП, ЛПОНП, ЛПВП), а также их апобелками (аполипопротеинами А-I, С и Е) in vitro. Липопротеины выделяли из сыворотки крови крыс с помощью изоплотностного ультрацентрифугирования в растворе KBr [Hatch F.T., Lees R.S., 1968]. Для получения аполипопротеинов проводили делипидирование липопротеинов охлажденной смесью хлороформ-метанол (2:1) с последующей многократной отмывкой эфиром. Фракции, содержащие аполипопротен A-I, С и Е, очищали с помощью ионообменной хроматографии с использованием ионообменника «DEAE-Toyopeare 650 М-TSK» (Япония) [Laemli U.K., 1970]. Инкубацию теней эритроцитов с липопротеинами и их апобелками проводили при 37°С в течение 20 мин с последующим однократным отмыванием и исследованием структурных свойств мембран эритроцитов с помощью флуоресцентного зонда пирен. Параллельно каждой опытной пробе ставилась контрольная проба, содержавшая тени эритроцитов того же животного с инкубационной средой (10 мМ трис-HCl буфер, рН 7.4).
Полученные в ходе исследования данные обрабатывали с использованием методов статистического анализа. Проверка на нормальность распределения была осуществлена с помощью критерия Колмогорова-Смирнова. Для проверки гипотезы о значимости различий законов распределения исследуемых признаков для отдельных групп пациентов был применен критерий Манна-Уитни (U-тест) для несвязанных выборок, для обработки результатов экспериментальных данных – критерий Вилкоксона для попарносвязанных выборок. Для выявления функциональных взаимосвязей между группами изученных параметров использовали вычисление коэффициента ранговой корреляции Спирмена. Распределение общей группы больных по категориям было осуществлено с помощью кластерного анализа методом К-средних.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
На сегодняшний день имеется немало данных, свидетельствующих о том, что зрелые эритроциты обновляют свой липидный состав благодаря взаимодействию с ЛПВП, ЛПНП и ЛПОНП [Quarford S.H., 1970; Faergeman O., Havel R.J., 1975; Poon R., 1981; Hollan S. et al., 1995, 1996; Broncel M. et al., 2005]. Подтверждением наличия обменных процессов между плазменными липопротеинами и мембраной эритроцитов является и установление факта дезорганизации липидного бислоя красных кровяных клеток у больных с дислипопротеинемиями.
Многочисленные данные литературы говорят о широкой распространенности нарушений липидного обмена у больных сахарным диабета как типа 1, так и типа 2, связанных прежде всего с нарушением гормональной регуляции метаболических процессов [Manzato E. et al., 1989; Hanefeld M., 1994; Деменкова, 2001; Яфасов К.М., Дубянская Н.В., 2001; Потеряева О.Н. и соавт., 2003; Vergès B., 2005; Lapolla A. et al., 2006]. Согласно данным наших исследований, у больных СД 1 липопротеиновый спектр сыворотки крови характеризовался повышением концентрации общего ХС, изменением субфракционного состава ЛПВП и повышением индекса атерогенности. При этом выраженность метаболических нарушений у пациентов с СД 1 зависела от длительности диабета, стадии компенсации углеводного обмена и наличия сосудистых осложнений: было отмечено выраженное повышение содержания общего ХС у пациентов с течением заболевания более 5 лет или с сосудистыми осложнениями II и III стадии (рис. 1.). Пациенты с СД 2 характеризовались более выраженными и разнообразными отклонениями показателей липидного обмена: повышение содержания общего холестерина и триацилглицеридов в сыворотке крови наряду со снижением концентрации ХС ЛПВП (табл. 2).
Механизмы развития гиперхолестеринемии, как было указано выше, при сахарном диабете связаны с нарушением гормональной регуляции. При этом инсулярная недостаточность проявляется не только в нарушении углеводного и жирового обмена, но и активацией контринсулярных гормонов. Гипертриглицеридемия сопряжена с повышением содержания ЛПОНП. У пациентов, страдающих СД типа 2, в сыворотке крови было обнаружено увеличение концентрации всех подфракций ЛПОНП (табл. 2). Так, содержание ЛПОНП1 у больных СД 2 превышало соответствующий показатель у здоровых доноров в 1,8 раз (р<0,01), а концентрация ЛПОНП2 был выше в 2,2 раза (р<0,001) (табл. 2).
Как полагают исследователи, повышение образования ЛПОНП в печени происходит благодаря увеличенному поступлению жирных кислот [Cummings M.H., 1995], а также отсутствию ингибирующего влияния инсулина на продукцию и формирование ЛПОНП [Reaven G.M., 1981; Tobey T.A., 1981; Malmström R., 1997]. Кроме того, обсуждается возможность увеличения синтеза жирных кислот в печени de novo [Shimomura I., 2000; Tobe K., 2001].
Таблица 2
Результаты исследования липопротеинового спектра сыворотки
крови у больных сахарным диабетом типа 1 и 2, Me(Q1-Q3)
| Показатель | Здоровые доноры | Больные сахарным диабетом типа 1 | Больные сахарным диабетом типа 2 |
| ЛПВП, мг/дл | 292,98 (246,29-334,75) | 236,89 (183,22-305,14) p1>0,05 | 295,17 (234,25-358,76) p1>0,05; p2>0,05 |
| ЛПВП3, мг/дл | 130,68 (62,06-182,31) | 91,73 (64,41-135,47) p1>0,05 | 126,94 (98,30-225,12) p1>0,05; p2<0,05 |
| ЛПВП2, мг/дл | 161,86 (123,54-203,81) | 111,46 (56,48-148,00) p1<0,05 | 115,85 (51,56-167,08) p1<0,05; p2>0,05 |
| ЛПНП, мг/дл | 457,06 (356,93-513,69) | 435,71 (324,62-612,80) p1>0,05 | 533,31 (428,62-586,60) p1>0,05; p2>0,05 |
| ЛПНП2-3, мг/дл | 246,66 (200,16-290,94) | 316,76 (210,41-411,35) p1<0,05 | 328,55 (264,78-364,41) p1<0,05; p2>0,05 |
| ЛППП, мг/дл | 214,20 (144,77-241,75) | 189,97 (84,98-192,82) p1>0,05 | 197,51 (98,41-267,76) p1>0,05; p2>0,05 |
| ЛПОНП, мг/дл | 53,47 (42,24-115,01) | 53,45 (22,62-100,16) p1>0,05 | 124,85 (67,79-246,87) p1<0,01; p2<0,01 |
| ЛПОНП2, мг/дл | 44,39 (26,59-97,23) | 47,94 (15,99-84,55) p1>0,05 | 96,02 (57,09-200,86) p1<0,05; p2<0,001 |
| ЛПОНП1, мг/дл | 15,20 (9,56-22,44) | 13,35 (6,62-25,50) p1>0,05 | 27,43 (18,35-36,78) p1<0,05; p2<0,01 |
| Общий холестерин, мг/дл | 169,63 (153,95-190,51) | 258,06 (193,05-306,42) p1<0,05 | 303,80 (264,89-353,31) p1<0,001; p2<0,01 |
| Общие триглицериды, мг/дл | 150,39 (128,69-170,16) | 119,38 (70,90-188,48) p1>0,05 | 213,67 (166,51-247,55) p1<0,001; p2<0,01 |
| ХС/ФЛ | 0,911 (0,882-0,957) | 0,960 (0,941-1,027) p1<0,01 | 0,960 (0,923-1,008) p1<0,01; p2>0,05 |
| ХС ЛПВП, мг/дл | 57,87 (48,48-61,73) | 43,91 (29,26-56,81) p1<0,05 | 48,13 (38,68-59,59) p1<0,05; p2>0,05 |
| Индекс атерогенности | 1,92 (1,81-2,04) | 4,87 (3,39-6,29) p1<0,01 | 5,37 (3,99-7,61) p1<0,01; p2>0,05 |
| апоЛПВП, мг/дл | 143,83 (129,55-179,94) | 111,15 (92,15-168,25) p1>0,05 | 150,46 (131,57-204,20) p1>0,05; p2<0,05 |
| апоЛПНП, мг/дл | 77,53 (63,85-96,62) | 88,96 (64,14-105,94) p1>0,05 | 96,42 (77,44-106,97) p1>0,05; p2>0,05 |
| апоЛПОНП, мг/дл | 5,51 (3,47-12,37) | 3,82 (1,85-10,26) p1>0,05 | 12,17 (6,49-26,95) p1<0,05; p2<0,01 |
Примечание. Здесь, и в табл. 3: p1 – уровень значимости различий по сравнению со значениями у здоровых доноров; p2 – уровень значимости различий по сравнению со значениями у пациентов сахарным диабетом типа 1. ЛПНП – липопротеины низкой плотности, ЛПОНП – липопротеины очень низкой плотности, ЛПВП – липопротеины высокой плотности, ХС ЛПВП – холестерин липопротеинов высокой плотности
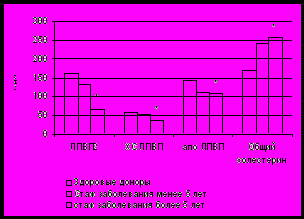
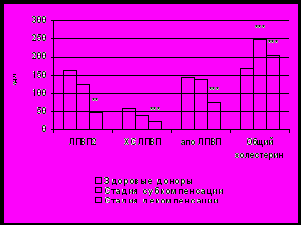
а) б)
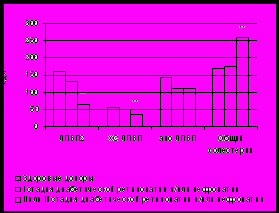
в)
