Роль молекул оксида азота в программированной гибели нейтрофилов при окислительном стрессе 03. 00. 04 биохимия 14. 00. 16 патологическая физиология
| Вид материала | Автореферат |
- Молекулярные механизмы апоптоза при окислительном стрессе 14. 00. 16 патологическая, 606.37kb.
- Динамика содержания цитокинов и оксида азота при легочной гипертензии у детей с хронической, 329.09kb.
- Структурно-функциональные свойства эритроцитарных мембран при дислипопротеинемиях 03., 415.43kb.
- Пояснительная записка Учебно-методический комплекс по курсу «Патологическая физиология», 140.7kb.
- Роль оксида азота и цитокинов в развитии синдрома острого повреждения лёгких, 619.73kb.
- Гормональный статус, генетический полиморфизм и мотивационно-потребностные особенности, 450.55kb.
- Программа вступительных испытаний для специальности магистратуры 1-79 80 29 Патологическая, 348.44kb.
- Язвенная болезнь: иммунитет и апоптоз, 81.87kb.
- Пояснительная записка к учебной дисциплине Эпизоотология и инфекционные болезни животных, 166.41kb.
- Этиопатогенетическая роль урогенитальной инфекции в развитии бесплодия 14. 00. 16 патологическая, 1280.37kb.
На правах рукописи
Стариков Юрий Витальевич
Роль молекул оксида азота
в программированной гибели нейтрофилов
при окислительном стрессе
03.00.04 – биохимия
14.00.16 – патологическая физиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Новосибирск-2008
Работа выполнена в ГОУ ВПО «Сибирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
| Научные руководители: | |
| доктор медицинских наук, профессор | Степовая Елена Алексеевна |
| доктор медицинских наук, профессор | Рязанцева Наталья Владимировна |
| Официальные оппоненты: | |
| доктор медицинских наук, профессор | Колпаков Аркадий Ростиславович |
| доктор медицинских наук | Меньщикова Елена Брониславовна |
Ведущая организация: ГОУ ВПО Красноярская государственная медицинская академия Росздрава
Защита состоится «__» __________ 2008 г. в __ часов на заседании диссертационного совета Д 001.034.01 при Государственном учреждении Научно-исследовательском институте биохимии СО РАМН по адресу: 630117, Новосибирск, ул. Академика Тимакова, 2
С диссертацией можно ознакомиться в библиотеке ГУ НИИ биохимии СО РАМН
Автореферат разослан «__» __________ 2008 г.
Ученый секретарь диссертационного совета,
кандидат биологических наук Русских Г.С.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. Окислительный стресс характеризуется избыточным накоплением в тканях активных форм кислорода (АФК), приводящих к повреждению нуклеиновых кислот, белков и липидов. В физиологических условиях АФК участвуют в развитии «респираторного взрыва», синтезе гормонов, процессах пролиферации клетки [Владимиров Ю.А., 2000; Октябрьский О.Н., Смирнова Г.В., 2007]. Наряду с этим АФК рассматриваются в качестве внутриклеточных мессенджеров, участвующих в регуляции метаболизма клетки. Универсальным участником регуляторных процессов в клетке является оксид азота. На организменном уровне основные эффекты оксида азота проявляют себя в поддержании тонуса сердечно-сосудистой системы, участии в синаптической передаче, регуляции воспалительного ответа и апоптоза клеток [Маеда Х., Акаике Т., 1998; Меньщикова Е.Б. и соавт., 2000].
Апоптоз является важнейшим механизмом контроля клеточных популяций в многоклеточном организме [Kerr J.F.R., 1972]. Активация программированной клеточной гибели напрямую связана с развитием окислительного стресса. Активные формы кислорода вызывают открытие пор во внутренней митохондриальной мембране, набухание матрикса и разрыв внешней мембраны митохондрий с освобождением проапоптотических белков (AIF, Smac, прокаспаза 9, цитохром с) из межмембранного пространства в цитозоль [Yi J. et al., 2002; Лущак В.И., 2007]. Выход цитохрома с приводит к резкому повышению внутриклеточного содержания АФК и активации каспазного каскада [Green D.R., Reed J.C., 1998; Gordon D.M., 2000].
Важнейшим радикалом, участвующим в регуляции апоптоза, является радикал оксид азота (NO). Уникальная химическая природа и большое число внутриклеточных мишеней для NO оставляют открытым вопрос, каким образом опосредуется регулирующее влияние оксида азота на апоптоз в условиях окислительного стресса [Choi B.M. et al., 2002; Меньщикова Е.Б. и соавт., 2006].
С одной стороны, известно, что оксид азота способен подавлять синтез белка Bcl-2 и увеличивать экспрессию Bax в митохондриях, провоцируя повышение проницаемости митохондриальной мембраны и выход в цитоплазму клетки АФК [Hortelano S. et al., 1997; Bruene B., 1999; Лущак В.И., 2006; Кулинский В.И., 2007]. Сильный окислитель пероксинитрит, образующийся при взаимодействии оксида азота с супероксиданионом, индуцирует образование гидроксильных и липидных радикалов [Маеда Х., Акаике Т., 1998], окисляет NH2- и SH-группы белков, что приводит к ингибированию супероксиддисмутазы и ДНК-лигазы.
С другой стороны, в ряде работ описаны диаметрально противоположные эффекты оксида азота на развитие программированной клеточной гибели. Так, активация NO/цГМФ-зависимого пути отменяла развитие апоптоза моноцитов клеточной линии U937 [De Nadai C. et al., 2000], гепатоцитов и В-лимфоцитов [Choi B.-M. et al., 2002]. Кроме того, блокирование апоптоза может быть связано с нитрозилированием каспазы-3 [Bruene B., 1999; Mannick J.B., 1999]. Следует отметить, что имеются данные, указывающие на способность оксида азота индуцировать синтез белков семейства Bcl-2 [Зенков Н.К. и соавт., 2001; Choi B.-M. et al., 2002].
Известно, что продукция АФК наиболее значима в нейтрофильных лейкоцитах по сравнению с другими клетками организма. Индукция окислительного стресса при воспалении инициирует развитие программированной гибели нейтрофилов. В связи с тем, что нейтрофилы быстро вступают на путь спонтанно развивающегося апотоза, не требующего какого-либо внешнего сигнала смерти [Edwards S.W. et al., 2003], состояние внутриклеточных сигнальных систем (Ca2+, цАМФ и цГМФ), баланс анти- и проапоптотических белков семейства Bcl-2 являются важными регуляторными факторами продолжительности жизни клеток.
Несмотря на очевидную взаимосвязь окислительного стресса и апоптоза, роль оксида азота в механизмах реализации программированной гибели нейтрофилов в полной мере до конца не ясна. Установление молекулярных механизмов регуляции продолжительности жизни нейтрофильных лейкоцитов позволит создать селективные технологии управления воспалительным процессом.
Цель исследования: изучить роль оксида азота в механизмах регуляции апоптоза нейтрофилов при окислительном стрессе.
Для достижения поставленной цели были сформулированы следующие задачи:
- Изучить особенности продукции нейтрофилами оксида азота при экспериментальном окислительном стрессе и у больных острыми воспалительными заболеваниями (внебольничная пневмония, острый аппендицит).
- Оценить количество апоптотически измененных нейтрофилов при окислительном стрессе in vitro в условиях влияния индуктора и ингибитора NO-синтазы.
- Оценить содержание белков-регуляторов с про- (Bax) и антиапоптотической (Bcl-2) активностью при индукции синтеза NO и ингибировании NO-синтазы в условиях экспериментального окислительного стресса.
- Определить роль внутриклеточных сигнальных молекул (Ca2+, цАМФ и цГМФ) в регуляции апоптоза нейтрофилов в условиях окислительного стресса in vitro при индукции синтеза NO и ингибировании NO-синтазы.
- Установить особенности влияния NO на апоптоз нейтрофилов в условиях окислительного стресса in vitro и острого воспаления в клинике внутренних болезней.
Научная новизна. Использование современных молекулярно-биологических и биохимических методов показало, что при экспериментальном окислительном стрессе и остром воспалительном процессе в клинике внутренних болезней (внебольничная пневмония, острый аппендицит) происходит увеличение продукции оксида азота нейтрофильными лейкоцитами.
Показано, что молекулярные механизмы влияния молекул оксида азота на апоптоз нейтрофилов при окислительном стрессе и остром воспалительном процессе сопряжены с участием ионов кальция, цАМФ и цГМФ. Установлено, что влияние оксида азота на реализацию программированной гибели нейтрофилов не связано с влиянием на баланс про- (Bax) и антиапоптотических (Bcl-2) белков.
Теоретическая и практическая значимость. Разработана экспериментальная модель окислительного стресса, позволяющего прогнозировать развитие программированной клеточной гибели нейтрофилов при использовании индукторов и ингибиторов NO-синтаз при острых воспалительных заболеваниях. Полученные в результате проведенного исследования данные носят фундаментальный характер и раскрывают молекулярные механизмы развития программированной гибели нейтрофильных лейкоцитов, опосредованные молекулами оксида азота, в условиях окислительного стресса in vitro и острого воспаления в клинике внутренних болезней. Установленные закономерности реализации апоптотической программы нейтрофильных лейкоцитов в условиях окислительного стресса при воспалении могут быть положены в основу разработки селективных молекулярных технологий управления развитием воспалительного процесса, влияя на продолжительность жизни нейтрофильных лейкоцитов.
Положения, выносимые на защиту:
- Молекулы оксида азота оказывают протективный эффект на реализацию апоптотической гибели нейтрофильных лейкоцитов при экспериментальном окислительном стрессе, индуцированным 5 мМ Н2О2, и остром воспалительном процессе.
- Нарушение реализации программированной гибели нейтрофилов при культивировании с индуктором синтеза оксида азота в условиях окислительного стресса in vitro и при остром воспалении сопряжено с изменением внутриклеточного содержания ионов кальция, цАМФ и цГМФ, не зависит от содержания белков Bax и Bcl-2.
Апробация и реализация работы. Результаты проведенных исследований докладывались и обсуждались на VII международном конгрессе молодых ученых и специалистов «Науки о человеке» (Томск, 2007), межрегиональной научно-практической конференции «Актуальные проблемы медицины» (Абакан, 2007), международном междисциплинарном симпозиуме «От экспериментальной биологии к превентивной и интегративной медицине» (Судак, Украина, 2007), на Всероссийской конференции «Национальные дни лабораторной медицины России 2007» (Москва, 2007), XХ съезде физиологического общества имени И.П. Пирогова (Санкт-Петербург, 2007), II конгрессе терапевтов «Новый курс: консолидация усилий по охране здоровья нации» (Москва, 2007).
В работе приводятся результаты исследований, поддержанных Советом по грантам при Президенте РФ для поддержки ведущих научных школ РФ, по проблеме «Молекулярные основы нарушения гомеостаза клеток при актуальных заболеваниях инфекционной и неинфекционной природы» (НШ-4153.2006.7), РФФИ «Молекулярные механизмы управления программированной гибелью клеток с использованием регуляторных молекул» (№ 07-04-12150 - ориентированные фундаментальные исследования 2007-2008), а так же проекта «Разработка способов коррекции нарушений регуляции апоптоза клеток при патологических процессах в условиях окислительного стресса» (гос. контракт № 02.442.11.7276 от 20.02.2006), реализованного в рамках Федеральной целевой научно-технической программы «Исследования и разработки по приоритетным направлениям развития науки и техники на 2002-2006».
Публикации. По материалам диссертации опубликовано 17 работ, из них 4 – в центральных рецензируемых журналах, рекомендованных ВАК РФ.
Объем и структура работы. Диссертация состоит из введения, 4-х глав (обзор литературы, материал и методы исследования, результаты собственных исследований, обсуждение результатов исследования), выводов и списка литературы (135 страниц машинописного текста), включающего 180 источников (из них – 62 отечественных и 118 зарубежных). Работа иллюстрирована 9 таблицами и 6 рисунками.
ХАРАКТЕРИСТИКА ЭКСПЕРИМЕНТАЛЬНОГО И КЛИНИЧЕСКОГО МАТЕРИАЛА, МЕТОДЫ ИССЛЕДОВАНИЯ
Для реализации предпринятого нами исследования были выделены экспериментальный и клинический блоки, включавшие манипулирование in vitro нейтрофильными лейкоцитами, полученными у здоровых доноров и у больных острыми воспалительными заболеваниями.
В исследование были включены 32 здоровых донора (18 мужчин и 14 женщин) в возрасте от 18 до 40 лет (25,0±5,4 лет). Обследовали 54 пациента (30 мужчин и 24 женщины) в возрасте от 18 до 50 лет (32,0±3,0 лет) с острыми воспалительными заболеваниями. Из них 29 человек с внебольничной пневмонией (13 мужчин и 16 женщин) и 25 больных острым аппендицитом (17 мужчин и 8 женщин). Все пациенты поступали в стационар в порядке скорой медицинской помощи, обследование проводилось до назначения терапии.
Для верификации диагноза использовали данные анамнеза, инструментальных (УЗИ, рентгенологическое исследование органов брюшной и грудной полости и др.) и лабораторных (общий анализ крови и мочи, биохимический анализ крови и др.) методов исследования.
Критериями исключения являлись: возраст (менее 18 и более 50 лет), период обострения хронических воспалительных заболеваний; аутоиммунные, наследственные и психические болезни, алкогольная и наркотическая зависимости.
Набор клинического материала осуществлялся на базе и при участии сотрудников кафедры терапии усовершенствования врачей (зав. кафедрой – канд. мед. наук, доцент Т.С. Агеева) Томского военно-медицинского института; терапевтического отделения (зав. отделением – канд. мед. наук А.В. Дубоделова) и хирургического отделения (зав. отделением – канд. мед. наук В.Я. Митасов) ММЛПУ «Городская больница №1» (главный врач – С.М. Кирютенко) (г. Томск); кафедры госпитальной хирургии (зав. кафедрой – член-корреспондент РАМН, проф. Г.Ц. Дамбаев) ГОУ ВПО СибГМУ Росздрава (г. Томск).
Материалом исследования служила венозная кровь, взятая из локтевой вены утром натощак с помощью стандартных вакуумных систем "BD VACUTAINERTM" («Greiner-bio-one», Австрия) с гепарином (25 Ед/мл).
В соответствии с поставленными целью и задачами исследования был предложен дизайн, предполагающий разделение работы на два последовательных этапа.
На первом этапе исследования проводили оценку выраженности апоптоза нейтрофильных лейкоцитов крови в условиях экспериментального окислительного стресса и при остром воспалении в клинике внутренних болезней. Окислительный стресс in vitro воспроизведен с использованием пероксида водорода [Yamamoto K. et al., 2003; Akishita M. et al., 2005] (табл.1).
Таблица 1
Распределение здоровых доноров и пациентов с острыми воспалительными заболеваниями в соответствии с использованными методами регистрации апоптоза и АФК в нейтрофилах
| Методы исследования | Группы обследованных | ||
| Здоровые доноры | Экспериментальный блок исследования (культивирование клеток in vitro с 1, 5, 10 и 50 мМ Н2О2) | Клинический блок исследования (внебольничная пневмония и острый аппендицит) | |
| Оценка апоптоза нейтрофилов в аннексиновом тесте с использованием проточной лазерной цитофлуориметрии | 32 | 32 | 54 |
| Определение уровня АФК в клетках с использованием проточной лазерной цитофлуориметрии | 32 | 32 | 54 |
| Оценка количества некротизированных клеток, с использованием окраски трепановым синим | 32 | 32 | 54 |
На втором этапе исследования для проверки гипотезы участия оксида азота в регуляции программированной гибели нейтрофильных лейкоцитов в условиях окислительного стресса клетки были культивированы в присутствии 5 мМ перекиси водорода и 500 мкМ L-аргинина («MP», США) (субстрата фермента NO-синтазы [Niu X.-F. et al., 1996]) или 500 мкМ L-NAME (NG-нитро-L-аргинин метиловый эфир) («Fluka» США) (селективного ингибитора NO-синтазы) [Beltran B. et al., 2002]). Далее оценивалось влияние оксида азота на содержание про- (Вах) и антиапоптотических белков (Вcl-2), концентрацию внутриклеточных мессенджеров в нейтрофилах (Ca2+, цАМФ и цГМФ) (табл. 2).
Исследование проводилось в Межкафедральной научно-образовательной лаборатории молекулярной медицины ГОУ ВПО СибГМУ Росздрава (зав. лабораторией – д-р мед. наук Л.С. Литвинова).
Таблица 2
Распределение здоровых доноров и пациентов с острыми воспалительными заболеваниями в соответствии с использованными методами исследования влияния NO на реализацию апоптоза нейтрофилов
в условиях окислительного стресса
| Методы исследования | Группы обследованных | ||||||
| Экспериментальный блок исследования | Клинический блок исследования | ||||||
| Интактные нейтрофилы | Нейтрофилы, инкубированные in vitro с 5 мМ Н2О2 | Нейтрофилы, инкубированные in vitro с 5 мМ Н2О2 и L-аргинином | Нейтрофилы, инкубированные in vitro с 5 мМ Н2О2 и L-аргинином | Интактные нейтрофилы | Нейтрофилы, инкубированные с L-аргинином | Нейтрофилы, инкубированные с L-NAME | |
| Лазерная проточная цитофлуориметрия | |||||||
| Нейтрофилы в стадии раннего апоптоза | 32 | 32 | 22 | 22 | 54 | 54 | 54 |
| Уровень АФК в клетке | 32 | 32 | 22 | 22 | 54 | 54 | 54 |
| Концентрация Ca2+ в клетке | 22 | 22 | 22 | 22 | 54 | 54 | 54 |
| Спектрофотометрический анализ | |||||||
| Концентрация метаболитов NO | 22 | 22 | 22 | 22 | 54 | 54 | 54 |
| Радиоимуннный анализ | |||||||
| Концентрация цАМФ в клетке | 7 | 7 | 6 | 7 | 14 | 15 | 17 |
| Концентрация цГМФ в клетке | 7 | 7 | 8 | 9 | 14 | 16 | 14 |
| Вестерн-блоттинг | |||||||
| Содержание Bax в клетке | 3 | 3 | 3 | 3 | 3 | Не определяли | Не определяли |
| Содержание Bcl-2 в клетке | 3 | 3 | 3 | 3 | 3 | Не определяли | Не определяли |
Нейтрофилы выделяли из гепаринизированной венозной крови путем центрифугирования в двойном градиенте плотности Ficoll-Paque (ρ=1,077 г/см3) («GE Healthcare», Швеция) и Ficoll-урографина (ρ=1,095 г/см3) (урографин – «Schering», Россия). Клетки культивировали в полной питательной среде [Гольдберг Е.Д. и соавт., 1992] в стерильных пенициллиновых флаконах (для определения концентрации конечных метаболитов оксида азота, содержания белков Bcl-2, Bax, концентрации цАМФ и цГМФ в нейтрофилах) и 96-луночных круглодонных иммунологических планшетах (для определения числа аннексин-положительных клеток, концентрации внутриклеточных АФК и цитоплазматического кальция методом проточной лазерной цитометрии) в течение 18 ч при температуре 37º С и 5 % СО2.
Методом лазерной проточной цитометрии с использованием цитометра Epics XL («Beckman Coulter», Франция) оценивали число аннексин-положительных клеток в культуре, содержание АФК и Са2+ в нейтрофилах. Оценка реализации программированной гибели нейтрофилов крови осуществляли с помощью набора реагентов «ANNEXIN V FITC» («Beckman Coulter», Франция) методом, основанным на способности аннексина V, меченного флуоресцеин изотиоцианатом, связываться с фосфатидилсерином, появляющимся на мембране клеток при запуске программы апоптоза [Van Engeland M. et al., 1998]. Концентрация внутриклеточных АФК определялась с помощью красителя с заблокированной флуоресценцией – дихлорфлюоресцеина диацетата («Sigma», США) [Bass D.A. et al., 1983]. Оценка концентрации ионов кальция в цитоплазме нейтрофильных лейкоцитов проводилась методом, основанным на определении интенсивности флуоресценции липофильного зонда Fluo 3 AM («MP Biomedicals TM», США), проникающего в клетку и связывающего ионы кальция [Merritt J.E. et al.,1990].
Спектрофотометрический метод определения содержания нитритов в супернатантах был основан на цветной реакции с реактивом Грисса (1 % сульфаниламид («MP», США), 0,1 % нафтилендиамин («MP», США), разведенные в 12 % уксусной кислоте) [Green L.C. et al., 1982].
Определение содержания циклических нуклеотидов цАМФ и цГМФ в нейтрофилах крови проводили с использованием метода конкурентного твердофазного радиоиммунного анализа [Yallow R.S., Berson S.A., 1970], при помощи наборов «RIA AMPc/cAMP» и «RIA сGMP» («Immunotech», Франция). Методические детали проведения радиоконкурентного анализа описаны в протоколах фирмы-изготовителя для каждого радиоиммунного комплекта.
С помощью метода вестерн-блоттинга в нейтрофилах определяли содержание белков Bcl-2 и Bax [Towbin H. et al., 1979]. Клеточные экстракты получены путем лизиса клеток в фосфатно-солевом буфере, содержащем 50 мМ трис-НCl буфер (рН=6,5), 100мМ дитиотреитол, 2% SDS, 0,1% бромфеноловый синий, 15% глицерол («Helikon», США), смесь протеазных ингибиторов («Sigma», США). Белки разделяли по молекулярной массе под действием электрического поля в течение 60 мин при напряжении поля 120 В. Для последующего исследования белки переносили на нитроцеллюлозную мембрану («Bio-Rad», США). Перенос белков осуществлялся электрофоретически в течение 90 мин при силе тока 60 мА. В качестве стандарта и внутреннего контроля использовали белок глицеро-3-фосфат-дегидрогеназу (антитела фирмы «Chemicon», США), выражая содержание белка Вах как отношение сигнала определяемого белка к сигналу белка глицеро-3-фосфат-дегидрогеназы в исследуемых образцах.
При оценке полученных данных были использованы методы статистического описания и проверки статистических гипотез [Лакин Г.Ф., 1980]. Для каждой выборки вычисляли средневыборочные характеристики: среднее арифметическое, среднее квадратичное отклонение и ошибка среднего или медиана, первый и третий квартили. Проверку нормальности распределения количественных показателей проводили с использованием критерия Колмогорова-Смирнова. При соответствии нормальному закону распределения признака в исследуемых выборках проверку гипотезы о равенстве средних выборочных величин осуществляли с использованием t-критерия Стьюдента. В случае отсутствия согласия данных с нормальным распределением для оценки различий между зависимыми выборками применяли непараметрический критерий Вилкоксона. С помощью рангового критерия Манна-Уитни оценивали достоверность различий независимых выборок. Наличие связи между изучаемыми показателями проводили с использованием корреляционного анализа по методу Спирмена. Различия считались достоверными при уровне значимости р<0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
1. Особенности программированной гибели нейтрофилов крови при окислительном стрессе in vitro и остром воспалении
Отсутствие в научной литературе данных, свидетельствующих об изменениях метаболизма нейтрофилов в зависимости от концентрации перекиси водорода in vitro, наличие различных способов индикации фенотипических проявлений апотоза и некроза определили задачу экспериментального подбора оптимальной концентрации Н2О2, способной эффективно индуцировать как развитие окислительного стресса (ОС), так и программированную гибель нейтрофильных лейкоцитов.
Для моделирования окислительного стресса in vitro нейтрофилы, полученные у здоровых доноров, инкубировали с перекисью водорода в конечной концентрации 1, 5, 10 и 50 мМ.
В ходе проведенного нами исследования было установлено, что Ооптимальной конечной концентрацией Н2О2, вызывающей нарастание внутриклеточной продукции АФК и индуцирующей апоптоз наибольшего числа нейтрофильных лейкоцитов, но не стимулирующей развитие некротических изменений нейтрофилов, является 5 мМ (рис 1). В ходе дальнейших исследований именно эта концентрация была использована для моделирования ОС in vitro.
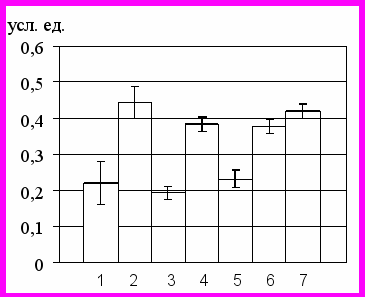
В ходе выполненного нами исследования, для подтверждения адекватности выбранной нами модели окислительного стресса было проведено сравнение внутриклеточного содержания АФК в условиях экспериментальной модели окислительного стресса (5 мМ Н2О2) и при остром воспалении. В данных группах количествоБыло выявлено, что содержание АФК в культуре нейтрофильных лейкоцитов лейкоцитах, полученных у больных внебольничной пневмонией (0,653(0,574–0,728) усл.ед.) и острым аппендицитом (0,673(0,561–0,690) усл.ед.)) значимо превышало контрольные величины (р<0,05) и статистически не отличалось от значений в экспериментальной модели (р>0,05). Этот факт, на наш взгляд, свидетельствует друг от друга. Отсутствие различий по уровню концентраций внутриклеточных АФК в клетках, культивируемых с 5 мМ перекисью водорода и клетках, полученных от больных с острым воспалением, свидетельствует об адекватности использованной в работе модели ОС и подобранной концентрации Н2О2 для имитации поведения нейтрофилов при развитии острого воспаления. Отсутствие различий содержания внутриклеточных АФК в нейтрофилах у больных острым аппендицитом и внебольничной пневмонией позволило нам объединить пациентов в одну клиническую группу с острым воспалительным процессом.
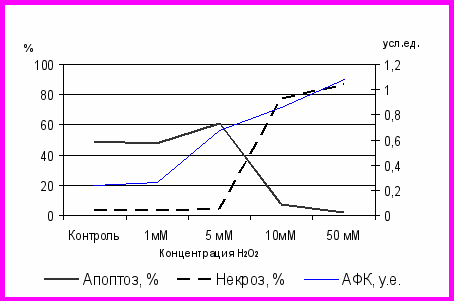
Рис. 1. Содержание внутриклеточных АФК, количество аннексин-положительных и некротизированных клеток в культуре нейтрофильных лейкоцитов при инкубации с разными концентрациями перекиси водорода
Сходная ситуация отмечается отмечалась при сравнении количества аннексин-положительных клеток в этих экспериментальной и клинических группахах, что указывает на близкий механизм активации апоптоза нейтрофилов, культивируемых в присутствии 5 мМ перекиси водорода in vitro, и нейтрофилов, полученных у больных с острым воспалением. Число апоптотических апоптотически измененных клеток в культуре нейтрофилов, полученных у пациентов с внебольничной пневмонией (62,37(54,25–69,20)%) и у больных острым аппендицитом (57,40(51,37–62,37)%), достоверно превышает превышало контрольную величину (р<0,05) и не отличалось от его значения при экспериментальном ОС (р>0,05). Количество клеток с пермеабилизированной мембраной в культуре нейтрофилов, полученных у больных внебольничной пневмонией (5,50(4,30–6,50) %), статистически превышало (p<0,05) контрольную величину; значения данного параметра в культуре нейтрофильных лейкоцитов, выделенных из крови у больных острым аппендицитом (4,20(3,80–5,70)%), оставалось в пределах контрольных величин (р>0,05).
В нашем проведенном нами исследовании влияние АФК на развитие апоптоза нейтрофилов подтверждается подтверждалось наличием положительной корреляции между увеличением внутриклеточного уровня АФК и возрастанием количества аннексин-положительных клеток в культурах нейтрофилов, полученных у здоровых доноров при индукции ОС 5 мМ Н2О2 (r=0,89, p<0,05), а также в клетках, полученных у больных острыми воспалительными заболеваниями (r=0,71, p<0,05).
2. Влияния оксида азота на апоптоз нейтрофилов крови при окислительном стрессе in vitro и остром воспалении
Известно, что оксид азота является, с одной стороны, одним из компонентов окислительного стресса, с другой – важнейшим медиатором клеточного метаболизма [Зенков Н.К., и соавт., 2001 Tuteja N. et al., 2004]. Для установления роли NO в механизмах регуляции апоптоза нейтрофилов при окислительном стрессе в параллельных экспериментах клетки культивировали в присутствии индуктора или ингибитора NO-синтазы.
Изучение концентрации конечных метаболитов NO в среде инкубации нейтрофилов показало, что под действием 5 мМ Н2О2 происходит статестически значимое увеличение продукции оксида азота по сравнению с интактной культурой (p<0,05), что в целом согласуется с данными литературы [Thomas S. R., 2002] (рис. 2). Оценка концентрации метаболитов оксида азота в культуре нейтрофилов, полученных у пациентов с острым воспалением, выявила увеличение значений исследованного показателя в 1,5 раза по сравнению с таковыми в интактной культуре клеток у здоровых доноров (р<0,05) и в 1,3 раза по сравнению со стресс-контролем (р<0,05) (рис. 2).
Было установлено, что при культивировании нейтрофилов в присутствии L-аргинина способствует повышению концентрации метаболитов NO достоверно повышается. Культивирование нейтрофильных лейкоцитов с L-NAME приводило к снижению концентрации метаболитов оксида азота при экспериментальном ОС до контрольных значений. При работе с нейтрофилами, полученных у больных острыми воспалительными заболеваниями, воздействие ингибитора NO-синтазы приводило к снижению концентрации метаболитов NO до базового уровня, характерного для клеток при остром воспалении. Данный факт свидетельствует о запуске как ферментативного, так и неферментативного механизмов наработки оксида азота, нечувствительных к воздействию L-NAME, в условиях воспалительного процесса [Реутов В.П. и соавт., 1998; Меньщикова Е.Б. и соавт., 2000; Beltran B. et al. 2000, 2002].
В результате проведенного исследования было установлено, что L-аргинин не влияет на содержание АФК в цитозоле нейтрофилов ни при ОС in vitro, ни у пациентов с острыми воспалительными заболеваниями. Увеличение уровня АФК отмечалось лишь при добавлении ингибитора NO-синтазы в условиях экспериментального окислительного стресса (р<0,05).
При оценке количества апоптотически измененных клеток оказалось, что L-аргинин эффективно снижал число аннексин-положительных нейтрофилов в культурах с моделированием ОС in vitro до уровня, не отличавшегося от контрольных значений (р>0,05). Исследование чувствительности нейтрофилов крови, полученных у больных с острым воспалением, к воздействию индуктора синтеза оксида азота не позволило выявить изменений количества апоптозных клеток по сравнению с культурой нейтрофилов, полученных у больных острыми воспалительными заболеваниями, не подвергавшейся воздействию L-аргинина (рис. 2).
Предположение о влиянии оксида азота на развитие апоптоза нейтрофилов подтверждается существованием обратной зависимости, выявленной при проведении корреляционного анализа, между концентрацией метаболитов NO в нейтрофилах и числом аннексин-положительных клеток в культурах нейтрофилов у здоровых доноров при индукции ОС 5 мМ Н2О2 (r =-0,83, p<0,05) и в клетках, полученных у больных острыми воспалительными заболеваниями (r =-0,59, p<0,05).
Воздействие L-NAME на нейтрофильные лейкоциты, полученные у больных с острыми воспалительными заболеваниями, сопровождалось увеличением числа аннексин-положительных клеток в 1,2 раза по сравнению с базовым уровнем (р<0,05) (рис. 2).
Подводя итог, можно сделать вывод о протекторной роли NO в регуляции программированной клеточной гибели нейтрофилов в условиях ОСокислительного стресса. Однако полученные результаты не позволяют однозначно ответить на вопрос, является ли оксид азота протекторным агентом непосредственно или стимулятором механизмов, защищающих клетку от повреждения. Установление молекулярных механизмов реализации апоптотической гибели в ответ на повышение или снижение концентрации оксида азота в клетке в условиях окислительного стресса является важной теоретической и практической задачей. Исследования в этом направлении позволят не только сделать выводы о влиянии NO на апоптоз нейтрофилов в условиях экспериментального окислительного стресса, но и предположить схожие механизмы участия оксида азота в развитии гибели нейтрофилов в очаге воспаления.
3. Молекулярные механизмы развития управления апоптоза нейтрофилов крови при окислительном стрессе in vitro и остром воспалении
ДДля определения молекулярных мишеней воздействия оксида азота при реализации программируемой программированной гибели нейтрофилов нами поставлена задача оценки необходимо проследить причинно-следственные следственных связей каскадных реакций передачи внутриклеточных сигналов. Для исследования регуляторной роли оксида азота нами изучены изменения концентрации внутриклеточных мессенджеров (цГМФ, цАМФ, Ca2+) в нейтрофильных гранулоцитах при развитии окислительного стресса.
Выявление молекулярных механизмов реализации апоптотической гибели в ответ на повышение или снижение концентрации оксида азота в клетки в условиях ОС является важной теоретической и практической задачей. Данные исследования позволят сделать выводы о влиянии NO не только на апоптоз нейтрофилов периферической крови, но и предположить подобный сценарий при развитии клеточной гибели нейтрофилов в очаге воспаления.
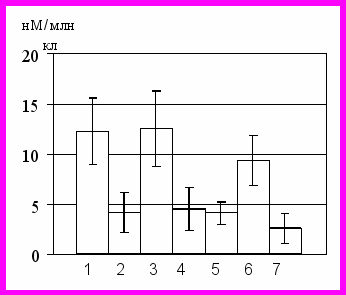
Исследование концентрации цАМФ и цГМФ в нейтрофилах у здоровых доноров, проведенное с помощью радиоиммунного метода, выявило, что данный показатель составл (114,13(101,96–120,55) нМ/106 кл) и (12,25(10,48–17,04) нМ/106 кл), соответственно. При количественной оценке содержания цАМФ и цГМФ в клетках, подвергшихся воздействию 5 мМ перекиси водорода, было установлено, что концентрация цАМФ возрастала в 1,2 раза (р<0,05), а концентрация цГМФ, напротив, снижалась в 3,0 раза (р<0,05), что приводило к существенному увеличению соотношения циклических нуклеотидов по сравнению с контрольными значениями в 3,4 раза.
Определение концентрации цАМФ в нейтрофилах, полученных у больных с острым воспалением, показало, что значения данного параметра были достоверно ниже аналогичных не только в интактной культуре нейтрофильных гранулоцитов, но и в группе стресс-контроля – в 1,3 и 1,5 раза, соответственно (р<0,05). Содержание цГМФ также было ниже соответствующего параметра в контроле (р<0,05), достигая при этом уровня, близкого к таковому в случае воздействия на клетки in vitro 5 мМ перекиси водорода (рис. 2). Выраженное снижение концентрации цГМФ в нейтрофилах, полученных у больных острыми воспалительными заболеваниями, обеспечивало увеличение (в 2 раза) отношения концентраций цАМФ/цГМФ в клетке.
Увеличение отношения содержания цАМФ и цГМФ при активации программированной клеточной гибели нейтрофилов, по всей видимости, носит защитно-приспособительный характер. Данные о влиянии цАМФ на апоптоз относительно малочисленны и свидетельствуют о тканеспецифическом характере регуляции программированной клеточной гибели системой циклических нуклеотидов [Chang H.S. et al., 2000; Kato T. et al., 2006].
Возможная биологическая роль повышения содержания цАМФ в нейтрофилах, полученных у больных острыми воспалительными заболеваниями, связана со способностью данного циклического нуклеотида подавлять фагоцитоз нейтрофилов макрофагами в очаге воспаления [Rossi A.G. et al., 1998].
Культивирование нейтрофилов с 500 мкМ L-аргинином в условиях окислительного стресса in vitro приводило к достоверному снижению внутриклеточного содержания цАМФ (р<0,05) и увеличению концентрации цГМФ в нейтрофилах до контрольных значений (р>0,05). Трехкратное увеличение содержания цГМФ в нейтрофильных гранулоцитах относительно базового уровня приводило к снижению отношения цАМФ/цГМФ до значений контрольной группы. Воздействие индуктора синтеза оксида азота на нейтрофилы, полученные у больных острыми воспалительными заболеваниями, не приводило к изменению концентрации цАМФ относительно собственного базового уровня (р>0,05), но сопровождалось увеличением содержания цГМФ в клетках в 2,3 раза (р<0,05), что также приводило к снижению отношения цАМФ/цГМФ. Повышение содержания цГМФ, на наш взгляд, может быть напрямую связано со стимуляцией растворимой гуанилатциклазы оксидом азота [Hanafy K. A., 2001; Bian K., 2006].
Приведенная выше интерпретация результатов собственных исследований и анализ данных, полученных другими авторами, позволили высказать предположение, что Мы предполагаем, что оксид азота за счет повышения внутриклеточного содержания цГМФ снижает соотношение циклических нуклеотидов до значений близких к контрольным значениям, тем самымсамым,, стабилизируя метаболизм нейтрофилов и продлевая жизнь клетки.
Культивирование нейтрофилов с 500 мкМ L-NAME в условиях окислительного стресса in vitro приводило к достоверному снижению концентрации цАМФ и цГМФ в нейтрофилах в (1,5 и 3,0 раза, соответственно) (р<0,05) (рис. 2), что, однако, сопровождалось увеличением отношения цАМФ/цГМФ в данных клетках. Воздействие ингибитора NO-синтазы на нейтрофильные гранулоциты, полученные у больных острыми воспалительными заболеваниями, сопровождалось снижением содержания цАМФ и цГМФ (в 1,4 и 1,6 раза относительно базового уровня, соответственно) (р<0,05) (рис. 2) и увеличением отношения концентраций циклических нуклеотидов.
Увеличение отношения концентраций цАМФ/цГМФ, отмеченное нами в нейтрофильных лейкоцитах, культивированных в присутствии 5 мМ Н2О2 перекиси водорода и ингибитора NO-синтазы, может быть связано с токсическим влиянием Н2О2 на аденилатциклазу и гуанилатциклазу. Токсическое влияние перекиси водорода во многом усиливается при отсутствии стабилизирующего влияния оксида азота на электронно-транспортную цепь митохондрий [Beltran B. et al. 2000, 2002]. Введение L-NAME в культуральную среду приводило к росту концентрации внутриклеточных АФК и усугубло развитие ОС.
Изменение баланса циклических нуклеотидов, отмеченное нами при культивировании нейтрофилов, полученных у больных острыми воспалительными заболеваниями, с селективным ингибитором NO-синтазы, происходило на фоне увеличения числа нейтрофилов, вступивших на путь апоптоза. Вероятно, что повышение отношения внутриклеточной концентрации циклических нуклеотидов при развитии программированной гибели нейтрофилов носит транзиторный характер, связанный с нормализацией клеточного метаболизма и предотвращением клеточной гибели.
Как показали результаты исследования, направленного на определение концентрации кальция в цитоплазме нейтрофилов крови, значения данного показателя в интактных клетках у здоровых доноров составили (0,220(0,114–0,234)усл.ед.). Добавление в культуральную среду 5 мМ перекиси водорода приводило к двукратному повышению содержания Ca2+в нейтрофилах нейтрофилах крови ) по сравнению с соответствующим параметром в контроле (р1<0,05) (рис.2).

а)
б)
в)
г)
д)
е)
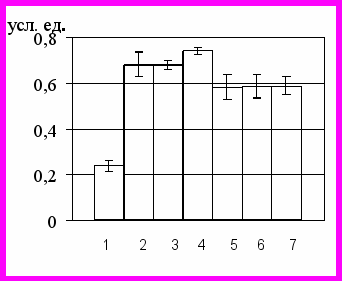
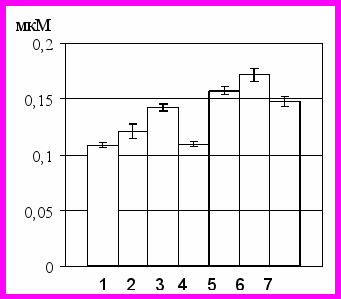
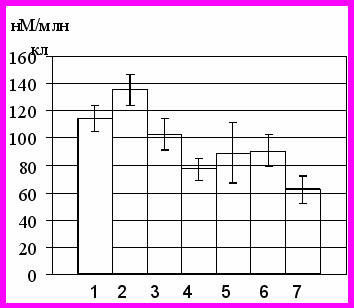
1 – интакные нейтрофилы
2 – нейтрофилы, культивированные с 5 мМ Н2О2
3 - нейтрофилы, культивированные с 5 мМ Н2О2 и L-аргинином
4 - нейтрофилы, культивированные с 5 мМ Н2О2 и L-NAME
5 – нейтрофилы, полученные у больных с острыми воспалительными заболеваниями
6 – нейтрофилы, полученные у больных с острыми воспалительными заболеваниями и культивированные с L-аргинином
7 – нейтрофилы, полученные у больных с острыми воспалительными заболеваниями и культивированные с L-NAME
Рис 2.Нейтрофилы в стадии раннего апоптоза (а), уровень АФК (б) в нейтрофилах, концентрация метаболитов NO в среде инкубации (в), концентрация цАМФ (г), цГМФ (д) и кальция (е) в нейтрофилах
По нашим данным, концентрация внутриклеточного кальция в нейтрофильных гранулоцитах, полученных у больных с острыми воспалительными заболеваниями, была достоверно в 1,9 раз ниже аналогичного показателя при индукции окислительного стресса (р<0,05) (рис. 2).
Существует множество данных о взаимосвязи систем наработки и утилизации АФК с изменением уровня свободного кальция в клетке [Yermolaieva O. et al., 2000, 2003]. Повышение уровня внутриклеточного кальция в нейтрофилах при воздействии 5 мМ Н2О2 объясняется стимулирующим влиянием АФК на высвобождение Ca2+ из внутриклеточных депо. В то же время ионы Ca2+ вызывают перестройку липидного матрикса мембраны митохондрии, приводящую к дезорганизации компонентов дыхательной цепи и повышению продукции АФК.
Культивирование нейтрофилов с 500 мкМ L-аргинином в условиях экспериментального окислительного стресса приводило к снижению концентрации ионов кальция до контрольных значений (р>0,05).
При воздействии индуктора синтеза оксида азота на нейтрофилы, полученные у больных острыми воспалительными заболеваниями, отмечалось достоверное повышение (в 1,6 раз) содержания кальция по сравнению с базовым уровнем (p<0,05). Однако концентрация внутриклеточного Ca2+ оставалась значительно ниже по сравнению с данными, полученными при культивировании нейтрофилов той же группы с селективным ингибитором NO-синтазы (р<0,05) и стресс-контролем (р<0,05) (рис. 2).
Известно, что митохондрии являются основным депо кальция в клетке. Следовательно, по изменению уровня Ca2+ можно косвенно судить о митохондриальной дисфункции. Возможно, снижение содержания кальция в нейтрофилах под действием NO происходит за счет стабилизирующего влияния оксида азота на проницаемость митохондриальных мембран [Реутов В.П. и соавт., 1998; Brune B., 1999; Beltran B. et al., 2000, 2002].
Наше предположение о подавлении оксидом азота развития апоптотической программы нейтрофилов за счет снижения выхода кальция из митохондрий подтвердилось наличием обратной корреляционной связи между концентрацией метаболитов NO и концентрацией внутриклеточного кальция в клетках стресс-контроля (r=-0,79, p<0,05) и содержанием, полученных у больных острыми воспалительными заболеваниями (r =-0,57, p<0,05).
Воздействие селективного ингибитора NO-синтазы на нейтрофильные гранулоциты, полученные у больных острыми воспалительными заболеваниями и в условиях экспериментального ОС, не приводило к изменению концентрации ионов кальция относительно клеток, подвергнувшихся воздействию 5 мМ перекиси водорода (р>0,05).
Активные формы кислорода и кальций могут действовать совместно, индуцируя повышение проницаемости внутренней митохондриальной мембраны (образование гигантской РТР-поры). Имеются сведения о способности оксида азота предотвращать открытие гигантской поры митохондрии, блокируя тем самым выход ионов Ca2+, цитохрома с в цитоплазму и предотвращая запуск каспазного каскада [Brookes P.S. et al., 2000]. Проницаемость РТР-пор зависит от соотношения про- (Bax) и антиапоптотического (Bcl-2) белков [Ravagnan L. et al., 1999; Smaili S.S. et. al., 2000].
При оценке содержания проапоптотического белка Вах в нейтрофилах крови, проведенной методом вестерн-блоттинга, было обнаружено отчетливое его увеличение в условиях окислительного стресса in vitro, а также в случае определения этого белка в нейтрофильных лейкоцитах у больных острыми воспалительными заболеваниями.
Оценка уровня Вах после воздействия L-аргинина и L-NAME на клетки здоровых доноров, культивированные при действии 5 мМ Н2О2, не выявила изменений значений указанного параметра по сравнению с аналогичным показателем в группе стресс-контроля.
Исследование содержания антиапоптотического протеина Bcl-2 в нейтрофилах, проведенное методом вестерн-блоттинга, не выявило указанного белка как в условиях экспериментального стресса, так и при изучении нейтрофилов, полученных у больных с острыми воспалительными заболеваниями. Воздействие L-NAME и L-аргинина не приводило к появлению Bcl-2 в нейтрофилах в условиях окислительного стресса in vitro.
Полученные результаты указывают на отсутствие влияния NO на транскрипционные регуляторные механизмы синтеза указанных протеинов. Также оксид азота не изменяет функциональные свойства Вах за счет нитрозилирования, что показано для ряда других белков, локализованных на митохондриальных мембранах [Alonso D. et al., 2002; Daniel P.T. et al., 2003].
В целом, в проведенном нами исследовании был освещен и конкретизирован ряд вопросов, затрагивающих взаимосвязь внутриклеточных сигнальных путей, участвующих в реализации программированной гибели нейтрофилов в условиях окислительного стресса. При этом важная роль в системе вторичных мессенджеров, обеспечивающих нормальную жизнедеятельность и функционирование клетки, принадлежит оксиду азота. Дальнейшая идентификация молекулярных мишеней действия оксида азота позволит создать картину регуляции клеточных функций, что в конечном итоге будет способствовать разработке подходов управления программированной гибелью клетки при широком спектре патологических процессов, сопровождающихся развитием окислительного стресса.
ВЫВОДЫ
- Окислительный стресс, как индуцированный in vitro, так и развивающийся при остром воспалении, сопровождается увеличением продукции нейтрофильными лейкоцитами оксида азота.
- Оксид азота обладает ингибирующим влиянием на развитие программированной гибели нейтрофилов: культивирование нейтрофильных лейкоцитов с L-аргинином приводит к блокированию развития апоптоза в условиях экспериментального окислительного стресса.
- Нарушение реализации программированной гибели нейтрофильных лейкоцитов при экспериментальном окислительном стрессе не связано с влиянием молекул оксида азота на баланс про- и антиапоптотических белков.
- Блокирующее влияние оксида азота на апоптоз нейтрофилов в условиях окислительного стресса in vitro опосредуется через снижение внутриклеточной концентрации ионов кальция и цАМФ, увеличение содержания в клетках цГМФ.
- Влияние молекул оксида азота на развитие программированной гибели нейтрофильных лейкоцитов при остром воспалении имеет однонаправленный характер с экспериментальной моделью окислительного стресса и сопряжено с увеличением содержания в клетке цГМФ.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Жаворонок Т.В., Носарева О.Л., Помогаева А.П., Бутусова В.Н., Стариков Ю.В. Нарушение физиологического баланса в системе прооксиданты-антиоксиданты при остром воспалении // Тезисы V Сибирского физиологического съезда. – г. Томск, 29-30 июня, 1 июля 2005г. – Бюллетень сибирской медицины. – 2005. – №6, Приложение 1.– С. 174.
- Жаворонок Т.В., Петина Г.В., Степовая Е.А., Стариков Ю.В., Агеева Т.С., Чудакова О.М., Рязанцева Н.В. Дезадаптивные изменения структурно-метаболических свойств нейтрофилов при острой пневмонии // Материалы научных конференций, симпозиумов, школ, проводимых в ТГУ. – Вестник ТГУ. – 2006. – № 21. – С. 34-35.
- Жаворонок Т.В., Агеева Т.С., Петина Г.В., Степовая Е.А., Стариков Ю.В., Рязанцева Н.В., Заводовская В.Д., Стракевич Е.Е. Функциональная активность нейтрофилов и оценка окислительной модификации белков при внебольничной пневмонии в зависимости от характера легочного инфильтрата // Материалы XVI Национального конгресса по болезням органов дыхания. – г. Санкт-Петербург, 14-17 ноября 2006. – Санкт-Петербург, 2006. – С. 27.
- Жаворонок Т.В., Степовая Е.А., Рязанцева Н.В., Петина Г.В., Соколович А.Г., Стариков Ю.В., Дума М.А., Иванов В.В., Горемыкин К.В., Чудакова О.М. Нарушение окислительного метаболизма при острых воспалительных заболеваниях // Клиническая лабораторная диагностика. – 2006. – № 12. – С. 10-14.
- Zhavoronok T.V., Stepovaya Ye.A., Petina G.V., Starikov Yu.V., Ryazantseva N.V., Ageeva T.S. Evaluation of neutrophilic and erythrocytic proteins’ oxidative modification in oxidative stress conditions // Abstracts 16th ERS Annual Congress - Munich, Germany, 2-6 September 2006. – European Respiratory Journal. – 2006. – Vol. 28. – Supplement 50. – P. ls.
- Zhavoronok T.V., Stepovaya Ye.A., Ryazantseva N.V., Petina G.V., Starikov Yu.V., Ageeva T.S. Influence of oxidative stress on redox-state and peripheral blood heterophilic leukocytes apoptotic program realization // European journal of natural history. – 2007. – N6. – P. 63-64.
- Zhavoronok T.V., Starikov Y.V., Ageeva T.S., Ryazantseva N.V., Stepovaya E.A., Bychkov V.A., Mishustin S.P. The effect of NO synthesis modulations on calcium accumulation and neutrophil apoptosis during the community-acquired pneumonia // Abstracts 17th ERS Annual Congress. – Stockholm, Sweden, 15-19 September 2007. – European Respiratory Journal. – 2007. – Vol. 30. – Supplement 51. – P. 34s.
- Агеева Т.С., Жаворонок Т.В., Тетенев Ф.Ф., Кривоногов Н.Г., Рязанцева Н.В., Завадовская В.Д., Степовая Е.А., Дубоделова А.В., Петина Г.В., Стариков Ю.В., Даниленко В.Ю. Внебольничные пневмонии: клинико-сцинтиграфическая характеристика и окислительный дисбаланс клеток // Клиническая медицина. – 2007. – № 7. – С. 43-48.
- Тетенев Ф.Ф., Агеева Т.С., Жаворонок Т.В., Кривоногов М.Г., Дубоделова А.В., Петина Г.В., Стариков Ю.В., Рязанцева Н.В., Степовая Е.А. Дополнительные возможности диагностики внебольничной пневмонии // Сибирский медицинский журнал. – 2007. – Т.68, №1. – С. 54-57.
- Жаворонок Т.В., Петина Г.В., Стариков Ю.В., Агеева Т.С., Степовая Е.А. Тиол-дисульфидная составляющая редокс-регуляции нейтрофилов при внебольничных пневмониях // Материалы II Конгресса терапевтов «Новый курс: консолидация усилий по охране здоровья нации». – г. Москва, 7-9 ноября 2007. – Москва, 2007. – С. 75-76.
- Жаворонок Т.В., Петина Г.В., Агеева Т.С., Стариков Ю.В., Рязанцева Н.В., Степовая Е.А., Бычков В.А. Окислительный метаболизм и апоптоз нейтрофильных лейкоцитов при внебольничной пневмонии // Материалы XVII Национального конгресса по болезням органов дыхания – г. Казань, 2-5 октября 2007. – Казань, 2007. – С. 128.
- Жаворонок Т.В., Стариков Ю.В., Рязанцева Н.В., Степовая Е.А., Бычков В.А., Петина Г.В. Механизмы реализации апоптотической программы нейтрофилов при ингибировании и активации синтеза NO в условиях окислительного стресса in vitro // Материалы Международного междисциплинарного симпозиума «От экспериментальной биологии к превентивной и интегративной медицине». – г. Судак, Украина, 17–28 сентября 2007. – Судак, 2007. – С. 46-48.
- Жаворонок Т.В., Петина Г.В., Стариков Ю.В., Степовая Е.А., Рязанцева Н.В., Агеева Т.С. Оценка окислительной модификации белков и метаболический статус нейтрофилов при внебольничной пневмонии в зависимости от характера легочного инфильтрата // Материалы Всероссийской конференции «Национальные дни лабораторной медицины России 2007». – г. Москва, 10-12 октября 2007. – Клиническая лабораторная диагностика. – 2007. – №9. – С. 85.
- Стариков Ю.В., Бычков В.А. Влияние оксида азота на реализацию программированной клеточной гибели нейтрофильных лейкоцитов в условиях окислительного стресса in vitro // Материалы Межрегиональной научно-практической конференции «Актуальные проблемы медицины». – г. Абакан, 17-19 мая 2007. – Абакан, 2007. – С. 27–29.
- Жаворонок Т.В., Степовая Е.А., Рязанцева Н.В., Петина Г.В. Стариков Ю.В., Агеева Т.С. Окислительный метаболизм клеток в дебюте внебольничной пневмонии // Материалы XХ Съезда физиологического общества имени И.П. Пирогова – г. Санкт-Петербург, 4-8 июня 2007.– Санкт-Петербург, 2007. – С. 226-227.
- Стариков Ю.В., Бычков В.А. Влияние оксида азота на апоптоз нейтрофилов в условиях окислительного стресса in vitro // Материалы VII Конгресса молодых ученых и специалистов «Науки о человеке». – г. Томск, 17-18 мая 2007. – Томск, 2007. – С. 200-201.
- Новицкий В.В., Рязанцева Н.В., Часовских Н.Ю., Старикова Е.Г., Кайгородова Е.В., Стариков Ю.В., Жукова О.Б. Модуляция апоптоза мононуклеаров в условиях окислительного стресса // Бюллетень экспериментальной биологии и медицины. – 2008. – Т. 145, №3. – С. 251-254.
СПИСОК СОКРАЩЕНИЙ
АФК – активные формы кислорода
ОС – окислительный стресс
цАМФ – циклический аденозин-3',5'-монофосфат
цГМФ – циклический гуанозин-3',5'-монофосфат
L-NAME – NG-нитро-L-аргинин метиловый эфир
Bax – проапоптотический белок (ассоциированный с Bcl-2 белок X)
Bcl-2 – антиапоптотический белок (белок лейкемии В-клеток-2)
NO – оксид азота
Автор выражает благодарность профессору кафедры биохимии и молекулярной биологии ГОУ ВПО СибГМУ Росздрава д-ру мед. наук, профессору Т.С. Федоровой, канд. мед. наук, заведующей лабораторией клинической иммунологии ГУЗ ЦМСЧ № 81 ЗАТО Северск Т.Т. Радзивил, канд. мед. наук, доценту кафедры биохимии и молекулярной биологии ГОУ ВПО СибГМУ Росздрава Т.В. Жаворонок, д-ру мед. наук, заведующей Межкафедральной научно-образовательной лаборатории молекулярной медицины ГОУ ВПО СибГМУ Росздрава Л.С. Литвиновой за проявленный интерес к работе, ценные теоретические и методические советы, а также за помощь в организации проведения исследований.
